Nová nonavalentní vakcína proti HPV
Souhrn:
Lidský papilomavirus (human papillomavirus, HPV) může být příčinou vzniku karcinomu děložního hrdla, vaginy, vulvy, penisu, anu a orofaryngu a také genitálních bradavic. Tato onemocnění jsou díky vakcinaci proti HPV preventabilní. Na trhu je dostupná nová nonavalentní vakcína proti HPV (HPV 6/11/16/18/31/33/45/52/58). Zajišťuje vysokou a trvalou ochranu proti infekcím a onemocněním spojeným s genotypy přítomnými ve vakcíně. Nonavalentní vakcína proti HPV vykazuje ve srovnání s kvadrivalentní vakcínou (HPV 6/11/16/18) významně zvýšený účinek a pokrývá okolo 90 % cervikálních karcinomů u žen a 80–95 % ostatních anogenitálních karcinomů souvisejících s HPV u mužů i žen. Přidání HPV genotypu 31/33/45/52/58 zvyšuje přínos vakcíny až o 20 % pro invazivní karcinomy děložního hrdla a o 35 % pro cervikální prekancerózy. Účinnost proti lézím spojenými s genotypy HPV 31/33/45/52/58 dosahuje 97 %. Očkování novou vakcínou proti HPV jistě v budoucnu ovlivní programy screeningu karcinomu děložního hrdla.
Key words: human papillomavirus – HPV‑associated diseases – prevention – nine‑valent HPV vaccine – Gardasil 9®.
Summary:
Human papillomavirus (HPV) infection can cause cervical, vaginal, vulvar, penile, anal, and oropharynx cancers and genitals warts, too. These diseases are preventable thanks to HPV vaccination. There is the new nine valent vaccine (HPV 6/11/16/18/31/33/45/52/58) available on the market. It provides high and consistent protection against infections and diseases related to the genotypes included in the vaccine. The nine valent HPV vaccine shows a significantly increased impact compared to the quadrivalent vaccine (HPV 6/11/16/18) and it covers around 90 % of cervical cancers in women and 80–95 % of other HPV associated anogenital cancers in both men and women. The addition of HPV 31/33/45/52/58 increases the benefit of the vaccine by up to 20 % for invasive cervical cancers and up to 35 % for cervical precanceroses. The efficacy against lesions related to HPV 31/33/45/52/58 reaches 97 %. The vaccination with new HPV vaccine will definitely affect cervical cancer screening programs in the future.
Úvod
Poprvé publikoval hypotézu o možné úloze lidského papilomaviru (human papillomavirus, HPV) v etiopatogenezi karcinomu děložního hrdla Harald zur Hausen v roce 1976 a následně v roce 1982 popsal v buňkách karcinomu děložního hrdla objev dvou nových lidských papilomavirů označených jako HPV 16 a HPV 18 [1]. Ale teprve v roce 1995 definovala Mezinárodní agentura pro výzkum nádorových onemocnění (International Agency for Research on Cancer, IARC) genotypy HPV 16 a HPV 18 jako kancerogenní [2]. Objevy vedly k určení infekce HPV jako příčiny karcinomu děložního hrdla a následně také vulvy, vaginy, penisu, anu a dlaždicobuněčných karcinomů hlavy a krku [3,4]. Světová zdravotnická organizace (World Health Organisation, WHO) řadí mezi vysoce rizikové (high‑risk, HR) genotypy zařazené do skupiny 1 HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 [2]. Infekce HPV způsobená vysoce rizikovými genotypy představuje spolu s infekcí Helicobacter pylori a s infekcí vyvolanou viry hepatitidy B a C nejčastější infekční příčinu malignit [3]. Z celkového množství 12,8 milionu nových karcinomů na světě v roce 2008 jich vzniklo asi 610 tisíc (570 tisíc u žen a 39 tisíc u mužů) v důsledku infekce HPV, což odpovídá 4,8 % všech karcinomů [4].
Vakcíny proti infekci HPV
V uplynulých desetiletích byly připraveny ke klinickému použití profylaktické vakcíny složené z vysoce purifikovaných částic podobných viru (virus‑like particles, VLPs) tvořených hlavním papilomavirovým kapsidovým proteinem L1 [5]. V České republice je od 5. prosince 2006 dostupná kvadrivalentní vakcína proti HPV Silgard® (HPV 6/11/16/18) a od 20. října 2007 bivalentní vakcína Cervarix® (HPV 16/18). Obě jsou vysoce účinné proti dvěma nejvíce rozšířeným onkogenním genotypům HPV – 16 a 18, vakcína Silgard® navíc proti dvěma neonkogenním genotypům HPV – 6 a 11. Obě vakcíny indukují masivní koncentrace protilátek, které díky zkřížené protekci chrání i proti prekancerózám a karcinomům asociovaným s jinými genotypy HPV (účinněji chrání Cervarix®). Míra této tzv. cross‑protekce ale časem postupně klesá [6]. Nejvyšší účinnosti dosahuje vakcinace při aplikaci alespoň čtyři až šest měsíců před začátkem pohlavního života. V České republice je očkování vakcínami proti lidským papilomavirům hrazeno ze zdravotního pojištění pro dívky ve věku 13 až 14 let.
Aby se zvýšila ochrana proti chorobám asociovaným i s dalšími vysoce rizikovými genotypy HPV, byla po letech výzkumů vyvinuta a úspěšně uvedena na trh nonavalentní vakcína proti HPV Gardasil 9®, která obsahuje viriony z kapsidových proteinů HPV 6/11/16/18/31/33/45/52/58. Tyto genotypy odpovídají za rozvoj přibližně 90 % těžkých prekanceróz a invazivních karcinomů děložního hrdla [5].
Výběr genotypů pro nonavalentní vakcínu proti HPV
Ve 23 státech USA se uskutečnila v rámci screeningu karcinomu děložního hrdla studie ATHENA s velkou heterogenní kohortou 40 901 žen starších 25 let, která detekovala u 10,3 % žen v děložním hrdle infekci HPV. Výskyt infekce HPV klesal s věkem – na úroveň 6,5 % u žen ve věku 50 let, u starších žen byla prevalence obdobná. Nejčastěji byl zachycen genotyp HPV 16 (1,6 %), následovaly genotypy HPV 52 (1,0 %), HPV 31 (0,8 %), HPV 18 (0,7 %), HPV 39 (0,7 %), HPV 58 (0,7 %), HPV 45 (0,6 %), HPV 35 (0,6 %) a HPV 33 (0,2 %). Infekce více genotypy vykazovala stejné tendence jako infekce jedním genotypem [7]. U žen s abnormálním nálezem onkologické cytologie děložního hrdla, tedy u těch, kterým je v rámci screeningu karcinomu děložního hrdla věnována zvýšená pozornost, byl nejčastějším genotypem opět HPV 16 (6,3 %), následovaly genotypy HPV 52 (2,8 %), HPV 31 (2,5 %), HPV 18 (2,1 %), HPV 35 (2,0 %), HPV 39 (1,8 %), HPV 58 (1,6 %), HPV 45 (1,1 %) a HPV 33 (0,6 %). Zatímco u žen s normálním nálezem onkologické cytologie děložního hrdla byla prevalence infekce HR HPV 9,0 %, u žen s abnormálním nálezem dosahovala 29,7 %, byla tedy třikrát vyšší [7]. Po očkování nonavalentní vakcínou proti HPV by velká část žen nedospěla k nálezu abnormální onkologické cytologie a tím by se ušetřily podstatné finanční prostředky vyhrazené pro zdravotní péči. Navíc Schiffman vypozoroval, že ve studii s 18 000 ženami staršími než 30 let s negativním nálezem onkologické cytologie děložního hrdla a s pozitivním nálezem infekce HR HPV bylo tříleté kumulativní riziko vzniku cervikální intraepiteliální neoplazie (CIN) 3. stupně největší pro genotyp HPV 16 (10,6 %), dále pro genotypy HPV 33 (5,9 %), HPV 18 (5,9 %), HPV 31 (4,5 %), HPV 52 (3,8 %) a HPV 45 (1,7 %) [8].
Velká retrospektivní studie zahrnovala 10 575 parafínových bločků invazivního cervikálního karcinomu, které shromáždil Katalánský onkologický institut v Barceloně. Tyto vzorky z let 1949 až 2009 byly získány ze 38 zemí šesti kontinentů včetně České republiky. Celkem 8 977 (85 %) vzorků bylo pozitivních na HPV. U 89,4 % vzorků pozitivních na HPV byl přítomen alespoň jeden z devíti genotypů (HPV 6/11/16/18/31/33/45/52/58) obsažených v nonavalentní vakcíně. Poměrně velké množství vzorků (18,5 %) bylo pozitivních pouze pro některý z genotypů (HPV 31/33/45/52/58). Přítomnost genotypů HPV 16/18/45 klesala s věkem (trend p < 0,0001), ale prevalence genotypů HPV 31/33/52/58 byla překvapivě vyšší u starších lidí. Na základě výsledků této studie se předpokládá, že počet invazivních karcinomů děložního hrdla by se celosvětově (mimo jiné vzhledem k prodlužujícímu se věku) mohl zvýšit ze 493 tisíc v roce 2012 na 560 tisíc v roce 2025 [9].
Stejný institut organizoval studii potenciální účinnosti nonavalentní vakcíny proti dalším prekancerózám a karcinomům (vulva, vagina a anus). Identickou metodikou vyšetřili 1 709 vulvárních, 408 vaginálních a 329 análních ženských karcinomů a 587 těžkých vulvárních intraepiteliálních neoplazií (VIN 2/3), 189 vaginálních intraepiteliálních neoplazií (VaIN 2/3) a 29 análních intraepiteliálních neoplazií (AIN 2/3). Infekce HPV DNA byla přítomna u 28,6 % vulvárních, 74,3 % vaginálních a u 90,0 % análních karcinomů a u 86,7 % VIN 2/3, u 95,8 % VaIN 2/3 a ve 100 % prekanceróz typu AIN 2/3. Zastoupení devíti genotypů přítomných ve vakcíně se lišilo relativně mírně, v rozmezí od 85,5 % (95% interval spolehlivosti – confidence interval – CI: 81,0–89,2) u vaginálního do 95,9 % (95% CI: 93,0–97,9) u análního karcinomu, zatímco výskyt pouze genotypů HPV 31/33/45/52/58 byl pozorován v rozmezí od 7,8 % (95% CI: 5,0–11,4) u karcinomu anu do 20,5 % (95% CI: 16,1–25,4) u karcinomu pochvy [10].
Také studie u české populace potvrdila zásadní význam prevence proti onemocněním spojeným s genotypy HPV 31/33/45/52/58. Tachezy a kol. na vzorku 86 dlaždicobuněčných karcinomů děložního hrdla, 49 vulvárních a 22 análních karcinomů, 649 cervikálních a 46 vulvárních prekanceróz detekovala léze asociované s HPV 31/33/45/52/58 u 18 % prekanceróz a u 16 % karcinomů [11].
Analýza jiných šesti retrospektivních multicentrických studií ve Francii vypočítala potenciální účinnost nonavalentní vakcíny proti HPV na 85 % (nízký odhad) až 92 % (vysoký odhad) pro dlaždicobuněčný karcinom děložního hrdla, na 77–90 % pro CIN 2/3, na 26–56 % pro CIN 1, na 81–93 % pro anální karcinom a na 41–44 % pro karcinomy hlavy a krku. Ve srovnání s kvadrivalentní vakcínou by se účinnost potenciálně zvýšila o 9,9–15,3 % pro dlaždicobuněčný karcinom děložního hrdla, o 24,7–33,3 % pro CIN 2/3, o 12,3–22,7 % pro CIN 1, o 8,5–10,4 % pro anální karcinom a jen minimálně (o 0,0–1,6 %) pro karcinomy hlavy a krku [12].
Účinnost nonavalentní vakcíny proti HPV
Kvůli zvýšení účinnosti oproti vakcínám předchozí generace bylo tedy do nonavalentní vakcíny přidáno pět dalších genotypů HPV – 31, 33, 45, 52, 58, u některých stávajících genotypů HPV, a sice u HPV 6, 16 a 18, bylo zvýšeno množství antigenu a také se zvýšilo množství přítomného adjuvans (tab. 1). Z etických důvodů ne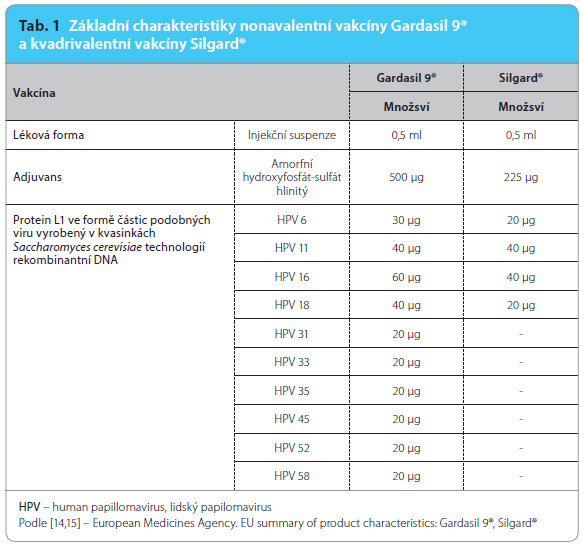 bylo možné provést placebem kontrolovanou studii pro studium účinnosti nonavalentní vakcíny proti HPV, proto kontrolní skupinu tvořily ženy po aplikaci kvadrivalentní vakcíny proti HPV. Pro léze související s genotypy HPV 6/11/16/18 byla pro nonavalentní vakcínu proti HPV prokázána non‑inferiorita. Účinnost proti onemocněním spojeným s HPV 31/33/35/45/52/58 a také proti perzistující infekci těmito genotypy dosahovala u nonavalentní vakcíny proti HPV více než 96 % [13].
bylo možné provést placebem kontrolovanou studii pro studium účinnosti nonavalentní vakcíny proti HPV, proto kontrolní skupinu tvořily ženy po aplikaci kvadrivalentní vakcíny proti HPV. Pro léze související s genotypy HPV 6/11/16/18 byla pro nonavalentní vakcínu proti HPV prokázána non‑inferiorita. Účinnost proti onemocněním spojeným s HPV 31/33/35/45/52/58 a také proti perzistující infekci těmito genotypy dosahovala u nonavalentní vakcíny proti HPV více než 96 % [13].
Studie prokazující účinnost přípravku Gardasil 9® proti genotypům HPV 6, 11, 16, 18 byla provedena v populaci 13 587 žen ve věku 16–26 let a u 600 dívek ve věku 9–15 let. Statistická analýza non‑inferiority byla provedena v sedmém měsíci po aplikaci vakcíny Gardasil 9® nebo Silgard® (kontrolní skupina) srovnáním kompetitivního imunologického stanovení protilátek anti‑HPV 6, anti‑HPV 11, anti‑HPV 16 a anti‑HPV 18 na bázi Luminexu (competitive Luminex Immunoassay, cLIA). Geometrické průměrné hodnoty titrů (geometric mean titers, GMT) protilátek nebyly pro Gardasil 9® nižší než imunitní odpověď po aplikaci vakcíny Silgard®. Celkově 99,6 % až 100 % jedinců sedm měsíců po aplikaci vakcíny Gardasil 9® indukovalo séropozitivní protilátky proti všem devíti genotypům obsaženým v nonavalentní vakcíně [14].
Účinnost přípravku Gardasil 9® proti genotypům HPV 31, 33, 45, 52 a 58 byla hodnocena ve dvojitě zaslepené, randomizované klinické studii kontrolované aktivním komparátorem, která zahrnovala 14 204 žen ve věku 16–26 let (Protokol 001, větev s vakcínou Gardasil 9® měla 7 099 žen, kontrolní skupina 7 105 žen). Jedinci byli sledováni až do 54. měsíce s mediánem délky sledování 40 měsíců. Přípravek Gardasil 9® byl účinný v prevenci perzistující infekce i v prevenci onemocnění asociovaných s genotypy HPV 31, 33, 45, 52 a 58 (tab. 2). Gardasil 9® rovněž snižoval incidenci abnormalit nálezu onkolog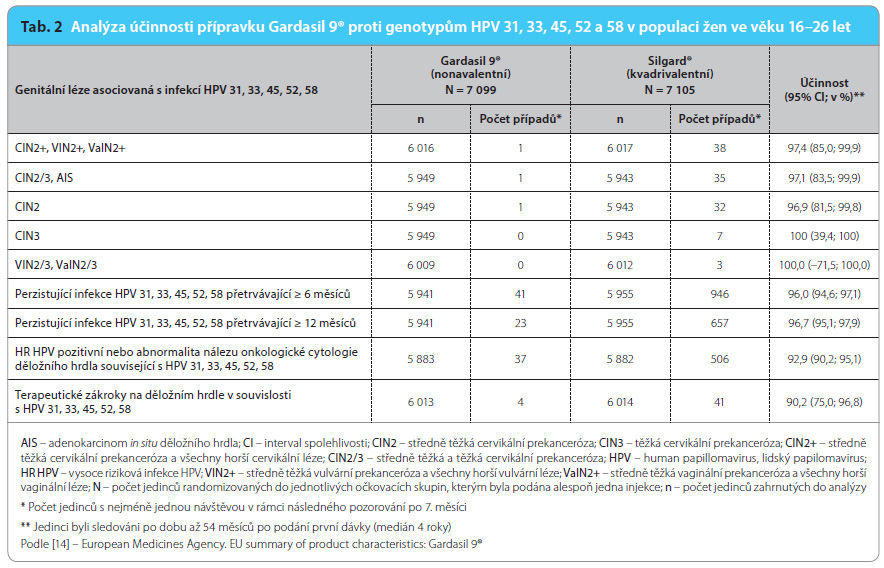 ické cytologie děložního hrdla, frekvenci biopsií na děložním hrdle a na vnějších genitáliích a také počet terapeutických chirurgických zákroků na děložním hrdle souvisejících s genotypy HPV 31, 33, 45, 52 a 58 (tab. 2) [14]. Potenciální účinnost nonavalentní vakcíny proti ženským anogenitálním karcinomům asociovaným s genotypy HPV obsaženými ve vakcíně zobrazuje tab. 3.
ické cytologie děložního hrdla, frekvenci biopsií na děložním hrdle a na vnějších genitáliích a také počet terapeutických chirurgických zákroků na děložním hrdle souvisejících s genotypy HPV 31, 33, 45, 52 a 58 (tab. 2) [14]. Potenciální účinnost nonavalentní vakcíny proti ženským anogenitálním karcinomům asociovaným s genotypy HPV obsaženými ve vakcíně zobrazuje tab. 3.
Stejně jako u vakcín proti HPV předchozí generace byly u adolescentů ve věku 9–15 let indukovány vyšší koncentrace protilátek [5]. Studie dále prokázaly, že vakcína je bezpečná a při současné aplikaci s jinými vakcínami se nesnižuje její imunogenita. Ve srovnání s kvadrivalentní vakcínou proti HPV se objevilo více lokálních reakcí jako logický důsledek většího množství antigenů a přítomného adjuvans. Výskyt systémových nežádoucích událostí byl ale srovnatelný [13]. Na základě těchto studií byla nonavalentní vakcína proti HPV dne 10. prosince 2014 zaregistrována v USA pro dívky a ženy ve věku 9–26 let a pro chlapce ve věku 9–15 let pod obchodním názvem Gardasil 9®. Cílem dalšího výzkumu je prokázat dostatečnou účinnost dvoudávkového schématu u adolescentů a studovat účinnost vakcíny aplikované chlapcům a mladým mužům ve věku do 26 let.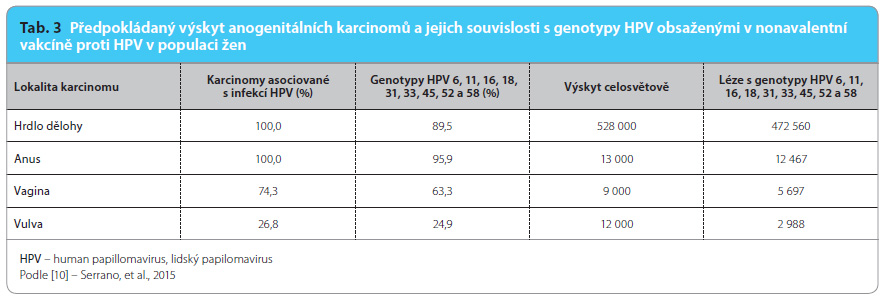
Terapeutická indikace nonavalentní vakcíny proti HPV
Přípravek Gardasil 9® je indikován k aktivní imunizaci jedinců ve věku od devíti let proti následujícím onemocněním způsobeným lidským papilomavirem (HPV) typu 6, 11, 16, 18, 31, 33, 45, 52 a 58: premaligní léze a cervikální, vulvární, vaginální a anální karcinomy způsobené typy HPV obsaženými v očkovací látce a genitální bradavice (condylomata acuminata) způsobené specifickými genotypy HPV [14].
Základní očkovací schéma sestává ze tří samostatných 0,5ml dávek podaných ve schématu 0, 2, 6 měsíců. Pokud je nezbytné použití alternativního očkovacího schématu, musí být druhá dávka podána alespoň jeden měsíc po aplikaci první dávky a třetí dávka musí být podána alespoň tři měsíce po aplikaci druhé dávky. Všechny tři dávky musejí být podány v průběhu jednoho roku. Očkovací látku je nutno aplikovat intramuskulární injekcí. Preferovaným místem aplikace je oblast deltového svalu horní paže nebo horní anterolaterální oblast stehna [14].
Závěr
Uvedení nové nonavalentní vakcíny proti HPV do klinického použití je dalším významným krokem k eradikaci onemocnění souvisejícího s HPV. Ochrana proti infekci dvěma nízce rizikovými genotypy HPV – HPV 6 a 11 – a sedmi vysoce rizikovými genotypy – HPV 16, 18, 31, 33, 45, 52 a 58 – by měla zabránit vzniku téměř 90 % případů karcinomů děložního hrdla a také 96 % análních, 85 % vaginálních a 87 % vulvárních karcinomů asociovaných s HPV. Nicméně u vaginálních a vulvárních karcinomů se prognózy provádějí obtížně vzhledem k malému množství případů. Oproti kvadrivalentní vakcíně HPV by se měla zvýšit účinnost až o 35 % pro těžké cervikální léze (CIN 2+) a až o 20 % pro cervikální invazivní karcinom [5]. Nová vakcína je vysoce bezpečná. Je indikována i k prevenci vzniku lézí asociovaných s HPV u obou pohlaví. V důsledku zařazení této vakcíny do očkovacích kalendářů dojde k zásadní změně ve screeningových programech karcinomu děložního hrdla [5].
Seznam použité literatury
- [1] zur Hausen H. Human genital cancer: synergism between two virus infections or synergism between a virus infection and initiating events? Lancet 1982; 2: 1370–1372.
- [2] Bouvard V, Baan R, Straif K, et al. A review of human carcinogens – Part B: biological agents. Lancet Oncol 2009; 10: 321–322.
- [3] Forman D, de Martel C, Lacey CJ, et al. Global burden of human papillomavirus and related diseases. Vaccine 2012; 30 Suppl 5: F12–23. doi: 10.1016/j.vaccine.2012.07.055.
- [4] Giuliano AR, Nyitray AG, Kreimer AR, et al. EUROGIN 2014 roadmap: differences in human papillomavirus infection natural history, transmission and human papillomavirus related cancer incidence by gender and anatomic site of infection. Int J Cancer 2015; 136: 2752–2760.
- [5] Pils S, Joura EA. From the monovalent to the nine valent HPV vaccine. Clin Microbiol Infect 2015; 21: 827–833.
- [6] Malagón T, Drolet M, Boily MC, et al. Cross protective efficacy of two human papillomavirus vaccines: a systematic review and meta analysis. Lancet Infect Dis 2012; 12: 781–789.
- [7] Monsonego J, Cox JT, Behrens C, et al. Prevalence of high risk human papilloma virus genotypes and associated risk of cervical precancerous lesions in a large U.S. screening population: data from the ATHENA trial. Gynecol Oncol 2015; 137: 47–54.
- [8] Schiffman M, Burk RD, Boyle S, et al. A study of genotyping for management of human papillomavirus positive, cytology negative cervical screening results. J Clin Microbiol 2015; 53: 52–59.
- [9] Serrano B, Alemany L, Tous S, et al. Potential impact of a nine valent vaccine in human papillomavirus related cervical disease. Infect Agent Cancer 2012; 7: 38.
- [10] Serrano B, de Sanjosé S, Tous S, at al. Human papillomavirus genotype attribution for HPVs 6, 11, 16, 18, 31, 33, 45, 52 and 58 in female anogenital lesions. Eur J Cancer 2015; 51: 1732–1741.
- [11] Tachezy R, Smahelova M, Salakova J, et al. Human Papillomavirus Genotype Distribution in Czech Women and Men with Diseases Etiologically Linked to HPV. PLoS One 2011; 6: e21913. http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0021913. Navštíveno 25. 4. 2016.
- [12] Riethmuller D, Jacquard AC, Lacau St Guily J, et al. Potential impact of a nonavalent HPV vaccine on the occurrence of HPV related diseases in France. BMC Public Health 2015; 15: 453.
- [13] Joura EA, Giuliano AR, Iversen OE, et al. Broad Spectrum HPV Vaccine Study. A 9 valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med 2015; 372: 711–723.
- [14] European Medicines Agency; EU summary of product characteristics: Gardasil 9®. http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/003852/WC500189111.pdf. Navštíveno 25. 4. 2016.
- [15] European Medicines Agency; EU summary of product characteristics: Silgard®. http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/000732/WC500051549.pdf. Navštíveno 12. 5. 2016.