Nové léky v terapii epilepsie
Souhrnný článek se zabývá současným postavením nových antiepileptik se zaměřením na ta, která byla zavedena do klinické praxe v posledních pěti letech, a krátce představuje léky, které jsou již v poslední fázi vývoje a lze je v nejbližší době v klinické praxi očekávat.
Úvod
Epilepsie je časté neurologické onemocnění s prevalencí aktivní epilepsie asi 8–9 případů na 1000 obyvatel. V České republice trpí některou z forem epilepsie asi 70 000 lidí. Prevalence epilepsie je vyšší v dětské populaci. Klinické projevy epileptických záchvatů jsou různorodé. Podle klasifikace epileptických záchvatů z roku 1981 dělíme epileptické záchvaty do dvou velkých skupin, na záchvaty fokální (parciální) a generalizované.
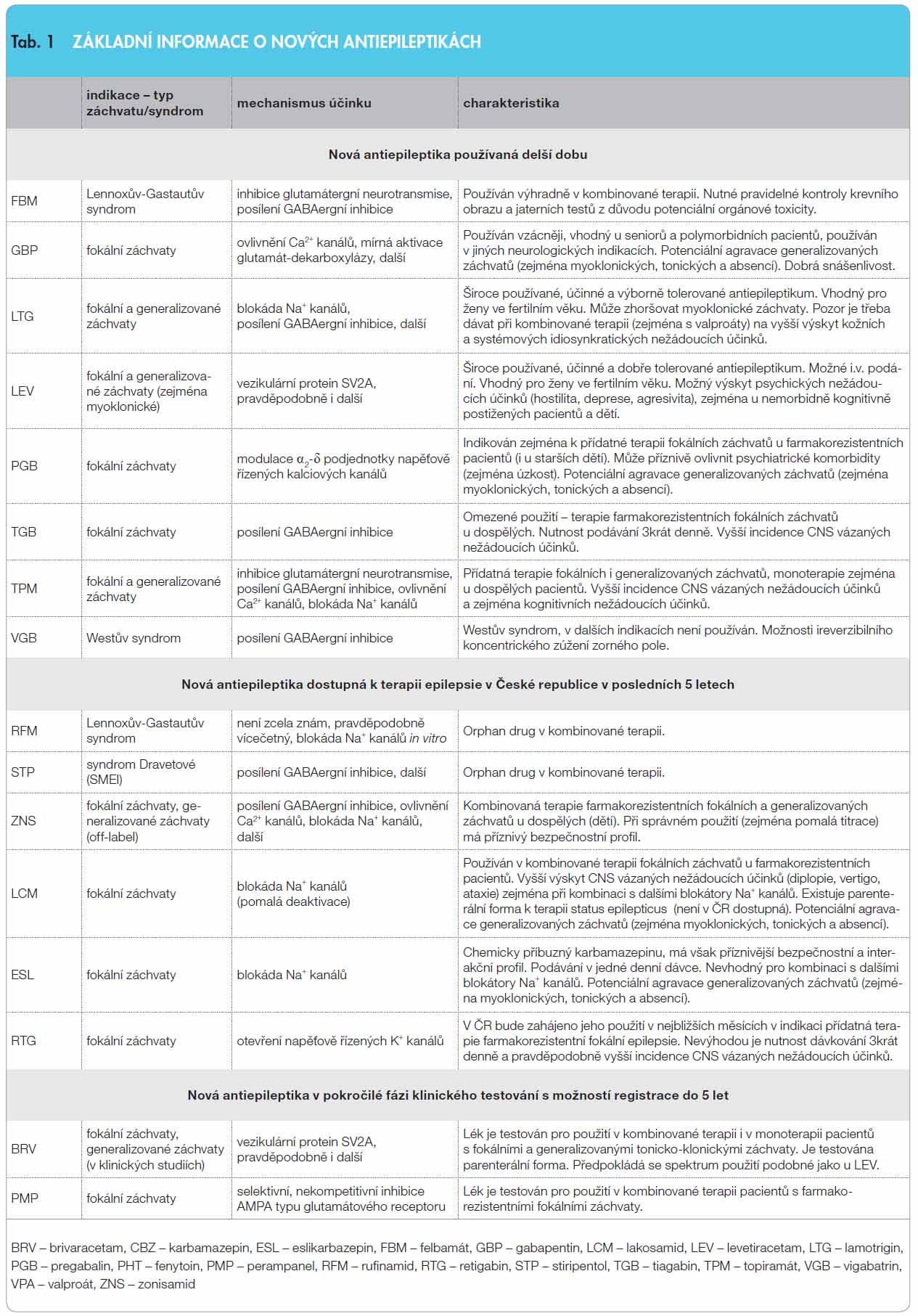 Antiepileptika jsou léky, které epilepsii neléčí, ale potlačují její projevy, tedy epileptické záchvaty. Éra moderní terapie epilepsie byla zahájena přesně před 100 lety, když byl v roce 1912 do terapie epilepsie zaveden fenobarbital. Až do konce 80. let minulého století byla objevena a do klinické praxe zavedena další antiepileptika, kterým říkáme klasická antiepileptika. V tuto dobu začíná éra takzvaných nových antiepileptik. Zatímco antiepileptický účinek klasických antiepileptik byl objeven víceméně náhodně, nová antiepileptika většinou byla a jsou a priori syntetizována za účelem léčby epilepsie. Do klinické praxe jich za posledních dvacet let bylo zavedeno více než 15. Některá z nich našla velmi široké uplatnění v terapii epilepsie, jiná mají pouze omezené indikace a některá z nich se používají i v dalších neurologických i „neneurologických“ indikacích (léčba bolesti, migréna, psychiatrické diagnózy a další).
Antiepileptika jsou léky, které epilepsii neléčí, ale potlačují její projevy, tedy epileptické záchvaty. Éra moderní terapie epilepsie byla zahájena přesně před 100 lety, když byl v roce 1912 do terapie epilepsie zaveden fenobarbital. Až do konce 80. let minulého století byla objevena a do klinické praxe zavedena další antiepileptika, kterým říkáme klasická antiepileptika. V tuto dobu začíná éra takzvaných nových antiepileptik. Zatímco antiepileptický účinek klasických antiepileptik byl objeven víceméně náhodně, nová antiepileptika většinou byla a jsou a priori syntetizována za účelem léčby epilepsie. Do klinické praxe jich za posledních dvacet let bylo zavedeno více než 15. Některá z nich našla velmi široké uplatnění v terapii epilepsie, jiná mají pouze omezené indikace a některá z nich se používají i v dalších neurologických i „neneurologických“ indikacích (léčba bolesti, migréna, psychiatrické diagnózy a další).
Antiepileptika modifikují excitabilitu neuronů ovlivněním receptorů a ionoforů a tím zabraňují rozvoji epileptických záchvatů. Mohou přímo i nepřímo ovlivňovat sodíkové, kalciové a draslíkové kanály, potencovat GABAergní inhibici postsynaptické membrány nebo tlumit excitační glutamát-ergní neurotransmisi.
Některá antiepileptika mají jediný, silný mechanismus účinku, zejména na sodíkové kanály (např. karbamazepin – CBZ, fenytoin – PHT) nebo ovlivnění GABAergní inhibice (např. tiagabin – TGB, vigabatrin – VGB). Tato antiepileptika jsou většinou účinná na fokální záchvaty, ale nemají efekt u záchvatů generalizovaných, nebo dokonce mohou některé jejich typy (zejména absence, tonické, atonické a myoklonické záchvaty) zhoršovat. Zhoršení frekvence nebo průběhu záchvatů při terapii antiepileptiky v tomto případě označujeme jako „paradoxní agravace záchvatů“. Tato antiepileptika nazýváme úzkospektrá.
Na druhé straně řada antiepileptik má více typů účinku na výše popsané molekulární struktury (např. valproát – VPA, lamotrigin – LTG, topiramát – TPM). Těmto antiepileptikům říkáme širokospektrá. Potlačují jak fokální, tak i generalizované záchvaty a mají nízký potenciál k paradoxní agravaci záchvatů.
Klasická antiepileptika
Podrobný výčet klasických antiepileptik, jejich klinické indikace a vedlejší účinky byly již opakovaně v české literatuře publikovány, proto odkazuji na tyto souhrnné práce [1–3].
Nová antiepileptika
Jak již bylo zmíněno výše, od konce 80. let minulého století byla do klinické praxe zavedena řada tzv. nových antiepileptik. Podobně jako u klasických antiepileptik byly již informace o těchto lécích v české literatuře opakovaně publikovány [3–6].
Dvě, v klinické praxi nejpoužívanější, nová antiepileptika představují LTG a levetiracetam (LEV). Mechanismem účinku LTG je blokáda napěťově řízených Na+ kanálů, dále působí na Ca2+ kanály a snižuje aktivitu excitačních aminokyselin. LTG je širokospektré antiepileptikum účinné u téměř všech typů epileptických záchvatů. Má minimální potenciál k paradoxní agravaci záchvatů. Patří k nejpoužívanějším antiepileptikům jak ve světě, tak i v České republice. Mimo účinnost je jeho nespornou výhodou i velmi dobrá snášenlivost. Z důvodu malého teratogenního potenciálu je LTG nejčastějším lékem používaným v ČR u žen ve fertilním věku.
Všechny mechanismy účinku LEV nejsou objasněny, pravděpodobně ale působí prostřednictvím vazby na synaptický vezikulární protein SV2A. Je indikován u fokálních i generalizovaných záchvatů v přídatné terapii u dospělých i dětí. Jedná se o lék s minimálním interakčním potenciálem, lze jej kombinovat s jakýmkoliv jiným antiepileptikem. Je dostupný i ve formě pro parenterální použití v léčbě kumulace záchvatů a v terapii status epilepticus. Podobně jako LTG je často používán u žen ve fertilním věku.
VGB je lékem první volby u infantilních spasmů v pediatrické epileptologii. Je lékem účinným i u fokálních záchvatů, nicméně jeho podávání v této indikaci je limitováno rizikem vzniku koncentrického zúžení zorného pole, vyskytujícím se přibližně u 30–40 % pacientů.
Felbamát (FBM) je indikován pouze k terapii Lennoxova-Gastautova syndromu v dětském i dospělém věku.
Gabapentin (GBP) je lékem používaným od poloviny 90. let minulého století. V epileptologii jej lze využít v terapii fokálních záchvatů. Vzhledem k nízké incidenci CNS vázaných nežádoucích účinků může být GBP vhodným lékem u seniorů a pacientů s řadou komorbidit a s polyterapií. GBP je v posledních letech podáván častěji v jiných indikacích, zejména při bolesti, a jeho použití v dospělé i dětské epileptologii je v současnosti spíše vzácností.
TGB je indikován v přídatné terapii fokálních záchvatů dospělých a dětí od 12 let. Zhoršuje některé z generalizovaných záchvatů. V České republice se v současné době používá jen minimálně.
Pregabalin (PGB) je v České republice indikován pro přídatnou terapii dospělých pacientů s fokálními záchvaty. V přídatné terapii je používán i v dětské epileptologii u starších dětí u stejného typu záchvatů. Řada kontrolovaných i postmarketingových studií prokazuje výbornou účinnost u fokálních záchvatů a dobrou snášenlivost.
V další části tohoto souhrnného článku se budu zabývat podrobněji těmi antiepileptiky, která se začala v České republice používat v posledních pěti letech.
Nová antiepileptika dostupná k terapii epilepsie v ČR v posledních pěti letech
Rufinamid
Rufinamid (RFM) je od roku 2007 na seznamu European Medicines Agency (EMA) jako orphan drug (lék, který byl vyvinut a používá se v prevenci nebo v terapii vzácnějších onemocnění) v přídatné terapii pacientů s Lennoxovým-Gastautovým syndromem. V posledních třech letech je v této indikaci používán i v České republice. Jeho jednoznačný mechanismus účinku nebyl do současnosti zcela definován. RFM se může navzájem metabolicky ovlivňovat s některými jinými antiepileptiky, která se metabolizují přes izoenzymy P-450 (např. CBZ, LTG, TPM). Několik klinických studií prokázalo účinnost RFM u pacientů s generalizovanými tonicko-klonickými, tonickými, atonickými, ale i fokálními záchvaty [7–10]. Mezi nejčastější vedlejší účinky patří nechutenství, nauzea, vertigo, somnolence, ataxie a dvojité vidění. Lék se v pediatrické populaci podává v dávkách 25–45 mg/kg/den, u dospělých v rozmezí 1600–3200 mg denně.
Stiripentol
Také stiripentol (STP) je veden na seznamu EMA jako orphan drug od roku 2007 s výlučnou indikací syndrom Dravetové (severe myoclonic epilepsy in infancy – SMEI) v přídatné terapii (nejčastěji s klobazamem, CLB, a s VPA). Mechanismem účinku STP je potenciace GABAergní neurotransmise ovlivněním chloridového kanálu, má však i další experimentálně prokázané účinky. Je významným hepatálním inhibitorem řady izoenzymů cytochromu P-450 a tím zvyšuje sérové hladiny řady antiepileptik, včetně CLB a VPA [11]. Jeho jediná klinická indikace je uvedena výše [12].
Zonisamid
V roce 2008 bylo zahájeno používání zonisamidu (ZNS) v České republice. Situace tohoto nového antiepileptika je zcela jiná než situace ostatních antiepileptik. V roce 1989 začal být používán v terapii epilepsie v Japonsku, v roce 2000 v USA a teprve až v letech 2004–2005 v Evropě. Protože se ZNS používá již více než dvacet let, je dostatek extenzivních zkušeností s touto léčbou. Jedná se o širokospektrý lék s více typy mechanismů účinku (inhibice Na+ a Ca2+ kanálů, ovlivnění GABA receptorů, inhibice karboanhydrázy), který je dle SPC indikován pouze v přídatné terapii fokálních záchvatů. Tato indikace vznikla na základě výsledků randomizovaných studií v posledních dvaceti letech [13–16]. Tyto studie prokázaly signifikantně vyšší účinnost ZNS (zejména v dávkách vyšších než 300 mg) oproti placebu. Výsledky kontrolovaných studií byly potvrzeny i v klinické praxi a některými otevřenými naturalistickými studiemi [17].
ZNS se podává v jedné nebo ve dvou (častěji) denních dávkách v rozmezí 200–500 mg denně u dospělých pacientů. Ve stejné indikaci se podává ZNS u dětí, jedná se nicméně o off-label použití, protože neexistují kontrolované studie u dětí s fokální epilepsií. Na druhé straně ale existují bohaté zkušenosti s podáváním ZNS u dětí, proto není důvod bránit léčbě ZNS v indikaci farmakorezistentní fokální epilepsie v dětském věku [18]. Vzhledem k tomu, že se jedná o lék širokospektrý, byl ZNS také zkoušen i v dalších epileptologických indikacích (idiopatické i symptomatické generalizované epilepsie: například Lennoxův-Gastautův syndrom, Westův syndrom, juvenilní myoklonická epilepsie, epilepsie s absencemi, progresivní myoklonické epilepsie a další) [19–22].
ZNS tak v současné době patří mezi účinná a širokospektrá antiepileptika používaná především v přídatné terapii řady typů epilepsií a záchvatů. Je dobře snášen, mezi jeho nejčastější vedlejší účinky patří somnolence, vertigo a gastrointestinální dyskomfort. V současné době probíhá kontrolovaná studie hodnotící efekt ZNS u pacientů s nově diagnostikovanou epilepsií.
Lakosamid
Lakosamid (LCM) je v ČR používán od roku 2010. Zatím nejsou objasněny všechny mechanismy jeho účinku, nicméně LCM je inaktivátorem Na+ kanálů. LCM nemá žádné zásadní farmakokinetické interakce s ostatními antiepileptiky a je registrován pro přídatnou terapii pacientů s fokální epilepsií starších 16 let v dávkách 200–400 mg na den. Podává se ve dvou denních dávkách. LCM prokázal účinnost ve třech randomizovaných kontrolovaných studiích u pacientů s farmakorezistentní fokální epilepsií v přídatné terapii oproti placebu [23–25]. Post-hoc analýza kontrolovaných studií ukázala, že je výhodnější podávat LCM s léky, které nejsou blokátory Na+ kanálů. U pacientů, u kterých byl LCM podáván s antiepileptiky, která nejsou blokátory Na+ kanálů, bylo dosaženo vyšší účinnosti LCM a nižšího výskytu vedlejších účinků [26]. Recentně byla publikována práce prokazující dobrou dlouhodobou účinnost LCM u pacientů s fokální epilepsií [27]. Lék je relativně dobře tolerován, mezi nejčastější vedlejší účinky patří dvojité vidění, vertigo a somnolence. V současné době probíhá klinická studie hodnotící efekt LCM u pacientů s nově diagnostikovanou epilepsií. Existuje také parenterální forma LCM pro léčbu kumulace záchvatů a status epilepticus, ta ovšem není zatím v této chvíli v České republice dostupná.
Eslikarbazepin
Eslikarbazepin (ESL) je další nové antiepileptikum ze skupiny tzv. Na+ blokátorů. Chemicky je příbuzný CBZ, tedy léku 1. volby u fokální epilepsie. Z hlediska farmakokinetických vlastností je výhodnější než CBZ z následujících důvodů:
- minimálně indukuje hepatální enzymatický systém vázaný na cytochrom P-450;
- metabolity ESL jsou odstraňovány převážně renální exkrecí;
- z důvodů 1 a 2 má minimum interakcí s ostatními antiepileptiky a jinými léky;
- léčbu provází nižší incidence vedlejších účinků;
- lze jej podávat 1krát denně.
Klinická účinnost a snášenlivost ESL byla před jeho uvedením na trh hodnocena ve třech placebem kontrolovaných klinických studiích u pacientů s farmakorezistentní fokální epilepsií [28–31]. Všechny studie shodně prokázaly statisticky signifikantně vyšší redukci počtu záchvatů u pacientů léčených ESL (v přídatné terapii) v dávkách 800 mg a 1200 mg denně při srovnání s placebem.
Podobné výsledky byly získány i hodnocením dlouhodobé účinnosti v otevřené studii navazující na studie placebem kontrolované [32]. ESL je v současné době indikován v přídatné terapii dospělých pacientů s fokální epilepsií. V současnosti probíhají studie analyzující účinnost a snášenlivost ESL v přídatné terapii u dětí a seniorů (starších 65 let) a v monoterapii fokální epilepsie u dospělých pacientů.
Mezi nejčastěji referované vedlejší účinky patří: závratě, somnolence, bolesti hlavy a dvojité vidění. Tyto vedlejší účinky jsou ve většině případů ovlivnitelné úpravou dávkování léku.
V blízké budoucnosti by měl ESL nahradit CBZ u těch pacientů, u kterých je CBZ sice účinný, ale má vedlejší účinky.
Retigabin
Retigabin (RTG) je antiepileptikum, které se v České republice dostane na trh v následujících měsících. RTG má zcela ojedinělý mechanismu účinku, který se u ostatních antiepileptik nevyskytuje. RTG primárně působí prostřednictvím otevření napěťově řízených draslíkových kanálů a tímto mechanismem stabilizuje klidový membránový potenciál. RTG je extenzivně metabolizován, především hepatální glukuronidizací. Má pravděpodobně velmi nízkou potenci indukovat nebo inhibovat hepatální metabolismus vázaný na cytochrom P-450. Studie prokázaly možnost prodloužení QT intervalu na EKG při vyšších dávkách léku, proto je třeba postupovat s velkou opatrností při podávání RTG spolu s dalšími léky, které QT interval prodlužují. RTG je nutno podávat ve 3 oddělených denních dávkách.
Tři randomizované, placebem kontrolované studie prokázaly účinnost RTG u pacientů s farmakorezistentní fokální epilepsií v přídatné léčbě v dávkách 600 mg, 900 mg a 1200 mg denně [32–35]. Mezi nejčastější vedlejší účinky patří motání hlavy, somnolence, únava a stavy zmatenosti, které byly v kontrolovaných studiích přítomny u 9 % pacientů. RTG bude podáván v první fázi výhradně pacientům s farmakorezistentní fokální epilepsií v přídatné terapii.
Nová antiepileptika v pokročilé fázi klinického testování s možností registrace do pěti let
Brivaracetam
Brivaracetam (BRV) je 4-n-propyl analog LEV, jednoho ze dvou nejpoužívanějších nových antiepileptik. Podobně jako LEV se váže na vezikulární protein SV2A a mimo to inhibuje napěťově řízené Na+ kanály. Jeho chemická podobnost s LEV předpokládá jeho širokospektrou účinnost u pacientů s různými typy epileptických záchvatů. BRV je hydrolyzován v játrech a při vyšších dávkách může snižovat plazmatickou hladinu CBZ a PHT. Několik studií fáze II a III prokázalo účinnost BRV při srovnání s placebem v přídatné terapii fokálních epilepsií [36–38]. Vedlejší účinky byly klasifikovány jako mírné, nejčastěji se vyskytovaly: bolesti hlavy, únava, vertigo a somnolence. Zdá se, že podobně jako LEV bude i BRV mít příznivý bezpečnostní profil. V jedné z kontrolovaných studií [37] bylo procento pacientů vyřazených ze studie pro vedlejší účinky u BRV srovnatelné s placebem. V současné době probíhá celosvětově několik studií s BRV, včetně studie hodnotící účinnost BRV v monoterapii a jeho snášenlivost při parenterálním podání. V současnosti se testují dávky od 50 mg do 200 mg BRV denně.
Perampanel
Perampanel (PMP) je dalším novým antiepileptikem, které se nachází v pokročilé fázi klinického testování. Lék byl vyvinut jako selektivní, nekompetitivní antagonista AMPA typu glutamátového receptoru. V animálních studiích prokázal PMP širokou účinnost u nejrůznějších modelů epilepsie. Několik studií fáze II a III klinického zkoušení prokázalo jeho účinnost proti placebu [39–40] u pacientů s refrakterní fokální epilepsií. V současné době probíhají otevřené studie hodnotící jeho dlouhodobou účinnost a snášenlivost v dávkách od 2 mg do 10 mg denně. Nejčastějšími vedlejšími účinky jsou únava, somnolence a závratě, nebyly popsány závažné vedlejší účinky.
V současné době se asi dalších 20 molekul s potencionálním antiepileptickým účinkem nachází v raných fázích klinického testování. V současnosti existují dva proudy vývoje nových antiepileptik.
Jsou vyvíjeny léky, které jsou chemickými deriváty stávajících antiepileptik, mají podobné mechanismy účinku a je snaha, aby způsobovaly méně vedlejších účinků než ta antiepileptika, od nichž jsou chemicky odvozeny.
Dále jsou vyvíjeny léky, které mají oproti dosud používaným antiepileptikům zcela odlišné a unikátní mechanismy účinku.
Závěr
I přes extenzivní farmakologický výzkum zůstává asi 10 % pacientů s epilepsií refrakterních na jakoukoliv farmakologickou terapii, bez naděje na úspěšný epileptochirurgický zákrok. Má proto stále význam zavádět do klinické praxe nová antiepileptika, zejména ta, která mají odlišný farmakologický efekt oproti lékům, jež jsou v klinické praxi používány.
Seznam použité literatury
- [1] Rektor I. Stará a nová antiepileptika u dospělých. Neurol prax 2002; 3: 76–81.
- [2] Kuba R. Antiepileptika a jejich klinické použití v epileptologii. Prakt lékáren 2010; 6: 62–66.
- [3] Kuba R. Léčba farmakorezistentní epilepsie. Prakt lékáren 2012; 8: 71–75.
- [4] Kuba R. Nová antiepileptika v klinické praxi. Neurol prax 2006; 7: 36–42.
- [5] Rektor I, Kuba R. Nová antiepileptika u dospělých – nové informace. Neurol prax 2007; 8: 70–74.
- [6] Hovorka J. Novinky v léčbě epilepsie. Remedia 2009; 19: 366–370.
- [7] Palhagan S, Canger R, Henriksen O, et al. Rufinamide: a double-blind, placebo-controlled proof of principle trial in patients with epilepsy. Epilepsy Res 2001; 43: 115–124.
- [8] Glauser T. Kluger G, Sachdeo R, et al. Rufinamide for generalized seizures associated with Lennox-Gastaut syndrome. Ann Neurol 2008; 70; 1950–1958.
- [9] Brodie MJ, Rosenfeld WE, Vazquez B, et al. Rufinamide for the adjunctive treatment of partial seizures in adults and adolescents; a randomized placebo-controlled trial. Epilepsia 2009; 50; 1899–1909.
- [10] Elger CE, Hermann S, Mann A, et al. A 24-week multicenter, randomized, double-blind, parallel-group, dose-ranging study of rufinamide in adults and adolescents with inadequately controlled partial seizures. Epilepsy Res 2010; 88: 255–263.
- [11] Fisher JL. The effects of stiripentol on GABA(A) receptors. Epilepsia 2011; 52 (Suppl. 2): 76–78.
- [12] Chiron C, Dulac O. The pharmacologic treatment of Dravet syndrome. Epilepsia 2011; 52 (Suppl. 2): 72–75.
- [13] Schmidt D, Jacob R, Loiseau P, et al. Zonisamide for add-on treatment of refractory partial epilepsy: a European double-blind trial. Epilepsy Research 1993; 15: 67–73.
- [14] Faught E, Ayala R, Montouris GG, Leppik IE. Randomized controlled trial of zonisamide for the treatment of refractory partial-onset seizures. Neurology 2001; 57: 1774–1779.
- [15] Sackellares JC, Ramsay RE, Wilder BJ, et al. Randomized, controlled clinical trial of zonisamide as adjunctive treatment for refractory partial seizures. Epilepsia 2004; 45: 610–617.
- [16] Brodie MJ, Duncan R, Vespignani H, et al. Dose--dependent safety and efficacy of zonisamide: a randomized, double-blind, placebo-controlled study in patients with refractory partial seizures. Epilepsia 2005; 46: 31–41.
- [17] Stephen LJ, Kelly K, Wilson EA, et al. A prospective audit of adjunctive zonisamide in an everyday clinical setting. Epilepsy Behav 2010; 17: 455–460.
- [18] Tan HJ, Martland TR, Appleton RE, Kneen R. Effectiveness and tolerability of zonisamide in children with epilepsy: a retrospective review. Seizure 2010; 19: 31–35.
- [19] Ohtahara S. Zonisamide in the management of epilepsy – Japanese experience. Epilepsy Res 2006; 68 (Suppl. 2): 25–33.
- [20] Conry JA. Pharmacologic treatment of the catastrophic epilepsies. Epilepsia 2004; 45 (Suppl. 5): 12–16.
- [21] Mantoan L, Walker M. Treatment options in juvenile myoclonic epilepsy. Curr Treat Options Neurol 2011; 13: 355–370.
- [22] Italiano D, Pezzella M, Coppola A, et al. A pilot open-label trial of zonisamide in Unverricht-Lundborg disease. Mov Disord 2011; 26: 341–343.
- [23] Ben-Menachem E, Biton V, Jatuzis D, et al. Efficacy and safety of oral lacosamide as adjunctive therapy in adults with partial-onset seizures. Epilepsia 2007; 48: 1308–1317.
- [24] Halasz P, Kalviainen R, Mazurkiewicz-Beldzinska M, et al. Lacosamide: efficacy and safety as oral adjuctive therapy in adults with partial seizures. Epilepsia 2009; 50: 443–453.
- [25] Chung S, Sperling M, Biton V, et al. Lacosamide: efficacy and safety as oral adjuctive therapy in adults with partial-onset seizures. Epilepsia 2007; 48 (Suppl. 7): 57.
- [26] Sake JK, Hebert D, Isojärvi J, et al. A pooled analysis of lacosamide clinical trial data grouped by mechanism of action of concomitant antiepileptic drugs. CNS Drugs 2010; 24: 1055–1068.
- [27] Husain A, Chung S, Faught E, et al. Long-term safety and efficacy in patients with uncontrolled partial-onset seizures treated with adjunctive lacosamide: results from a Phase III open-label extension trial. Epilepsia 2012; 53: 521–528.
- [28] Gil-Nagel A, Lopes-Lima J, Almeida L, et al; BIA-2093-303 Investigators Study Group. Efficacy and safety of 800 and 1200 mg eslicarbazepine acetate as adjunctive treatment in adults with refractory partial-onset seizures. Acta Neurol Scand 2009; 120: 281–287.
- [29] Elger C, Halász P, Maia J, et al.; BIA-2093-301 Investigators Study Group. Efficacy and safety of eslicarbazepine acetate as adjunctive treatment in adults with refractory partial-onset seizures: a randomized, double-blind, placebo-controlled, parallel-group phase III study. Epilepsia 2009; 50: 454–463.
- [30] Ben-Menachem E, Gabbai AA, Hufnagel A, et al. Eslicarbazepine acetate as adjunctive therapy in adult patients with partial epilepsy. Epilepsy Res 2010; 89: 278–285.
- [31] Halász P, Cramer JA, Hodoba D, et al.; BIA-2093-301 Study Group. Long-term efficacy and safety of eslicarbazepine acetate: results of a 1-year open-label extension study in partial-onset seizures in adults with epilepsy. Epilepsia 2010; 51: 1963–1969.
- [32] Porter RJ, Partiot A, Sachdeo R, et al.; 205 Study Group. Randomized, Multicenter, Dose-Ranging Trial of Retigabine for Partial-Onset Seizures. Neurology 2007; 68: 1197–1204.
- [33] French JA, Abou-Khalil BW, Leroy RF, et al. RESTORE 1/Study 301 Investigators. Randomized, double-blind, placebo-controlled trial of ezogabine (retigabine) in partial epilepsy. Neurology 2011; 76: 1555–1563.
- [34] Brodie MJ, Lerche H, Gil-Nagel A, et al. Efficacy and safety of adjunctive ezogabine (retigabine) in refractory partial epilepsy. Neurology 2010; 75: 1817–1824.
- [35] Porter RJ, Burdette DE, Gil-Nagel A, et. al. Retigabine as adjunctive therapy in adults with partial-onset seizures: Integrated analysis of three pivotal controlled trials. Epilepsy Res 2012; 16. In press.
- [36] Van Paesschen W, von Rosentiel P. Efficacy and tolerability of brivaracetam as adjunctive treatment for adults with refractory partial-onset epilepsy: platform session 064. 27th International Epilepsy Congress; 2007 Jul 8–12; Singapore.
- [37] Werkahn KJ, Biton V, Johnson ME, et al., On behalf of the N01252 and N01253 Brivaracetam Study Groups. Adjunctive brivaracetam in adults with uncontrolled focal epilepsy: results from two randomized, double-blind, placebo-controlled trials [abstract]. Epilepsia 2010; 51 (Suppl. 4): 150.
- [38] Kwan P. Johnson ME. Merschemke M, et al., on behalf of the N01254 Brivaracetam Study Group. Safety and tolerability of adjunctive brivaracetam in adults with uncontrolled epilepsy: randomized, double-blind, placebo controlled trial, [abstract]. Epilepsia 2010; 51 (Suppl. 4): 152.
- [39] Krauss G, Yang J, Biton V, et al. Determination of maximum tolerated dose (MTD), safety, efficacy, and pharmacokinetics (PK) of perampanel, a selective AMPA receptor antagonist, as adjunctive therapy in subjects with refractory partial seizures [abstract]. Epilepsia 2008; 49 Suppl. 7: 1.106.
- [40] Eisai Co. Ltd. Status of the E2O07 (perampanel) Development Program: termination of Parkinson’s disease clinical development and focus on neuropathic pain and epilepsy indications [media release]. 2008 Apr 11 [online].