Novinky v léčbě epilepsie
Článek uvádí některé novinky v léčbě epilepsie, zejména tato témata: volba antiepileptické léčby podle dvou os daných typem záchvatu/syndromu a typem, individualitou pacienta; informace o nových antiepileptikách, nově registrovaných a v pokročilém stadiu vývoje; pokroky v nefarmakologické invazivní léčbě epilepsie.
Úvod
Epilepsie patří k nejčastějším závažným neurologickým onemocněním. Diagnostické i léčebné možnosti v epileptologii prodělaly v posledních přibližně patnácti letech nesmírný rozvoj. Zlepšila se prognóza onemocnění z hlediska kompenzace záchvatů, ale i kvalita života nemocných s epilepsií. V mnohém se změnila taktika léčby, do terapie vstoupila řada nových moderních antiepileptik a rozvinuly se nefarmakologické invazivní postupy léčby. K dispozici jsou i psychofarmaka bezpečná u epilepsie, zejména nová antidepresiva, resp. atypická antipsychotika. Změnil se posudkový pohled na epilepsii, s úspěchem se daří bořit staré negativistické mýty, pacienti se stávají díky uvedené komplexní péči aktivnější a zapojují se plnohodnotně do života. Všechny tyto oblasti směřují stále a nezadržitelně kupředu. Z širokého spektra novinek v epileptologii jsou pro článek vybrána tři témata: první se týká širšího pohledu na volbu konkrétního antiepileptika, druhé se zabývá aktuálně nově nastupujícími léky a poslední část se věnuje nefarmakologickým invazivním možnostem léčby epilepsie.
Seznam citovaných léčivých látek a jejich zkratek:
AZM – acetazolamid, CBZ – karbamazepin, CLB – klobazam, CZP – klonazepam, BZD – benzodi-a-zepiny, ESL – eslikarbazepin, GBP – gabapentin, LCM – lakosamid, LEV – levetiracetam, LTG – lamotrigin, OXC – oxkarbazepin, PHB – fenobarbital, PHT – fenytoin, PGB – pregabalin, PRIM – primidon, RFM – rufinamid, STIR – stiripentol, SUL – sultiam, TGB – tiagabin, TPM – topiramát, VGB – vigabatrin, VPA – valproát, soli kyseliny valproové, ZNS – zonisamid
Cíl antiepileptické léčby – optimální kvalita života
Antiepileptická léčba je volena podle dvou os: „seizure related“ a „patient related“. Tento koncept je základním vodítkem pro celostní pohled na léčbu nemocných s epilepsií. Antiepileptika totiž neovlivňují pouze epileptické záchvaty, ale řadu dalších mozkových i tělesných funkcí a orgánů u naprosté většiny nemocných na řadu let, ne-li doživotně. Ovlivňují tak celkovou tělesnou a psychickou kondici nemocných s epilepsií, tedy jejich „funkční stav“. Právě optimální kvalita života nemocných je jediným a konečným cílem antiepileptické léčby a zde se jedná o více než pouhou kompenzaci epileptických záchvatů.
Osa I: volba léčby podle typu epileptických záchvatů či epileptického syndromu – „seizure related“
-
generalizovaný tonicko-klonický záchvat (GTCS) – TGB, VGB,
-
absence, myoklonické záchvaty – CBZ, GBP, OXC, TGB, VGB.
Údaje o agravaci záchvatů nejsou, až na jednu výjimku, v české verzi EpiStop uvedeny. Byly však publikovány formou přehledného článku [3] a jsou dostupné v tabelárním přehledu NICE guidelines [2]. Zjednodušeně řečeno, širokospektrá antiepileptika (VPA, LTG, TPM, LEV, ZNS) agravaci záchvatů nevyvolávají, a můžeme je tedy využít tam, kde si konkrétním typem záchvatů či syndromu nejsme jisti. Antiepileptika s užším spektrem účinku (např. CBZ, OXC, GBP, TGB, VGB aj.) jsou účinná jen u některých typů záchvatů a naopak jiné mohou agravovat. Většinou jde o léky indikované u fokálních epilepsií, zhoršující idiopatické generalizované epilepsie. Na tyto aspekty je při volbě antiepileptické léčby podle osy I – „seizure related“ – nutno vždy myslet. I přes dlouhodobou znalost dané problematiky se tento pohled v klinické praxi prosazuje v širší míře až v posledních letech.
Osa II: volba léčby podle typu pacienta – „patient related“
Jde o velmi širokou a relativně novější, mezioborovou oblast epileptologie. Při volbě léčby zohledňujeme konkrétní typ, individualitu pacienta v plné šíři: jeho věk, pohlaví, životní etapu (potenciálně fertilní ženy), tělesný a psychický stav, ostatní farmakoterapii, lékové interakce, ale i faktory psychosociální aj. Možnost výběru antiepileptické léčby z hlediska více aspektů než jen podle typu záchvatů umožnilo až rozšíření škály léků příchodem nových moderních antiepileptik.
V rámci tohoto sdělení jsou uvedeny jen příklady některých častějších problémů dopadu antiepileptické léčby na celkový, interiktální stav nemocných. U dětí je například nutno zohlednit častější výskyt závažných hypersenzitivních reakcí na lék (rash u LTG, CBZ), hepatotoxických reakcí (VPA), kognitivního narušení (PHB, CBZ, TPM aj.), poruch chování (PHM BZD, LEV aj.), hypohidrózy a metabolické acidózy (AZM, SUL, TPM, ZNS) aj.
Velmi široká je problematika léčby žen s epilepsií: kosmetické problémy (PHT, VPA), nadváha (VPA, VGB, GBP, PGB, CBZ), dospívání, poruchy reprodukce u syndromu polycystických ovarií (VPA), interakce s kontraceptivy (induktory hepatálních enzymů CBZ, OXC, PHT, PHB), riziko teratogenicity (polyterapie, vyšší dávky VPA), péče prekoncepční, během gravidity, v období kolem porodu, během kojení a nakonec problematika menopauzy [4–6].
Novějším tématem je epilepsie u starších pacientů se specifickými atributy [7–10]: změna farmakodynamiky (nižší dávky léků) i farmakokinetiky ve vyšším věku, lékové interakce (enzymatické induktory vs. warfarin (!!), antihypertenziva, hypolipidemika, psychofarmaka aj.), polymorbidita, častější výskyt neurotoxických nežádoucích účinků (útlum, kognice, závrativost, pády, zlomeniny, mobilita), častější hyponatremie (CBZ, OXC), výskyt osteopatií a až pětkrát častější výskyt zlomenin femuru a páteře u enzymatických induktorů (změna léčby, event. suplementace Ca2+, vitaminem D3, antiresorpční léčba aj.), výběr a dávkování léků podle jejich eliminace a stavu orgánových funkcí (především renální eliminace – GBP, PGB, LEV, VGB, hepatální eliminace – ostatní antiepileptika), nadváha jako rizikový faktor dalších zdravotních poruch (metabolický syndrom X). Zde se problematika starších nemocných v mnohém prolíná se specifiky léčby mladších polymorbidních pacientů s polyterapií. Některá antiepileptika jsou schopna léčit několik poruch najednou – jedním lékem. Například u polymorbidního pacienta-diabetika s epilepsií, s algickou formou diabetické neuropatie s porušeným spánkem a úzkostí, můžeme pomocí PGB úspěšně léčit fokální epilepsii, bolestivou diabetickou neuropatii, úzkost a účinně zlepšit spánek. PGB navíc nevstupuje do žádných významných interakcí s dalšími farmaky (včetně warfarinu, antihypertenziv, hypolipidemik, antidiabetik). Obdobně můžeme pomocí TPM úspěšně léčit pacienta s epilepsií a migrénou, příznivě může být ovlivněna i jeho případná nadváha. Dalším aktuálním a důležitým tématem jsou psychotropní účinky antiepileptik [11–13]. Vedle výše zmíněných a tradičních nežádoucích účinků (útlum, kognitivní problémy) mohou antiepileptika individuálně vykazovat i specifické negativní psychotropní účinky: působit depresogenně (PHB, PRIM, PHT, VGB aj.), event. způsobit iritabilitu, agitovanost, agresi, manické a psychotické příznaky.
V současné době se pozornost zaměřuje na využití pozitivních-žádoucích psychotropních účinků: ovlivnění úzkosti (PGB, GBP, BZD), deprese (LTG) a stabilizace nálady (LTG, CBZ, VPA, GBP) aj., což jsou poruchy u pacientů s epilepsií časté. Oblastí, kde a jak antiepileptika ovlivňují interiktální stav nemocných, je samozřejmě více, než zde můžeme uvést, a bude jich jistě přibývat.
Nová antiepileptika
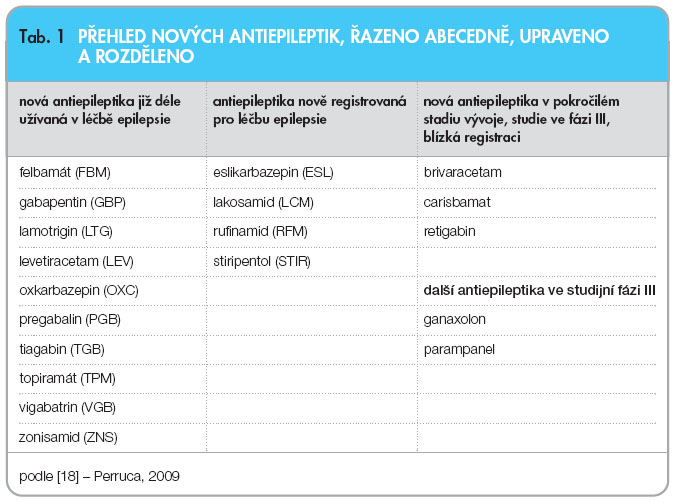
Tato část je věnována především novým antiepileptikům, která aktuálně prošla registrací v Evropské unii a následně i u nás a která vstoupila, resp. vstupují na náš farmaceutický trh. Stručně charakterizujeme léky, které jsou v pokročilé fázi vývoje a registraci se velmi pravděpodobně blíží. Recentně ve stručném přehledu tuto problematiku týkající se příchodu nových antiepileptik shrnul Perruca, jak uvádí tab 1.
V prvním sloupci tabulky jsou uvedena nová antiepileptika, která jsou v léčbě epilepsie již dlouhodobě používána a bylo o nich v naší i světové literatuře již opakovaně referováno [14–17]. Tyto léky jsou dobře známy z klinické praxe i v ČR. Výjimkou je zonisamid, který v minulém roce získal úhradu a vstoupil na náš trh. Ve stručnosti je níže popsána jeho základní charakteristika.
Ve druhém sloupci jsou uvedeny léčivé látky v EU již k léčbě epilepsie registrované. Z této skupiny se blíže zmíníme o těch, které u nás v brzké době rozšíří nabídku antiepileptik.
Zonisamid (ZNS)
ZNS je v současné době v ČR posledním registrovaným antiepileptikem, které rovněž získalo úhradu. Tím ZNS vstoupil do běžné klinické praxe. Mechanismy účinku jsou vícečetné, způsobuje blokádu Na+ a Ca2+ kanálů, je inhibitorem karboanhydrázy, váže se na GABA-A receptor a zvyšuje jeho aktivitu, inhibuje glutamátergní transmisi, facilituje dopaminergní a serotoninergní transmisi. ZNS nezpůsobuje významné lékové interakce. Jde o širokospektré antiepileptikum účinné nejen u záchvatů parciálních a sekundárně generalizovaných, ale některé studie ukazují i jeho účinnost v léčbě primárně generalizovaných záchvatů a progresivní myoklonické epilepsie. Registrován je pro přídatnou léčbu fokální epilepsie.
Účinnost zonisamidu podávaného v dávkách 400 mg/den dosahovala v klinických studiích až 41% úspěšnosti v redukci frekvence záchvatů oproti 9% úspěšnosti dosažené při podávaní placeba, počet respondérů (pacienti s redukcí záchvatů ≥ 50 %) byl 42 % oproti 22 % ve prospěch léčby zonisamidem. V recentních studiích došlo u pacientů s refrakterní epilepsií ke snížení frekvence záchvatů oproti placebu při dávkách zonisamidu 300 mg/den, resp. 500 mg/den, o 42 %, resp. 51 %, při podávání placeba představovalo snížení frekvence záchvatů 18 % [19], počet respondérů byl 42 %, resp. 53 %, ve skupině placeba 18 %. Účinnost byla závislá na dávce. V otevřené klinické studii bylo 15 % pacientů s refrakterní epilepsií bez záchvatů [20]. Ve dvouleté klinické studii setrvalo v léčbě zonisamidem 60 % pacientů, tedy více než při léčbě topiramatem [21], což je významný údaj zohledňující účinnost i tolerabilitu léčby [21, 22].
ZNS vyžaduje pomalou titraci, podává se ve dvou denních dávkách, iniciálně v dávce 50 mg dvakrát denně s titrací do 300–500 mg/den. Nejčastějšími nežádoucími účinky jsou somnolence, únavnost a závrativost, jejich výskyt může být redukován pomalou titrací. Vyskytnout se mohou podrážděnost, insomnie, oligohydróza, urolitiáza, anorexie a jiné nežádoucí účinky. Léčba ZNS může být provázena úbytkem hmotnosti, z čehož může mít část pacientů přínos. ZNS má výhodný farmakokinetický profil s dlouhým eliminačním poločasem, který může umožnit u některých pacientů podání i v jedné denní dávce. Hlavní výhody ZNS jsou vícečetné komplementární mechanismy účinku, širokospektrá účinnost a výhodný farmakokinetický profil. Nevýhodou jsou potenciální vedlejší účinky léčby.
Lakosamid (LCM)
Lakosamid prošel v EU registračním řízením, probíhá jednání o jeho úhradě. Mechanismus účinku není zcela jasný, předpokládá se modulace, podpora pomalé inaktivace Na+ kanálů, snížení patologické hyperexcitability bez ovlivnění fyziologické aktivity, vazba na CRMP-2 (colapsin response mediator protein) s potenciálními neuroprotektivními a neuroregenerativními účinky a případným ovlivněním průběhu onemocnění. LCM je bez významných farmakokinetických interakcí. LCM je registrován pro „add-on“, je přídatnou léčbou fokální epilepsie se záchvaty parciálními se sekundární generalizací nebo bez ní u pacientů nad 16 let v dávkách 200–400 mg na den. Podává se ve dvou denních dávkách, úvodní dávka je 100 mg/den. Kontraindikací je atrioventrikulární blokáda III. stupně.
LCM prokázal účinnost ve třech randomizovaných kontrolovaných studiích – RCT (randomized controlled trial) v tzv. add-on léčbě parciální epilepsie [23–26]. Podíl respondérů při podávání dávek 200 mg/den proti placebu byl 33–35 % vs. 22–26 %, při dávkách 400 mg/den proti placebu činil 38–41 % vs. 18–26 %. Účinek je závislý na dávce. Souhrnná data ze tří studií uvádějí medián redukce záchvatové frekvence 33 % (200 mg), 37 % (400 mg) a 18 % (placebo), podíl respondérů 34 % (200 mg), 40 % (400 mg) a 23 % (placebo) [27]. Dlouhodobého setrvání v léčbě dosahuje po dvou letech až 61 % nemocných [28], což je opět významný údaj zohledňující účinnost i tolerabilitu dlouhodobé léčby.
V dalších studiích je hodnocena účinnost v léčbě bolestivé formy diabetické neuropatie, fibromyalgie a v profylaktické léčbě migrény. Výsledky jsou ve stadiu zpracování. Nejčastějšími nežádoucími účinky jsou: závrativost, gastrointestinální příznaky, ataxie, poruchy koordinace, cefalea, nauzea, diplopie a mírné prodloužení PR intervalu na EKG – bez dalších kardiálních komplikací. Zásadně převažuje výskyt časných vedlejších účinků v období titrace oproti pokračující dlouhodobé léčbě. V tomto ohledu může být vhodné zvážit pomalejší titraci, než která je běžně doporučována, podáním jen jedné iniciální dávky denně a zpomalit navyšování léčby zvláště u pacientů dostávajících polyterapii. Výhody: relativně vysoká účinnost, počet respondérů bez významných farmakokinetických interakcí a bez sedativních vedlejších účinků (odlišnost od jiných léků). Dále dostupná intravenózní forma, potenciální využití u algické formy diabetické neuropatie, migrény a fibromyalgie i v podobě komorbidit u epilepsie. Nevýhody: předpokládaná nutnost postupné titrace, nejasná potenciální účinnost u primárně generalizovaných záchvatů.
Eslikarbazepin (ESL)
Eslikarbazepin prošel v EU registračním řízením, předmětem jednání bude jeho úhrada. Mechanismus účinku není zcela známý. Předpokládá se interakce s napěťově řízenými Na+ kanály – stabilizuje jejich inaktivní stav, moduluje uvolňování glutamátu, GABA, aspartátu a dopaminu. Po CBZ a OXC je třetí generací těchto látek. ESL má příznivou farmakokinetiku, nezpůsobuje významné interakce s dalšími antiepileptiky. Eliminační poločas je 20 hodin, což umožňuje podávání v jedné denní dávce. ESL je od roku 2009 v EU registrován pro přídatnou léčbu parciálních záchvatů se sekundární generalizací nebo bez sekundární generalizace u dospělých. V souhrnných datech se v RCT uvádí počet respondérů 24 % (400 mg/den), 36 % (800 mg/den), 47 % (1200 mg/den) a 20 % (placebo) [18]. V recentní RCT při „add-on terapii“ ESL byla redukce frekvence záchvatů 26 % (400 mg), 36 % (800 mg), 45 % (1200 mg) a 16 % (placebo). Podíl respondérů byl 23 % (400 mg), 34 % (800 mg), 43 % (1200 mg) a 20 % (placebo). Bez záchvatů bylo 8 % (1200 mg), 4 % (800 mg), 2 % (400 mg) a 2 % (placebo) [29]. Vzhledem k blízkosti ESL k CBZ bylo zajímavé, že až 60 % pacientů ve studii užívalo s nedostatečným efektem CBZ, přitom podíl respondérů byl vysoký: 31 % (800 mg), 46 % (1200 mg) a 11 % (placebo). Léčba ESL byla dobře snášena, nejčastějšími nežádoucími účinky byly závratě, bolesti hlavy, diplopie a somnolence.
Výhody: oproti CBZ lepší tolerabilita, nižší výskyt hyponatremie, příznivější kinetika s možným podáním v jedné denní dávce, kombinovaná léčba s CBZ i přes formálně obdobné mechanismy účinku. Nevýhody: ne zcela jasná odlišnost od OXC a jeho cena oproti CBZ a OXC.
Rufinamid (RFM)
Mechanismus účinku není zcela objasněn, předpokládají se interakce s Na+ kanály a další mechanismy. Jde o širokospektré antiepileptikum nadějné pro pacienty s Lennoxovým-Gastautovým syndromem [15, 18, 30]. Významné je ovlivnění nejen celkové frekvence záchvatů, ale zvláště atonických záchvatů (drop-ataky) [18, 30]. V této indikaci je též v EU registrován u pacientů ve věku vyšším než čtyři roky. RFM vykazuje některé farmakokinetické interakce: zvýšení hladin současnou medikací VPA, jejich snížení medikací s induktory. Léčba RFM je dobře tolerována.
Stiripentol
Předpokládaným mechanismem účinku je zvýšení GABA-ergní transmise na více úrovních, možné jsou i další mechanismy. Stiripentol je inhibitorem hepatálních enzymů a může zvyšovat hladiny dalších antiepileptik. V EU je registrován v přídatné léčbě farmakorezistentní epilepsie, generalizovaných tonicko-klonických záchvatů a u syndromu Dravetové, kde jsou výsledky studií povzbudivé. Následující léčivé látky jsou v současné době v pokročilém stadiu studií fáze III, předběžné výsledky nasvědčují tomu, že by se mohly úspěšně uplatnit v klinické praxi [15–18].
Brivaracetam
BRIV navazuje svými mechanismy účinku na LEV. Vazebná afinita na synaptický vezikulární protein SV2A je však desetkrát silnější, navíc moduluje aktivitu Na+ kanálů. BRIV však vykazuje některé farmakokinetické odlišnosti a významný hepatální metabolismus (riziko lékových interakcí). Ze studií u parciální epilepsie v pokročilé fázi vyplývá vysoká účinnost léčby, lék navíc ovlivňuje fotosenzitivitu [17].
Karisbamat
Předpokládaným mechanismem účinku je ovlivnění Na+ a Ca2+ kanálů, v experimentálních studiích vykazoval karisbamat široké spektrum účinku. V současné době probíhají klinické studie u pacientů s parciální, fokální epilepsií.
Retigabin
Mechanismus účinku je ojedinělý v tom, že retigabin moduluje K+ kanály a potencuje GABA-ergní transmisi [17]. Eliminační poločas je kratší, a lék je nutno podávat ve třech denních dávkách. Lék je v pokročilém stadiu vývoje u parciální, fokální epilepsie.
Nefarmakologická, invazivní, neurochirurgická léčba epilepsie, „epileptochirurgie“
Ani přes správně vedenou farmakologickou léčbu se dnes přibližně u jedné čtvrtiny až třetiny nemocných nedaří dosáhnout plné kompenzace záchvatů. V současné době je považováno za velmi významné takové pacienty konzultovat ve specializovaném epileptologickém centru co nejdříve, nejpozději do dvou let. Velká část těchto pacientů s tzv. farmakorezistentní (refrakterní) epilepsií může být totiž úspěšně léčena neurochirurgicky. Seznam epileptologických center disponujících komplexními diagnostickými i léčebnými postupy je dostupný na webových stránkách České ligy proti epilepsii (www.clpe.cz). Včasnou indikaci epileptochirurgické léčby u pacientů s refrakterní temporální epilepsií podpořila i recentní randomizovaná kontrolovaná studie. Po jednom roce bylo bez záchvatů cca 60 % odoperovaných pacientů a pouze 8 % pacientů léčených konzervativně [31]. Epileptochirurgie dnes nabízí širokou škálu zákroků, které můžeme rozdělit do dvou skupin – na zákroky kurativní a paliativní [32].
Kurativní zákroky
Pokud je to možné, logicky preferujeme zákroky kurativní, resekční, jejichž cílem je odstranění epileptického ložiska a úplné vyléčení pacienta. Patří sem například anteromediální temporální resekce, selektivní amygdalohipokampektomie, kortikální resekce, ale také radioterapie, stereotaktická elektrokoagulace aj. Nejlepších výsledků dosahují operace temporálního laloku, kdy je bez záchvatů 70–80 % nemocných. Méně úspěšné jsou zákroky extratemporální, jejich úspěšnost se pohybuje v závislosti na průkaznosti léze mezi 30–70 %.
Radioterapie pomocí gama nože prokázala v prospektivní multicentrické studii účinnost v redukci záchvatové frekvence a vedla i ke zlepšení kvality života u nemocných s meziální temporální epilepsií (MTLE) [33, 34]. Při delším sledování však původní optimistické výsledky studie nebyly potvrzeny. U části pacientů se vyvinul rozsáhlejší kolaterální postradiační edém, někdy i expanzivního charakteru, se syndromem nitrolební hypertenze. Část pacientů následně navíc podstoupila klasický epileptochirurgický zákrok s dobrým efektem. Čeští i zahraniční autoři dnes k radiochirurgické léčbě epilepsie přistupují rezervovaně, zdrženlivě a tyto zákroky provádějí spíše výjimečně [34].
Jakkoli byly výsledky radioterapie v léčbě MTLE jistým zklamáním, velmi slibné výsledky přináší renesance stereotaktické radiofrekvenční terapie (elektrokoagulace). Ve zcela recentní studii bylo po jednom roce zaznamenáno 72 % nemocných bez záchvatů a po dvou letech 82 % [35], léčba byla navíc bezpečná, velmi dobře tolerovaná. Tyto výsledky opravňují k předpokladu, že v indikovaných případech by potenciálně mohla nahradit invazivnější klasickou epileptochirurgickou léčbu.
Paliativní zákroky
Cílem paliativních zákroků je snížení frekvence, závažnosti záchvatů, a tím i zlepšení kvality života nemocných. K těmto zákrokům patří již kalosotomie, hemisferektomie, ale i léčba stimulační. Novinky se týkají spíše léčby stimulační.
Stimulační, neuromodulační léčba epilepsie
Stimulační, neuromodulační léčba je v neurologii a psychiatrii stále více využívána u čtyř základních okruhů onemocnění, pokud dostatečně nereagují na standardní farmakologickou terapii. Vedle epilepsie jde o extrapyramidová onemocnění (nejčastěji Parkinsonova nemoc, dystonie, tremor), dále o léčbu chronické bolesti a léčbu deprese. Cílovou strukturou stimulace může být centrální i periferní nervový systém.V léčbě epilepsie byla testována stimulace řady centrálních struktur (bazální ganglia, cerebellum, thalamus, temporální lalok), někdy s povzbudivými, jindy s kontroverzními výsledky [36]. Navzdory tomu, že se v rutinní praxi tento typ stimulace zatím neprosadil, aktuálně probíhají další studie, např. studie SANTE (Stimulation of the Anterior Nucleus of the Thalamus). Předběžné povzbuzující výsledky studie byly v minulém roce prezentovány na Americkém epileptologickém kongresu v Seattlu: léčba je bezpečná, účinnost je obdobná jako při stimulaci nervus vagus; 60 % nemocných dosahuje ≥ 50% redukce záchvatů, 19 % dosáhlo ≥ 90% redukce záchvatů a 9 % léčených je bez záchvatů. Je významné, že léčba byla účinná i u části pacientů, kteří neprofitovali ze stimulace nervus vagus. Lze očekávat, že tato metoda se v dohledné době rozšíří do klinické praxe.
Chronická stimulace nervus vagus (VNS – vagus nerve stimulation) je dnes stále jedinou rutinně zavedenou neuromodulační metodou léčby farmakorezistentní (refrakterní) inoperabilní epilepsie se záchvaty parciálními (se sekundární generalizací nebo bez ní) nebo generalizovanými. Touto metodou je dnes v ČR léčeno více než 300 pacientů.
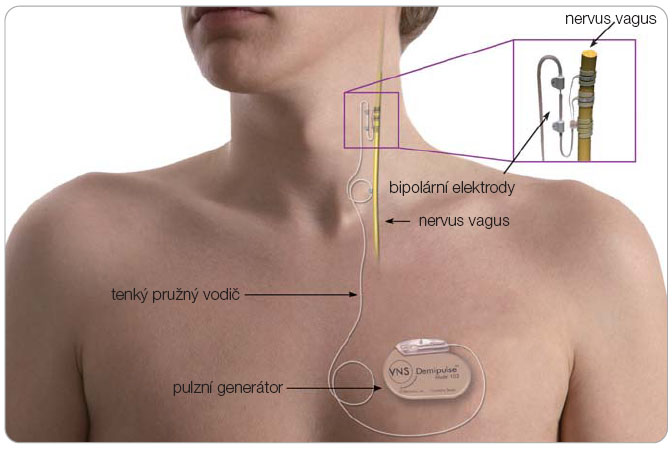 Principem VNS je periferní přímá elektrická stimulace levého nervus vagus v oblasti krku pomocí bipolární elektrody. Ta je napojena na generátor pulzů uložený podkožně v levé podklíčkové oblasti (obr. 1). Stimulace je intermitentní v přesně definovaných intervalech, které lze obdobně jako další stimulační parametry průběžně měnit v závislosti na průběhu léčby. Právě zde došlo v posledních letech ke konsenzu o stimulačních parametrech. V současné době se VNS zapíná již na operačním sále, stimulační parametry se postupně upravují, zvyšuje se stimulační proud (mA) po 2–4 týdnech a zkracuje se „off-perioda“ po 2–3 měsících. V současné době jsou považovány za obvykle maximálně efektivní následující stimulační parametry: frekvence 20/30 Hz, šířka pulzu 250 us, cyklace „on“ 30 s, „off“ 3 min, proud 1,75 mA při šířce pulzu 250 us, resp. 1,5 mA/500 us [37]. U rezistentních pacientů lze pak parametry dále upravovat: zvýšit proud v závislosti na šířce pulzu, zkrátit „off-periodu“ až k 25–41 % „duty-cycle“. V tomto roce dodala firma Cyberonics (v ČR Cardion) na trh nový typ stimulátoru. Komfortnější, výrazně menší a lehčí, s prodlouženou životností baterií.
Principem VNS je periferní přímá elektrická stimulace levého nervus vagus v oblasti krku pomocí bipolární elektrody. Ta je napojena na generátor pulzů uložený podkožně v levé podklíčkové oblasti (obr. 1). Stimulace je intermitentní v přesně definovaných intervalech, které lze obdobně jako další stimulační parametry průběžně měnit v závislosti na průběhu léčby. Právě zde došlo v posledních letech ke konsenzu o stimulačních parametrech. V současné době se VNS zapíná již na operačním sále, stimulační parametry se postupně upravují, zvyšuje se stimulační proud (mA) po 2–4 týdnech a zkracuje se „off-perioda“ po 2–3 měsících. V současné době jsou považovány za obvykle maximálně efektivní následující stimulační parametry: frekvence 20/30 Hz, šířka pulzu 250 us, cyklace „on“ 30 s, „off“ 3 min, proud 1,75 mA při šířce pulzu 250 us, resp. 1,5 mA/500 us [37]. U rezistentních pacientů lze pak parametry dále upravovat: zvýšit proud v závislosti na šířce pulzu, zkrátit „off-periodu“ až k 25–41 % „duty-cycle“. V tomto roce dodala firma Cyberonics (v ČR Cardion) na trh nový typ stimulátoru. Komfortnější, výrazně menší a lehčí, s prodlouženou životností baterií.
Účinnost léčby pomocí VNS je hodnocena poklesem frekvence záchvatů a zejména podílem respondérů na léčbu (pacienti s redukcí záchvatů ≥ 50 %). Ten se ve studiích pohybuje v rozmezí 45–65 %. Recentně byly publikovány sumární výsledky pětileté léčby VNS v ČR ze všech pěti epileptologických center (Nemocnice u sv. Anny v Brně, Nemocnice Na Homolce, Nemocnice Na Františku, Thomayerova nemocnice a FN Motol). Jako v jiných studiích narůstal i zde efekt léčby dlouhodobě v letech: podíl respondérů byl v 1. roce 44 % a v 5. roce léčby 64 %, u 16 % pacientů byla zaznamenána ≥ 90% redukce záchvatů, bez záchvatů bylo 6 % nemocných [38]. Vedlejší účinky léčby se objevily u 13 % nemocných, dominovaly obvyklé projevy (chrapot/kašel během stimulace), lokální zánět a traumatické poškození elektrody.
Je významné, že vedle celkové frekvence záchvatů bývají VNS více ovlivněny záchvaty generalizované, tedy nejzávažnější. To může mít další pozitivní dopad na kvalitu života nemocných. Léčba VNS obvykle přináší zlepšení dalších parametrů kvality života, zlepšení pozornosti, paměti a především nálady – zmírnění deprese. To je rovněž významné, neboť právě tyto položky, zejména deprese, patří k nejčastějším komorbiditám u nemocných s epilepsií. Léčba rezistentní deprese pomocí VNS je navíc v současné době schválena v EU i v USA.
Práce je podpořena výzkumným záměrem Patofyziologie neuropsychických onemocnění a její klinické aplikace VZ 0021620816.
Seznam použité literatury
- [1] EpiStop. Soubor minimálních diagnostických a terapeutických standardů u pacientů s epilepsií. EpiStop, Maxdorf, Praha 2007: 1–58. (www.epistop.cz)
- [2] National Institute for Clinical Excellence (NICE). The Epilepsies. The diagnosis and management of the epilepsies in adults and children in primary and secondary care. Clinical Guideline 20. London 2004: 1–73. (www.nice.org.uk)
- [3] Ošlejšková H. Zhoršování epileptických záchvatů a epilepsií antiepileptiky – je to možné? Čes Slov Neurol Neurochir 2007; 103: 137–142.
- [4] EpiStop (pracovní skupina). Minimální diagnostické a terapeutické standardy: Kontracepce. Těhotenství a porod. Perimenopauza a postmenopauza. EpiStop, Maxdorf, Praha 2007: 37–43. (www.epistop.cz)
- [5] Zárubová J. Epilepsie a mateřství. Neurologie pro praxi 2004; 6: 331–336.
- [6] Zárubová J, et al. Žena a epilepsie. EpiStop, Maxdorf, Praha 2004: 1–109.
- [7] Hovorka J, Nežádal T, Janicadisová M. Klinická charakteristika epilepsie a epileptických záchvatů ve stáří. Čes Ger Rev 2006; 4: 146–156.
- [8] EpiStop. Soubor minimálních diagnostických a terapeutických standardů u pacientů s epilepsií. Epilepsie a epileptické záchvaty ve stáří. EpiStop, Maxdorf, Praha 2007: 44–46. (www.epistop.cz)
- [9] Nežádal T, Hovorka J, Bajaček M, Janicadisová M. Léčba epilepsie ve vyšším věku – farmakokinetické interakce. Čes Ger Rev 2007; 5: 156–163.
- [10] Hovorka J, Nežádal T, Bajaček M. Epilepsie a epileptické záchvaty ve stáří. Postgraduální medicína 2008; 10: 763–771.
- [11] Hovorka J, Herman E, Nežádal T. Epilepsie a základy antiepileptické léčby I. Psychiatrie pro praxi 2004; 3: 123–130.
- [12] Hovorka J, Herman E, Nežádal T. Epilepsie a základy antiepileptické léčby II, aspekty psychiatrické. Psychiatrie pro praxi 2004; 4: 191–196.
- [13] Hovorka J, Herman E, Bajaček M, et al. Psychiatrické aspekty epilepsie. Neurol pro praxi 2005; 2: 89–94.
- [14] Rektor I, Kuba R. Nová antiepileptika u dospělých – nové informace. Neurol pro praxi 2007; 2: 70–74.
- [15] Zárubová J. Novinky ve farmakoterapii epilepsie. Farmakoterapie 2008; 1: 29–34.
- [16] Shorvon S. Handbook of epilepsy treatment (second edition) 2006. Blackwell Publishing, Oxford, UK: 195–199.
- [17] Bialer M, Svein I, Johannessen R, et al. Progress report on new antiepileptic drugs: A summary of Ninth Eilat Conference (EILAT IX). Epilepsy Research 2009; 83: 1–43.
- [18] Perruca E. Emerging pharmacological therapy in epilepsy. Masterclass. Excellence in Epilepsy. London 5.–6. 6. 2009.
- [19] Brodie MJ, Duncan R, Vespignani H, et al. Dose-dependent safety and efficacy of zonisamide: a randomized, double-blind, placebo-controlled study in patients with refractory partial seizures. Epilepsia 2005; 46: 31–41.
- [20] Dupont S, Striano S, Trinka E, et al. ZEUS: An open-label, naturalistic study of zonisamide in adult partial onset seizures. Poster presented at the 12th Congress of the European Federation of Neurological Societies. Madrid. Spain. 23–26 August 2008.
- [21] Chung S, Wang N, Hank N. Comparative retention rates and long-term tolerability of new antiepileptic drugs. Seizure 2007; 16: 296–304.
- [22] Baulac M, Leppik IE. Efficacy and safety of adjunctive zonisamide therapy for refractory partial seizures. Epilepsy Research 2007; 75: 75–83.
- [23] Ben-Menachem E, Biton V, Jatuzis D, et al. Efficacy and safety of oral lacosamide as adjunctive therapy in adults with partial-onset seizures. Epilepsia 2007; 48: 1308–1317.
- [24] Halasz P, Kalviainen R, Mazurkiewicz-Beldzinska M, et al. Lacosamide: efficacy and safety as oral adjuctive therapy in adults with partial seizures. Epilepsia 2006; 47: (Suppl. 4): 3.
- [25] Halasz P, Kalviainen R, Mazurkiewicz-Beldzinska M, et al. Lacosamide: efficacy and safety as oral adjuctive therapy in adults with partial seizures. Epilepsia 2009; 50: 443–453.
- [26] Chung S, Sperling M, Biton V, et al. Lacosamide: efficacy and safety as oral adjuctive therapy in adults with partial-onset seizures. Epilepsia 2007; 48 (Suppl. 7): 57.
- [27] Beydoun A, D'Souza J, Hebert D, Doty P. Lacos-amide: pharmacology, mechanisms of action and pooled efficacy and safety data in partial-onset seizures. Expert Rev Neurother 2009; 9: 33–42.
- [28] Rosenfeld W, Fountain NB, Kaubrys G, Heinzen L, McShea C on behalf of the SP 615 Study Group SP615 Study Team. Lacosamide: an interim evaluation of long-term safety and efficacy as oral adjunctive therapy in subjects with partial-onset seizures (poster). 8th European Congress on Epileptology, Berlin. 21.–25. 9, 2008.
- [29] Elger Ch, Halász P, Maia J, et al. Efficacy and safety of eslicarbazepine acetate as adjunctive treatment in adults with refractory partial-onset seizures : A randomized, double-blind, placebo-controlled, parallel group phase II study. Epilepsia 2009; 50: 1–10.
- [30] Kluger G, Bauer B. Role of rufinamide in the management of Lennox-Gastaut syndrome (childhood epileptic encephalopathy). Neuropsychiatr Dis Treat 2007; 3: 3–11.
- [31] Wiebe S, Blume WT, Girvin JP, Eliasziw M. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl Med 2001: 345: 311–318.
- [32] Brázdil M, Hadač J, Komárek V, et al. Epileptochirurgické zákroky. Farmakorezistentní epilepsie. Triton, Praha 2004: 182–203.
- [33] Régis J, Rey M, Bartolomei F, et al. Gamma knife surgery in mesial temporal epilepsy: a prospective multicenter study. Epilepsia 2004; 45: 504–515.
- [34] Urgošík D. Funkční neurochirurgie. In: Radiochirurgie gama nožem. Liščák a kol. Praha, Grada Publishing 2009: 215–217.
- [35] Malíková H, Vojtěch Z, Liščák R, et al. Stereotactic radiofrequency amygdalohippocampec-tomy for treatment of mesial temporal lobe epilepsy: Correlation of MRI with clinical outcome. Epilepsy Research 2009; 83: 235–242.
- [36] Rektor I, Kršek P. Jiné stimulační metody. In: Brázdil M, Hadač J, Marusič P. Farmakorezistentní epilepsie. Praha, Triton 2004: 204–207.
- [37] Heck C, Helmers SL, DeGiorgio CM. Vagus nerve stimulation therapy, epilepsy and device parameters. Scientific basis and recommendations for use. Neurology 2002; 50 (Suppl. 4): 31–37.
- [38] Kuba R, Brázdil M, Kalina M, et al. Vagus nerve stimulation: Longitudinal follow-up of patiens treated for 5 years. Seizure 2009; 18: 269–274.