Novinky v léčbě metastatického karcinomu prsu
Nové postupy v terapii metastatického karcinomu prsu zlepšily i léčebné výsledky. Jedním z nich je také ovlivnění dráhy mTOR u karcinomu prsu s pozitivitou estrogenových nebo progesteronových receptorů. Klinická studie BOLERO-2 srovnává účinnost léčby steroidním inhibitorem aromatázy exemestanem samotným nebo v kombinaci s inhibitorem mTOR everolimem u pacientek s HER-2 negativním metastatickým karcinomem prsu, u kterých selhala předchozí léčba nesteroidním inhibitorem aromatázy. Pacientky léčené kombinací měly signifikantně příznivější léčebné výsledky ve sledovaném parametru přežívání bez progrese onemocnění (6,9 měsíce při léčbě kombinací vs. 2,8 měsíce při monoterapii, HR = 0,43; 95% CI: 0,35–0,54; p < 0,001). Slibným lékem u pacientek s HER-2 pozitivním karcinomem prsu se zdá být pertuzumab. Klinická studie fáze III pod názvem CLEOPATRA srovnávala účinnost kombinace trastuzumab a docetaxel s pertuzumabem nebo bez pertuzumabu v první linii léčby u pacientek s HER-2 pozitivním metastatickým karcinomem prsu. Pertuzumab významně prodloužil přežívání pacientek bez progrese onemocnění (18,5 měsíce vs. 12,4 měsíce; p < 0,001) u všech sledovaných podskupin. Eribulin mesylát, inhibitor mikrotubulů netaxanového typu, je novým nadějným cytostatikem. Klinická studie EMBRACE srovnává léčbu zvolenou ošetřujícím lékařem u těžce předléčených pacientek s metastatickým karcinomem prsu s léčbou eribulinem. Pacientky byly předléčeny v mediánu 4 cykly chemoterapie. Medián celkového přežívání byl 13,1 měsíce pro pacientky léčené eribulinem versus 10,6 měsíce (HR = 0,81; 95% CI: 0,66–0,99; p = 0,041).
Úvod
Karcinom prsu je nejčastější malignitou žen v České republice [1]. Metastatický karcinom prsu je i v současné době nevyléčitelným onemocněním. Hlavním cílem léčby je prodloužení života pacientek, kontrola progrese onemocnění, zlepšení symptomů nemoci a kvality života. Přestože časná diagnostika a nové léčebné možnosti zlepšily přežívání pacientek s karcinomem prsu přibližně o 1 % ročně v posledních letech, pětileté přežívání je u pacientek s metastatickým karcinomem prsu nižší než 25 % [2]. Nové poznatky v oblasti léčby karcinomu prsu vyžadují komplexní terapeutický přístup. Díky screeningu a zavedení nových diagnostických metod je až 90 % karcinomů prsu diagnostikováno ve stadiu, kdy je onemocnění potenciálně kurabilní [3]. U více než poloviny souboru těchto pacientek se ale po skončení adjuvantní léčby objeví lokální nebo vzdálená recidiva onemocnění [4].
K základním histopatologickým markerům zvažovaným při léčbě karcinomu prsu patří estrogenový receptor (ER), progesteronový receptor (PR), proliferace nádoru měřená pomocí indexu Ki-67, grade nádoru a exprese genu HER-2. K základním systémovým léčebným modalitám patří chemoterapie, hormonální léčba a biologická léčba.
Blokáda dráhy mTOR u karcinomu prsu s pozitivitou ER nebo PR
Přibližně 65 % nádorů u premenopauzálních pacientek exprimuje ER a PR, u postmenopauzálních pacientek je to 80 % nádorů. Vzhledem k tomu, že až dvě třetiny pacientek s nově diagnostikovaným karcinomem prsu jsou postmenopauzální, lze předpokládat, že karcinomy prsu s pozitivními hormonálními receptory tvoří až tři čtvrtiny všech karcinomů prsu [5].
H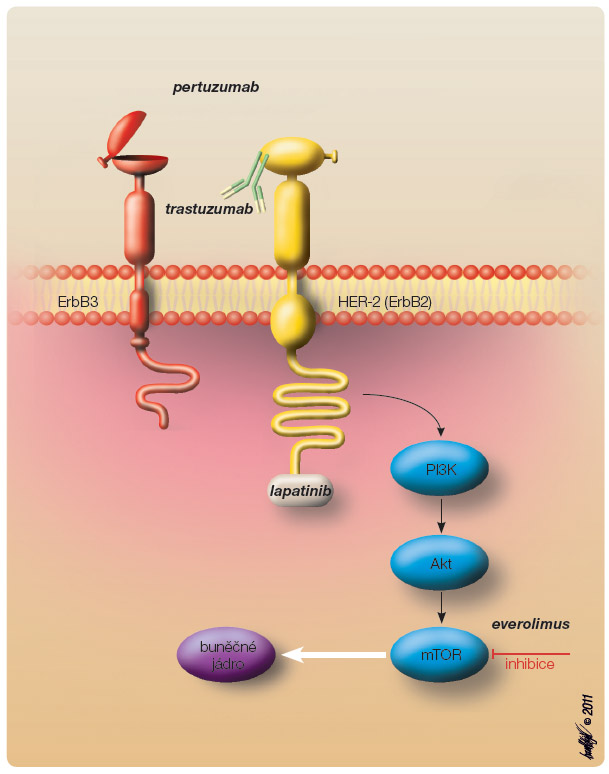 ormonální léčba je základním léčebným postupem u této skupiny pacientek. Hlavním klinickým problémem selhání hormonální léčby je rezistence k hormonální léčbě de novo nebo získaná. Na vzniku rezistence se podílejí různé mechanismy. Inhibici signální dráhy prostřednictvím blokády ER se může nádorová buňka vyhnout aktivací jiných signálních drah, jako jsou EGFR/HER-2, MAPK (mitogen-activated protein kinase), ERK1/2 (extracellular signal-regulated kinase) a PI3K/Akt (fosfatidylinositol-3-kináza/proteinkináza B). Mezi dráhy, které nejsou závislé na estrogenu, patří dráha PI3K/Akt/mTOR. Aktivací této dráhy dochází k proliferaci a přežívání nádorových buněk i při pokračující hormonální blokádě. Dráha mTOR reguluje růst a proliferaci nádorových buněk na úrovni translace [6]. Právě blokáda dráhy mTOR se zdá být slibným mechanismem k obnovení citlivosti nádorových buněk k hormonální léčbě (obr. 1).
ormonální léčba je základním léčebným postupem u této skupiny pacientek. Hlavním klinickým problémem selhání hormonální léčby je rezistence k hormonální léčbě de novo nebo získaná. Na vzniku rezistence se podílejí různé mechanismy. Inhibici signální dráhy prostřednictvím blokády ER se může nádorová buňka vyhnout aktivací jiných signálních drah, jako jsou EGFR/HER-2, MAPK (mitogen-activated protein kinase), ERK1/2 (extracellular signal-regulated kinase) a PI3K/Akt (fosfatidylinositol-3-kináza/proteinkináza B). Mezi dráhy, které nejsou závislé na estrogenu, patří dráha PI3K/Akt/mTOR. Aktivací této dráhy dochází k proliferaci a přežívání nádorových buněk i při pokračující hormonální blokádě. Dráha mTOR reguluje růst a proliferaci nádorových buněk na úrovni translace [6]. Právě blokáda dráhy mTOR se zdá být slibným mechanismem k obnovení citlivosti nádorových buněk k hormonální léčbě (obr. 1).
V klinických studiích byly zkoušeny tři inhibitory signální dráhy mTOR: sirolimus, temsirolimus a everolimus. Nejslibnější jsou výsledky klinických studií s everolimem.
Everolimus byl kombinován s tamoxifenem v klinické studii II. fáze TAMRAD u celkem 111 postmenopauzálních pacientek s ER pozitivním HER-2 negativním karcinomem prsu, které byly v adjuvanci léčeny inhibitorem aromatázy (IA). Pacientky byly rozděleny do dvou skupin: nemocné s předpokládanou primární rezistencí na IA (časná progrese po IA) nebo se sekundární rezistencí na IA (pozdní progrese po IA). Pacientky byly léčeny buď kombinací tamoxifenu a everolimu, který byl podáván kontinuálně v dávce 10 mg denně, nebo pouze tamoxifenem. Primárním cílem byl klinický přínos z léčby, který byl signifikantně vyšší u pacientek léčených kombinací ve srovnání s pacientkami léčenými pouze tamoxifenem (61 % vs. 42 %; p = 0,045). Doba do progrese onemocnění byla rovněž delší v rameni s kombinovanou léčbou (8,5 vs. 4,6 měsíce, HR = 0,54; p = 0,021), stejně jako i celkové přežívání pacientek (HR = 0,45, p = 0,007). Při vyhodnocení výsledků studie podle stratifikace na skupinu pacientek s předpokládanou primární a sekundární rezistencí měly pacientky s předpokládanou sekundární rezistencí větší přínos z kombinační léčby než pacientky s primární rezistencí. U pacientek s primární rezistencí nebyl signifikantní rozdíl v době do progrese onemocnění. U pacientek se sekundární rezistencí byla doba do progrese 14,8 měsíce vs. 5,5 měsíce ve prospěch kombinace (HR = 0,46; p = 0,0087). Lepší bylo i celkové přežívání pacientek léčených kombinační léčbou ve srovnání s léčenými pouze tamoxifenem ve skupině pacientek se sekundární hormonální rezistencí (HR = 0,73; p = 0,41 vs. HR = 0,21; p = 0,02) [7].
Na základě předchozích výsledků byla navržena klinická studie III. fáze pod názvem BOLERO-2. Zahrnovala celkem 724 pacientek s ER pozitivním HER-2 negativním karcinomem prsu po selhání předchozí léčby IA (letrozol nebo anastrozol). Klinická studie BOLERO-2 srovnává účinnost léčby steroidním inhibitorem aromatázy exemestanem samotným nebo v kombinaci s inhibitorem mTOR everolimem u pacientek s HER-2 negativním metastatickým karcinomem prsu, u kterých selhala předchozí léčba nesteroidním inhibitorem aromatázy. Podle charakteristiky pacientek zařazených do studie se jednalo o značně předléčenou skupinu. Více než polovina z nich byla léčena třemi nebo více řadami systémové léčby, z toho chemoterapii dostávalo 26 % pacientek. Více než polovina pacientek měla přítomny viscerální metastázy. Výsledky druhé průběžné analýzy uvádí ve své publikaci Jose Baselga [8]. Pacientky léčené kombinací měly signifikantně příznivější léčebné výsledky ve sledovaném parametru přežívání bez progrese onemocnění (6,9 měsíce pro kombinaci vs. 2,8 měsíce pro monoterapii, HR = 0,43; 95% CI: 0,35–0,54; p < 0,001). Na konferenci ASCO 2012 byly prezentovány nejnovější výsledky závěrečné analýzy studie. Ta byla plánována na prosinec 2011 v mediánu sledování 18 měsíců a počtu 510 sledovaných událostí. I při delším intervalu sledování přetrvává výrazný rozdíl mezi léčebnými rameny, přičemž pacientky léčené kombinací mají signifikantně delší přežívání bez progrese onemocnění (7,8 měsíce vs. 3,2 měsíce, HR = 0,45; 95% CI: 0,38–0,54; p < 0,0001) [9].
Přínos léčby byl nezávislý na přítomnosti viscerálních metastáz a na předléčení pacientek chemoterapií nebo hormonální léčbou. U pacientek léčených kombinací byl navíc pozorován trend ke zlepšení celkového přežívání. U pacientek s kombinovanou léčbou byl medián trvání léčby everolimem 23,9 měsíce a medián trvání léčby exemestanem 29,5 měsíce. U pacientek léčených pouze everolimem byl medián trvání léčby 14,7 měsíce.
Nejčastějšími nežádoucími účinky léčby inhibitory mTOR jsou stomatitida, vyrážka, únava a průjem. K nejčastěji pozorovaným nežádoucím účinkům stupně 3 a 4 patřila stomatitida, hyperglykemie a slabost.
Kombinace hormonální léčby a inhibitoru mTOR se v budoucnu určitě stane standardem léčby pacientek s metastatickým HER-2 negativním karcinomem prsu s pozitivními hormonálními receptory. Přínos léčby inhibitory mTOR je na základě výsledků klinických studií jednoznačný a toxicita zvládnutelná. Pomůže tak oddálit indikaci chemoterapie u této skupiny nemocných. Na základě příznivých výsledků klinické studie BOLERO-2 byl everolimus v červenci 2012 v ČR registrován pro léčbu metastatického ER pozitivního HER-2 negativního karcinomu prsu. O úhradě ze zdravotního pojištění nebylo k 1. 4. 2013 rozhodnuto.
Pokroky v léčbě HER-2 pozitivního karcinomu prsu
Podle literárních údajů lze přibližně u 15–20 % karcinomů prsu prokázat overexpresi proteinu HER-2 nebo amplifikaci genu HER-2, který je současně prognostickým, ale i prediktivním markerem v léčbě karcinomu prsu. Pacientky s HER-2 pozitivním karcinomem prsu mají horší prognózu s kratším přežíváním bez známek onemocnění, ale i s kratším celkovým přežíváním [10]. Zavedení trastuzumabu do léčby HER-2 pozitivních karcinomů prsu dramaticky zlepšilo prognózu pacientek s tímto onemocněním. Dawood srovnával ve své retrospektivní práci prognózu pacientek s HER-2 pozitivním metastatickým karcinomem prsu bez léčby trastuzumabem a s léčbou tras-
tuzumabem. Pacientky, které dostávaly v první linii léčby trastuzumab, měly signifikantně lepší prognózu (o 44 % nižší riziko úmrtí) [11].
Problémem zůstává rezistence části nádorů k léčbě trastuzumabem. Asi 66–88 % HER-2 pozitivních nádorů je primárně rezistentních k monoterapii trastuzumabem [12]. Část nádorů se stane rezistentní až sekundárně, tedy v průběhu léčby, po předchozí odpovědi na léčbu trastuzumabem. Nejčastějším mechanismem rezistence jsou změny oblasti receptoru, jako např. alterace v oblasti vazebného místa maskováním epitopu nebo sekrecí receptoru p95 HER-2, který má odštěpenou extracelulární část receptoru, nebo mutace oblasti tyrozinkinázové (TK) intracelulární domény receptoru. Další zlepšení prognózy této skupiny pacientek mohou přinést léky namířené proti struktuře HER-2 s novým mechanismem účinku.
Oblast označená jako doména II slouží jako dimerizační doména pro vznik heterodimerů a váže se na ni nová monoklonální protilátka pertuzumab [13]. Vazba pertuzumabu zabrání vzniku heterodimerů HER-2 a HER-3, které jsou nejsilnějšími přenašeči signálu. Jiný mechanismus účinku pertuzumabu umožňuje zahájit jeho podávání i u nádorů rezistentních k léčbě trastuzumabem. V klinické studii fáze II prokázala kombinace trastuzumabu a pertuzumabu slibné výsledky u pacientek, u nichž onemocnění progredovalo při léčbě trastuzumabem [14]. Klinická studie III. fáze pod názvem CLEOPATRA srovnávala účinnost kombinace trastuzumab a docetaxel s pertuzumabem nebo bez pertuzumabu v první linii léčby u pacientek s HER-2 pozitivním metastatickým karcinomem prsu. Pertuzumab dramaticky zlepšil přežívání pacientek bez progrese onemocnění (18,5 měsíce vs. 12,4 měsíce; p < 0,001) u všech sledovaných podskupin. Pacientky léčené pertuzumabem měly i vyšší léčebnou odpověď (80,2 % vs. 69,3 %; p = 0,001) a byl u nich prokázán trend k delšímu celkovému přežívání. Nebyl nalezen rozdíl v kardiotoxicitě mezi rameny studie. Pacientky léčené pertuzumabem měly vyšší incidenci průjmu, rashe, slizničních zánětlivých změn a febrilní neutropenie [15]. Pertuzumab je v ČR registrován pro léčbu HER-2 pozitivního metastického karcinomu prsu v kombinaci s trastuzumabem a docetaxelem pro první linii léčby. O úhradě ze zdravotního pojištění nebylo k 1. 4. 2013 rozhodnuto.
Koncepce duální blokády receptoru HER-2 je nyní v popředí zájmu. Několik neoadjuvantních klinických studií fáze II–III prokázalo vysoké procento dosažených kompletních remisí pomocí kombinací duální blokády receptoru HER-2. Kombinaci lapatinibu a trastuzumabu zkoumaly studie neo-ALTTO, GeparQuinto a C HER–LOB a kombinaci trastuzumabu a pertuzumabu studie NeoSp HER-e a THYPHAENA.
Ideální představu kombinace cytostatika navázaného na protilátku, která cytostatikum dopraví přímo k cílové struktuře nádorové buňky (obr. 2), splňuje nový lék trastuzumab emtansin (T-DM1). Jedná se o konjugát trastuzu![Obr. 2 Schematické znázornění mechanismu účinku T-DM1; podle [20] – LoRusso, et al., 2011. T-DM1 je konjugátem monoklonální protilátky trastuzumabu a cytotoxické molekuly emtansinu – derivátu maytansinu (DM1). Na jednu molekulu trastuzumabu je navázáno více molekul emtansinu. Navázání emtansinu na trastuzumab umožní cílené nasměrování léčiva do nádorové tkáně. T-DM1 se váže na receptor HER-2, po vazbě dochází k internalizaci komplexu HER-2-T-DM1, degradaci v lysozomech a uvolnění emtansinu. Intracelulárně emtansin inhibuje polymerizaci mikrotubulů a zastavuje tak buněčné dělení, což vede ke smrti nádorové buňky.](https://www.remedia.cz/photo-a-29325---.jpg) mabu s vysoce účinnou antimikrotubulární látkou emtansinem, který je označován jako DM 1. Cytostatikum tak působí selektivně a má vysoký terapeutický index [16]. V klinické studii II. fáze prokázal T-DM1 léčebnou odpověď 25,9 % u pacientek, u nichž došlo k progresi onemocnění při léčbě trastuzumabem v kombinaci s cytostatikem [17]. Pozorovanými nežádoucími účinky stupně 3 a 4 byly trombocytopenie, hypokalcemie a únava. Na konferenci ESMO 2011 byly prezentovány výsledky klinické studie II. fáze; 137 pacientek s metastatickým HER-2 pozitivním karcinomem prsu bylo léčeno kombinací docetaxelu a trastuzumabu nebo T-DM1. U pacientek léčených T-DM1 bylo zaznamenáno delší přežívání bez progrese onemocnění (14,2 měsíce vs. 9,2 měsíce; p = 0,0353), pacientky léčené T-DM1 měly nižší incidenci nežádoucích účinků léčby stupně 3 a více (46,4 % vs. 89,4 %) [18]. Očekávány jsou výsledky dvou randomizovaných klinických studií III. fáze. Klinická studie vedená pod názvem EMILIA srovnává účinnost léčby T-DM1 s kombinací lapatinibu a kapecitabinu. Studie MARIANNE srovnává T-DM1 (s pertuzumabem nebo bez něj) s kombinací taxanů a trastuzumabu v první linii léčby metastatického HER-2 pozitivního karcinomu prsu. Léčivá látka T-DM1 není v ČR pro léčbu HER-2 pozitivního karcinomu prsu registrována.
mabu s vysoce účinnou antimikrotubulární látkou emtansinem, který je označován jako DM 1. Cytostatikum tak působí selektivně a má vysoký terapeutický index [16]. V klinické studii II. fáze prokázal T-DM1 léčebnou odpověď 25,9 % u pacientek, u nichž došlo k progresi onemocnění při léčbě trastuzumabem v kombinaci s cytostatikem [17]. Pozorovanými nežádoucími účinky stupně 3 a 4 byly trombocytopenie, hypokalcemie a únava. Na konferenci ESMO 2011 byly prezentovány výsledky klinické studie II. fáze; 137 pacientek s metastatickým HER-2 pozitivním karcinomem prsu bylo léčeno kombinací docetaxelu a trastuzumabu nebo T-DM1. U pacientek léčených T-DM1 bylo zaznamenáno delší přežívání bez progrese onemocnění (14,2 měsíce vs. 9,2 měsíce; p = 0,0353), pacientky léčené T-DM1 měly nižší incidenci nežádoucích účinků léčby stupně 3 a více (46,4 % vs. 89,4 %) [18]. Očekávány jsou výsledky dvou randomizovaných klinických studií III. fáze. Klinická studie vedená pod názvem EMILIA srovnává účinnost léčby T-DM1 s kombinací lapatinibu a kapecitabinu. Studie MARIANNE srovnává T-DM1 (s pertuzumabem nebo bez něj) s kombinací taxanů a trastuzumabu v první linii léčby metastatického HER-2 pozitivního karcinomu prsu. Léčivá látka T-DM1 není v ČR pro léčbu HER-2 pozitivního karcinomu prsu registrována.
Pokroky v léčbě cytostatiky
Ačkoli je hlavní zřetel v klinických studiích dnes kladen hlavně na cílenou léčbu, v běžné klinické praxi zůstává chemoterapie základním léčebným postupem. Cílená léčba je v současné době dostupná pouze pro pacientky s HER-2 pozitivním karcinomem prsu.
Eribulin mesylát je inhibitor mikrotubulů netaxanového typu. Jedná se o syntetický analog halichondrinu B, přirozený produkt, který byl izolován z mořské houby Halichondria okadai. V roce 2011 byly publikovány překvapivé výsledky III. fáze klinické studie EMBRACE. Studie srovnává léčbu eribulinem s léčbou zvolenou ošetřujícím lékařem u těžce předléčených pacientek s metastatickým karcinomem prsu. Pacientky byly předléčeny v mediánu 4 cykly chemoterapie. Objektivní léčebná odpověď byla 12 % u pacientek léčených eribulinem oproti 5% odpovědi u pacientek s léčbou zvolenou ošetřujícím lékařem (p = 0,002). Překvapivé byly výsledky v parametru celkového přežívání, které bylo i primárním cílem studie. Medián celkového přežívání byl 13,1 měsíce pro pacientky léčené eribulinem versus 10,6 měsíce (HR = 0,81; 95% CI: 0,66–0,99; p = 0,041). Přínos léčby byl zaznamenán ve všech podskupinách pacientek. Studie EMBRACE je tak první velkou randomizovanou klinickou studií, která prokázala přínos studiové léčby v parametru celkového přežívání u skupiny těžce předléčených pacientek s metastatickým karcinomem prsu. Na základě těchto výsledků byl eribulin v ČR registrován pro léčbu metastatického karcinomu prsu [19].
Diskuse
Prognóza pacientek s karcinomem prsu se za posledních patnáct let výrazně zlepšila. I pacientkám s diseminovaným onemocněním lze výrazně (až o roky) prodloužit život a zachovat jeho dobrou kvalitu. Zavedení dalších nových přípravků do léčby může tyto výsledky ještě zlepšit.
Seznam použité literatury
- [1] http://www.svod.cz
- [2] Hayat MJ, Howlader M, Reichman ME, et al. Cancer statistics, trends and multiple primary cancer analyses from the Surveillance, Epidemiology, and End Results (SEER) program. The Oncologist 2007; 12: 20–37.
- [3] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2007. CA Cancer J Clin 2007; 57: 43–66.
- [4] Early Breast Cancer Trialists´ Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-years survival: an overview of the randomised trials. Lancet 2005; 365: 1687–1717.
- [5] Hankey BF, Miller B, Curtis R, et al. Trends in breast cancer in younger women in contrast to older women. J Natl Cancer Inst Monogr 1994; 16: 7–14.
- [6] Margariti N, Fox SB, Bottini A, Generali D. “Overcoming breast cancer drug resistance with mTOR inhibitors”. Could it be a myth or a real possibility in the short-term future? Breast Cancer Res Treat 2011; 128: 599–606.
- [7] Bachelot T, Bourgier C, Cropet C, et al. TAMRAD: a GINECO randomized phase II trial of everolimus in combination with tamoxifen versus tamoxifen alone in patients (pts) with hormone receptor-positive, HER-2 negative metastatic breast cancer (MBC) with prior exposure to aromatase inhibitors (AI). Cancer Research 2011; 70: S1–S6; (Abstr S1–6).
- [8] Baselga J, Campone M, Piccart M, et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med 2012; 366: 520–529.
- [9] Piccart M, Noguchi S, Pritchard K, et al. Everolimus for postmenopausal women with advanced breast cancer: Updated results of the BOLERO-2 phase III trial. Abstract 101092.
- [10] Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: Correlation of relapse and survival with amplification of the HER-2 (neu oncogene). Science 1987; 235: 177–182.
- [11] Dawood S, Broglio K, Buzdar AU, et al. Prognosis of women with metastatic breast cancer by HER-2status and trastuzumab treatment: An institutional-based review. J Clin Oncol 2010; 28: 92–98.
- [12] Spector NL, Blackwell KL. Understanding the mechanisms behind trastuzumab t HER-apy for human epidermal growth factor receptor 2-positive breast cancer. J Clin Oncol 2009; 27: 5838–5847.
- [13] Franklin M, Carey K, Vajdos F, et al. Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex. Cancer Cell 2004; 5: 317–328.
- [14] Baselga J, Gelmon KA, Verma S, et al. Phase II trial of pertuzumab and trastuzumab in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer that progressed during prior trastuzumab therapy. J Clin Oncol 2010; 28: 1138–1144.
- [15] Baselga J, Cortes L, Kim SB, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med 2012; 366: 109–119.
- [16] Lewis Phillips GD, Li G, Dugger DL, et al. Targeting HER-2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate. Cancer Res 2008; 68: 9280–9290.
- [17] Burris H, Rugo HS, Vukelja SL, et al. Phase II study of the antibody drug conjugate trastuzumab-DM1 for the treatment of human epidermal growth factor receptor 2 (HER-2) positive breast cancer after prior HER-2-directed therapy. J Clin Oncol 2011; 29: 398–405.
- [18] Hurvitz S, Dirix L, Kocsis J, et al. Trastuzumab emtansine (T-DM1) versus trastuzumab + docetaxel in previously untreated HER-2-positive metastatic breast cancer (MBC): Primary results of a randomized, multicenter, open-label phase II study (TDM4450g/BO21976) (abstract 5.001). Presented at the ESMO-ECCO European Multidisciplinary Cancer Congress, Stockholm, Sweden, September 23–27, 2011.
- [19] Cortes J, O´ Shaughnessy J, Losech D, et al. EMBRACE (Eisai Metastatic Breast Cancer Study Assessing Physician’s Choice Versus E7389) investigators. Lancet 2011; 377: 914–923.
- [20] LoRusso PM, Weiss D, Guardino E, et al. Trastuzumab Emtansine: A Unique Antibody-Drug Conjugate Receptor 2-Positive Cancer in Development for Human Epidermal Growth Factor. Clin Cancer Res 2011; 17: 6437–6447.