Novinky v léčbě nemalobuněčného karcinomu plic
Karcinom plic patří mezi nejčastější zhoubné nádory v Evropě i ve světě. Incidence činí v evropských zemích 30,2/100 000 obyvatel, přičemž ČR zaujímá deváté místo; mortalita v Evropě dosáhla hodnoty 25,2/100 000 obyvatel a ČR v evropském srovnání obsazuje desáté místo. Podle dat z Národního onkologického registru byl v letech 2004–2008 nemalobuněčný karcinom plic zastoupen 65,9 % u mužů a 62,1 % u žen. Vzhledem ke své biologické povaze bylo onemocnění považováno až do roku 1980 za léčitelné pouze v těch případech, kdy byla možná operace. V posledních letech zaznamenala léčba nemalobuněčného karcinomu plic prudký rozvoj především díky rozpoznání prediktivních faktorů. Na jejich základě je indikována cytostatická léčba pemetrexedem v kombinaci s cisplatinou a dále je stanovena úhrada nebo se její stanovení předpokládá u řady biologických léků (afatinib, bevacizumab, crizotinib, erlotinib, gefitinib a jiné). Dalším pokrokem jsou důkazy o významu pokračovací léčby nemalobuněčného karcinomu plic.
Úvod
Karcinom plic patří mezi nejčastější zhoubné nádory v Evropě i ve světě. Incidence (věkově standardizovaná na světový věkový standard) činí v evropských zemích 30,2/100 000 obyvatel, přičemž ČR zaujímá deváté místo; mortalita v Evropě dosáhla hodnoty 25,2/100 000 obyvatel a ČR zde v evropském srovnání obsazuje desáté místo [1–4].
Země střední a východní Evropy v současnosti patří mezi nejvíce postižené těmito nádory u mužů, Česká republika v tomto není bohužel výjimkou. V ČR je nově diagnostikováno 6250–6550 pacientů s tímto onemocněním a 5400–5700 pacientů na něj zemře. Celková incidence se v posledním období stabilizuje, avšak existují významné rozdíly mezi muži a ženami. Index růstu vztažený k roku 1998 dosáhl hodnoty -6 % u mužů a +44 % u žen. Typický věk českého pacienta s bronchogenním karcinomem se pohybuje v intervalu 59–74 let a 25 % všech nemocných je mladších než 60 let. Prevalence dosáhla v roce 2008 hodnoty 10 193 osob a ve srovnání s rokem 1998 tak vrostla o 40 % [4].
Bronchogenní karcinom je v ČR velmi často diagnostikován ve stavu pokročilého onemocnění. Více než 60 % pacientů obou pohlaví je diagnostikováno v pokročilých stadiích III nebo IV, kde již často není indikován radikální operační výkon, a prognóza je tedy vysoce nepříznivá. Aktuální data z USA uvádějí 41 % generalizovaných onemocnění u bronchogenního karcinomu, což je údaj takřka totožný s českými daty [5].
Nádory plic bývají zjišťovány ve věku 35–85 let, nejčastěji mezi 55.–80. rokem života. U kuřáků je nezvratně prokázáno řadou studií větší ohrožení rakovinou plic. Ti, kteří kouřili více než 20 cigaret denně po dobu 20 let, mají 20krát vyšší riziko vzniku karcinomu plic než nekuřáci. Samozřejmě existuje řada dalších příčin, které vznik nádoru také podporují – ionizující záření, chemické a biologické příčiny (viry). Uplatňují se také ekologicky nepříznivé vlivy (např. oxid siřičitý). Riziko zvyšuje rovněž pasivní kouření [6].
Ná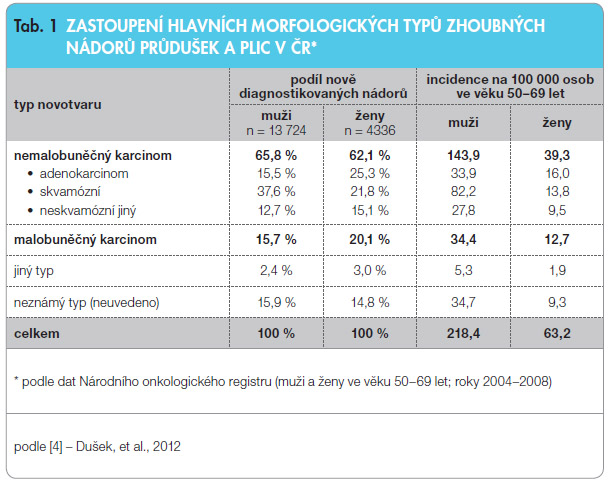 dory plic dělíme podle jejich biologického chování, histologického složení, rozsahu a umístění. Co nejpřesnější klasifikace nádoru a určení stadia jsou nezbytné pro plánování léčby, rozhodnutí o léčebné strategii a sledování [6].
dory plic dělíme podle jejich biologického chování, histologického složení, rozsahu a umístění. Co nejpřesnější klasifikace nádoru a určení stadia jsou nezbytné pro plánování léčby, rozhodnutí o léčebné strategii a sledování [6].
Úplný přehled histologických typů zhoubných nádorů užívaných v rámci Národního onkologického registru (NOR) ČR poskytuje třetí vydání Mezinárodní klasifikace nemocí pro onkologii [7]. Rozdělení na nejčastější morfologické typy dle klasifikace National Cancer Institute (NCI) je včetně aktuálního zastoupení v datech NOR uvedeno v tab. 1.
Rozložení histologických typů je závislé na pohlaví a na anamnéze kouření. U mužů bylo v datech NOR celkově zjištěno 39 % spinocelulárních karcinomů, u žen pak 23 %, což odpovídá publikovaným údajům 40 % a 20 %. Podíl 15–16 % adenokarcinomů u mužů a 25 % u žen je však výrazně nižší než běžně publikované údaje ze západních zemí (24 % a 46 %) [4].
Vývoj léčby nemalobuněčného karcinomu plic
Nemalobuněčný typ plicní rakoviny (non-small cell lung cancer, NSCLC) je jedním z nejčastějších plicních nádorů. Roste pomalu, později metastazuje a je málo citlivý k chemoterapii a radioterapii. Jen 10 % nemocných má naději na pětileté přežití [6].
Vzhledem ke své biologické povaze byl tento nádor, na rozdíl od malobuněčných forem, považován až do roku 1980 za léčitelný pouze v těch případech, kdy byla možná operace. Přihlédneme-li ke skutečnosti, že ze všech „včasně“ zjištěných případů není ani 20 % operabilních, bylo zbývajících více než 80 % považováno za nádory neléčitelné. Pro pokročilá stadia onemocnění se léčba nedoporučovala. Výsledky studií z posledních let prokázaly, že i pokročilé formy nemalobuněčného karcinomu plic reagují na léčbu chemoterapií a u některých stadií společně s radioterapií. Současná léčba se zaměřuje na prodloužení délky života, jeho kvalitu a ovlivnění nežádoucích příznaků nemoci.
Léčba nemalobuněčných nádorů plic se řídí zařazením do klasifikace TNM* a klinických stadií. Více než polovina nemocných je při stanovení diagnózy onemocnění už v pokročilých stadiích (IIIB a IV) [6].
*Klasifikace TNM charakterizuje stadium nádoru.
T – popisuje velikost nádoru a míru infiltrace okolní tkáně.
N – popisuje regionální mízní uzliny, které jsou nádorem postiženy.
M – popisuje metastázy ve vzdálených částech těla.
Základní léčebné možnosti u NSCLC
Chirurgický zákrok s léčebným záměrem
Podle současných poznatků je doporučován při malém rozsahu nádoru a minimálním nádorovém postižení uzlin. Jde především o klinická stadia I a II, není-li operace vyloučena z hlediska plicní ventilace nebo kvůli závažnému internímu onemocnění. Obdobně je tomu u klinického stadia IIIA, ale před operací se doporučuje u tohoto stadia zmenšit rozsah nádoru pomocí chemoterapie, popř. v kombinaci s radioterapií. V době stanovení diagnózy je chirurgická léčba reálná u 20–25 % nemocných podle zahraničních zdrojů, v České republice u 10–17 % nemocných. Pět let přežívá u klinického stadia I zhruba 60–70 % operovaných nemocných, u stadia II 35–40 % a u stadia IIIA 10–15 % operovaných pacientů.
Chemoterapie (léčba cytostatická, konvenční chemoterapie)
Pokud je nádor diagnostikován jako místně pokročilý nebo jsou přítomny metastázy, indikuje se chemoterapie s následnou nebo souběžnou radioterapií. V devadesátých letech 20. století byla do léčby zařazena tzv. cytostatika III. generace (paklitaxel, docetaxel, vinorelbin, gemcitabin). Při použití léčebných kombinací platinových derivátů s těmito cytostatiky se u více pacientů nádor zmenšuje (objektivně odpovídá na léčbu), což pro nemocné znamená především ústup potíží. Od roku 2010 je v první linii léčby adenokarcinomu a velkobuněčného karcinomu indikováno podání antifolátu pemetrexedu v kombinaci s cisplatinou [8].
Radioterapie s léčebným záměrem
Radioterapie je indikována u nemocných, kteří nejsou schopni operace a nemají prokázány vzdálené metastázy. Kombinovaná léčba chemoterapií a radioterapií patří v současné době do standardních léčebných postupů. Perspektivy léčby chemoterapií a radioterapií spočívají v současné době ve zdokonalování léčebné taktiky, v optimálním načasování léčby s využitím intenzity dávek, ve snižování toxicity, v účinnějším předcházení vzniku metastáz a v překonání rezistence vůči chemoterapii. Snahou je podávat cytostatika perorálně (obvykle v tabletách), pokud perorální forma existuje [6].Ukázalo se, že v chemoterapii již bylo dosaženo maxima a žádná nová cytostatika ani nové kombinace již nepřispějí k významnému zlepšení léčebného účinku a přežívání nemocných.
Biologická léčba
Biologická léčba je někdy označována také jako tzv. cílená molekulární terapie, protože lépe vyjadřuje skutečnost, že zasahuje selektivněji do nitrobuněčných pochodů v nádorové buňce. Většinou se jedná o nízkomolekulární látky, které vazbou např. na receptory blokují signální dráhy vedoucí do buněčného jádra. Tyto signální dráhy ve svém důsledku ovlivňují vlastnosti buňky, které ji činí maligní, jako jsou: inhibice apoptózy (u nádorové buňky nedochází ke kontrolované buněčné smrti tak jako u fyziologické buňky), schopnost novotvorby cév a vlastního zásobování nádoru živinami, nekontrolovaná proliferace nádorové buňky, schopnost nádorové buňky metastazovat [8].
V léčbě pokročilého NSCLC jsou v ČR v současné době využívány inhibitory tyrozinkinázy receptoru epidermálního růstového faktoru (epidermal growth factor receptor, EGFR) – erlotinib a gefitinib. EGFR patří do rodiny proteinů ErbB, kterou tvoří čtyři strukturálně příbuzné receptory – jedná se o ErbB1 až ErbB4. V rámci této rodiny nese EGFR označení ErbB1. EGFR je monomer umístěný v buněčné membráně. Skládá se z extracelulární, transmembránové a intracelulární domény. Pokud dojde k navázání ligandu, dochází ke změnám ve struktuře receptoru, k aktivaci jeho tyrozinkinázové aktivity a ke spuštění signální dráhy směrem do buněčného jádra. Důsledky aktivace EGFR jsou pak nadměrná proliferace, angiogeneze a invazivita nádorové buňky, zvyšuje se její schopnost zakládat metastázy a inhibovat apoptózu [9].
Na základě výsledku randomizované (kontrolované) studie s placebem byla v naší republice v roce 2005 stanovena úhrada pro léčbu erlotinibem u nemocných s NSCLC. Erlotinib je indikován u nemocných v dobrém klinickém stavu s pokročilým NSCLC po selhání první nebo druhé linie chemoterapie [10].
Dále je pro léčbu první linie NSCLC na základě výsledků studie [11] u nemocných s průkazem aktivačních mutací genu EGFR v ČR od února 2011 podáván gefitinib.Frekvence mutace genu pro EGFR v kavkazské populaci je 10 %. Asijská populace je mutovaná ve větší míře, ve 30–40 % případů. Mezinárodní klinické studie ISEL, INTEREST a IPASS prokázaly účinnost a bezpečnost léčby tyrozinkinázovými inhibitory (TKI) právě u pacientů s aktivační mutací genu pro EGFR. Obecně je vyšší výskyt mutace genu pro EGFR u žen, nekuřáků, Asijců, v případě histologické diagnózy adenokarcinomu a při vysoké expresi EGFR. Mezi běžnější mutace na genu pro EGFR patří delece na exonu 19 a mutace L858R na exonu 21 [12–15]. Oba přípravky (erlotinib i gefitinib) se podávájí perorálně. Ve srovnání s konvenční cytostatickou léčbou je tato léčba především staršími nemocnými velmi dobře tolerována [15, 16].
Dalším biologickým léčivem užívaným v ČR v léčbě NSCLC je protilátka bevacizumab, která blokuje receptor vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor receptor, VEGFR). V klinických studiích byly prokázány velmi dobré léčebné výsledky v kombinaci s konvenční chemoterapií u nemocných s pokročilým nedlaždicobuněčným NSCLC již v první linii po stanovení diagnózy [17]. V ČR je indikováno podání bevacizumabu společně s chemoterapií na bázi platiny v první linii léčby nemocných s adenokarcinomem, u kterých není nádor lokalizován centrálně. Jeho širší užití limituje fakt, že není zařazen mezi tzv. centrové léky, tudíž náklady na něj spadají do paušálu jednotlivých pneumoonkologických center.
Novinky biologické léčby v první a dalších liniích klinických studií
U 70 % pacientů s NSCLC a pozitivní aktivační mutací genu EGFR, kteří odpovídají na terapii TKI, není léčba dlouhodobě úspěšná. Vyvíjí se rezistence s mediánem 10 měsíců od zahájení cílené terapie [12–15]. Proto je snah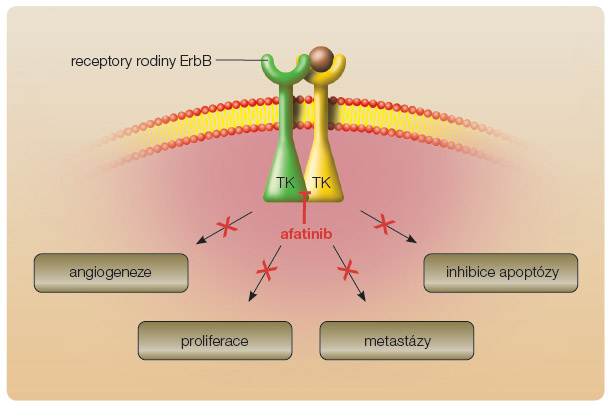 a najít ireverzibilní inhibitor. V roce 2012 byly publikovány na konferenci Americké společnosti klinické onkologie (ASCO) výsledky léčby afatinibem ve studii LUX-Lung 3, která prokázala, že afatinib významně prodlužuje dobu přežití do progrese (progression free survival, PFS) v porovnání s nejlepší standardní chemoterapií. Afatinib je selektivní ireverzibilní inhibitor proteinů rodiny ErbB, biologicky dostupný při perorálním podávání. Afatinib blokuje činnost EGFR (epidermal growth factor receptor, též ErbB1), HER2 (ErbB2) a ErbB4. Afatinib působí odlišným způsoben než jiné dostupné přípravky cílené léčby. Mechanismus účinku spočívá v ireverzibilní blokádě rodiny receptorů ErbB (obr. 1) [18].
a najít ireverzibilní inhibitor. V roce 2012 byly publikovány na konferenci Americké společnosti klinické onkologie (ASCO) výsledky léčby afatinibem ve studii LUX-Lung 3, která prokázala, že afatinib významně prodlužuje dobu přežití do progrese (progression free survival, PFS) v porovnání s nejlepší standardní chemoterapií. Afatinib je selektivní ireverzibilní inhibitor proteinů rodiny ErbB, biologicky dostupný při perorálním podávání. Afatinib blokuje činnost EGFR (epidermal growth factor receptor, též ErbB1), HER2 (ErbB2) a ErbB4. Afatinib působí odlišným způsoben než jiné dostupné přípravky cílené léčby. Mechanismus účinku spočívá v ireverzibilní blokádě rodiny receptorů ErbB (obr. 1) [18].
Mezi běžnější mutace na genu pro EGFR patří delece na exonu 19 a mutace L858R na exonu 21. Právě ve skupině těchto „běžných“ mutací dosáhl afatinib ve studii LUX-Lung 3 nejlepších výsledků v PFS. U méně častých mutací bylo také prokázáno prodloužení PFS, ale v menší míře. Podstatné je, že afatinib vykazuje in vitro i aktivitu vůči mutaci T790M, která je spojena s rezistencí na léčbu inhibitory EGFR. Studie LUX-Lung 1 a LUX-Lung 2 nejprve prokázaly, že pacienti s mutací genu pro EGFR mají jednoznačně z léčby afatinibem přínos. Studie LUX-Lung 3 pak dokázala, že první linie léčby afatinibem ve skupině pacientů s aktivační mutací genu pro EGFR byla úspěšnější než léčba kombinací pemetrexedu a cisplatiny [18].
Studie LUX-Lung 3 zjišťovala účinnost a bezpečnost afatinibu ve srovnání s chemoterapií ve složení cisplatina a pemetrexed u pacientů s pokročilým plicním adenokarcinomem s pozitivní mutací EGFR. Je nejrozsáhlejší prospektivní studií na souboru pacientů s pozitivní mutací EGFR a jako první srovnává biologickou léčbu plicního adenokarcinomu afatinibem s chemoterapií ve složení cisplatina a pemetrexed, která je vysoce účinná a dobře tolerovaná, ale nebyla dosud srovnána s TKI ve skupině EGFR mutovaných pacientů. Do studie bylo ve 133 centrech ve 25 státech zařazeno od srpna 2009 do února 2011 celkem 345 pacientů s pozitivní mutací EGFR, která se u všech vyšetřovala pomocí Thera screen EGFR RGQ PCR kitu. Celkem byl mutační status EGFR testován u 1269 pacientů, z nichž pozitivní mutaci mělo 452 pacientů, 107 těchto nemocných ale nevyhovovalo podmínkám zařazení do studie. Všichni zařazení pacienti byli chemonaivní a nebyli před vstupem do studie léčeni inhibitory EGFR. Performance status (PS) byl 0–1, pacienti se nacházeli v klinickém stadiu IIIb a IV patologicky potvrzeného plicního adenokarcinomu. Přípustné pro zařazení byly asymptomatické mozkové metastázy. Odpověď na léčbu byla u všech pacientů hodnocena podle kritérií RECIST 1.1 (Response Evaluation Criteria In Solid Tumors). Pacienti byli randomizováni a rozděleni v poměru 2 : 1 dle rasy a druhu mutace – 230 pacientů do větve léčené afatinibem (z nichž nebyl léčen jeden pacient), 115 pak do větve s chemoterapií v kombinaci cisplatina a pemetrexed (z nichž léčbu nepodstoupili čtyři pacienti). Afatinib byl aplikován perorálně jedenkrát denně v dávce 40 mg. Chemoterapie byla podávána intravenózně, pemetrexed v dávce 500 mg/m2 tělesného povrchu, cisplatina v dávce 75 mg/m2 tělesného povrchu za tři týdny, minimálně šest cyklů léčby [18].
Primárním výstupem studie bylo nezávislé posouzení PFS, sekudárními výstupy pak zhodnocení míry výskytu objektivní odpovědi na léčbu (objective response rate, ORR), čas do progrese symptomů nádorového onemocnění a bezpečnost užívání. Medián doby potřebné k určení mutačního statusu EGFR byl pět dní. Uzavření dat pro primární analýzu proběhlo v únoru 2012, medián follow-up činil 16,4 měsíce [18].
![Graf 1 Nezávislé hodnocení PFS ve skupině všech randomizovaných pacientů (n = 345); podle [18] – Yang, et al., 2012. PFS – přežití bez progrese; CI – konfidenční interval, interval spolehlivosti; HR – hazard ratio, poměr rizik; cis/pem – cisplatina/pemetrexed](https://www.remedia.cz/photo-a-29329---.jpg) Léčba afatinibem vedla ve srovnání s chemoterapií k výraznému prodloužení PFS. Medián PFS byl 11,1 měsíce u ramene s afatinibem, 6,9 měsíce u ramene s chemoterapií (HR = 0,58; 95% CI: 0,43–0,78; p = 0,0004). U 308 pacientů s obvyklými mutacemi (Del19 či L858R) byl medián PFS 13,6 měsíce u afatinibu oproti 6,9 měsíce u pacientů léčených chemoterapií (HR = 0,47; 95% CI: 0,34–0,65; p < 0,0001), viz graf 1 a graf 2. ORR bylo významně vyšší při léčbě afatinibem oproti chemoterapii (56 % vs. 23 %; p < 0,0001). Signifikantně se při léčbě afatinibem ve srovnání s chemoterapií podařilo oddálit progresi kašle (HR = 0,60; p = 0,072) a dušnosti (HR = 0,68; p = 0,0145) [18].
Léčba afatinibem vedla ve srovnání s chemoterapií k výraznému prodloužení PFS. Medián PFS byl 11,1 měsíce u ramene s afatinibem, 6,9 měsíce u ramene s chemoterapií (HR = 0,58; 95% CI: 0,43–0,78; p = 0,0004). U 308 pacientů s obvyklými mutacemi (Del19 či L858R) byl medián PFS 13,6 měsíce u afatinibu oproti 6,9 měsíce u pacientů léčených chemoterapií (HR = 0,47; 95% CI: 0,34–0,65; p < 0,0001), viz graf 1 a graf 2. ORR bylo významně vyšší při léčbě afatinibem oproti chemoterapii (56 % vs. 23 %; p < 0,0001). Signifikantně se při léčbě afatinibem ve srovnání s chemoterapií podařilo oddálit progresi kašle (HR = 0,60; p = 0,072) a dušnosti (HR = 0,68; p = 0,0145) [18].
Nejčastějšími nežádoucími účinky léčby afatinibem byly průjem (95 %), vyrážka (62 %), par![Graf 2 Nezávislé hodnocení PFS u skupiny pacientů s mutacemi Del19/L858R (n = 308); podle [18] – Yang, et al., 2012. PFS – přežití bez progrese; CI – konfidenční interval, interval spolehlivosti; HR – hazard ratio, poměr rizik; cis/pem – cisplatina/pemetrexed](https://www.remedia.cz/photo-a-29330---.jpg) onychium – zánět nehtového lůžka a jeho okolí (57 %). U pacientů léčených chemoterapií se objevila nauzea (66 %), nechutenství (53 %) a zvracení (42 %). Léčbu afatinibem bylo nutno kvůli nežádoucím účinkům přerušit u 8 % pacientů (z toho u 1 % pro průjem), chemoterapii u 12 % pacientů [18].
onychium – zánět nehtového lůžka a jeho okolí (57 %). U pacientů léčených chemoterapií se objevila nauzea (66 %), nechutenství (53 %) a zvracení (42 %). Léčbu afatinibem bylo nutno kvůli nežádoucím účinkům přerušit u 8 % pacientů (z toho u 1 % pro průjem), chemoterapii u 12 % pacientů [18].
Z uvedených statistických dat plyne, že léčba afatinibem ve srovnání s uvedenou chemoterapií významně prodlužuje PFS, velmi dobře ze studie vyšla i frekvence výskytu objektivní odpovědi na léčbu a doba do progrese symptomů onemocnění. Nežádoucí účinky léčby afatinibem byly zvládnutelné a léčba musela být přerušena pouze v malém počtu případů. S prodloužením mediánu PFS o 4,2 měsíce v celém sledovaném souboru a o 6,8 měsíce u pacientů s běžnými mutacemi představuje podávání afatinibu významnou možnost první linie léčby pokročilého plicního adenokarcinomu. Úspěšnost léčby afatinibem je totiž na rozdíl od ostatních dosud dostupných inhibitorů tyrozinkinázové aktivity EGFR dána tím, že nepůsobí pouze na jeden konkrétní cíl; afatinib inhibuje tyrozinkinázovou aktivitu více členů rodiny ErbB a může být využit v první linii léčby i u těch nemocných, u kterých je zjištěna mutace T790M nepříznivá pro erlotinib a gefitinib [18].
Dalším z nových přípravků biologické léčby je crizotinib. Je to selektivní inhibitor ALK (anaplastické lymfomové kinázy) a jejích onkogenních variant (ALK fúze a vybrané ALK mutace). Působí i jako TKI receptoru pro růstový faktor hepatocytů (hepatocyte growth factor receptor, HGFR, c-Met). ALK je člen „čeledi“ inzulinového receptoru ze souboru receptorových tyrozinkináz. Jedná se o transmembránový protein o jednom řetězci složený z 1620 aminokyselin u lidí, myší, drosofil. Fyziologická funkce ALK je neznámá. Současné údaje naznačují, že ALK je zahrnuta do neuronální buněčné diferenciace a regenerace, formování synapsí a do migrace svalových buněk. Patologicky zvýšená je ALK v době diagnózy nebo při progresi maligních onemocnění. Specifický onkogen EML4-ALK (fúzní mutace) je přítomen přibližně u 5 % nemocných s NSCLC. Výskyt EML4-ALK mutace je vyšší u adenokarcinomů a u pacientů nekuřáků či v minulosti lehkých kuřáků. Crizotinib prokázal klinickou aktivitu u pacientů s NSCLC EML4-ALK pozitivních a je předmětem dalšího klinického zkoušení. Průkaz mutace EML4-ALK je nezbytný pro podání crizotinibu u nemocných s NSCLC. V roce 2012 bylo možné pacienty s NSCLC testovat pro indikaci crizotinibu v rámci specifického léčebného programu. Vyšetření mutace ALK se provádí v metodou FISH (fluorescenční in situ hybridizace), což je cytogenetická metoda, která umožňuje označit konkrétní místo na DNA. Touto metodou se prokáže zlom genu ALK, současně se detekuje translokace zasahující gen ALK. Dále je indikováno imunohistochemické vyšetření (IHC) [19–24].
Crizotinib se podává perorálně v tvrdých tobolkách (200 mg nebo 250 mg). V ČR se předpokládá indikace pro léčbu dospělých pacientů s již dříve léčeným pokročilým NSCLC pozitivním vůči ALK. Stanovení translokace EML-ALK se provádí metodou FISH a IHC. Hodnocení by měly provádět laboratoře s prokázanou zkušeností v používání specifické technologie. Doporučená dávka je 250 mg 2krát denně, dávku lze snížit na 200 mg 2krát denně nebo na 250 mg 1krát denně. Kontraindikací podávání je hypersenzitivita na léčivo nebo na pomocné látky a závažná porucha funkce jater. Při podání crizotinibu může dojít k hepatotoxicitě, pneumonitidě, prodloužení QT intervalu, možné jsou účinky na zrak, léková interakce se silnými inhibitory/induktory CYP3A a substráty CYP3A4 s úzkým terapeutickým indexem. Crizotinib může indukovat enzymy regulované pregnanovým X receptorem (PXR). Nejčastějšími nežádoucími účinky jsou poruchy zraku (dvojité vidění, fotopsie, rozmazané vidění), nauzea, průjem, zvracení, otoky, zácpa a únava [24–26].
V současnosti (únor 2013) se předpokládá, že crizotinib bude mít stanovenou úhradu pro léčbu dříve léčeného pokročilého ALK-pozitivního nemalobuněčného karcinomu. Dle společného mezioborového konsenzu by na přestavbu genu ALK měli být testováni všichni pacienti, u kterých je zvažována léčba crizotinibem, je u nich stanovena morfologická diagnóza adenokarcinomu, NSCLC spíše adenokarcinomu či NSCLC NOS (blíže nespecifikovaného NSCLC) a nebyla u nich prokázána přítomnost mutace genu EGFR. Pacienti by neměli být vybíráni na základě klinických faktorů (pohlaví, kuřáctví, věk, etnikum) [27].Další novinkou jsou výsledky léčby erlotinibem v první linii léčby NSCLC. Studie fáze III EURTAC (The EURopean TArceva vs Chemotherapy) hodnotila léčbu erlotinibem ve srovnání s chemoterapií v první linii léčby kavkazských pacientů s pokročilým NSCLC nesoucím aktivační mutaci EGFR. Výsledky průběžné analýzy studie EURTAC (clinicaltrials.gov NCT00446225) prezentované na výročním zasedání ASCO v červnu 2011 byly podkladem pro indikaci erlotinibu v první linii léčby pacientů s NSCLC s prokázanou aktivační mutací EGFR [28].
Studie EURTAC byla vedena Španělskou skupinou pro léčbu nádorů plic (SLCG). Během února 2007 až ledna 2011 byl proveden screening zaměřený na přítomnost aktivační mutace EGFR u 1277 pacientů ve 42 centrech ve Španělsku, Francii a Itálii; 174 pacientů s potvrzenou aktivační mutací EGFR bylo randomizováno k léčbě erlotinibem nebo k chemoterapii obsahující platinu. Primárním cílem studie bylo prokázat superioritu erlotinibu nad chemoterapií v parametru PFS. Sekundárními cíli byly: četnost odpovědí, celkové přežití (OS), místo progrese, bezp![Graf 3 PFS u nemocných s pokročilým NSCLC léčených v první linii erlotinibem a chemoterapií; podle [28] – De Marinis, et al., 2012. PFS – přežití bez progrese; HR – hazard ratio, poměr rizik; CI – konfidenční interval, interval spolehlivosti](https://www.remedia.cz/photo-a-29331---.jpg) ečnost, sérová analýza EGFR mutace a kvalita života [28]. K léčbě erlotinibem bylo randomizováno 86 pacientů, k léčbě chemoterapií 87 pacientů. Medián doby do progrese byl signifikantně prodloužen u pacientů léčených erlotinibem na 9,7 měsíce vs. 5,2 měsíce u pacientů léčených chemoterapií (HR = 0,37; 95% CI: 0,25–0,54; p < 0,0001), viz graf 3. Bezpečnostní profil erlotinibu je v souladu s předchozími studiemi u NSCLC. Incidence nežádoucích účinků v souvislosti se studijní léčbou byla v obou ramenech podobná, avšak při podávání chemoterapie byla vyšší incidence závažných nežádoucích účinků než při léčbě erlotinibem (21 % vs. 7 %). Předčasné ukončení léčby kvůli nežádoucímu účinku bylo nutné u 19 % pacientů léčených chemoterapií a 7 % pacientů léčených erlotinibem. Pacienti léčení chemoterapií měli častější výskyt nežádoucích příhod stupně 3–4 (neutropenie stupně 3 u 14 %, stupně 4 u 7 % z 83 pacientů léčených chemoterapií vs. 0 pacientů léčených erlotinibem). Rash a průjem byly dle očekávání častější v rameni s erlotinibem (rash stupně 3 u 9 % pacientů, průjem stupně 3 u 5 % pacientů z 84 pacientů léčených erlotinibem). Rash ani průjem stupně 4 se nevyskytly. Anémie stupně 4 a elevace hladin ALT stupně 4 se vyskytla u 1 % pacientů léčených erlotinibem [28].
ečnost, sérová analýza EGFR mutace a kvalita života [28]. K léčbě erlotinibem bylo randomizováno 86 pacientů, k léčbě chemoterapií 87 pacientů. Medián doby do progrese byl signifikantně prodloužen u pacientů léčených erlotinibem na 9,7 měsíce vs. 5,2 měsíce u pacientů léčených chemoterapií (HR = 0,37; 95% CI: 0,25–0,54; p < 0,0001), viz graf 3. Bezpečnostní profil erlotinibu je v souladu s předchozími studiemi u NSCLC. Incidence nežádoucích účinků v souvislosti se studijní léčbou byla v obou ramenech podobná, avšak při podávání chemoterapie byla vyšší incidence závažných nežádoucích účinků než při léčbě erlotinibem (21 % vs. 7 %). Předčasné ukončení léčby kvůli nežádoucímu účinku bylo nutné u 19 % pacientů léčených chemoterapií a 7 % pacientů léčených erlotinibem. Pacienti léčení chemoterapií měli častější výskyt nežádoucích příhod stupně 3–4 (neutropenie stupně 3 u 14 %, stupně 4 u 7 % z 83 pacientů léčených chemoterapií vs. 0 pacientů léčených erlotinibem). Rash a průjem byly dle očekávání častější v rameni s erlotinibem (rash stupně 3 u 9 % pacientů, průjem stupně 3 u 5 % pacientů z 84 pacientů léčených erlotinibem). Rash ani průjem stupně 4 se nevyskytly. Anémie stupně 4 a elevace hladin ALT stupně 4 se vyskytla u 1 % pacientů léčených erlotinibem [28].
Ve srovnání se standardní chemoterapií prokázal erlotinib signifikantní prodloužení přežití do progrese u pacientů s NSCLC aktivační mutací EGFR. Léčba erlotinibem byla pacienty lépe tolerována. Výsledky potvrdily možnost podávání erlotinibu v první linii léčby pokročilého NSCLC s prokázanou aktivační mutací EGFR.
Studie fáze III OPTIMAL, provedená u čínských pacientů s NSCLC s aktivační mutací EGFR, také prokázala v první linii léčby signifikantně prodloužené PFS pacientů léčených erlotinibem ve srovnání s chemoterapií s platinovým dubletem (PFS 13,7 měsíce v rameni s erlotinibem vs. 4,6 měsíce v rameni s chemoterapií, HR = 0,164) [29].
Necitumumab je nová molekula, která je zkoušena pro případné využití v systémové paliativní léčbě pokročilého metastazujícího NSCLC. V současné době probíhají registrační studie fáze III. Jedná se o plně humánní monoklonální protilátku typu IgG1 s vysokou vazebnou afinitou k extracelulární vazebné doméně receptoru typu 1 pro epidermální růstový faktor (EGFR1). Svým působením blokuje vazbu EGF ligandu s následnou aktivací receptoru a spuštěním EGFR signální dráhy [30].
V současnosti probíhá velká mezinárodní randomizovaná registrační studie fáze III (SQUIRE), která testuje na souboru 1097 pacientů s pokročilým/metastazujícím NSCLC dlaždicobuněčné histologie účinnost a bezpečnost necitumumabu přidaného v první linii léčby ke kombinaci cisplatina-gemcitabin a podávaného do progrese onemocnění ve srovnání s první linií léčby kombinací cisplatina-gemcitabin. Primárním hodnoceným parametrem ve studii je celkové přežití. V roce 2012 byl dokončen příjem pacientů a studie se nyní nachází v tzv. fázi fol-
low-up. V případě pozitivního výsledku studie a následné registrace by mohl být necitumumab první biologickou léčbou (monoklonální protilátkou) pro pacienty s dlaždicobuněčným typem NSCLC [30].
Dalším nadějným léčivem je ramucirumab. Jedná se o plně humánní monoklonální protilátku typu IgG1 s vysokou afinitou k extracelulární vazebné doméně receptoru typu 2 pro vaskulární endoteliální růstový faktor (VEGFR2). Svým působením blokuje vazbu ligandů (zejména VEGF-A) a následnou aktivaci VEGFR2 a spuštění VEGFR signální dráhy. Patří tedy mezi potenciální inhibitory angiogeneze, mechanismem účinku je odlišný od bevacizumabu. Ramucirumab neblokuje solubilní ligand (VEGF-A) jako bevacizumab, ale blokuje přímo extracelulární vazebnou doménu receptoru (VEGFR2), čímž znemožňuje receptorovou vazbu a aktivaci VEGFR2 signální dráhy nejen působením ligandu VEGF-A, ale i působením jiných aktivujících ligandů, které mohou kromě VEGF-A receptor VEGFR2 aktivovat a signální dráhu spouštět. V současnosti probíhá velká mezinárodní randomizovaná registrační studie fáze III (REVEL) testující u souboru 1097 pacientů s pokročilým/metastazujícím NSCLC všech histologických typů (tedy včetně dlaždicobuněčného histologického typu) účinnost a bezpečnost ramucirumabu přidaného do kombinace k docetaxelu ve druhé linii léčby ve srovnání s monoterapií docetaxelem ve druhé linii léčby. Primárním hodnoceným parametrem je OS. Na přelomu let 2012 a 2013 byl dokončen příjem pacientů a studie se nyní nachází ve fázi follow-up [31].
Novinky v udržovací léčbě NSCLC
Jednou z prvních studií, ve které bylo dosaženo velmi dobrých výsledků, byla studie SATURN. Ve studii byl erlotinib podáván bezprostředně po minimálně čtyřech cyklech chemoterapie na bázi platiny (konsolidační udržovací léčba – „switch maintenance“) a jeho účinek byl opět bezprostředně porovnáván s placebem. Udržovací léčba erlotinibem vedla k signifikantnímu zlepšení PFS i OS. Účinek erlotinibu byl nezávislý na EGFR IHC, EGFR FISH, CA-SSR1 i na stavu KRAS. K signifikantnímu zlepšení PFS došlo u nemocných s „divokým“ (nemutovaným) i mutovaným typem EGFR. Stejně tak došlo k signifikantnímu zlepšení OS u nemocných s „divokým“ i mutovaným typem EGFR. Žádná z analýz sledovaných biomarkerů nepodporovala vyloučení některých nemocných z udržovací léčby erlotinibem [32].
Udržovací léčbě byla věnována i randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III ATLAS, která porovnávala bevacizumab s erlotinibem nebo bez erlotinibu po ukončení první linie léčby režimem chemoterapie s bevacizumabem u nemocných s lokálně pokročilým, rekurentním nebo metastatickým NSCLC. Cílem práce bylo porovnání PFS u nemocných s pokročilým NSCLC, kteří byli randomizováni k léčbě bevacizumabem v kombinaci s erlotinibem, resp. k léčbě bevacizumabem a placebem, po dokončení čtyř cyklů chemoterapie s bevacizumabem bez progrese nemoci nebo bez významné toxicity. Přidání erlotinibu k bevacizumabu po čtyřech cyklech chemoterapie s bevacizumabem významně zlepšilo parametr PFS (HR 0,722; p = 0,0012). Zlepšení PFS bylo pozorováno v různých podskupinách, včetně podskupin určených pohlavím, histologií, věkem a anamnézou kouření [33].
Randomizovaná, dvojitě slepá, placebem kontrolovaná studie fáze III JMEN s léčbou pemetrexedem v režimu tzv. „switch maintenance“ (udržovací léčba se změnou preparátu) hodnotila podávání monoterapie pemetrexedem do progrese onemocnění ve srovnání s placebem. Pemetrexed nebo placebo byly podávány u pacientů s NSCLC stadia IIIB/IV, u kterých bylo dosaženo kontroly onemocnění (objektivní odpovědi či stabilizace onemocnění) po čtyřech cyklech léčby platinovým derivátem (cisplatina nebo karboplatina) v kombinaci s gemcitabinem, docetaxelem nebo paklitaxelem. V této studii bylo dosaženo primárního cíle, tj. průkazu prodloužení PFS při udržovací léčbě pemetrexedem proti tzv. nejlepší podpůrné léčbě bez ohledu na morfologický typ nádoru (4,6 vs. 2,6 měsíce, HR = 0,5; p < 0,0001). Rovněž byl prokázán velmi důležitý vliv v podobě prodloužení OS (13,4 vs. 10,6 měsíce, HR = 0,79; p = 0,012). Největší prospěch z výše uvedené léčby jak v parametru PFS, tak v hodnotě OS měli nemocní s neskvamózní histologií nádoru (PFS 4,4 vs. 1,8 měsíce, HR = 0,47; p < 0,0001 a OS 15,5 vs. 10,3 měsíce, HR = 0,7; p = 0,02). Podávání pemetrexedu v monoterapii bezprostředně po ukončení první linie léčby bylo pacienty dobře tolerováno a profil nežádoucích účinků byl velmi příznivý [34].
V loňském roce byly na ASCO 2012 v Chicagu (5. června 2012) publikovány finální výsledky OS ve studii PARAMOUNT. Jedná se o velkou randomizovanou studii fáze III kontrolovanou placebem, která na souboru 539 PS 0–1 pacientů s NSCLC jiné než převážně dlaždicobuněčné histologie, u nichž nebyly zjištěny známky progrese onemocnění bezprostředně po ukončení čtyř cyklů léčby první linie kombinací cisplatina-pemetrexed, testovala účinnost a bezpečnost pokračovací udržovací léčby (continuation maintenance) monoterapií pemetrexedem ve srovnání s přístupem „watch and wait“; pacientům byla současně poskytována nejlepší podpůrná péče. Primárním hodnoceným parametrem studie, jejíž výsledky byly publikovány již v roce 2011, byla délka PFS. Studie byla pozitivní, pokračovací udržovací léčba pemetrexedem prodloužila statisticky významně nezávisle hodnocenou střední dobu PFS o 1,3 měsíce (3,9 vs. 2,6 měsíce, HR = 0,64; 95% CI: 0,51–0,81; p = 0,0002). Délka OS pacientů ve studii byla sekundárním hodnoceným parametrem, design studie nicméně plánoval dostatečnou statistickou výpovědní sílu ke spolehlivému průkazu účinku i v tomto, klinicky pravděpodobně nejdůležitějším, parametru účinnosti [35, 36].
Pokračovací udržovací léčba pemetrexedem ve studii PARAMOUNT vedla ke statisticky významnému prodloužení OS oproti sledování s podáváním placeba a nejlepší podpůrné péče. Střední doba OS se při aktivní udržovací léčbě prodloužila o 2,9 měsíce (16,9 vs. 14 měsíců od zahájení léčby první linie, HR = 0,78; 95% CI: 0,64–0,96; p = 0,0191). Pozitivní účinek na OS byl konzistentně pozorován i ve všech následných podskupinových analýzách ve studii PARAMOUNT [35, 36].
Studie PARAMOUNT je první pozitivní studií prokazující u pacientů s pokročilým/metastazujícím NSCLC při použití pokračovací udržovací léčby statisticky významné a klinicky relevantní prodloužení OS při akceptovatelné toxicitě léčby a bez významného zhoršení celkové kvality života. Pemetrexed získal v EU schválení k pokračovací udržovací léčbě NSCLC jiné než převážně dlaždicobuněčné histologie [37] a tato skutečnost otevírá možnost změny náhledu na koncepci paliativní systémové léčby pokročilých stadií NSCLC a její přiblížení současné strategii léčby aplikované například u pokročilých stadií karcinomu prsu nebo kolorektálního karcinomu.
V současnosti probíhají jednání o podmínkách úhrady léčivého přípravku s účinnou látkou pemetrexed pro pokračovací udržovací léčbu NSCLC v České republice.
Závěr
Díky novému terapeutickému přístupu k pacientům s pokročilými formami NSCLC, který spočívá v léčbě podle prediktivních znaků (morfologických a molekulárněgenetických), bylo u této skupiny nemocných v posledních letech dosaženo výrazného prodloužení PFS i OS.
Seznam použité literatury
- [1] Tyczynski JE, Bray F, Parkin DM. Lung cancer in Europe in 2000: epidemiology, prevention, and early detection. Lancet Oncol 2003; 4: 45–55.
- [2] Ferlay J, Shin HR, Bray F, et al. GLOBOCAN 2008, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 10 [Internet]. Lyon, France: International Agency for Research on Cancer; 2010. Available from: http://globocan.iarc.fr
- [3] Ústav zdravotnických informací a statistiky ČR, Národní zdravotnický informační systém (NZIS), Národní onkologický registr (NOR), [20. 12. 2007], dostupné z http://www.uzis.cz/info.php?article=368&mnu_id=7300
- [4] Dušek L, Májek O, Mužík J, et al. Epidemiologie zhoubných nádorů plic, průdušnice a průdušek v České republice. In. J. Skřičková J, Kolek V a kol. Základy moderní pneumoonkologie. Praha, Maxdorf 2012. 490 s.
- [5] University of California Berkeley, Max Planck Institute for Demographic Research. Human Mortality Database.[cited 11. 9. 2009]; Available from: www.mortality.org. Bray F., Guilloux A., Sankila R., Parkin D.M. Practical implications of imposing a new world standard population. Cancer Causes Control 2002; 13: 175–182.
- [6] Skřičková J, Čoupek P, Babičková L, et al. Léčebné postupy u nemalobuněčného karcinomu plic. Klin Onkol 2008; 21: 317–329.
- [7] Fritz A, Percy C, Jack A, et al. Mezinárodní klasifikace nemocí pro onkologii, třetí vydání, česká verze. 2004, ÚZIS ČR: Praha.
- [8] Skřičková J, Kolek V, et al. Základy moderní pneumoonkologie. Praha, Maxdorf 2012. 490 s.
- [9] Bonomi P. Clinical studies with non-iressa EGFR tyrosine kinase inhibitors. Lung Cancer 2003; 41: S43–S48.
- [10] Shepherd FA, Pereira JR, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005; 353: 123–132.
- [11] Duffield EL, Watkins CL, Armour AA, Fukuoka M. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361: 947–957.
- [12] Lynch TJ, Bell DW, Sordella R, et al. Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non-Small-Cell Lung Cancer to Gefitinib. N Engl J Med 2004; 350: 2129–2139.
- [13] Kim ES, Hirsch V, Mok T, et al. Gefitinib versus docetaxel in previously treated non-small-cell lung cancer: a randomised Phase III trial (INTEREST). Lancet 2008; 372: 1809–1818.
- [14] Pešek M. Nemalobuněčný karcinom plic. EUNI. http://www.euni.cz/tema.php
- [15] Thatcher N, Chang A, Parikh P, et al. Gefitinib plus best supportive care in previously treated patients with refractory advanced non-small-cell lung cancer: results from a randomised, placebo-controlled, multicentre study (Iressa Survival Evaluation in Lung Cancer). Lancet 2005; 366: 1527–1537.
- [16] Pešek M, Skřičková J, V Kolek V, et al. Výsledky klinického hodnocení účinnosti a toxicity gefitinibu v rámci programu časného přístupu u nemalobuněčného karcinomu plic v České republice. Stud Pneumol Phtiseol 2009; 69: 62–68.
- [17] Reck M, von Pawel J, Zatloukal P, et al. Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil. J Clin Oncol 2009; 27: 2415.
- [18] Yang JCH, Schuler M, Yamamoto N, et al. LUX-Lung 3: a randomized, open-label, Phase III study of afatinib vs cisplatin/pemetrexed as 1st-line treatment for patients with advanced adenocarcinoma of the lung harboring EGFR-activating mutations. J Clin Oncol 2012; 30 (suppl; abstr LBA7500).
- [19] Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature 2007; 448: 561–566.
- [20] Wong DW, Leung EL, SoKK, et al. The EML4-ALK fusion gene is involved in various histologic types of lung cancers from nonsmokers with wild-type EGFR and KRAS. Cancer 2009; 115: 1723–1733.
- [21] Shaw AT, Solomon B. Targeting anaplastic lymphoma kinase in lung cancer. Clin Cancer Res 2011; 17: 2081–2086.
- [22] Rikova K, Guo A, Zeng Q, et al. Global survey of phosphotyrosine signaling identifies oncogenic kinases in lung cancer. Cell 2007; 131: 1190–1203.
- [23] Takeuchi K, Choi YL, Togashi Y, et al. KIF5B-ALK, a novel fusion oncokinase identified by an immunohistochemistrybased diagnostic system for ALK-positive lung cancer. Clin Cancer Res 2009; 15: 3143–3149.
- [24] Shaw AT, Yeap BY, Solomon BJ, et al. Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis. Lancet Oncol 2011; 12: 1004–1012.
- [25] Pfizer Inc. Xalkori_ oral capsules (crizotinib): US prescribing information [online]. Available from URL: http://labeling.pfizer.com [Accessed 2011 Sep 27].
- [26] Christensen JG, Zou HY, Arango ME, et al. Cytoreductive antitumor activity of PF-2341066, a novel inhibitor of anaplastic lymphoma kinase and c-Met, in experimental models of anaplastic large-cell lymphoma. Mol Cancer Ther 2007; 6: 3314–3322.
- [27] Ryška A, Hajdúch M, Petruželka L, et al. Interdiscplinární konsenzus pro prediktivní vyšetřování u nemalobuněčného karcinomu plic (NSCLC) – aktualizace 2012. Stud Pneumol Phthiseol 2012; 72: 168.
- [28] De Marinis F, Rosell R, Vergnenegre A, et al. Erlotinib vs chemotherapy (CT) in advanced non-small-cell lung cancer (NSCLC) patients (p) with epidermal growth factor receptor (EGFR) activating mutations: the EURTAC phase III randomized trial interim results. European Society for Medical Oncology 36th Congress – ECCO 16 and ESMO 36 | ESMO. Abstract 9016.
- [29] Zhou C, Wu YL, Liu X, et al. Overall survival (OS) results from OPTIMAL (CTONG0802), a phase III trial of erlotinib (E) versus carboplatin plus gemcitabine (GC) as first-line treatment for Chinese patients with EGFR mutation-positive advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2012; 30 (suppl; abstr 7520).
- [30] http://www.lillyoncologypipeline.com/Pages/egfr-antibody.aspx. Navštíveno dne 31. 1. 2013.
- [31] http://www.lillyoncologypipeline.com/Pages/vegfr2-kdr-antibody.aspx. Navštíveno dne 31. 1. 2013.
- [32] Cappuzzo F, Ciuleanu T, Stelmakh L, et al. Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebo-controlled phase 3 study. Lancet Oncol 2010; 11: 521–529.
- [33] Miller VA, O’Connor P, Soh C, et al. A randomized, double-blind, placebo-controlled, phase IIIb trial (ATLAS) comparing bevacizumab (B) therapy with or without erlotinib (E) after completion of chemotherapy with B for first-line treatment of locally advanced, recurrent, or metastatic non-small cell lung cancer (NSCLC). J Clin Oncol 2009; 27: 18 (suppl; abstr LBA8002).
- [34] Ciuleanu T, Brodowicz T, Zielinski C, et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet 2009; 374: 1432–1440.
- [35] Paz-Ares L, De Marinis F, Dediu M, et al. PARAMOUNT: Final Overall Survival Results Phase III Study of Maintenance Pemetrexed plus Best Supportive Care (BSC) versus Placebo plus BSC Immediately Following Induction with Pemetrexed plus Cisplatin for Advanced Nonsquamous NSCLC. J Clin Oncol 2012; 30 (suppl; abstr LBA7507).
- [36] Paz-Ares L, de Marinis F, et al. Maintenance therapy with pemetrexed plus best supportive care versus placebo plus best supportive care after induction therapy with pemetrexed plus cisplatin for advanced non-squamous non-small-cell lung cancer (PARAMOUNT): a double-blind, phase 3, randomised controlled trial. Lancet Oncol 2012; 13: 247–255.
- [37] ALIMTA EU SPC, http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000564/WC500025611.pdf. Navštíveno dne 31. 1. 2013.