Novinky ve farmakoterapii dyslipidemií
Dyslipidemie představují kategorii onemocnění, která jsou mnoho let známa a léčena více skupinami hypolipidemik. Přes velké množství dostupných přípravků existují pacienti, kteří nedosahují dostatečných výsledků při dosud známé a standardní léčbě nebo tuto léčbu netolerují. Tato práce předkládá aktuální souhrn potenciálně nových léčiv v oblasti farmakoterapie dyslipidemií. Zahrnuty jsou jak naprosto nové, pouze hypotetické možnosti cílových míst, tak jsou charakterizovány léky nacházející se v pokročilých fázích klinického výzkumu, které s velkou pravděpodobností budou brzy uvedeny do praxe.
Úvod
Dyslipidemie je souhrnný název pro skupinu metabolických onemocnění, která se dnes vzhledem ke kombinaci genetických faktorů s vlivy našeho životního stylu vyskytují velmi často. Dle posledních epidemiologických šetření trpělo v ČR dyslipidemií asi 80 % populace [1]. K odhalení velké části poruch také přispívá poměrně propracovaný systém preventivní péče uskutečňovaný praktickými lékaři, podle kterého je doporučeno provádět laboratorní kontroly lipidogramu u jedinců obou pohlaví ve věku 18, 30, 40, 50 a 60 let [2]. Narůstají tedy počty pacientů, u kterých je porucha diagnostikována, a zároveň přibývá pacientů, u kterých je indikována farmakoterapie.
Kardiovaskulární riziko
Všeobecně lze říci, že celkové riziko rozvoje aterosklerotických komplikací kalkulujeme podle tabulek absolutního rizika úmrtí v důsledku kardiovaskulární příhody v následujících deseti letech. Tuto pomůcku označovanou jako tabulky SCORE máme k dispozici také specificky pro českou populaci, jak bylo opakovaně uvedeno v doporučeních českých odborných společností (například doporučení České společnosti pro hypertenzi z roku 2012) [3].
K farmakologické léčbě dyslipidemie přistupujeme v případě, že vyšetřovaný při nefarmakologické léčbě nedosahuje cílových hodn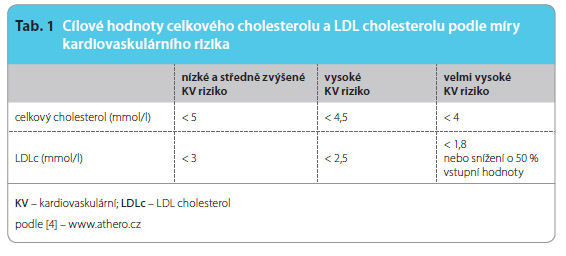 ot LDL cholesterolu pro příslušnou kategorii rizika (tab. 1) [4]. U osob s vysokým nebo velmi vysokým kardiovaskulárním (KV) rizikem (tab. 2) používáme farmakologickou léčbu prakticky vždy, pokud je pacientem tolerována.
ot LDL cholesterolu pro příslušnou kategorii rizika (tab. 1) [4]. U osob s vysokým nebo velmi vysokým kardiovaskulárním (KV) rizikem (tab. 2) používáme farmakologickou léčbu prakticky vždy, pokud je pacientem tolerována.
Komplexní léčba
Léčbu zahajujeme pokaždé komplexní intervencí životního stylu, která se skládá z edukace o vhodné fyzické aktivitě (všeobecně doporučován je aerobní pohyb v rozsahu 45–60 minut 3krát týdně), ukončení (abstinence) ko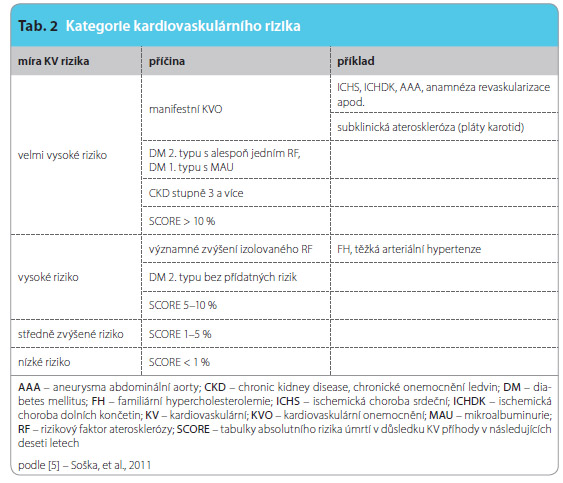 uření a dietní edukace [5]. Pokud změna životního stylu nevede k uspokojivé úpravě lipidogramu, pak přistupujeme k farmakoterapii. Z dosud běžně známých možností medikace v léčbě dyslipidemií můžeme v tuto chvíli použít léky ze skupiny fibrátů, statinů, pryskyřic a/nebo ezetimib. Začátkem roku 2013 byl z trhu stažen přípravek obsahující kyselinu
nikotinovou a selektivní inhibitor jejích nežádoucích účinků laropiprant.
Důvodem k tomuto kroku byly výsledky studie HPS-2-THRIVE (Heart Protection
Study-2-Treatment of HDL to Reduce the Incidence of Vascular Events) [6], které prokázaly nulový přínos této kombinace ke snížení rizika vzniku kardiovaskulárních příhod, ale naopak významné zvýšení rizika nežádoucích účinků.
uření a dietní edukace [5]. Pokud změna životního stylu nevede k uspokojivé úpravě lipidogramu, pak přistupujeme k farmakoterapii. Z dosud běžně známých možností medikace v léčbě dyslipidemií můžeme v tuto chvíli použít léky ze skupiny fibrátů, statinů, pryskyřic a/nebo ezetimib. Začátkem roku 2013 byl z trhu stažen přípravek obsahující kyselinu
nikotinovou a selektivní inhibitor jejích nežádoucích účinků laropiprant.
Důvodem k tomuto kroku byly výsledky studie HPS-2-THRIVE (Heart Protection
Study-2-Treatment of HDL to Reduce the Incidence of Vascular Events) [6], které prokázaly nulový přínos této kombinace ke snížení rizika vzniku kardiovaskulárních příhod, ale naopak významné zvýšení rizika nežádoucích účinků.
Přestože máme dnes k dispozici poměrně velké množství skupin i jednotlivých léků ovlivňujících příznivě lipidogram, existuje nezanedbatelné množství pacientů, kteří ani při kombinační léčbě těmito běžně užívanými přípravky nedosahují cílových hodnot. Obvykle se jedná o nemocné s geneticky podmíněnými primárními dyslipidemiemi, typicky o pacienty s familiární hypercholesterolemií (FH).Pokud byly vstupní hodnoty lipidogramu u pacientů tak vysoké, že i přes užití vysokých dávek statinů v kombinaci s jiným léčivem nejsme schopni dosáhnout dostatečného snížení hladiny LDL cholesterolu, pak je namístě zvážit některou z možností nové léčby (jedná se především o heterozygoty FH, případně o nemocné s těžšími formami polygenní hypercholesterolemie). I s prvně jmenovanými se můžeme poměrně často ve své praxi setkat. Frekvence výskytu pacientů s FH v naší populaci je odhadována na více než 1 : 500. Z toho vyplývá, že v naší republice by mělo být více než 20 tisíc jedinců s heterozygotní konstitucí FH.
V této souvislosti nelze nezmínit celonárodní unikátní projekt MedPed, který sdružuje lékaře poskytující specializovanou péči pacientům s těžkými, převážně dědičnými poruchami metabolismu lipidů. Součástí tohoto projektu je i databáze soustřeďující informace o nemocných postižených FH a snaha vyhledávat jejich příbuzné se stejným onemocněním. Aktuálně je v České republice identifikováno více než 6100 pacientů s diagnózou FH [7]. Dále nemusejí dnešní možnosti farmakoterapie dostačovat u pacientů, kteří mají intoleranci některých léků či celých lékových skupin, typickým příkladem je intolerance statinů pro nežádoucí účinky na svaly (bolest, slabost či nevýkonnost). Z výše uvedeného vyplývá, že zde existuje poměrně velká skupina pacientů, u kterých mohou být dosud běžně dostupné možnosti farmakoterapie neuspokojivé.
Co můžeme pacientům s těžkými poruchami lipidového metabolismu nabídnout?
Inhibitory CETP
Jednou z již delší dobu zkoumaných skupin nových léků jsou inhibitory CETP (cholesterylester transfer protein). Blokádou CETP se snižuje transfer cholesterolu a triglyceridů mezi částicemi HDL a na triglyceridy bohatými lipoproteiny. Inhibice CETP má za následek vzestup plazmatické koncentrace HDL cholesterolu. Byly popsány případy vrozeného snížení aktivity tohoto proteinu vedoucí ke zvýšení hladiny HDL cholesterolu a k dlouhověkosti [8, 9 ].
Dosud byly studovány čtyři léky z této skupiny. Vývoj torcetrapibu byl v roce 2007 zastaven poté, co bylo ve studii ILLUMINATE (Investigation of Lipid Level Management to Understand its Impact in Atherosclerotic Events) prokázáno zvýšení výskytu kardiovaskulárních příhod o 30 % [10]. Dalším ze zklamání byl dalcetrapib, při jehož podávání bylo potvrzeno významné zvýšení hladin HDL cholesterolu, avšak bez prokazatelného vlivu na klinický stav pacienta [11]. Ve fázi klinických studií zůstávají ještě dva zástupci této skupiny – anacetrapib a evacetrapib, jejichž farmakologické vlastnosti se liší od dvou dříve zkoumaných látek, a tak trvá naděje, že by mohly přispět nejen ke zlepšení lipidogramu, ale především k poklesu kardiovaskulárního rizika. Tyto účinky jsou ověřovány v probíhajících studiích.
Mimetika apolipoproteinu A1 Milano
Mimetika apolipoproteinu A1 Milano jsou další teoretickou možností léčby. Tato geneticky podmíněná varianta apolipoproteinu A1 s aminokyselinovou záměnou v pozici 173 peptidového řetězce (Cys173-Arg) je spojena s velmi nízkými hladinami HDL cholesterolu, se zvýšením hladin triglyceridů a s překvapivou dlouhověkostí jejích nositelů. Klinickými důsledky přítomnosti mutovaného apolipoproteinu A1 je jeho větší produkce, vyšší aktivita v reverzním transportu cholesterolu a tím daná nižší hladina měřeného HDL cholesterolu v plazmě, antitrombogenní účinky a regrese aterosklerózy včetně snížení rizika restenózy koronární tepny po rekanalizačním výkonu [12]. Širšímu využití brání především nutnost parenterální aplikace a vysoká cena.
Inhibitory mikrozomálního triglyceridy transferujícího proteinu
Inhibitory mikrozomálního triglyceridy transferujícího proteinu (microsomal triglyceride transfer protein, MTTP) jsou dalším možným směrem ovlivnění dyslipidemie, v současné době se ve fázi klinických studií nachází pouze lomitapid. MTTP je přítomen v hepatocytu a enterocytu. Slouží k lipidaci apolipoproteinu B a formaci chylomikronů a VLDL částic [13]. Je známa deficience MTTP nazývaná klinicky abetalipoproteinemie. Lomitapid v dávce 1 mg/kg prokazatelně snižuje hladinu LDL cholesterolu o 50 %. Nežádoucími účinky léčby jsou dyspepsie, hepatopatie a steatóza jater. Lomitapid prokázal účinnost u jinak prakticky neléčitelných pacientů s homozygotní formou FH, u nichž klesly koncentrace triglyceridů při použití lomitapidu až o 65 % za současného snížení LDL cholesterolu o 50 % a koncentrace apolipoproteinu B o 55 % oproti vstupním hodnotám [14]. Lomitapid je schválen evropskými i severoamerickými autoritami k léčbě homozygotů FH; kromě faktu, že jde o vzácnou formu onemocnění (výskyt v poměru 1 : 1 000 000), však jeho rozšíření brání velmi vysoká cena.
Zajímavá je zatím nejdelší zkušenost s lomitapidem publikovaná ve formě kazuistiky. Představuje ji pacientka s recidivujícími, téměř fatálními pankreatitidami, kterými trpěla od svých 15 let. Její hladina triglyceridů se chronicky pohybovala mezi 40 mmol/l a 50 mmol/l, neboť jde o nositelku homozygotní formy deficience lipoproteinové lipázy. Při této experimentální léčbě dosahuje pacientka hodnot triglyceridů okolo 10 mmol/l při dávce 30 mg/kg lomitapidu, a dokonce hodnot 3–5,5 mmol/l při dávce 40 mg/kg. Léčba je z klinického hlediska velmi úspěšná, trvá již 13 let bez recidivy pankreatitidy a bez subjektivních obtíží. Nežádoucím, ale očekávaným následkem je progrese steatózy jater do steatohepatitidy až fibrózy [15].
Biologická léčba
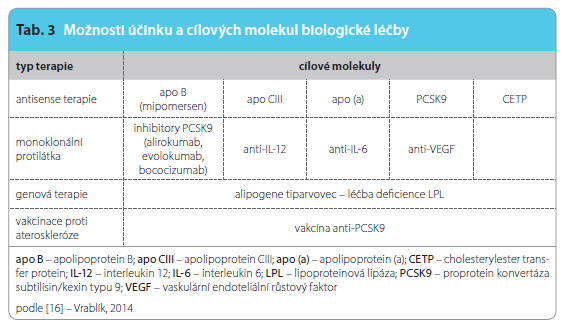 Biologická léčba dyslipidemie je umožněna poslední velmi slibnou skupinou nových látek. Rozlišujeme rozmanité způsoby účinku a velké množství cílových molekul (tab. 3) [16]. Z velkého množství výše nastíněných možností probereme pouze ty, které jsou již v pokročilejší fázi výzkumu, převážně ve vyšších fázích klinického vývoje, a je tedy pravděpodobné, že se s nimi v blízké budoucnosti začneme setkávat v praxi. Specifikem těchto léků je obvykle subkutánní podání lokalizované do stehen, břicha či paží. Obvykle se léky aplikují s větším časovým odstupem, např. jednou za čtrnáct dní či jednou za měsíc. Dle našich vlastních klinických zkušeností toto obvykle nečiní pacientům žádné obtíže (nesetkali jsme se s odmítáním ani s neschopností si lék samostatně aplikovat). Ba naopak bylo překvapením, že většina pacientů tento způsob aplikace vítá z důvodu malé pravděpodobnosti, že zapomenou užít lék (čímž se zvyšuje adherence k léčbě), a v konečném důsledku i kvůli vyššímu pohodlí užívání.
Biologická léčba dyslipidemie je umožněna poslední velmi slibnou skupinou nových látek. Rozlišujeme rozmanité způsoby účinku a velké množství cílových molekul (tab. 3) [16]. Z velkého množství výše nastíněných možností probereme pouze ty, které jsou již v pokročilejší fázi výzkumu, převážně ve vyšších fázích klinického vývoje, a je tedy pravděpodobné, že se s nimi v blízké budoucnosti začneme setkávat v praxi. Specifikem těchto léků je obvykle subkutánní podání lokalizované do stehen, břicha či paží. Obvykle se léky aplikují s větším časovým odstupem, např. jednou za čtrnáct dní či jednou za měsíc. Dle našich vlastních klinických zkušeností toto obvykle nečiní pacientům žádné obtíže (nesetkali jsme se s odmítáním ani s neschopností si lék samostatně aplikovat). Ba naopak bylo překvapením, že většina pacientů tento způsob aplikace vítá z důvodu malé pravděpodobnosti, že zapomenou užít lék (čímž se zvyšuje adherence k léčbě), a v konečném důsledku i kvůli vyššímu pohodlí užívání.
Genová terapie
Zvláštní postavení mezi novými přípravky zaujímá alipogene tiparvovec jako první genová terapie schválená lékovými agenturami k léčbě familiární deficience lipoproteinové lipázy (LPDL). Tato léčba využívá principu vnesení správné genetické informace do genomu pomocí adenovirového vektoru – v případě LPDL tedy genu pro lipoproteinovou lipázu. Po rozsáhlém preklinickém testování byl účinek léčby ověřen v několika studiích s celkem 22 nemocnými a na základě této dokumentace byla léčba jako první genová terapie schválena k použití. Problémem léčby zůstává vysoká cena, náročnost podání (40–60 injekcí do oblasti čtyřhlavého stehenního svalu), a především relativně krátká doba trvání účinku [17].
Antisense terapie
Ze skupiny antisense terapie si povšimněme látky mipomersen, která funguje jako antisense mRNA (mediátorová ribonukleová kyselina) oligonukleotid druhé generace. Jak si takový účinek představit? Při přepisu DNA (deoxyribonukleová kyselina) až na funkční protein dochází v mezistupni k transkripci dvoušroubovice DNA na jednošroubovici mRNA, ta se stává cíle![Obr. 1 Funkce antisense molekul; podle [18] – Kastelein, 2006. ASO – antisense oligonukleotid; DNA – deoxyribonukleová kyselina; mRNA – mediátorová ribonukleová kyselina](https://www.remedia.cz/photo-a-29834---.jpg) m oligonukleotidu antisense léku. Na jednošroubovici mRNA se naváží části léku přesně kopírující zrcadlový obraz některých úseků mRNA a tím zablokují další průběh translace proteinu (obr. 1). V případě mipomersenu se jedná o blokádu přepisu mRNA pro apolipoprotein B-100. Dále pak nefunkční mRNA pro apolipoprotein B-100 podléhá rozkladu endoribonukleázou H. Takto je docíleno komplexního účinku na všechny lipoproteiny, které apolipoprotein B-100 obsahují. V klinické praxi to znamená, že se snižuje koncentrace apolipoproteinu B a hladina LDL cholesterolu o 25–60 % [18]. Tento lék lze použít u heterozygotů i homozygotů FH. Podobně jako většina nově testovaných hypolipidemik se přípravek obvykle užívá jako přídatná terapie k maximální tolerovatelné dávce statinů. Zatímco americká léková agentura FDA (Food and Drug Administration) schválila použití mipomersenu u nemocných s homozygotní FH, evropská EMA (European Medicine Agency) si vyžádala další výsledky klinických studií a zatím mipomersen v Evropě k použití neautorizovala.
m oligonukleotidu antisense léku. Na jednošroubovici mRNA se naváží části léku přesně kopírující zrcadlový obraz některých úseků mRNA a tím zablokují další průběh translace proteinu (obr. 1). V případě mipomersenu se jedná o blokádu přepisu mRNA pro apolipoprotein B-100. Dále pak nefunkční mRNA pro apolipoprotein B-100 podléhá rozkladu endoribonukleázou H. Takto je docíleno komplexního účinku na všechny lipoproteiny, které apolipoprotein B-100 obsahují. V klinické praxi to znamená, že se snižuje koncentrace apolipoproteinu B a hladina LDL cholesterolu o 25–60 % [18]. Tento lék lze použít u heterozygotů i homozygotů FH. Podobně jako většina nově testovaných hypolipidemik se přípravek obvykle užívá jako přídatná terapie k maximální tolerovatelné dávce statinů. Zatímco americká léková agentura FDA (Food and Drug Administration) schválila použití mipomersenu u nemocných s homozygotní FH, evropská EMA (European Medicine Agency) si vyžádala další výsledky klinických studií a zatím mipomersen v Evropě k použití neautorizovala.
Monoklonální protilátky proti PCSK9
Poslední rychle se rozvíjející skupinou nových hypolipidemik jsou monoklonální protilátky proti PCSK9 (proprotein konvertáza subtilisin/kexin typu 9). Jedná se o protein účastnící se intracelulární i extracelulární regulace exprese receptoru pro LDL cholesterol. Jednou z funkcí PCSK9 je tvorba komplexu PCSK9 s LDL receptorem a jeho internalizace v endozomu. Vazba PCSK9 na LDL receptor v buňce brání normálnímu průběhu recyklace receptoru a jeho zpětnému vystavení na ![Obr. 2 Zapojení proteinu PCSK9 v metabolismu LDL receptoru; podle [19, 20] – Horton, et al., 2009, Qian, et al., 2007. LDL-R – LDL receptor; mRNA – mediátorová ribonukleová kyselina; PCSK9 – proprotein konvertáza subtilisin/kexin typu 9](https://www.remedia.cz/photo-a-29835---.jpg) plazmatické membráně. Naopak je tento komplex degradován. Počet LDL receptorů na povrchu buněk je tak snižován v závislosti na přítomnosti PCSK9 (obr. 2) [19, 20].Autozomálně dominantní aktivační mutace tohoto proteinu je jednou z genetických příčin FH. Naopak inaktivační mutace vedou ke snížení hladiny LDL cholesterolu o 0,3–0,5 mmol/l a je prokázáno, že tak snižují celoživotní kardiovaskulární riziko o 70–80 % [21]. Protilátky proti PCSK9 prokázaly svou schopnost zvýšit expresi LDL receptoru a v konečném důsledku snížit hladiny LDL cholesterolu o desítky procent. Ve fázi klinického vývoje jsou doposud tři zástupci: alirokumab, evolokumab a bococizumab. Alirokumab je podáván subkutánně jedenkrát za dva nebo čtyři týdny. Je testován v programu klinických studií ODYSSEY. Snižuje u pacientů s FH koncentraci LDL cholesterolu o 36–58 % v monoterapii nebo v kombinaci se statinem [22].
plazmatické membráně. Naopak je tento komplex degradován. Počet LDL receptorů na povrchu buněk je tak snižován v závislosti na přítomnosti PCSK9 (obr. 2) [19, 20].Autozomálně dominantní aktivační mutace tohoto proteinu je jednou z genetických příčin FH. Naopak inaktivační mutace vedou ke snížení hladiny LDL cholesterolu o 0,3–0,5 mmol/l a je prokázáno, že tak snižují celoživotní kardiovaskulární riziko o 70–80 % [21]. Protilátky proti PCSK9 prokázaly svou schopnost zvýšit expresi LDL receptoru a v konečném důsledku snížit hladiny LDL cholesterolu o desítky procent. Ve fázi klinického vývoje jsou doposud tři zástupci: alirokumab, evolokumab a bococizumab. Alirokumab je podáván subkutánně jedenkrát za dva nebo čtyři týdny. Je testován v programu klinických studií ODYSSEY. Snižuje u pacientů s FH koncentraci LDL cholesterolu o 36–58 % v monoterapii nebo v kombinaci se statinem [22].
Evolokumab je testován ve velmi komplexním výzkumném projektu s názvem PROFICIO, který zahrnuje například testování evolokumabu v kombinaci se statinem (LAPLACE-2), při intoleranci statinů (GAUSS-2), v monoterapii (MENDEL-2), u heterozygotů familiární hypercholesterolemie (RUTHERFORD-2) a/nebo homozygotů familiární hypercholesterolemie (TESLA a TAUSSIG). Podobně jako alirokumab prokázal i evolokumab v ukončených studiích (např. RUTHEFORD, LAPLACE) významné snížení hladin sérových lipidů, včetně jinak obtížně ovlivnitelného aterogenního lipoproteinu (a), jehož hladiny poklesly o 20–30 % [23]. Bococizumab je testován v hodnoceních SPIRE-1 a SPIRE-2, kde jsou primárním sledovaným cílem kardiovaskulární mortalita a kardiovaskulární příhody, a jejich výsledky můžeme očekávat až v roce 2016–2017 [24, 25].
Vakcinace
Na principu blokády účinku PCSK9 působí i zatím experimentálně testovaná vakcinace proti PCSK9. Na rozdíl od podávání blokujících protilátek spočívá v aplikaci imunogenního proteinu, který je schopen indukovat tvorbu vlastních anti-PCSK9 protilátek. První pokusy na zvířecích modelech ukazují dlouhodobou (až 12 měsíců trvající) inhibici PCSK9 s podobnými účinky na sérové lipidy, jako je tomu u výše uvedených monoklonálních protilátek [26].
Závěr
Statiny mají v oblasti léčby dyslipidemií nejširší využití a zásadní roli vzhledem k poznatkům medicíny založené na důkazech i vzhledem k rokům úspěšného klinického použití. Přesto se ukazují možnosti uplatnění několika dalších skupin léků, především v kombinační léčbě. I přes optimistický výhled vyplývající z některých recentních studií nesmíme zapomenout, že nejnovější skupiny léků budou indikovány jen u vybraných klinických situací a vybraných diagnóz. Přesto především inhibitory PCSK9 přinášejí velmi zajímavý a novátorský přístup k léčbě dyslipidemií jak svým mechanismem účinku, tak dobrým profilem nežádoucích účinků, a nakonec i subkutánní aplikací, která v léčbě dyslipidemií představuje dosud neobvyklý způsob podávání.
Práce byla podpořena grantem IGA MZd ČR č. NT14186.
Seznam použité literatury
- [1] Cífková R, Skodová Z, Bruthans J, et al. Longitudinal trends in major cardiovascular risk factors in the Czech population between 1985 and 2007/8. Czech MONICA and Czech post-MONICA. Atherosclerosis 2010; 211: 676–681.
- [2] Všeobecná zdravotní pojišťovna, otázky a odpovědi; dostupné na: http://www.vzp.cz/otazky-a-odpovedi/zdravotnictvi-a-zdravotni-pece/20/vysetreni-cholesterolu-periodicita Navštíveno 25. 7. 2014.
- [3] Filipovský J, Widimský J Jr., Ceral J, et al. Diagnostické a léčebné postupy u arteriální hypertenze – verze 2012. Doporučení České společnosti pro hypertenzi. Vnitř Lék 2012; 58: 785–801.
- [4] Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, Česká společnost pro aterosklerózu; dostupné na: http://www.athero.cz/cze/odborna-doporuceni/doporuceni-pro-diagnostiku-a-lecbu-dyslipidemii.php Navštíveno 7. 8. 2014.
- [5] Soška V, Vaverková H, Vrablík M, et al. Stanovisko výboru ČSAT k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2011. DMEV 2013; 16: 26–31.
- [6] Landray MJ, Haynes R, Hopewell JC, et al. Effects of Extended-Release Niacin with Laropiprant in High-Risk Patients. The HPS2-THRIVE Collaborative Group. N Engl J Med 2014; 371: 203–212.
- [7] Projekt MedPed – odborná část; dostupné na: http://www.athero.cz/cze/projekt-medped Navštíveno 25. 7. 2014.
- [8] Tall AR. CETP inhibitors to increase HDL cholesterol levels. N Engl J Med 2007; 356: 1364–1366.
- [9] Joy TR, Hegele RA. The failure of torcetrapib: what have we learned? Br J Pharmacol 2008; 154: 1379–1381.
- [10] Barter PJ, Caulfield M, Eriksson M, et al. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med 2007; 357: 2109–2122.
- [11] Fayad ZA, Mani V, Woodward M, et al. Safety and efficacy of dalcetrapib on atherosclerotic disease using novel non-invasive multimodality imaging (dal-PLAQUE): a randomised clinical trial. Lancet 2011; 378: 1547–1559.
- [12] Nissen SE, Tsunoda T, Tuzcu EM, et al. Effect of recombinant ApoA-I Milano on coronary atherosclerosis in patients with acute coronary syndromes: a randomized controlled trial. JAMA 2003; 290: 2292–2300.
- [13] Stein EA. Other therapies for reducing low-density lipoprotein cholesterol: medications in development. Endocrinol Metab Clin North Am 2009; 38: 99–119.
- [14] Cuchel M, Bloedon LT, Szapary PO, et al. Inhibition of microsomal triglyceride transfer protein in familial hypercholesterolemia. N Engl J Med 2007; 356: 148–156.
- [15] Sacks FM, Stanesa M, Hegele RA. Severe hypertriglyceridemia with pancreatitis: thirteen years’ treatment with lomitapide. JAMA Intern Med 2014; 174: 443–447.
- [16] Vrablík M. Co přinese hypolipidemická léčba v roce 2014? Acta Medicinae 2014; 2: 54–56.
- [17] Bryant LM, Christopher DM, Giles AR, et al. Lessons learned from the clinical develompent and market authorization of Glybera. Hum Gene Ther Clin Dev 2013; 24: 55–64.
- [18] Kastelein JJ, Wedel MK, Baker BF, et al. Potent reduction of apolipoprotein B and low-density lipoprotein cholesterol by short-term administration of an antisense inhibitor of apolipoprotein B. Circulation 2006; 114: 1729–1735.
- [19] Horton JD, Cohen JC, Hobbs HH. PCSK9: a convertase that coordinates LDL catabolism. J Lipid Res 2009; 50 (suppl): S172–S177.
- [20] Qian YW, Schmidt RJ, Zhang Y, et al. Secreted PCSK9 downregulates low density lipoprotein receptor through receptor-mediated endocytosis. J Lipid Res 2007; 48: 1488–1498.
- [21] Cohen CJ, Boerwinkle E, Mosley TH, et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med 2006; 354: 1264–1272.
- [22] Swergold G, Smith W, Mellis S, et al. Inhibition of proprotein convertase subtilisin/kexin type 9 with a monoclonal antibody REGN727/SAR236553, effectively reduces low-density-lipoprotein cholesterol, as mono or add-on therapy in heterozygous familial and non familial hypercholesterolemia. Circulation 2011; 124 (21 Suppl.): A16265 (Abstract).
- [23] Stein EA, Wasserman SM, Dias C, et al. AMG-145. Drugs Fut 2013; 38: 451–459.
- [24] New drugs online record for bococizumab; dostupné na: http://www.ukmi.nhs.uk/applications/ndo/record_view_open.asp?newDrugID=6143 Navštíveno 25. 7. 2014.
- [25] Bococizumab: Phase III; dostupné na: http://www.biocentury.com/weekinreview/clinicalstatus/2013-11-18/bococizumab-phase-iii-started-370470 Navštíveno 25. 7. 2014.
- [26] Galabova G, Juno C, Wanko B, et al. Affitope®-Based Anti-PCSK9 Vaccines. Circulation 2013; 128: A11020.