Novinky ve farmakoterapii karcinomu prsu
Karcinom prsu je velmi heterogenní onemocnění, jeho léčba je diferencována na základě fenotypu. V poslední době se zlepšila zejména prognóza nemocných s HER2-pozitivním onemocněním. Nově je možné podávat monoklonální protilátku pertuzumab, subkutánní trastuzumab a brzy by měla být schválena úhrada trastuzumab emtansinu. V hormonální terapii se používá vzhledem k prokázané vyšší účinnosti vysokodávkovaný fulvestrant a připravuje se stanovení úhrady pro everolimus v kombinaci s exemestanem v léčbě hormonálně dependentního diseminovaného onemocnění po progresi při léčbě nesteroidním inhibitorem aromatázy. V konvenční chemoterapii metastatického onemocnění předléčeného taxany, antracykliny a kapecitabinem je do praxe nově uveden eribulin.
Úvod
Karcinom prsu je nejčastějším zhoubným nádorovým onemocněním žen ve vyspělých zemích. Jeho incidence v České republice neustále narůstá, mortalita v posledních letech mírně klesá (asi o 5 %) [1]. Alespoň tento příznivý trend je známkou toho, že se nám častěji daří zachytit onemocnění v raném stadiu; zčásti je tomu tak díky probíhajícímu screeningu, zčásti díky pokroku dosaženému moderní léčbou, a to jak účinnější eradikací minimální reziduální choroby adjuvantní terapií, tak efektivnější léčbou metastatického onemocnění. Intenzivní výzkum molekulárněbiologické povahy karcinomu prsu v posledních letech ukázal, že jde o velice heterogenní onemocnění, a umožnil léčbu lépe diferencovat, zacílit a dosáhnout tak její vyšší účinnosti. Předpokladem správné farmakoterapie karcinomu prsu je v současné době jako nepodkročitelné minimum pro stanovení fenotypu znalost gradu tumoru, proliferace vyjádřené markerem Ki-67, exprese estrogenového receptoru (ER), progesteronového receptoru (PR) a receptoru 2 pro lidský epidermální růstový faktor (HER2).
Hormonální terapie
Hormonální terapie je cílená léčba, účinná u nemocných s karcinomem prsu s expresí estrogenového receptoru (ER+), která je přítomna asi u 70 % onemocnění. Hormonální terapie je široce užívána ve všech indikacích, v neoadjuvanci, adjuvanci a jako terapie diseminovaného onemocnění. Látky, které se v této léčbě používají, blokují svým antiestrogenním účinkem syntézu estrogenu nebo brání jeho navázání na specifické místo receptoru. V léčbě metastatického karcinomu prsu (metastatic breast cancer – MBC) hormonální terapii upřednostňujeme vzhledem k relativně dobré toleranci ve srovnání s konvenční chemoterapií všude tam, kde nepotřebujeme dosáhnout rychlé redukce nádorové masy. U postmenopauzálních žen lze užít v první linii tamoxifen nebo nesteroidní inhibitor aromatázy, který ve studiích prokázal mírně lepší výsledky [2]. V další linii se užívá fulvestrant nebo steroidní inhibitor aromatázy exemestan. V případě fulvestrantu se u léčiva již zavedeného do běžné praxe změnilo jeho doporučené dávkování.
Fulvestrant
Fulvestrant je čistý antiestrogen, inhibuje dimerizaci a aktivitu estrogenového receptoru, na rozdíl od selektivního modulátoru estrogenového receptoru tamoxifenu nemá žádný agonistický účinek, a jeho podání tedy není spojeno s rizikem nárůstu endometria. Může někdy způsobit návaly horka, nevolnost nebo bolest v místě vpichu, ale většinou je velmi dobře tolerován. V Evropě je schválen k léčbě pokročilého nebo metastatického onemocnění ve třetí linii po vyčerpání tamoxifenu a nesteroidního inhibitoru aromatázy. Ve studii fáze II dosahoval 14,3 % parciálních léčebných odpovědí a 20,8 % pacientek mělo onemocnění stabilizováno po dobu nejméně 6 měsíců [3]. Jeho účinnost a délka trvání léčebné odpovědi je v této klinické situaci srovnatelná se steroidním inhibitorem aromatázy exemestanem [4]. Tradičně se fulvestrant podával jako intramuskulární injekce v dávce 250 mg jednou měsíčně. V randomizované klinické studii fáze III CONFIRM byla následně prokázána lepší účinnost fulvestrantu podaného intramuskulárně v dávce 500 mg v den 1, 14, 28 a dále vždy 1krát za 28 dní ve srovnání s nižším dávkováním, a to při zachování dobré tolerance léčby. Finální data této studie prezentoval Di Leo v roce 2012 na San Antonio Breast Cancer Symposium [5]. Medián celkového přežití (overall survival, OS) byl při vyšším dávkování fulvestrantu delší o 4,1 měsíce (OS: 26,4 měsíce vs. 22,3 měsíce) a riziko úmrtí bylo redukováno o 19 % (poměr rizik, hazard ratio – HR: 0,81; bezpečnostní interval, confidence interval – 95% CI: 0,69–0,96; p = 0,016). Dávka 500 mg s posilovací injekcí aplikovanou za 14 dní od zahájení léčby je nyní používána jako standardní.
Everolimus
Zásadním problémem hormonální terapie je rezistence, primární nebo sekundární, ke které dospěje v průběhu léčby většina nemocných. Jedním z významných mechanismů sekundární rezistence je přítomnost signálních drah uvnitř buňky, jejichž aktivace zajistí náhradní cestu přenosu signálů nutných pro přežití a proliferaci nádorové buňky v situaci, kdy jsou zablokovány estrogenové receptory. U karcinomu prsu jde zejména o dráhy PI3K (fosfatidyl-inositol-3-kináza)/AKT/mTOR (mammalian target of rapamycin) a MEK/ERK, které mohou být aktivovány epidermálním růstovým faktorem a inzulinu podobným růstovým faktorem (EGF, IGF-1). Zvláštního významu nabývá jejich trvalá aktivace v případě nádoru prsu s pozitivitou HER2. V současné době se zkouší k překonání rezistence několik cílených léčiv. V kombinaci s hormonální terapií jsou to například inhibitory PI3K (buparlisib neboli BKM 120, GDC 0941) a inhibitory cyklin-dependentních kináz 4/6 (palbociclib, LEE 011). Běžnému použití v každodenní praxi je nejblíže perorální inhibitor mTOR everolimus. Tento přípravek je již používán v léčbě generalizovaného renálního karcinomu a neresekovatelného nebo metastatického dobře a středně diferencovaného pankreatického neuroendokrinního tumoru. V léčbě karcinomu prsu prokázal účinnost v kombinaci s tamoxifenem ve studii TAMRAD [6] a v kombinaci se steroidním inhibitorem aromatázy exemestanem v randomizované klinické studii fáze III BOLERO-2 [7]. Ta zařadila celkem 724 postmenopauzálních pacientek s ER+ HER2-negativním pokročilým karcinomem prsu refrakterním na předchozí léčbu nesteroidním inhibitorem aromatázy (relaps při adjuvantní léčbě nebo progrese během paliativní léčby). Kombinovaná léčba everolimem a exemestanem ve srovnání s monoterapií exemestanem prodlužovala při centrálním hodnocení výsledků medián doby do progrese onemocnění více než dvojnásobně, a to na 10,6 měsíce vs. 4,1 měsíce (HR: 0,36; 95% CI: 0,27–0,47; p < 0,001). V daném souboru nemocných nebylo dosaženo statisticky významného prodloužení přežití nemocných, což však význam této práce nesnižuje. V kombinovaném rameni s everolimem bylo po 39 měsících sledování dosaženo mediánu celkového přežití 31 měsíců ve srovnání s 26,6 měsíce v rameni s exemestanem (HR: 0,89; 95% CI: 0,73–1,10; p = 0,1426)[8]. I když sekundární cíl studie nebyl splněn, jedná se o dosud nejdelší dosažený medián celkového přežití v rámci všech randomizovaných klinických studií fáze III pro hormonálně dependentní HER-2 negativní pokročilý karcinom prsu předléčený nesteroidními inhibitory aromatázy. Ze závažných nežádoucích účinků stupně 3 a 4 byly pozorovány anémie, dušnost, hyperglykemie, únava a neinfekční pneumonitida, častěji v rameni s everolimem. Výsledky byly konzistentní ve všech podskupinách pacientek, stejný prospěch z léčby měly při zachování dobré kvality života i ženy s viscerálními metastázami. Everolimus je v kombinaci s exemestanem v Evropě registrován k léčbě postmenopauzálních pacientek s HER2-negativním pokročilým karcinomem prsu bez symptomatického viscerálního postižení, s recidivou nebo progresí onemocnění po předchozí léčbě nesteroidním inhibitorem aromatázy, stanovení úhrady v České republice se očekává během roku 2014.
Chemoterapie
Konvenční chemoterapie je základní léčebnou modalitou karcinomu prsu ve všech indikacích. V poslední době znovu nabývají většího významu platinové deriváty (cisplatina a karboplatina), a to u triple negativního onemocnění a zejména u pacientek s mutací genu BRCA. Zcela nové účinné látky se v poslední době neobjevovaly, šlo spíše o technologické inovace, které redukovaly toxicitu již užívaných léčiv, např. nepegylovaný lipozomální doxorubicin (nižší riziko kardiotoxicity) nebo paklitaxel vázaný na albumin – nab-paklitaxel (nižší riziko neurotoxicity).
Eribulin
Velmi příjemným překvapením proto byly výsledky studie fáze III EMBRACE, která randomizovaně rozdělila pacientky předléčené pro metastatické onemocnění minimálně dvěma liniemi chemoterapie v poměru 2 : 1 k podání nového cytostatika eribulinu nebo léčby dle volby lékaře [9]. Nemocné musely být léčeny adjuvantně nebo paliativně antracyklinem a taxanem. Eribulin (eribulin mesylát) je netaxanový inhibitor dynamiky mikrotubulů. Jde o strukturálně zjednodušený syntetický analog halichondrinu B, který byl jako přirozený produkt izolován z mořské houby rodu Halichondria okadai. Inhibuje pouze fázi růstu mikrotubulů, aniž by ovlivňoval fázi jejich zkracování, výsledkem je tvorba neproduktivního tubulinu. Svým účinkem vede k blokádě buněčného cyklu ve fázi G2/M, k narušení dělicího vřeténka a k apoptotické smrti nádorové buňky. Podává se v dávce 1,23 mg/m2 povrchu jako krátká nitrožilní infuze (2–5 minut) v den 1 a 8 v intervalu 21 dní. V souvislosti s jeho podáním lze očekávat zejména neutropenii, anémii, alopecii, únavu a neurotoxicitu. Ve studii EMBRACE eribulin prodlužoval dobu do progrese, statisticky signifikantně redukoval riziko úmrtí o 19 % (p = 0,041) a prodlužoval přežití (OS: 13,12 měsíce vs. 10,65 měsíce) ve srovnání se standardní léčbou, jakou byl kapecitabin nebo vinorelbin. Vzhledem k těžké předléčenosti části souboru pacientek (medián počtu podaných linií chemoterapie byl 4) jde o pozoruhodný výsledek. Eribulin je registrován k podání u nemocných v dobrém celkovém stavu s lokálně pokročilým nebo metastatickým karcinomem prsu progredujícím po léčbě, která obsahovala antracyklin, taxan a kapecitabin. Má již stanovenu úhradu v režimu vysoce inovativního léčivého prostředku (VILP) a jeho podání je vázáno na komplexní onkologická centra.
Cílená léčba HER2
Karcinom prsu s nadměrnou expresí HER2 je mimořádně nepříznivým onemocněním, s vysokým rizikem relapsu a horším celkovým přežitím, v České r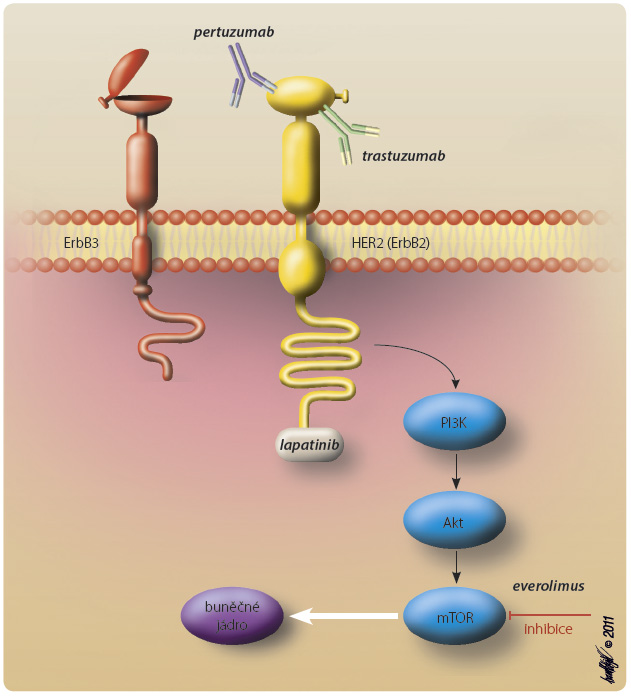 epublice představuje necelých 15 % všech onemocnění. S příchodem cílené léčby se prognóza těchto pacientek stala podobnou pacientkám bez exprese HER2. Dosud jsme v cílené léčbě tohoto typu onemocnění měli k dispozici humanizovanou monoklonální protilátku proti extracelulární doméně HER2 trastuzumab a tyrozinkinázový inhibitor lapatinib. Mechanismus jejich účinku ukazuje obr. 1.
epublice představuje necelých 15 % všech onemocnění. S příchodem cílené léčby se prognóza těchto pacientek stala podobnou pacientkám bez exprese HER2. Dosud jsme v cílené léčbě tohoto typu onemocnění měli k dispozici humanizovanou monoklonální protilátku proti extracelulární doméně HER2 trastuzumab a tyrozinkinázový inhibitor lapatinib. Mechanismus jejich účinku ukazuje obr. 1.
Subkutánní trastuzumab
Nově je možné podat trastuzumab subkutánně. Injekční roztok obsahuje vysoce koncentrovaný trastuzumab a rekombinantní lidskou hyaluronidázu (rHuPH20), která umožní vstřebání léčiva z podkoží. Účinnost i bezpečnost srovnatelnou s intravenózním podáním prokázal subkutánní trastuzumab v randomizované multicentrické studii fáze III HannaH (enHANced treatment with NeoAdjuvant Herceptin), která podávala neoadjuvantně a adjuvantně 596 pacientkám s HER2-pozitivním časným karcinomem prsu trastuzumab buď intravenózně nebo subkutánně [10]. Studie byla koncipována jako noninferiorní, primární cíle byly dva – farmakokinetika (koncentrace trastuzumabu v séru v ustáleném stavu před podáním v 8. cyklu léčby před chirurgickým výkonem) a účinnost, hodnocená kompletní patologickou odpovědí (pCR) v prsu. Farmakokinetika subkutánně podaného trastuzumabu v neoadjuvantní fázi léčby byla identická s nálezy po intravenózní aplikaci (primární farmakokinetický cíl studie), patologické kompletní remise v prsu bylo dosaženo u 45,4 %, respektive 40,7 % pacientek léčených subkutánní a intravenózní aplikací, a tím byly oba primární cíle studie splněny. Tolerance subkutánní aplikace byla podobná nitrožilnímu podání, s výjimkou častějšího výskytu infekcí (závažné nežádoucí účinky u 21 % vs. 12 % pacientek ve srovnání s nitrožilní aplikací). Rozdíl ve výskytu kardiotoxicity nebo alergických reakcí pozorován nebyl. V multicentrické studii PrefHer, která byla randomizovaná, otevřená a zkřížená, byla subkutánní aplikace trastuzumabu preferována před nitrožilní více než 85 procenty nemocných [11]. Subkutánně se lék podává střídavě do levého a pravého stehna v jednotné dávce 600 mg během 2–5 minut jednou za 3 týdny, a to bez nutnosti podat dávku nasycovací, jako je tomu u nitrožilní léčby. Koncem roku 2013 již byla stanovena cena a podmínky úhrady v České republice, lék by měl být dostupný od července 2014. Aktuálně probíhající studie SafeHer (n = 2500) ověřuje ve druhé kohortě nemocných bezpečnost subkutánního podání trastuzumabu samoaplikátorem, který by do budoucna mohl pacientkám umožnit, aby si lék aplikovaly samy a mohly se tak vzdálit od své nemocnice na dobu delší než tři týdny.
Rezistence na terapii anti-HER2
Bohužel značná část pacientek i přes podání cílené léčby HER2 relabuje nebo nedosáhne odpovědi. Důvodem může být zvýšená exprese receptoru HER1, HER2, HER3, zkrácená (truncated) forma HER2, uvnitř buňky potom mutace PIK3CA nebo ztráta funkce tumor supresorového genu PTEN. Výzkum se soustřeďuje na hledání způsobů, jak tyto mechanismy překonat. Nejblíže klinické praxi je nyní užití pertuzumabu a trastuzumab emtansinu.
Pertuzumab
Pertuzumab je rekombinantní humanizovaná monoklonální protilátka. Brání na ligandu závislé dimerizaci HER2, váže se na extracelulární část receptoru, avšak na jiný epitop než trastuzumab. Jejich účinky jsou navzájem komplementární a při společném podání mají větší protinádorový efekt, než pokud je každá z nich podána samostatně. Pertuzumab se podává jako nitrožilní infuze v nasycovací dávce 840 mg a dále 420 mg jako dávka udržovací jedenkrát za 21 dní. Dle platných doporučení NCCN (National Comprehensive Cancer Network guidelines) je podávání pertuzumabu v kombinaci s trastuzumabem a docetaxelem doporučeno jako první linie léčby HER2-pozitivního MBC. Doporučení se opírá o výsledky randomizované, placebem kontrolované studie fáze III CLEOPATRA (n = 808), která zkoumala účinnost a bezpečnost přidání pertuzumabu k léčbě docetaxelem a trastuzumabem [12]. Primárním cílem studie byla doba do progrese onemocnění, sekundárními cíli celkové přežití, objektivní odpověď a bezpečnost. Kombinovaná léčba signifikantně prodloužila dobu do progrese, medián PFS (progression free survival, čas do progrese onemocnění) byl 12,4 měsíce ve skupině kontrolované placebem a 18,5 měsíce v rameni s pertuzumabem. Při mediánu sledování 30 měsíců bylo prokázáno statisticky významné prodloužení celkového přežití (37,6 měsíce v kontrolním rameni, v rameni s pertuzumabem nebylo mediánu přežití dosud dosaženo), riziko úmrtí bylo pertuzumabem redukováno o 34 % ( p = 0,0008). Pertuzumab nezvyšoval výskyt kardiotoxicity, častěji se vyskytla jen febrilní neutropenie a průjem stupně 3 a 4, vyrážka a mukozitida. Pertuzumab prokázal přínos ve všech podskupinách nemocných, včetně malé části souboru pacientek, které byly v rámci neoadjuvance nebo adjuvance předléčeny trastuzumabem (n = 88; PFS: 10,4 měsíce v rameni s placebem vs. 6,9 měsíce v rameni s pertuzumabem). Pertuzumab má od konce roku 2013 stanovenu výši a podmínky úhrady v režimu VILP pro první léčebnou linii diseminovaného HER2-pozitivního onemocnění.
V neoadjuvantním podání ve studii NeoSPHERE zvyšovalo přidání pertuzumabu k trastuzumabu a chemoterapii procento dosažených patologických kompletních remisí, proto se nyní velmi očekávají jeho výsledky v adjuvanci (studie APHINITY).
Trastuzumab emtansin (T-DM1)
Dosud nebyla zcela jasná optimální varianta druhé linie léčby HER2-pozitivního MBC po progresi při léčbě trastuzumabem. Pokračování v cílené terapii anti-HER2 se jevilo jako smysluplné, pokračování aplikace trastuzumabu s jiným cytostatikem bylo ve studii účinnější než samotná chemoterapie [13]. Dosud byl ve druhé linii léčby podáván lapatinib s kapecitabinem [14]. Aktuálně panel NCCN [15] již preferuje jako léčbu druhé linie po selhání terapie založené na trastuzumabu podávání trastuzumab emtansinu (T-DM1). Mezinárodní multicentrická randomizovaná studie EMILIA prokázala jeho superioritu ve srovnání s léčbou lapatinibem a kapecitabinem [16]. T-DM1 statisticky signifikantně prodloužil medián doby do progrese o 3 měsíce (9,6 měsíce vs. 6,4 měsíce) a celkové přežití (30,9 měsíce vs. 25,1 měsíce), riziko úmrtí z jakékoliv příčiny redukoval o 38 %.
Trastuzumab emtansin způsoboval častěji trombocytopenii a elevaci hladin transamináz stupně 3 a 4, zatímco podání lapatinibu a kapecitabinu častěji z![Obr. 2 Schematické znázornění mechanismu účinku T-DM1; podle [18] – LoRusso, et al., 2011. T-DM1 je konjugátem monoklonální protilátky trastuzumabu a cytotoxické molekuly emtansinu – derivátu maytansinu (DM1). Na jednu molekulu trastuzumabu je navázáno více molekul emtansinu. Navázání emtansinu na trastuzumab umožní cílené nasměrování léčiva do nádorové tkáně. T-DM1 se váže na receptor HER2, po vazbě dochází k internalizaci komplexu HER2-T-DM1, degradaci v lyzozomech a k uvolnění emtansinu. Intracelulárně emtansin inhibuje polymerizaci mikrotubulů a zastavuje tak buněčné dělení, což vede ke smrti nádorové buňky.](https://www.remedia.cz/photo-a-29733---.jpg) působovalo průjmy, nevolnost, zvracení a syndrom ruka-noha. T-DM1 je v onkologii solidních nádorů vysoce inovativním léčivem, protože se jedná o konjugát protilátky trastuzumabu a cytostatika (derivátu maytansinu), které je cíleně dodáno pouze do nádorové buňky nadměrně exprimující HER2, obr. 2. Podává se jako nitrožilní infuze v dávce 3,6 mg/kg tělesné hmotnosti jednou za 21 dní. V této indikaci je již T-DM1 v Evropě registrován, očekává se stanovení úhrady během roku 2014. T-DM1 prokázal svoji účinnost také ve třetí linii léčby u pacientek předléčených dvěma liniemi terapie anti-HER2 dle aktuálně prezentovaných výsledků první interim analýzy studie TH3RESA [17], kde prodlužoval ve srovnání s léčbou dle volby lékaře dobu do progrese onemocnění téměř dvojnásobně. Jeho efektivitu v první linii ukáží výsledky studie MARIANNE, v adjuvanci pak výsledky studie KAITLIN.
působovalo průjmy, nevolnost, zvracení a syndrom ruka-noha. T-DM1 je v onkologii solidních nádorů vysoce inovativním léčivem, protože se jedná o konjugát protilátky trastuzumabu a cytostatika (derivátu maytansinu), které je cíleně dodáno pouze do nádorové buňky nadměrně exprimující HER2, obr. 2. Podává se jako nitrožilní infuze v dávce 3,6 mg/kg tělesné hmotnosti jednou za 21 dní. V této indikaci je již T-DM1 v Evropě registrován, očekává se stanovení úhrady během roku 2014. T-DM1 prokázal svoji účinnost také ve třetí linii léčby u pacientek předléčených dvěma liniemi terapie anti-HER2 dle aktuálně prezentovaných výsledků první interim analýzy studie TH3RESA [17], kde prodlužoval ve srovnání s léčbou dle volby lékaře dobu do progrese onemocnění téměř dvojnásobně. Jeho efektivitu v první linii ukáží výsledky studie MARIANNE, v adjuvanci pak výsledky studie KAITLIN.
Závěr
Největšího pokroku bylo v posledních letech dosaženo v léčbě HER2-pozitivního karcinomu prsu, kde se cílenou terapií podařilo velmi zlepšit nepříznivou prognózu těchto nemocných. Obecně se přežití žen s diseminovaným onemocněním za posledních deset let prodloužilo na dvojnásobek. Intenzivní výzkum karcinomu prsu a vývoj nových léčiv, která, jak doufáme, budou postupně zaváděna do běžné terapeutické praxe, dávají naději na další zlepšení léčebných výsledků všech stadií tohoto onemocnění.
Práce byla podpořena MZ ČR – RO (MOÚ, 00209805).Seznam použité literatury
- [1] ÚZIS. Novotvary 2008 ČR. Dostupné online na www.svod.cz
- [2] Gibson L, Lawrence D, Dawson C, et al. Aromatase inhibitors for treatment of advanced breast cancer in postmenopausal women. Cochrane Database Syst Rev 2009.
- [3] Ingle JN, Suman VJ, Rowland KM, et al. Fulvestrant in women with advanced breast cancer after progression on prior aromatase inhibitor therapy: North Central Cancer Treatment Group Trial N0032. J Clin Oncol 2006; 24: 1052–1056.
- [4] Chia S, Gradishar W, Mauriac L, et al. Double-blind, randomized placebo controlled trial of fulvestrant compared with exemestane after prior nonsteroidal aromatase inhibitor therapy in postmenopausal women with hormone receptor-positive, advanced breast cancer: results from EFECT. J Clin Oncol 2008; 26: 1664–1670.
- [5] Di Leo A, Jerusalem G, Petruzelka L, et al. Final analysis of overall survival for the Phase III CONFIRM trial: fulvestrant 500 mg versus 250 mg. Program and abstracts of the 34th Annual San Antonio Breast Cancer Symposium; December 4-8, 2012; San Antonio, Texas. Abstract S1-4.
- [6] Bachelot T, Bourier C, Cropet C, et al. TAMRAD: A GINECO randomized phase II trial of everolimus in combination with tamoxifen versus tamoxifen alone in patients (pts) with hormone-receptor positive, HER2 negative metastatic breast Cancer (MBC) with prior exposure to aromatase inhibitors (AI), abstract. Cancer Res 2010; 70 (24 Supplement): abstract S1–S6.
- [7] Baselga J, Campone M, Piccart M, et al. Everolimus in postmenopausal hormone-receptor-positive advanced breasst cancer. N Engl J Med 2012; 36: 520–529.
- [8] Piccart M et al. Everolimus plus exemestane for hormone receptor positive (HR+), human epidermal growth factor receptor-2 negative (HER2-) advanced breast cancer (BC): overall survival results from BOLERO-2. Oral Presentation Abstract LBA1. European Breast Cancer Conference (EBCC-9), 2014, Glasgow, Scotland.
- [9] Cortes J, O´Shaughnessy J, Loesch D, et al. Eribulin monotherapy versus treatment of physician´s choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomized study. Lancet 2011, 377: 914–923.
- [10] Ismael G, Hegg R, Muehlbauer S, et al. Subcutaneous versus intravenous administration of (neo)adjuvant trastuzumab in patients with HER2-positive, clinical stage I-III breast cancer (HannaH study): a phase 3, open-label, multicentre, randomised trial. Lancet Oncol 2012; 13: 869–878.
- [11] Pivot X, Gligorov J, Müller V, et al. Preference for subcutaneous or intravenous administration of trastuzumab in patients with HER2-positive early breast cancer (PrefHer): an open-label randomized study. Lancet Oncol 2013; 14: 962–970.
- [12] Baselga J, Cortes J, Kim SB, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med 2012; 366: 109–119.
- [13] Von Minckwitz G, Zielinski C, Maarteense E, et al. Capecitabine vs. capecitabine + trastuzumab in patients with HER2-positive metastatic breast cancer progressing during trastuzumab treatment: The TBP phase III study (CGB 26/BIG3-05). J Clin Oncol 2008; 15 (Suppl.): 1025.
- [14] Geyer CE, Forster J, et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med 2006; 355: 2733–2743.
- [15] NCCN Practice Guidelines in Oncology. National Comprehensive Cancer Network (online), http://www.nccn.org/professionals/physicians_gls/PDF/breast.pdf, verze 3/2014.
- [16] Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2 positive advanced breast cancer. N Engl J Med 2012; 367:1783–1791.
- [17] Krop IE, Kim SB, Gonzáles-Martín A, et al. Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial. Lancet Oncol 2014; 15: 689–699. Epub 2014 May.
- [18] LoRusso PM, Weiss D, Guardino E, et al. Trastuzumab Emtansine: A Unique Antibody-Drug Conjugate Receptor 2-Positive Cancer in Development for Human Epidermal Growth Factor. Clin Cancer Res 2011; 17: 6437–6447.