Novinky ve vakcinaci proti HPV
Souhrn:
Infekce HPV (human papilloma virus, lidský papilomavirus, Papillomavirus z čeledi Papovaviridae) je pravděpodobně nejčastějším sexuálně přenosným onemocněním. Minimálně 13 genotypů HPV je řazeno mezi kancerogenní ve vztahu ke karcinomu děložního hrdla. Cílem očkovacích programů v mnoha zemích je prevence karcinomu děložního hrdla pomocí bivalentní (Cervarix®) nebo kvadrivalentní (Silgard®, Gardasil®) vakcíny proti HPV. Objevují se první údaje o účinnosti přípravků u karcinomů lokalizovaných v jiných částech těla. Rozsáhlé studie ukazují u obou vakcín významnou účinnost proti infekci HPV a různým onemocněním souvisejícím s HPV. Rozšiřují se indikace uvedené v Souhrnu údajů o přípravku obou vakcín. Randomizované kontrolované studie prokazují robustní protilátkovou odpověď a vysokou účinnost vakcinace proti HPV také u mužů. Několik zemí doporučuje očkování obou pohlaví. Studie na základě tzv. immunobridgingu ukázaly, že dvě dávky obou vakcín proti HPV indukují u mladých adolescentů non inferiorní titry protilátek ve srovnání s titry protilátek produkovaných u žen ve věku 15–25 let očkovaných třemi dávkami. V České republice je od roku 2012 očkování dívek ve věku 13–14 let hrazeno ze zdravotního pojištění.
Key words: human papillomavirus, HPV associated diseases, cervical cancer, vulvar cancer, vaginal cancer, penile cancer, genital warts, Silgard®, Cervarix®, Gardasil®, 2 dose schedule of HPV vaccination, HPV vaccination in men.
Summary:
HPV (human papilloma virus, Papillomavirus of the family Papovaviridae) infection is probably the most frequent sexually transmitted disease. At least 13 HPV genotypes are classified as carcinogenic in the relation to the cervical cancer. The prevention of cervical cancer using either the bivalent (Cervarix®) or the quadrivalent (Silgard®, Gardasil®) HPV vaccine is the goal of immunization programs in many countries. First data of efficiency against cancers at other localisations also emerge. Large trials for both vaccines find efficacy against HPV related infection and different HPV associated diseases. The indications written in SPC (Summaries of Product´s Characteristics) of both vaccines become broader. Randomized control trials demonstrate robust antibody responses and high efficacy also in men. Several countries recommend gender neutral vaccination. The immunobridging studies show that two doses of both HPV vaccines induce non inferior antibody titers in young adolescents to antibody titers elicited in women 15–25 years old with three doses of the vaccine. Since 2012, vaccination of girls at the age of 13–14 years has been covered from the health insurance in the Czech Republic.
Úvod
Lidský papilomavirus (HPV, human papillomavirus) je malý DNA virus, který přes malé ragády infikuje epitel kůže nebo sliznice orofaryngeální a anogenitální oblasti [1,2]. Infekce se přenáší hlavně během koitálních i nekoitálních sexuálních aktivit, postačuje kontakt kůže s kůží. Jde o nejčastěji se vyskytující sexuálně přenosnou infekci, která alespoň jednou za život postihne 75–80 % sexuálně aktivních lidí [3,4]. Životní cyklus viru se odehrává v epitelu infikovaného orgánu, reinfekce identickým genotypem HPV probíhá často za velmi podobných podmínek jako primoinfekce [5].
Dosud bylo identifikováno více než 150 genotypů HPV, které se dělí na nízce rizikové (low risk, LR) a vysoce rizikové (high risk, HR) podle potenciálu iniciovat kancerogenezi děložního hrdla [6]. Do skupiny HR HPV patří 13–18 genotypů, za nejdůležitější pro etiopatogenezi lidských malignit jsou považovány genotypy HPV 16, 18, 31, 33 a 45 [7,8]. Předpokládá se, že přibližně 5,2 % ze všech lidských karcinomů je způsobeno infekcí HR papilomaviry [9] a jen ve Spojených státech amerických (USA) je infekci HPV přičítán vznik přibližně 25 000 až 32 000 karcinomů ročně [10].
Primární prevence onemocnění asociovaných s infekcí HPV
Principem primární prevence je zabránit rozvoji infekce vyvolávajícím činitelem papilomavirem. Celoživotní sexuální abstinence a striktní celoživotní monogamie spadá v evropských sociálních poměrech spíše do oblasti teorie. Pohlavní styk s kondomem proti transmisi HPV nechrání. Jediná reálná možnost primární prevence spočívá v profylaktické vakcinaci. Aby bylo dosaženo maximální ochrany, je třeba zahájit očkování alespoň 4–6 měsíců před začátkem pohlavního života.
Vakcíny proti infekci HPV
Identifikace HR HPV jako primární příčiny cervikálního karcinomu umožnila Mezinárodní agentuře pro výzkum nádorových onemocnění (International Agency for Research on Cancer, IARC) klasifikovat v ro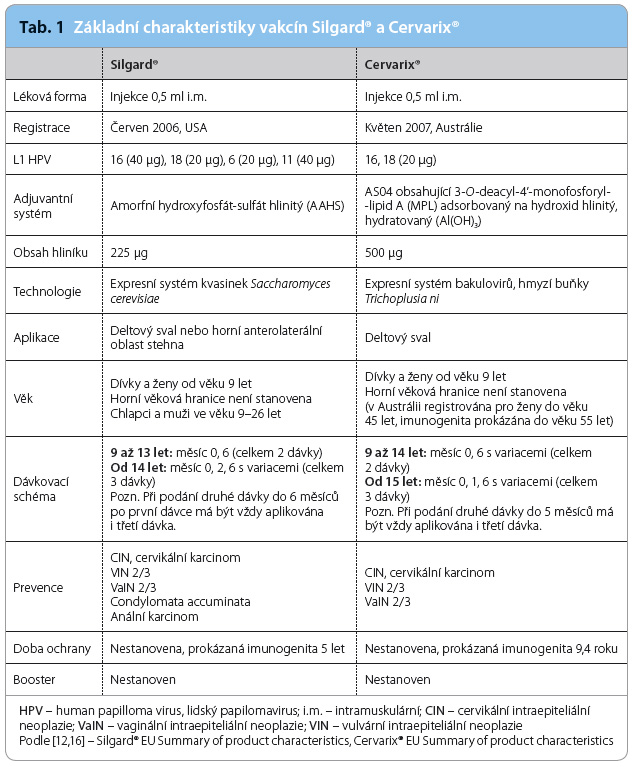 ce 1995 genotypy HPV 16 a HPV 18 jako lidské kancerogeny [8]. Kompletní popis struktury genomu HPV se stal podmínkou pro přípravu rekombinantní vakcíny složené z vysoce purifikovaných viru podobných částic (virus like particles, VLPs) tvořených hlavním papilomavirovým kapsidovým proteinem L1 [11]. VLPs neobsahují žádnou virovou DNA, a nemohou tak infikovat buňky ani se nemohou množit. Cílem vakcinace je navození tvorby vysokých hladin neutralizačních protilátek. Vývoj vakcín první generace byl zaměřen proti dvěma nejvíce rozšířeným onkogenním genotypům HPV 16 a HPV 18. V současnosti jsou v České republice (ČR) registrovány dvě vakcíny – bivalentní vakcína Cervarix® proti HPV 16 a HPV 18 a kvadrivalentní vakcína Silgard® proti HPV 6, 11, 16 a 18, která je v některých zemích distribuována pod názvem Gardasil®. V ČR je od 1. dubna 2012 vakcinace proti infekci HPV pro dívky ve věku 13 až 14 let hrazena z prostředků zdravotního pojištění. Základní charakteristiky obou dostupných vakcín shrnuje tab. 1.
ce 1995 genotypy HPV 16 a HPV 18 jako lidské kancerogeny [8]. Kompletní popis struktury genomu HPV se stal podmínkou pro přípravu rekombinantní vakcíny složené z vysoce purifikovaných viru podobných částic (virus like particles, VLPs) tvořených hlavním papilomavirovým kapsidovým proteinem L1 [11]. VLPs neobsahují žádnou virovou DNA, a nemohou tak infikovat buňky ani se nemohou množit. Cílem vakcinace je navození tvorby vysokých hladin neutralizačních protilátek. Vývoj vakcín první generace byl zaměřen proti dvěma nejvíce rozšířeným onkogenním genotypům HPV 16 a HPV 18. V současnosti jsou v České republice (ČR) registrovány dvě vakcíny – bivalentní vakcína Cervarix® proti HPV 16 a HPV 18 a kvadrivalentní vakcína Silgard® proti HPV 6, 11, 16 a 18, která je v některých zemích distribuována pod názvem Gardasil®. V ČR je od 1. dubna 2012 vakcinace proti infekci HPV pro dívky ve věku 13 až 14 let hrazena z prostředků zdravotního pojištění. Základní charakteristiky obou dostupných vakcín shrnuje tab. 1.
V poslední době je vývoj očkovacích látek proti HPV zaměřen nejen na vakcíny profylaktické, ale i na vakcíny terapeutické a kombinované. V dohledné době by měla přijít na trh nonavalentní profylaktická vakcína s tvorbou typově specifických neutralizačních protilátek proti dvěma neonkogenním a sedmi onkogenním genotypům HPV. Také se testují alternativní a méně invazivní způsoby aplikace VLPs, a to ve formě nosní (sprej, aerosol) a perorální, pozornost se také věnuje vývoji levnějších vakcín z rostlinných extraktů.
Prokázaná účinnost vakcinace proti HPV
Při uvádění na trh byla v SPC (Summary of Product Characteristics, Souhrn údajů o přípravku) obou přípravků uvedena jako terapeutická indikace prevence cervikálních lézí a cervikálního karcinomu, které jsou v příčinné souvislosti s HPV 16 a HPV 18, u kvadrivalentní vakcíny navíc prevence genitálních bradavic. Možnost ovlivnění celkové prevalence infekce HPV vakcinací, a tím incidence onemocnění spojených s HPV vyvolala obrovský celosvětový zájem o tuto problematiku. Téměř každý rok je na dané téma zahrnující i přidružené disciplíny organizován velký kongres EUROGIN (EUropean Research Organisation on Genital Infection and Neoplasia), jehož se účastní několik tisíc delegátů z celého světa. Zatím poslední kongres EUROGIN 2013 ve Florencii se nesl v duchu hesla „HPV na křižovatkách – 30 let výzkumu a praxe“. Díky intenzivnímu výzkumu se prokázala výrazně širší ochrana proti onemocněním asociovaným s HPV, než se původně předpokládalo, rozšířily se indikace vakcín proti HPV a změnilo se dávkování pro některé věkové skupiny, což vedlo k opakovaným úpravám SPC obou přípravků.
Obě vakcíny mají prakticky 100% účinnost proti onemocněním vyvolaným genotypy HPV 16 a 18, určité rozdíly jsou u lézí asociovaných s jinými genotypy HPV. Silgard® díky přítomnosti VLPs pro HPV 6 a 11 chrání také proti genitálním bradavicím spojeným s těmito genotypy. Podání přípravku Silgard® HPV naivním ženám snížilo incidenci genitálních bradavic bez ohledu na vyvolávající genotyp HPV o 82,8 % (95% CI – confidence interval, interval spolehlivosti: 74,3–88,8) [12].
Nejdůležitější indikací zůstává ochrana proti cervikálním prekancerózám a karcinomům. Očkování kvadrivalentní vakcínou Silgard® v populaci HPV naivních žen snižuje vznik CIN 2+ (těžká cervikální intraepiteliální neoplazie 2. a 3. stupně, adenocarcinoma in situ, invazivní cervikální karcinom) bez ohledu na vyvolávající genotyp HPV o 42,7 % (95% CI: 23,7–57,3) [12]. Je však nutno si uvědomit, že těžké prekancerózy děložního hrdla jsou způsobeny širokým spektrem genotypů HPV a nezřídka je přítomna souběžná infekce více genotypy HPV [13]. Asi jen 5 % všech CIN 2 progreduje až do stadia invazivního karcinomu, a to především v důsledku infekce genotypy HPV 16, 18 a 45. Podle výsledků evropských multicentrických studií SCALE a HERACLES jsou v invazivních karcinomech děložního hrdla nejčastěji přítomny genotypy HPV 16 (63,3 %), 18 (15,2 %) a 45 (5,3 %) [14]. Při plné ochraně proti HPV 16 a HPV 18 po očkování HPV naivních žen vakcínou Silgard® by ochrana proti invazivnímu karcinomu děložního hrdla měla být v ČR minimálně na úrovni 78 %.
Po očkování bivalentní vakcínou Cervarix® studie doložily určitou míru zkřížené ochrany i proti některým nevakcinálním genotypům HR HPV. Mechanismus této zkřížená protekce nebyl doposud plně vysvětlen, ale předpokládá se, že souvisí s fylogenetickou příbuzností HPV a s vysokými titry protilátek indukovaných díky imunomodulačnímu adjuvantnímu systému AS04 (obsahujícímu 3 O deacyl 4´ monofosforyl lipid A) [15]. Po očkování HPV naivních žen vakcínou Cervarix® se snížil výskyt CIN 2+ o 64,9 % (95% CI: 52,7–74,2) bez ohledu na přítomný genotyp HPV. Redukce nejzávažnějších lézí CIN 3+ bez ohledu na vyvolávající genotyp HPV dosahovala ve stejné kohortě dokonce 93,2 % (95% CI: 78,9–98,7) [16].
Studie prokázaly statisticky významnou ochranu i proti dalším genitálním prekancerózám. V metaanalýze 93 prací ze čtyř světadílů byla infekce HPV diagnostikována u 85,3 % těžkých prekanceróz vulvy, u 40,4 % vulvárních karcinomů, u 90,1 % těžkých prekanceróz pochvy, u 69,9 % vaginálních karcinomů, u 93,9 % těžkých análních prekanceróz (anální intraepiteliální neoplazie, AIN 2/3) a u 84,3 % análních karcinomů [17]. Ve všech lézích dominoval genotyp HPV 16. Autoři metaanalýzy vyvozují, že očkováním účinným pouze proti genotypům HPV 16 a 18 by bylo možno zabránit vzniku přibližně 40 % vulvárních, 60 % vaginálních a 80 % análních karcinomů [17]. U homosexuálních mužů očkovaných vakcínou Silgard® se zjistila signifikantní redukce AIN 2/3 souvisejících s HPV 6, 11, 16 a 18 o 74,9 % (95% CI: 8,8–95,4) [12].
Podle současného platného SPC jsou obě vakcíny určeny k podání jedincům ve věku od 9 let k prevenci premaligních genitálních lézí (cervikálních, vulvárních a vaginálních) a cervikálního karcinomu, které jsou způsobeny určitými onkogenními typy lidských papilomavirů [12,16]. Platná indikace v SPC vakcíny Silgard® zahrnuje navíc prevenci análního karcinomu a genitálních bradavic v příčinné souvislosti se specifickými genotypy HPV [12].
Předpokládaná účinnost vakcinace proti HPV
Ve studii sledující účinnost vakcinace proti HPV na snížení výskytu karcinomu penisu po očkování vakcínou Silgard® nebyl ve studované skupině zaznamenán ani jeden případ prekancerózy penisu (penilní intraepiteliální neoplazie, PIN) ve spojitosti s očkovanými genotypy, zatímco v kontrolní skupině byly zaznamenány čtyři případy PIN; výsledky však nebyly statisticky signifikantní [12]. Plošná vakcinace proti HPV u mužů by tak pravděpodobně snížila incidenci karcinomu penisu, ale pro řídký výskyt tohoto onemocnění a nedostatek jednoznačně přímých důkazů o souvislosti s infekcí HPV není zatím možné doporučit očkování proti HPV jako účinné v primární prevenci karcinomu penisu [18].
Mezi dlaždicobuněčné karcinomy hlavy a krku (head and neck squamous cell carcinoma, HNSCC) zahrnujeme malignity dutiny ústní, jazyka, dutiny nosní, paranazálních dutin, epifaryngu, orofaryngu, hypofaryngu, laryngu a slinných žláz. Celosvětově jde o šestou nejčastější malignitu s rozšířenějším výskytem u mužů [19]. Jednotlivé práce z posledních let potvrzují zastoupení infekce HPV u dlaždicobuněčných karcinomů dutiny ústní a orofaryngu až v 85 %, dříve se udávala spojitost výrazně nižší [20,21]. Přestože stále není zcela jasné, jak očkování proti HPV ovlivní incidenci karcinomů hlavy a krku, existují již první práce, které dokládají snížení prevalence orální infekce HPV po podání vakcíny [22].
Laryngeální papilomatóza (rekurentní respirační papilomatóza) je vzácné benigní, ale obtížně léčitelné onemocnění s velmi závažným průběhem. Riziko maligní transformace představuje asi 2 %, u plicní formy však dosahuje až 80 % [23]. Genotypy HPV 6 a HPV 11, které v 95 % souvisejí s rekurentní respirační papilomatózou, nelze tedy v oblasti dýchacího ústrojí považovat za nízce rizikové [19]. Paralely mezi charakterem provozovaných sexuálních praktik a výskytem orofaryngeálního karcinomu a rekurentní respirační papilomatózy naznačují, že očkování proti HPV před počátkem pohlavního života by mohlo mít výrazný ochranný vliv [19].
Dvoudávkové očkovací schéma vakcín proti HPV
Při sledování hladin protilátek po aplikaci vakcín proti infekcím HPV mladým dívkám (9–14 let) se zjistilo, že více než 99 % těchto pacientek vytváří 1,7–2krát vyšší hladiny protilátek, než se tvoří u dospělé populace při stejném režimu aplikace [24,25]. Uvedený poznatek vedl k prvním úvahám o možnosti snížení počtu dávek pro mladší věkové kategorie. Další argumenty podporující redukci dávek zahrnovaly jednoznačný pokles finančních nákladů a zvýšení počtu jedinců, kteří dokončí celé doporučené vakcinační schéma [24]. Účinnost pro nízké věkové kohorty dívek byla odvozena na základě tzv. immunobridgingu, který spočívá ve stanovení postvakcinačních hladin protilátek bez ověření klinického výstupu účinnosti. Pokud jsou hladiny protilátek ve studované kohortě non inferiorní s hladinami protilátek ve skupině, kde již byla účinnost prokázána, předpokládá se obdobná účinnost v obou skupinách. Výraz non inferiorní znamená ekvivalentní nebo také srovnatelný. Pokud klinická studie potvrdí ve sledovaném parametru non inferioritu, musejí být studované vlastnosti ve srovnání s výchozím subjektem stejné nebo lepší a nesmějí být horší.
Multicentrická studie, která se soustředila na ověření dostatečné produkce protilátek a na zhodnocení bezpečnosti kvadrivalentní vakcíny Silgard® ve dvoudávkovém očkovacím schématu pro dívky ve věku 9–13 let, proběhla ve třech provinciích Kanady. Celkem 830 dívek a mladých žen bylo stratifikováno do dvou věkových kohort a poté rozděleno 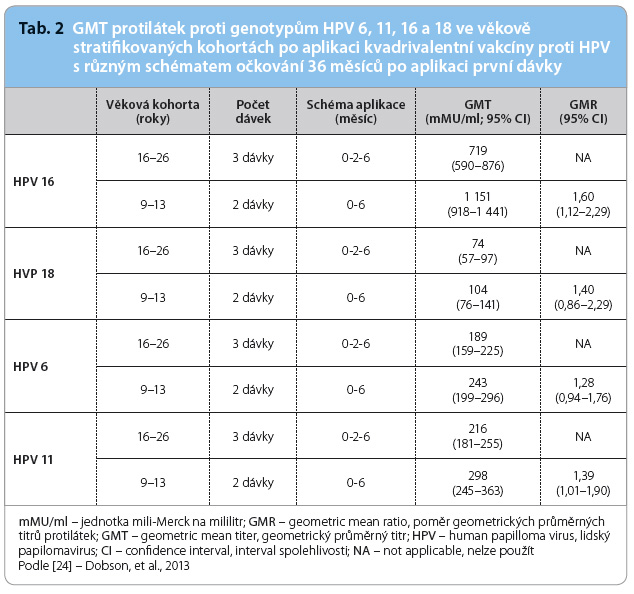 do tří paralelních skupin [4]. Hladiny protilátek proti genotypům HPV 6, 11, 16 a 18 byly měřeny ze vzorků séra metodou Luminex immunoassay za 7, 18, 24 a 36 měsíců po aplikaci první dávky. Nebyla hlášena žádná závažná nežádoucí událost. Po celou dobu sledování byl poměr GMT (geometric mean titer, geometrický průměrný titr) protilátek proti genotypům HPV 6, 11, 16 a 18 non inferiorní pro 9–13leté dívky po očkování dvěma dávkami kvadrivalentní vakcíny (měsíc 0, 6) ve srovnání s GMT protilátek u mladých 16–26letých žen se třemi dávkami (tab. 2) [24].
do tří paralelních skupin [4]. Hladiny protilátek proti genotypům HPV 6, 11, 16 a 18 byly měřeny ze vzorků séra metodou Luminex immunoassay za 7, 18, 24 a 36 měsíců po aplikaci první dávky. Nebyla hlášena žádná závažná nežádoucí událost. Po celou dobu sledování byl poměr GMT (geometric mean titer, geometrický průměrný titr) protilátek proti genotypům HPV 6, 11, 16 a 18 non inferiorní pro 9–13leté dívky po očkování dvěma dávkami kvadrivalentní vakcíny (měsíc 0, 6) ve srovnání s GMT protilátek u mladých 16–26letých žen se třemi dávkami (tab. 2) [24].
K ověření dostatečné produkce protilátek, paměťových buněk a ke zhodnocení bezpečnosti bivalentní HPV vakcíny Cervarix® ve dvoudávkovém očkovacím schématu pro dívky ve věku 9–14 let byly realizovány studie HPV 048 a HPV 070 [5,8,9]. Studie HPV 048 byla multicentrická (21 center v Německu a v Kanadě), částečně dvojitě zaslepená, randomizovaná a věkově stratifikovaná. Do studie bylo zahrnuto 960 zdravých dívek a žen, kterým byla po rozdělení do čtyř věkových skupin aplikována bivalentní vakcína proti HPV, ale s různými dávkami obou antigenů HPV a v různých schématech aplikace [25]. Respondentky s aplikací dvou dávek vakcíny obdržely namísto třetí dávky placebo. Následně byly zjišťovány hladiny protilátek metodou ELISA (Enzyme Linked ImmunoSorbent Assay) v 0., 3., 7., 12., 18., 24., 36. a 48. 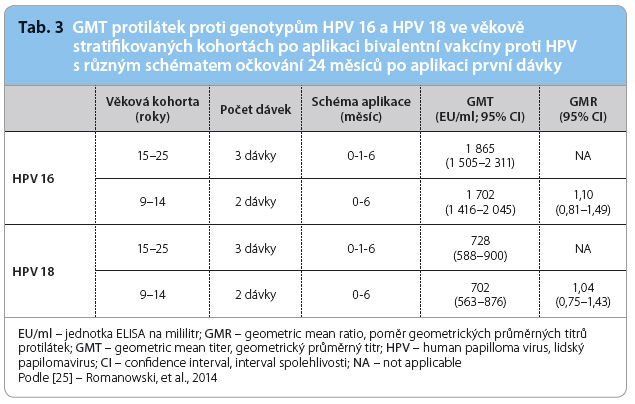 měsíci od aplikace první dávky; celková délka trvání studie je plánována na 60 měsíců. Ze závěrů studie HPV 048 vyplynulo, že protilátková odpověď pro genotypy HPV 16 a 18 a také pro nevakcinační genotypy HPV 31 a 45 je po aplikaci vakcíny podle dvoudávkového očkovacího schématu (měsíc 0 6) u 9–14letých dívek minimálně po dobu 48 měsíců non inferiorní ve srovnání s hladinami protilátek indukovanými po očkování ve třídávkovém schématu (měsíc 0 1 6) u 15–25letých žen [26]. Hodnoty GMT protilátek proti genotypům HPV 16 a HPV 18 za 24 měsíců po podání první dávky ve věkově stratifikovaných kohortách s různým schématem aplikace shrnuje tab. 3.
měsíci od aplikace první dávky; celková délka trvání studie je plánována na 60 měsíců. Ze závěrů studie HPV 048 vyplynulo, že protilátková odpověď pro genotypy HPV 16 a 18 a také pro nevakcinační genotypy HPV 31 a 45 je po aplikaci vakcíny podle dvoudávkového očkovacího schématu (měsíc 0 6) u 9–14letých dívek minimálně po dobu 48 měsíců non inferiorní ve srovnání s hladinami protilátek indukovanými po očkování ve třídávkovém schématu (měsíc 0 1 6) u 15–25letých žen [26]. Hodnoty GMT protilátek proti genotypům HPV 16 a HPV 18 za 24 měsíců po podání první dávky ve věkově stratifikovaných kohortách s různým schématem aplikace shrnuje tab. 3.
Studie HPV 070 probíhala v Německu, Kanadě, Itálii, Thajsku a na Tchaj wanu a porovnávala celkové hodnoty protilátek proti genotypům HPV 16 a 18, hladinu specifických neutralizačních protilátek a další parametry buněčné imunity [8]. Celkem bylo do studie zahrnuto 1 447 dívek a žen rozdělených do tří skupin. Při analýze výsledků se zjistila non inferiorní specifická imunitní odpověď včetně reakce lymfocytů T a B pro genotypy HPV 16 a 18 u 9–14letých dívek (schéma 0 6) sedm měsíců po aplikaci první dávky ve srovnání s 15–25letými ženami (schéma 0 1 6) [27].
Vakcinace proti HPV u mužů
V některých rozvinutých státech západní Evropy je množství karcinomů souvisejících s HPV obdobné u obou pohlaví, zastoupení karcinomů asociovaných s HPV v jednotlivých lokalitách u mužů a žen v USA zobrazuje graf 1 [10]. V tomto kontextu se implementace očkování proti HPV u chlapců zdá být příležitostí pozitivně ovlivnit veřejné zdraví. Přestože existují určité rozdíly v průběhu a rozsah![Graf 1 Karcinomy asociované s infekcí HPV v USA v letech 2004–2007; podle [10] – Zandberg, et al., 2013.](https://www.remedia.cz/photo-a-30065---.jpg) u imunitní odpovědi na přirozenou infekci HPV mezi ženami a muži, studie prokázaly dostatečnou tvorbu protilátek a bezpečnost u žen i mužů po aplikaci bivalentní nebo kvadrivalentní vakcíny proti HPV [28].
u imunitní odpovědi na přirozenou infekci HPV mezi ženami a muži, studie prokázaly dostatečnou tvorbu protilátek a bezpečnost u žen i mužů po aplikaci bivalentní nebo kvadrivalentní vakcíny proti HPV [28].
Základním protiargumentem očkování mužů proti HPV je finanční nevýhodnost založená na ekonomických modelech, podle nichž je vakcinace obou pohlaví obecně méně ekonomicky výhodná než plošná vakcinace samotných žen [29]. Při širokém rozsahu vakcinace proti HPV u dívek není zahrnutí preadolescentních chlapců do očkovacích kalendářů zatím finančně efektivní. Dosažení cíle očkovat 90 % dívek by mělo větší účinnost na zdraví celé populace a bylo by levnější než 71% proočkovanost u obou pohlaví [29]. Podle údajů VZP však v současné době využije v ČR možnosti bezplatné vakcinace proti HPV jen 52 % dívek ve věku 13–14 let [30]. Navíc z ženské populace s protilátkami proti HPV nemají přínos homosexuální muži a riziko incidence infekce HPV zůstává v této populaci vysoké.
Přestože by muži měli z plošné vakcinace proti HPV jednoznačný přínos, u obou pohlaví ji doporučují pouze USA, Kanada, Austrálie, Rakousko, Nový Zéland a Mexiko [31]. Ekonomická výhodnost očkování mužů proti HPV v různých regionech závisí na lokální incidenci jednotlivých onemocnění spojených s HPV, na pokrytí očkované dívčí populace, na ceně vakcíny a také na finanční politice jednotlivých poskytovatelů zdravotní péče [31].
Argumenty podporující očkování mužů proti HPV zahrnují následující fakta: 1) vakcinace pouze žen nechrání homosexuální muže; 2) plošná vakcinace mužů proti HPV urychlí proces snížení incidence karcinomu děložního hrdla u žen; 3) vakcinace mužů i žen podporuje myšlenku shodného přístupu k oběma pohlavím; 4) na distribuci viru v populaci se podílejí obě pohlaví rovným dílem; 5) v některém sociálním prostředí je vakcinace mužů přijímána naopak lépe než očkování žen; 6) onemocnění spojená s HPV u mužů jsou častá a jejich léčba je finančně náročná; 7) celonárodní programy zaměřené jen na jednu skupinu obyvatelstva mají obecně menší úspěšnost [31].
Závěr
Karcinom děložního hrdla a některé další karcinomy jsou důsledkem perzistující infekce onkogenními genotypy HPV. Odhaduje se, že infekce HPV je každoročně zodpovědná za více než 550 000 nových lidských malignit na celém světě. Přítomnost neutralizačních protilátek, které jsou indukovány vakcinací, brání přenosu infekce nejčastějšími onkogenními genotypy.
Obě profylaktické vakcíny Cervarix® a Silgard® jsou bezpečné a vysoce účinné proti infekci způsobené nejčastějšími onkogenními genotypy HPV 16 a 18, vakcína Silgard® působí i proti neonkogenním genotypům HPV 6 a 11. Vzhledem k prokázané signifikantní zkřížené ochraně i proti jiným nevakcinačním onkogenním genotypům, v případě vakcíny Silgard® proti HPV 31 a v případě vakcíny Cervarix® proti HPV 31, 33, 39, 45 a 51, je poskytována ochrana proti lidským malignitám v mnohem větší šíři, než se původně přepokládalo. Vedle výrazného snížení incidence lézí děložního hrdla je neméně významná i ochrana proti prekancerózám a karcinomům vulvy, vaginy a anu, kde již uskutečněné studie potvrdily významnou protekci. Vysokou účinnost vakcinace lze předpokládat u dlaždicobuněčných karcinomů penisu, dutiny ústní a orofaryngu, kde však data o přínosu očkování dosud chybějí. Nově bylo zavedeno u obou vakcín proti HPV dvoudávkové očkovací schéma pro mladistvé. Důraz na zvýšení počtu očkovaných žen zatím zůstane hlavním cílem zdravotní politiky většiny států, v budoucnu ale stále více zemí bude finančně podporovat i vakcinaci proti HPV u mužů.
Práce byla podpořena grantem IGA NT14079 3/2013 a projektem PRVOUK P27/LF1/1.
Seznam použité literatury
- [1] Fehrmann F, Laimins LA. Human papillomaviruses: targeting differentiating epithelial cells for malignant transformation. Oncogene 2003; 22: 5201–5207.
- [2] White EA, Sowa ME, Tan MJ, et al. Systematic identification of interactions between host cell proteins and E7 oncoproteins from diverse human papillomaviruses. Proc Natl Acad Sci USA 2012; 109: E260–E267.
- [3] Spitzer M. Human papillomavirus: epidemiology, natural history, and clinical sequelae. OBG Management 2006; 18: S5–S10.
- [4] Trollfors B. Human papillomavirus vaccines: an outsider´s point of view. Expert Rev Vaccines 2008; 7: 1131–1133.
- [5] Schwarz TF. ASO4 adjuvanted human papillomavirus – 16/18 vaccination: recent advances in cervical cancer prevention. Expert Rev Vaccines 2008; 7: 1465–1473.
- [6] zur Hausen H. Papillomaviruses in the causation of human cancers – a brief historical account. Virology 2009; 384: 260–265.
- [7] Bouvard V, Baan R, Straif K, et al. A review of human carcinogens–Part B: biological agents. Lancet Oncol 2009; 10: 321–322.
- [8] Muñoz N, Bosch FX, de Sanjosé S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003; 348: 518–527.
- [9] Driák D, Sehnal B. Význam infekcí způsobených lidskými papilomaviry. Čas Lék čes 2013; 152: 15–19.
- [10] Zandberg DP, Bhargava R, Badin S, et al. The role of human papillomavirus in nongenital cancers. CA Cancer J Clin 2013; 63: 57–81.
- [11] Zhou J, Sun XY, Stenzel DJ, et al. Expression of vaccinia recombinant HPV 16 L1 and L2 ORF proteins in epithelial cells is sufficient for assembly of HPV virion like particles. Virology 1991; 185: 251–257.
- [12] European Medicines Agency. Silgard®: EU summary of product characteristics. http://www.ema.
- [13] Wentzensen N, Schiffman M, Dunn T, et al. Multiple human papillomavirus genotype infections in cervical cancer progression in study to understand cervical cancer early endpoints and determinants. Int J Cancer 2009; 125: 2151–2158.
- [14] Tjalma WA, Fiander A, Reich O, et al. Differences in human papillomavirus type distribution in high grade cervical intraepithelial neoplasia and invasive cervical cancer in Europe. Int J Cancer 2013; 132: 854–867.
- [15] Beran J. Význam adjuvantního systému AS04 ve vakcíně proti lidskému papilomaviru. Vakcinologie 2013; 7: 64–71.
- [16] European Medicines Agency. Cervarix®: EU summary of product characteristics. http://www.ema.
- [17] De Vuyst H, Clifford GM, Nascimento MC, et al. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a meta analysis. Int J Cancer 2009; 124: 1626–1636.
- [18] Shabbir M, Barod R, Hegarty PK, et al. Primary prevention and vaccination for penile cancer. Ther Adv Urol 2013; 5: 161–169.
- [19] Gillison ML, Alemany L, Snijders PJ, et al. Human Papillomavirus and Diseases of the Upper Airway: Head and Neck Cancer and Respiratory Papillomatosis. Vaccine 2012; 30S: F34–F54.
- [20] Klozar J, Tachezy R, Rotnáglová E, et al. Human papillomavirus in head and neck tumors: epidemiological, molecular and clinical aspects. Wien Med Wochenschr 2010; 160: 305–309.
- [21] Näsman A, Attner P, Hammarstedt L, et al. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: an epidemic of viral induced carcinoma? Int J Cancer 2009; 125: 362–366.
- [22] Herrero R, Quint W, Hildesheim A, et al. CVT Vaccine Group. Reduced prevalence of oral human papillomavirus (HPV) 4 years after bivalent HPV vaccination in a randomized clinical trial in Costa Rica. PLoS One 2013; 8(7): e68329.
- [23] Dedo HH, Yu KC. CO(2) laser treatment in 244 patients with respiratory papillomas. Laryngoscope 2001; 111: 1639–1944.
- [24] Dobson SR, McNeil S, Dionne M, et al. Immunogenicity of 2 doses of HPV vaccine in younger adolescents vs 3 doses in young women: a randomized clinical trial. JAMA 2013; 309: 1793–1802.
- [25] Romanowski B, Schwarz TF, Ferguson LM, et al. Immune response to the HPV 16/18 AS04 adjuvanted vaccine administered as a 2 dose or 3 dose schedule up to 4 years after vaccination: Results from a randomized study. Hum Vaccin Immunother 2014; 10: 1155–1165.
- [26] Romanowski B, Schwarz T, Ferguson L, et al. Immune response to the HPV 16/18 AS04 adjuvanted vaccine administered as a 2 dose or 3 dose schedule up to 4 years after vaccination. Abstract. Poster. Eurogin 2013, 3.–6. 11. 2013, Florencie, Itálie.
- [27] Puthanakit T, Schwarz T, Esposito S, et al. Immune response to a 2 dose schedule of the HPV 16/18 AS04 adjuvanted vaccine in girls (9 14) versus 3 doses in women (15 25): a randomized trial. Abstract. Oral presentation. Eurogin 2013, 3.–6. 11. 2013, Florencie, Itálie.
- [28] Petäjä T, Keränen H, Karppa T, et al. Immunogenicity and safety of human papillomavirus (HPV) 16/18 AS 04 adjuvanted vaccine in healthy boys aged 10–18 years. J Adolesc Health 2009; 44: 33–40.
- [29] Burger EA, Sy S, Nygård M, et al. Prevention of HPV related cancers in Norway: cost effectiveness of expanding the HPV vaccination program to include pre adolescent boys. PLoS One 2014; 9: e89974.
- [30] Prymula R. Ústní sdělení. X. Hradecké vakcinologické dny. Hradec Králové, 2.–4. 10. 2014.
- [31] Zimet GD, Rosenthal SL. HPV vaccine and males: Issues and challenges. Gynecol Oncol 2010; 117 (2 Suppl): S26–S31.