Odlišnosti modulátorů sfingosin‑1‑fosfátových receptorů užívaných v léčbě roztroušené sklerózy – zaměřeno na siponimod
Souhrn:
Elišák M. Odlišnosti modulátorů sfingosin‑1‑fosfátových receptorů užívaných v léčbě roztroušené sklerózy – zaměřeno na siponimod. Remedia 2022; 32: 439–444.
Sfingosin‑1‑fosfátové receptory (S1PR) byly navrženy jako terapeutický cíl pro různá onemocnění z důvodu jejich zapojení do regulace pohybu lymfocytů z lymfatických uzlin, ovlivnění buněk centrálního nervového systému, srdce, cévní permeability i cévního a bronchiálního tonu. V léčbě roztroušené sklerózy se prokázaly jako účinná léčba, přičemž mechanismus je nejen imunosupresivní (snížení počtu a kvalitativní změna lymfocytů v periferní krvi), ale i přímý ovlivněním buněk centrálního nervového systému a zřejmě i ovlivněním permeability hematoencefalické bariéry. Modulátor S1PR siponimod se od fingolimodu odlišuje větší receptorovou specifičností a také stabilnější, předvídatelnou kinetikou. Díky těmto vlastnostem prokázal jako dosud jediný lék příznivý účinek jak na formy relabující, tak i sekundárně progresivní fáze roztroušené sklerózy. Díky specifické vazbě na S1PR1 a S1PR5, možnosti testování genetických polymorfismů jeho metabolismu a titraci dávky je u siponimodu doložen nižší výskyt nežádoucích účinků provázejících zejména zahájení léčby. Potvrzení eventuálního lepšího profilu dlouhodobé bezpečnosti vyžaduje další sledování.
Summary:
Elisak M. Differences among sphingosine 1‑phosphate receptor modulators used in the treatment of multiple sclerosis – focus on siponimod. Remedia 2022; 32: 439–444.
Sphingosine 1‑phosphate receptors (S1PR) were proposed as therapeutic goals for many diseases because of their involvement in regulation of lymphocyte migration from lymph nodes, influence over the central nervous system and heart cells, vascular permeability, and both vascular and bronchial tone. Their modulators proved to be an effective treatment of multiple sclerosis, the mechanism of action being not only immunosuppressive (lowering the count of lymphocytes in peripheral blood and achieving their qualitative change) but also direct – via influencing the central nervous system cells and possibly also the permeability of the blood‑brain barrier. S1PR modulator siponimod is characterized by higher receptor specificity and more stable and predictable kinetics compared to fingolimod. Owing to these qualities, siponimod was confirmed as – so far – the only medication with a favorable effect in both active forms and secondary progressive phase of multiple sclerosis. Thanks to specific binding to S1PR1 and S1PR5, possibilities to test genetic polymorphisms of its metabolism a to titrate the dose properly, siponimod treatment is associated with a lower rate of side effects, usually present at the beginning of treatment. Further follow‑up is necessary to confirm the hypothesis that siponimod has a more favorable long‑term safety profile.
Key words: sphingosine 1‑phosphate receptors, siponimod, multiple sclerosis, differences.
Úvod
Modulátory sfingosin 1 fosfátových receptorů (S1PR) představují účinnou možnost léčby roztroušené sklerózy (RS). Jako první z této skupiny byl v léčbě RS používán fingolimod schválený pro léčbu relabující remitující formy (RR RS). Spektrum modulátorů S1PR se v poslední době rozšiřuje – siponimod je schválen k léčbě aktivní sekundárně progresivní RS (SP RS) v Evropě, relabující RS včetně aktivní sekundárně progresivní formy ve Spojených státech amerických a SP RS v Austrálii a Japonsku. Pro léčbu RR RS jsou v době přípravy článku v Evropě dále schváleny ozanimod a ponesimod.
V České republice jsou v současné době hrazeny následující léky: fingolimod u pacientů s RR RS, 1) u kterých došlo navzdory léčbě nejméně jedním lékem první linie k rozvoji alespoň jednoho středně těžkého/těžkého relapsu, nebo 2) u pacientů s rychle progredující závažnou formou RR RS, kteří prodělali nejméně dva relapsy v jednom roce a současně vykazují jednu nebo více gadolinium (Gd) enhancujících lézí na magnetické rezonanci (MR) mozku nebo zvýšení objemu T2 lézí ve srovnání s předchozí MR; ponesimod u pacientů s aktivní (1 dokumentovaný a léčený relaps v předchozím roce nebo 2 dokumentované a léčené relapsy za dva roky) RR RS, siponimod u nemocných se SP RS s minimální dobou trvání progrese disability šest měsíců nezávisle na relapsech a zároveň s aktivitou onemocnění (klinickou – ataka v posledních dvou letech, nebo rezonanční – Gd enhancující T1 léze nebo nová či zvětšující se T2 léze).
Byť je společným hlavním mechanismem vazba na S1PR, jednotlivé modulátory S1PR se od sebe liší v řadě farmakokinetických i farmakodynamických charakteristik. Cílem článku je porovnat vlastnosti jednotlivých modulátorů S1PR dostupných v současné době v České republice se zaměřením na klinický význam těchto odlišností především u progresivní formy RS.
Vazba na sfingosin 1 fosfátové receptory
Sfingosin 1 fosfát působí
jako extracelulární signální molekula, jejíž aktivita je
zprostředkována pěti podtypy receptorů spřažených s G
proteiny (S1PR1–5), které jsou odlišně exprimovány
v různých typech orgánů včetně imunitního systému,
centrálního nervového systému (CNS), hematoencefalické bariéry
(HEB) a kardiovaskulárního systému. Kromě různých tkání,
v nichž jsou receptory exprimovány, mají i odlišné
signalizační vlastnosti, jež se v některých případech
také kříží (obr. 1) [1].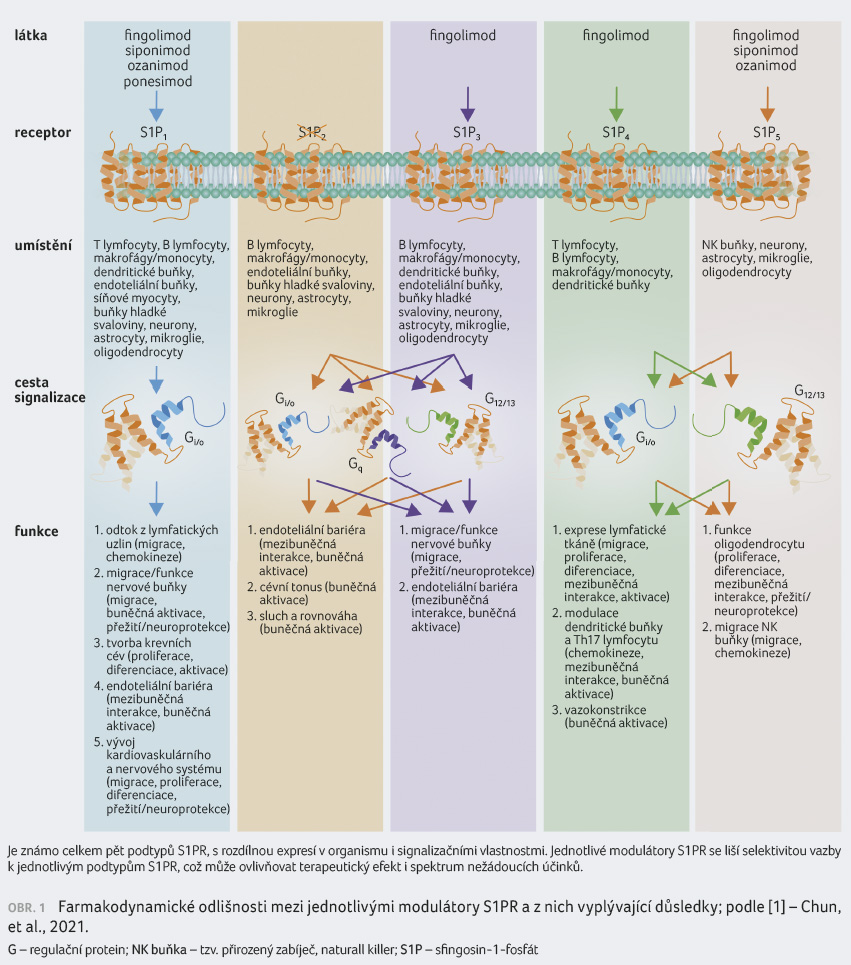
Jednotlivé modulátory S1PR se liší afinitou vazby na jednotlivé podtypy receptorů. První užívaný modulátor S1PR fingolimod má poměrně neselektivní vazbu na všechny S1PR s výjimkou S1PR2, zatímco siponimod se selektivně váže na S1PR1 a S1PR5 a ponesimod výlučně na S1PR1.
Právě vazba na S1PR1 je jedním z hlavních mechanismů účinku – po svém navázání působí modulátor nejprve jako silný agonista. Tento účinek je však rychle nahrazen funkčním antagonismem, kdy vazba způsobuje internalizaci a degradaci S1PR1. Uvedená vazba a následná internalizace jsou závislé na dávce. Vazba na S1PR1 má zásadní vliv na blokaci výstupu určitých lymfocytů z uzlin [2]. Kromě účinku na lymfocyty má vazba na S1PR1 efekt rovněž v CNS. U pacientů s RS jsou na astrocytech koncentrace S1PR1 zvýšeny a funkční antagonismus S1PR1 pomocí fingolimodu je spojen mimo jiné se snížením úrovně astrogliózy [3].
Předpokládaný efekt v CNS má i vazba na S1PR5, která ale nevede k internalizaci tohoto receptoru, a předpokládá se tedy agonistický účinek [4]. Interakce fingolimodu a siponimodu se S1PR5 na oligodendrocytech byla ve studiích in vitro i in vivo spojena mimo jiné s podporou remyelinizace [5].
Ačkoliv bylo působení fingolimodu na S1PR3 považováno za hlavní mechanismus nežádoucího chronotropního kardiálního účinku a novější modulátory S1PR byly vyvíjeny tak, aby se na S1PR3 nevázaly, novější data ukazují, že tato vazba ovlivňuje srdeční frekvenci pouze na zvířecích modelech [6]. Chronotropní efekt modulátorů S1PR je u lidí pravděpodobně způsoben přechodným antagonismem na S1PR1 exprimovaný v převodním systému srdce. Ovlivnění zánětlivého efektu vazby na S1PR3 je sporné – fingolimod prostřednictvím S1PR3 sice indukuje zánětlivý mediátor cyklooxygenázu 2 [7], studie in vitro však ukázaly, že fingolimod může být dle dávky i částečným agonistou S1PR3 a může mít rovněž protizánětlivé účinky [8].
Farmakokinetika
Fingolimod je proléčivo, které musí být fosforylováno sfingosinkinázami, než projeví vysokou vazebnou afinitu k S1PR. Právě terminální fosforylace přispívá k dlouhému poločasu eliminace fingolimodu. Fosforylovaný fingolimod je metabolizován v játrech hlavně prostřednictvím cytochromu P450 3A4 (CYP3A4), s možným ovlivněním induktory/inhibitory enzymů CYP3A4; klinicky významné interakce ale u fingolimodu pozorovány obvykle nebývají [1].
Siponimod, stejně jako ostatní modulátory S1PR, má přímou vazbu na receptory bez nutnosti fosforylace. Clearance siponimodu je závislá na metabolizaci CYP2C9 s malým podílem CYP3A4. Vzhledem k polymorfismům CYP2C9 je před zahájením léčby nezbytná genotypizace jako prevence těžké lymfopenie – u pacientů se slabou metabolickou aktivitou CYP2C9 (kombinace alel *3*3) je expozice siponimodu o 284 % vyšší než u pacientů se silným metabolismem. U pacientů s alelou *3*3 je tedy siponimod kontraindikován. U pacientů se střední metabolickou aktivitou CYP2C9 (kombinace alel *1*3 a *2*3) je expozice siponimodu vyšší o 61–91 % a dávka siponimodu se snižuje na polovinu (1 mg denně). Možné interakce s inhibitory či induktory CYP2C9, ale i CYP3A4 byly ve studiích pozorovány, avšak klinický efekt není obvykle výrazný.
Efekt na orgánové systémy
Průnik a působení modulátorů S1PR v různých tkáních podmiňuje jak terapeutický efekt (imunitní systém, buňky CNS, endotel HEB), tak nežádoucí účinky (imunitní systém – imunokompetence a snížení efektu vakcinace; endotel – makulární edém, teratogenita a změna krevního tlaku; převodní systém srdce – bradykardie, blokády vedení).
Buňky imunitního systému
Interakce S1P s lymfocyty exprimujícími S1PR1 překonává retenční signalizaci v lymfatických uzlinách vyvolanou C C chemokinovým receptorem typu 7 (CCR7) na lymfocytech, které CCR7 exprimují. Zpětný výstup těchto lymfocytů je umožněn gradientem S1P. Pokud tyto lymfocyty nemají na svém povrchu S1P, nedochází k výstupu lymfocytů zpět do cirkulace. Vysokou expresi CCR7 nacházíme převážně u naivních T lymfocytů a u podskupin centrálních paměťových T lymfocytů a části B lymfocytů (byla pozorována redukce migrace B lymfocytů do lymfatických uzlin a potlačení humorální odpovědi v zárodečných centrech v periferních lymfoidních tkáních) [9]. Naproti tomu efektorové paměťové T lymfocyty typicky postrádají expresi CCR7, a tudíž pravidelně nerecyklují přes lymfatické uzliny a tvoří většinu T lymfocytů, které zůstávají v periferní krvi jedinců léčených modulátory S1PR [10]. Výstup T lymfocytů závislý na S1PR je regulován rozdílně u nedávno antigenem aktivovaných T lymfocytů, které mohou překonat závislost na signalizaci S1PR1 při výstupu z lymfatických uzlin snížením modulace CCR7 a opustit uzliny pomocí jiného molekulárního mechanismu [11].
Nástup zadržení citlivých lymfocytů
v uzlinách po podání modulátorů S1PR je rychlý, první
účinky jsou pozorovány během 4–16 hodin po podání [1].
Pokles počtu lymfocytů a jejich obnovení (mimo jiné
v závislosti na eliminačním poločase) se liší (viz tab. 1) [12].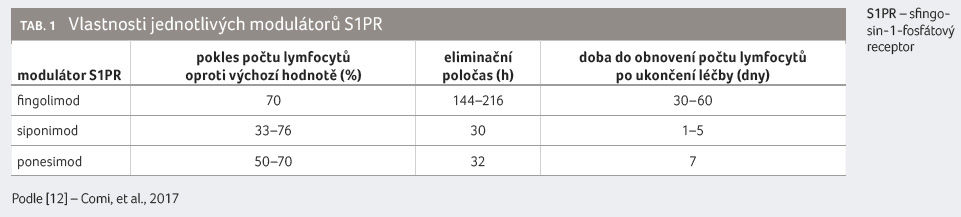
Buňky centrálního nervového systému
Podtypy S1PR1, S1PR3 a S1PR5 se nacházejí na neuronech, astrocytech, mikrogliích, oligodendrocytech a prekurzorových buňkách oligodendrocytů, zatímco S1PR2 se nachází na neuronech, astrocytech a mikrogliích, ale ne na oligodendrocytech. Role signalizace zprostředkované S1P se u jednotlivých typů buněk liší a zahrnují proliferaci, migraci, přežití a produkci cytokinů a růstových faktorů [13]. Jejich efekt byl pozorován na zvířecích modelech, přesný význam tohoto působení u pacientů není ve všech případech dosud znám.
Endotel
Podtypy S1PR1 a S1PR3 hrají úlohu v regulaci funkce endoteliální bariéry a korekce krevního tlaku. Antagonismus na S1PR1 může zvyšovat arteriální tlak pravděpodobně v důsledku snížení regulace uvolňování oxidu dusnatého z endoteliálních buněk hladkého svalstva cév, což vede k vazokonstrikci [14]. Byť byly popsány i kazuistické případy syndromu zadní reverzibilní encefalopatie [15], při dlouhodobé léčbě fingolimodem je pozorováno lehké průměrné zvýšení systolického a diastolického krevního tlaku (3 mm Hg, resp. 1 mm Hg) [16]. V klinické studii fáze III byla hypertenze častěji hlášena u pacientů léčených siponimodem (12,6 % oproti 9,0 % v placebové skupině). Léčba siponimodem měla za následek zvýšení systolického a diastolického krevního tlaku pozorované krátce po zahájení aplikace a dosahující maxima po přibližně šesti měsících terapie (systolický tlak 3 mm Hg, diastolický tlak 1,2 mm Hg), posléze došlo ke stabilizaci.
Vazba na endotel může způsobovat, zejména u predisponovaných jedinců (věk, již existující makulopatie v důsledku uveitidy či diabetes mellitus), zvýšenou cévní propustnost zprostředkovanou S1PR1 a S1PR3, která způsobuje makulární edém. Vyskytuje se zejména v době zahájení léčby u 0,2–2 % pacientů léčených fingolimodem [16] a u 1,8 % pacientů léčených siponimodem [17].
Efekt na buňky endotelu může mít potenciálně i příznivý vliv. Ačkoliv u pacientů s RS zatím nebyl prokázán pozitivní efekt na integritu HEB, u siponimodu byly potvrzeny pozitivní účinky na její integritu na zvířecím modelu traumatického poškození mozku [18].
Klinická účinnost
Výsledky klinických studií u pacientů s RR RS se zdají být poměrně konzistentní u různých modulátorů S1PR, což svědčí o účinnosti tohoto mechanismu u nemocných s aktivní RS (tab. 2) [19]. Dosud neexistují žádné přímé údaje porovnávající jednotlivé modulátory S1PR, a nelze tedy provést přímé srovnání účinnosti. Fingolimod, ponesimod i siponimod prokázaly u pacientů účinnost v redukci roční míry rizika relapsu i MR aktivity.
Z buněčných a zvířecích modelů RS existují doklady o přímém účinku fingolimodu a siponimodu na neurodegeneraci CNS, proto byly oba zkoušeny u progresivních forem RS. Fingolimod byl testován u pacientů s primárně progresivní RS (PP RS) ve studii INFORMS. Studie nesplnila primární cílový ukazatel, přičemž nebyl prokázán žádný přínos fingolimodu z hlediska progrese postižení nebo změny objemu mozku oproti placebu [20]. Ve studii INFORMS se však jednalo o populaci s progresivní RS a velmi nízkou zánětlivou aktivitou. V post hoc analýze byl pozorován pozitivní účinek na objem mozkové tkáně u podskupiny progresivních pacientů, kteří měli na počátku zánětlivou aktivitu onemocnění [21].
U progresivních forem RS prokázal účinnost pouze siponimod, a to u pacientů v sekundární progresi. Studie EXPAND prokázala snížení rizika tříměsíční potvrzené progrese v porovnání s placebem o 21 %. Vliv siponimodu na MR parametry byl v souladu s klinickým efektem: objem T2 lézí narůstal pomaleji, objem mozku klesal pomaleji, 89 % pacientů léčených siponimodem nemělo žádné Gd enhancující léze po dobu studie (67 % pacientů s placebem), 57 % (siponimod) versus 37 % (placebo) nemělo žádné nové nebo zvětšující se T2 léze [22]. Účinnost siponimodu byla doložena u pacientů s aktivní formou SP RS, ale subanalýza studie EXPAND dospěla k závěru, že efekt ve zpomalení progrese nebyl závislý na efektu na snížení počtu relapsů [22]. Účinnost siponimodu v progresivních fázích onemocnění s nízkou zánětlivou aktivitou naznačuje i studie, která prokázala pokles hodnot neurofilament v krvi i u pacientů léčených siponimodem se SP RS bez relapsů.
Lepší výsledky siponimodu oproti fingolimodu u progresivní formy RS mohou mít více příčin. Analýza jaderného transkriptomu buněk extrahovaných z pitevních vzorků prefrontální kůry pacientů s RR RS nebo SP RS zjistila, že exprese sfingosinkinázy je u pacientů se SP RS výrazně nižší. Snížení fosforylace fingolimodu v CNS pacientů s progresivním onemocněním tak může přispívat k nedostatečné účinnosti fingolimodu u této skupiny nemocných [4]. S1PR1 a S1PR5 v CNS mohou podléhat klasické signalizaci vyvolané agonismem s desenzitizací nebo tachyfylaxí při supramaximálních dávkách, která se projevuje ztrátou neuroprotektivních a promyelinizačních účinků při vysokých expozicích siponimodu nebo fingolimod fosfátu v CNS. Optimální poměr expozice léku v CNS a krvi je proto rozhodující pro souběžnou účinnost v krvi i v CNS. Fingolimod vykazuje až čtyřikrát vyšší průnik do CNS při dávkách způsobujících na periferii lymfopenii, navíc tento průnik je vyšší při experimentálně navozené encefalitidě na zvířecích modelech než u zdravých jedinců.
Bezpečnost
V publikovaných studiích se všechny modulátory S1PR ve srovnání se svými komparátory jevily jako relativně dobře snášené a nejčastější nežádoucí příhody byly u všech modulátorů obdobné. Nejvíce dat a nejdelší sledování je u fingolimodu jako prvního zástupce této skupiny. Ke květnu 2020 bylo publikováno užití u 303 600 pacientů s kumulativní expozicí 808 900 pacientoroků [23]. Podrobnější informace o dlouhodobé bezpečnosti lze nalézt v pracích popisujících účinnost a bezpečnost po 14 letech u fingolimodu, resp. po pěti letech u siponimodu [24,25]. Kromě nežádoucích účinků diskutovaných níže byly jako méně závažné či raritní popsány častější infekce horních cest dýchacích a močových cest, zvýšení hodnot jaterních enzymů a snížení vitální kapacity plic. Modulátory S1PR také snižují účinnost vakcinace. Ačkoliv se zdá být výskyt závažných nežádoucích účinků u pacientů léčených siponimodem nižší, je nutné vzhledem ke kratší době užívání a nižšímu počtu exponovaných jedinců porovnání vyhodnotit až po delší době sledování.
Lymfopenie
Lymfopenie v periferní krvi je
jedním z mechanismů účinku modulátorů S1PR. Míra poklesu
počtu lymfocytů se u jednotlivých léků liší (tab. 2)
[12]. I když krátkodobá lymfopenie (roční sledování)
nebyla u pacientů spojena se zvýšeným rizikem infekce [26]
a potvrdila to i data ze 14letého sledování
nemocných léčených fingolimodem [25],
dlouhodobá a zejména závažná lymfopenie s sebou nese
potenciální riziko rozvoje oportunních infekcí včetně
progresivní multifokální leukoencefalopatie (PML), oportunních
infektů a sekundárních malignit. Závažná lymfopenie
4. stupně dle Světové zdravotnické organizace (< 200/mm3)
se ve studii EXPAND vyskytla u méně než 1 % pacientů
léčených siponimodem. V dlouhodobém 14letém sledování
pacientů léčených fingolimodem byla závažná lymfopenie důvodem
k vysazení léku v 0,4 % případů [25].
V klinických studiích bylo sice popsáno, že počet lymfocytů
se do tří měsíců obnoví u většiny pacientů na 80 %
výchozí hodnoty [27],
u části nemocných léčených fingolimodem však může být
problémem protrahovaná lymfopenie, která přetrvává i déle
po vysazení léku [28]
a může zapříčinit, že se oddálí zahájení jiné chorobu
modifikující terapie (disease modifying therapy, DMT).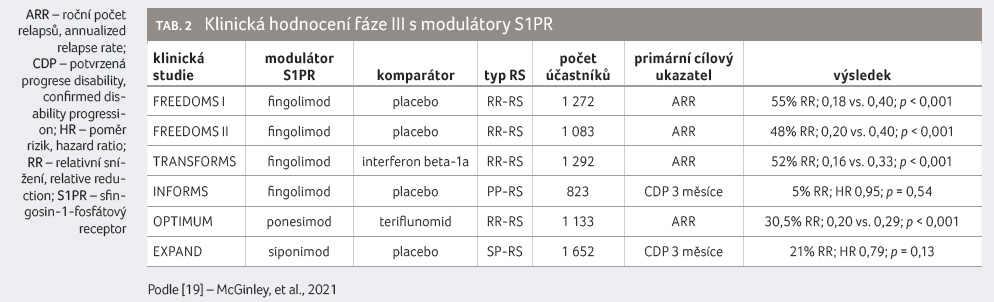
Infekce
Ze závažných infekcí byla při léčbě fingolimodem popsána dvě úmrtí na herpetické infekce (pacienti léčení 1,25 mg fingolimodu denně s recentní anamnézou léčby kortikoidy). K roku 2020 bylo od schválení fingolimodu zaznamenáno 36 potvrzených případů PML z více než 746 700 léčených pacientů. V analýze nemocných bez anamnézy léčby natalizumabem v posledních šesti měsících bylo odhadované riziko 0,069/1 000 pacientů. U žádného z pacientů s PML se nevyskytovala těžká lymfopenie. Riziko rozvoje PML se zvyšuje s délkou expozice fingolimodu [29]. K únoru 2019 bylo hlášeno 46 případů kryptokokových infekcí, z nichž většina byla léčena dva a více let [23].
U siponimodu dosud nebyly hlášeny žádné případy PML ani fatálních herpetických infekcí, ale byl hlášen jeden případ zosterové meningitidy a jeden případ kryptokokové meningoencefalitidy [24].
Ovlivnění srdečního vedení
Předpokládaným mechanismem ovlivnění srdečního rytmu je přechodný antagonismus na S1PR1 v převodním systému myokardu.
U fingolimodu začíná pokles srdeční frekvence po první dávce během jedné hodiny a je nejvyšší během šesti hodin. Tento efekt po podání dávky přetrvává v následujících dnech, i když je obvykle mírnější a většinou odezní během týdnů. Při pokračujícím podávání se průměrná srdeční frekvence vrací k výchozím hodnotám do jednoho měsíce. S ohledem na riziko závažných poruch rytmu nebo významné bradykardie je fingolimod kontraindikován u pacientů se sinoatriálním srdečním blokem, symptomatickou bradykardií, rekurentní synkopou nebo srdeční zástavou v anamnéze a u pacientů s významným prodloužením QT intervalu (QTc > 470 ms u žen, resp. > 450 ms u mužů). Vzhledem k možnému aditivnímu účinku není doporučováno užívání fingolimodu spolu s léky snižujícími srdeční frekvenci (hlavně betablokátory, blokátory vápníkových kanálů, digoxin, anticholinesterázy) [30].
Při léčbě siponimodem při jeho pozvolné titraci začíná pokles srdeční frekvence po první titrační dávce během jedné hodiny. Při pokračování titrace pokles srdeční frekvence přetrvává v následujících dnech, přičemž maximálního poklesu vzhledem k výchozí hodnotě je dosaženo v pátém až šestém dni. Největší denní pokles po podání dávky v absolutním hodinovém průměru srdeční frekvence je pozorován první den, s tepovou frekvencí klesající v průměru o 5–6 tepů za minutu. Při pokračujícím podávání začíná srdeční frekvence stoupat po šestém dni a dosahuje úrovně placeba během 10 dnů od zahájení léčby. Zahájení léčby siponimodem bylo spojeno s přechodným zpomalením atrioventrikulárního vedení, které vykazovalo podobný časový průběh jako pozorovaný pokles srdeční frekvence během titrace dávky. Zpomalení atrioventrikulárního vedení se ve většině případů projevilo jako atrioventrikulární blokáda prvního stupně (prodloužený PR interval na elektrokardiogramu). V klinických studiích byly pozorovány atrioventrikulární blokády druhého stupně u méně než 1,7 % pacientů. Abnormality vedení byly typicky přechodné, asymptomatické, vymizely během 24 hodin a nevyžadovaly ukončení léčby. Podrobná QT studie neprokázala žádný významný přímý účinek na prodloužení QT intervalu. Při zahájení léčby siponimodem, který je pozvolna titrován, proto není nutná monitorace. Vzhledem k možnému aditivnímu účinku na pokles srdeční frekvence a nedostatku sledování u pacientů léčených současně siponimodem a léky s potenciálem snížení srdeční frekvence je možné uvažovat o léčbě siponimodem pouze tehdy, pokud očekávaný přínos převýší možná rizika [17].
Těhotenství a laktace
Modulátory S1PR jsou vzhledem k ovlivnění angiogeneze teratogenní u zvířat. Tato sledování potvrzuje zdokumentované dvojnástobné riziko rozvoje vrozených vývojových vad u dětí, jejichž matky užívaly fingolimod – ze 113 narozených dětí mělo 6,2 % významnou srdeční, renální nebo muskuloskeletální abnormitu. Vzhledem k jeho dlouhé eliminaci je doporučováno vysazení fingolimodu dva měsíce před otěhotněním [31]. Přerušení léčby fingolimodem může vést k reaktivaci onemocnění i v období početí nebo těhotenství [32], proto je management léčby u žen ve fertilním věku obtížný.
Pro siponimod zatím nejsou k dispozici údaje, ale pravděpodobně má podobné účinky, i když jeho kratší eliminační poločas umožňuje přerušení léčby 10 dní před početím [31].
Přenos fingolimodu i siponimodu jako malých molekul do mateřského mléka byl prokázán ve studiích na zvířatech. Byť nejsou data u lidí známa, užívání obou léků v období laktace se nedoporučuje.
Nádorová onemocnění
U léčených fingolimodem byl popsán vyšší výskyt bazocelulárního karcinomu – v dlouhodobém sledování 14 let se vyskytl u 0,9 % pacientů [25] a vyšší riziko vzniku bylo popsáno také u siponimodu [24]. Dle dat ze švédského registru mezi lety 2011–2017 bylo u fingolimodu hraničně významné zvýšené riziko rozvoje nádorového onemocnění (bez možnosti přiřazení konkrétního typu nádoru) [33].
Rizika změny DMT
Vysazení fingolimodu může mít za následek opětovný výskyt aktivity RS označovaný jako tzv. rebound fenomén. Udávaná frekvence tohoto fenoménu se v různých kohortách pohybuje od 4 % do 27 % [34], byť v některých případech může jít spíše o přetrvávající vysokou aktivitu RS a výskyt rebound fenoménu jako následku vysazení je popisován spíše na dolní hranici tohoto pásma [35], což naznačují i pozorování ze studie FREEDOMS II. Rychlý návrat lymfocytů do CNS po vysazení léku byl hypoteticky považován za vysvětlení rebound fenoménu. Lze předpokládat, že tento jev není způsoben pouze repopulací periferních lymfocytů, protože byl zaznamenán i v případě, kdy počet lymfocytů v periferní krvi zůstal snížený [36]. Při stoupajícím počtu lymfocytů se ale zvyšuje riziko aktivity nemoci – při zvýšení počtu lymfocytů nad 800/mm3 riziko stoupá až dvojnásobně [37], i když není plně objasněna míra vlivu lymfopenie, resp. časového intervalu od vysazení. Dalším možným mechanismem je nadměrná exprese S1PR1 na astrocytech a následná aktivace nukleárního faktoru kappa B s uvolněním zánětlivých cytokinů a oxidu dusnatého, která byla popsána v histopatologickém nálezu jednoho pacienta [38]. K rebound fenoménu dochází obvykle za 3–16 týdnů po ukončení podávání fingolimodu, což je v souladu s průměrným eliminačním poločasem fingolimodu 6–9 dní s normalizací počtu lymfocytů po 1–2 měsících [39]. Kromě tumoriformních demyelinizačních lézí jako důsledku rebound fenoménu byly kazuisticky popsány i uvedené léze vzniklé po nasazení fingolimodu [40]. U siponimodu byl v době přípravy článku publikován jeden případ výrazné MR aktivity po přerušení léčby tímto přípravkem a normalizace počtu lymfocytů u pacientky s aktivní RS [41]. Zda nízký výskyt tohoto fenoménu u pacientů léčených siponimodem souvisí s častější nižší zánětlivou aktivitou, farmakologickými vlastnostmi léku, či se zatím kratší dobou sledování, je otázkou dalších studií.
Vzhledem k účinnosti siponimodu na aktivní formy RS je dle průběžných výsledků probíhající klinické studie EXCHANGE bezpečné přejít na léčbu siponimodem, a to bez nutnosti tzv. wash out periody. Tato průběžná analýza zahrnovala údaje od 112 pacientů ve věku 18–65 let s RR RS (n = 83), SP RS (n = 24) i PP RS (n = 4). Celkem 42 % účastníků mělo v předchozích 12 měsících jeden nebo více relapsů onemocnění. Nejčastěji užívaným DMT byl fingolimod, následovaný glatiramer acetátem, dimetylfumarátem, interferonem a teriflunomidem (u kterého pacienti podstoupili jeho zrychlenou eliminaci). Závažný nežádoucí účinek související s léčbou hlásilo 4,5 % pacientů (astenie, relaps RS, nekardiální bolest na hrudi, pneumonie, záchvat a tubulointersticiální nefritida) a 5,4 % mělo jeden nebo více nežádoucích účinků, které vedly k přerušení léčby (abnormální chování, kognitivní porucha, periferní edém, únava, nespavost, nevolnost, bolest končetin, třes a zvracení) [42]. Ačkoliv se tedy zdá přechod na léčbu siponimodem u většiny pacientů bezpečný, byla popsána i kazuistika těžkého relapsu po změně z fingolimodu na siponimod [43] a v případě klinické aktivity po změně léčby je nutné brát v potaz i tuto možnost.
Seznam použité literatury
- [1] Chun J, Giovannoni G, Hunter SF. Sphingosine 1‑phosphate Receptor Modulator Therapy for Multiple Sclerosis: Differential Downstream Receptor Signalling and Clinical Profile Effects. Drugs 2021; 81: 207–231.
- [2] Mehling M, Johnson TA, Antel J, et al. Clinical immunology of the sphingosine 1‑phosphate receptor modulator fingolimod (FTY720) in multiple sclerosis. Neurology 2011; 76: S20–S27.
- [3] Choi JW, Gardell SE, Herr DR, et al. FTY720 (fingolimod) efficacy in an animal model of multiple sclerosis requires astrocyte sphingosine 1‑phosphate receptor 1 (S1P1) modulation. Proc Natl Acad Sci U. S. A. 2011; 108: 751–756.
- [4] Kipp M. Does Siponimod Exert Direct Effects in the Central Nervous System? Cells 2020; 9: 1771.
- [5] Roggeri A, Schepers M, Tiane A, et al. Sphingosine‑1‑Phosphate Receptor Modulators and Oligodendroglial Cells: Beyond Immunomodulation. Int J Mol Sci 2020; 21: 7537.
- [6] Gergely P, Nuesslein‑Hildesheim B, Guerini D, et al. The selective sphingosine 1‑phosphate receptor modulator BAF312 redirects lymphocyte distribution and has species‑specific effects on heart rate. Br J Pharmacol 2012; 167: 1035–1047.
- [7] Fischer I, Alliod C, Martinier N, et al. Sphingosine kinase 1 and sphingosine 1‑phosphate receptor 3 are functionally upregulated on astrocytes under pro‑inflammatory conditions. PLoS One 2011; 6: e23905.
- [8] Jongsma M, van Unen J, van Loenen PB, et al. Different response patterns of several ligands at the sphingosine‑1‑phosphate receptor subtype 3 (S1P(3). Br J Pharmacol 2009; 156: 1305–1311.
- [9] Han S, Zhang X, Wang G, et al. FTY720 suppresses humoral immunity by inhibiting germinal center reaction. Blood 2004; 104: 4129–4133.
- [10] Mehling M, Brinkmann V, Antel J, et al. FTY720 therapy exerts differential effects on T cell subsets in multiple sclerosis. Neurology 2008; 71: 1261–1267.
- [11] Pham THM, Okada T, Matloubian M, et al. S1P1 receptor signaling overrides retention mediated by G alpha i‑coupled receptors to promote T cell egress. Immunity 2008; 28: 122–133.
- [12] Comi G, Hartung H‑P, Bakshi R, et al. Benefit–Risk Profile of Sphingosine‑1‑Phosphate Receptor Modulators in Relapsing and Secondary Progressive Multiple Sclerosis. Drugs 2017; 77: 1755–1768.
- [13] Groves A, Kihara Y, Chun J. Fingolimod: direct CNS effects of sphingosine 1‑phosphate (S1P) receptor modulation and implications in multiple sclerosis therapy. J Neurol Sci 2013; 328: 9–18.
- [14] Camm J, Hla T, Bakshi R, Brinkmann V. Cardiac and vascular effects of fingolimod: mechanistic basis and clinical implications. Am Heart J 2014; 168: 632–644.
- [15] Lindå H, von Heijne A. A case of posterior reversible encephalopathy syndrome associated with gilenya(®) (fingolimod) treatment for multiple sclerosis. Front Neurol 2015; 6: 39.
- [16] Kappos L, Cohen J, Collins W, et al. Fingolimod in relapsing multiple sclerosis: An integrated analysis of safety findings. Mult Scler Relat Disord 2014; 3: 494–504.
- [17] SPC Mayzent. Dostupné na: https://www.ema.europa.eu/en/docu-
- [18] Cuzzocrea S, Doyle T, Campolo M, et al. Sphingosine 1‑Phosphate Receptor Subtype 1 as a Therapeutic Target for Brain Trauma. J Neurotrauma 2018; 35: 1452–1466.
- [19] McGinley MP, Cohen JA. Sphingosin‑1‑phosphate receptor modulators in multiple sclerosis and other conditions. Lancet 2021; 398: P1184–1194.
- [20] Lublin F, Miller DH, Freedman MS, et al. Oral fingolimod in primary progressive multiple sclerosis (INFORMS): a phase 3, randomised, double‑blind, placebo‑controlled trial. Lancet 2016; 387: 1075–1084.
- [21] De Stefano N, Silva DG, Barnett MH. Effect of Fingolimod on Brain Volume Loss in Patients with Multiple Sclerosis. CNS Drugs 2017; 31: 289–305.
- [22] Kappos L, Bar‑Or A, Cree BAC, et al. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double‑blind, randomised, phase 3 study. Lancet 2018; 391: 1263–1273.
- [23] Data on file. GILENYA exposure. August 2020 cutoff. Novartis Pharmaceuticals Corp; November 2020. Dostupné na: https://www.gilenyahcp.com
- [24] Cree BAC, Arnold DL, Fox RJ, et al. Long‑term efficacy and safety of siponimod in patients with secondary progressive multiple sclerosis: Analysis of EXPAND core and extension data up to > 5 years. Mult Scler 2022; 28: 1591–1605.
- [25] Cohen JA, Tenenbaum N, Bhatt A, et al. Extended treatment with fingolimod for relapsing multiple sclerosis: the 14‑year LONGTERMS study results. Ther Adv Neurol Disord 2019; 12: 1756286419878324.
- [26] Boffa G, Bruschi N, Cellerino M, et al. Fingolimod and Dimethyl‑Fumarate‑Derived Lymphopenia is not Associated with Short‑Term Treatment Response and Risk of Infections in a Real‑Life MS Population. CNS Drugs 2020; 34: 425–432.
- [27] Francis G, Kappos L, O’Connor P, et al. Temporal profile of lymphocyte counts and relationship with infections with fingolimod therapy. Mult Scler 2014; 20: 471–480.
- [28] Nagy S, Kuhle J, Derfuss T. Lymphocyte recovery after fingolimod discontinuation in patients with MS. Neurol Neuroimmunol Neuroinflamm 2020; 7: e874.
- [29] Berger JR, Cree BA, Greenberg B, et al. Progressive multifocal leukoencephalopathy after fingolimod treatment. Neurology 2018; 90: e1815–e1821.
- [30] SPC Gilenya. Dostupné na: https://www.ema.europa.eu/en/docu-
- [31] Krysko KM, Bove R, Dobson R, et al. Treatment of Women with Multiple Sclerosis Planning Pregnancy. Curr Treat Options Neurol 2021; 23: 11.
- [32] Alroughani R, Alowayesh MS, Ahmed SF, et al. Relapse occurrence in women with multiple sclerosis during pregnancy in the new treatment era. Neurology 2018; 90: e840–e846.
- [33] Alping P, Askling J, Burman J, et al. Cancer Risk for Fingolimod, Natalizumab, and Rituximab in Multiple Sclerosis Patients. Ann Neurol 2020; 87: 688–699.
- [34] Nygaard GO, Torgauten H, Skattebøl L, et al. Risk of fingolimod rebound after switching to cladribine or rituximab in multiple sclerosis. Mult Scler Relat Disord 2022; 62: 103812.
- [35] Frau J, Sormani MP, Signori A, et al. Clinical activity after fingolimod cessation: disease reactivation or rebound? Eur J Neurol 2018; 25: 1270–1275.
- [36] Hatcher SE, Waubant E, Nourbakhsh B, et al. Rebound Syndrome in Patients With Multiple Sclerosis After Cessation of Fingolimod Treatment. JAMA Neurol 2016; 73: 790–794.
- [37] Giovannoni G. Lymphopaenia – What is a safe lymphocyte count? 2020. Dostupné na: https://neurologyacademy.org/events/webinar/live‑webinar‑lymphopaenia‑what‑is‑a‑safe‑lymphocyte‑count
- [38] Giordana MT, Cavalla P, Uccelli A, et al. Overexpression of sphingosine‑1‑phosphate receptors on reactive astrocytes drives neuropathology of multiple sclerosis rebound after fingolimod discontinuation. Mult Scler 2018; 24: 1133–1137.
- [39] Giovannoni G, Hawkes C, Waubant E, Lublin F. The “Field Hypothesis”: rebound activity after stopping disease‑modifying therapies. Mult Scler Relat Disord 2017; 15: A1–A2.
- [40] Pilz G, Harrer A, Wipfler P, et al. Tumefactive MS lesions under fingolimod: a case report and literature review. Neurology 2013; 81: 1654–1658.
- [41] Litwin T, Smoliński Ł, Członkowka A. Substantial disease exacerbation in a patient with relapsing‑remitting multiple sclerosis after withdrawal from siponimod. Neurol Neurochir Pol 2018; 52: 98–101.
- [42] Bigica A. Switch to Siponimod Safe, Tolerable With No Washout, Study Finds. Neurology Live, April 18, 2021. Dostupné na: https://www.neurologylive.com/view/switch‑to‑siponimod‑safe‑tolerable‑no‑washout‑exchange‑clinical‑trial
- [43] Senzaki K, Ochi H, Ochi M, et al. Disease reactivation in a patient with secondary progressive multiple sclerosis after switching treatment from fingolimod to siponimod. eNeurologicalSci 2021; 23: 100346.