Olaratumab v léčbě pokročilého sarkomu měkkých tkání
Souhrn:
Sarkomy měkkých tkání jsou heterogenní skupinou vzácných nádorů. Prognóza pokročilých stadií i relabujících onemocnění je velmi nepříznivá. Nově registrovaný přípravek olaratumab nabízí po dlouhých desetiletích možnost zlepšení výsledků paliativní léčby. V Evropské unii byl podmíněně registrován a schválen se statutem tzv. orphan drug již na základě výsledků studie fáze II v léčbě pacientů s pokročilými nebo metastatickými sarkomy, kde není možná kurativní terapie lokální. Jde o první biologickou léčbu, která v kombinaci s chemoterapií doxorubicinem prodloužila medián celkového přežití o 11,8 měsíce oproti doxorubicinu samotnému jako terapii standardní. Sdělení informuje o výsledcích registrační studie fáze II a o možnostech využití olaratumabu v klinické praxi.
Key words: soft tissue sarcomas – systemic therapy – targeted therapy – olaratumab.
Summary:
Soft tissue sarcomas represent a heterogenous group of rare malignancies. Prognosis of advanced and relapsed disease is very poor. After long decades, olaratumab that has recently been approved as a new drug, offering improvements in palliative treatment. Based on the results of phase 2 study, olaratumab has already been conditionally registered and approved in the EU as an orphan drug in the treatment of patients with advanced or metastatic soft tissue sarcomas that cannot be treated with local curative therapy. In combination with doxorubicin chemotherapy, olaratumab represents the first biological drug that achieved significant prolongation of median overall survival by 11.8 months compared to current standard‑of‑care represented by doxorubicin monotherapy. The article provides a brief description of registrational phase 2 trial outcomes and informs about the use of olaratumab in clinical practice.
Úvod
Sarkomy měkkých tkání (soft tissue sarcomas, STS) představují skupinu velmi různorodých vzácných nádorů vycházejících z mezenchymálních buněk, které se za normálních okolností diferencují ve svalovou nebo tukovou tkáň, vazivo, kost nebo chrupavku [1]. Vyskytují se napříč všemi věkovými skupinami. Incidence se na území Evropské unie pohybuje kolem 4–5 nových případů na 100 000 obyvatel ročně [2]. V posledním dostupném pětiletém období (2008–2012) činí roční incidence sarkomů měkkých tkání v České republice 442 nově diagnostikovaných případů [3,4]. Vyrůstat mohou kdekoliv, nejčastěji jsou diagnostikovány v oblasti končetin, končetinových pletenců a dutiny břišní.
Pětileté přežití se u dospělých pacientů se STS pohybuje kolem 62 % [3,4] v závislosti na stupni mitotické aktivity, velikosti, hloubce, lokalizaci a histologickém typu. Asi 15 % pacientů má detekovány vzdálené metastázy v době stanovení diagnózy, pětileté přežití těchto nemocných se pohybuje kolem 16 %. I přes optimální multimodální terapii vzniká u 10‒50 % pacientů lokální recidiva. U téměř poloviny nemocných dochází k rozvoji metastatické nemoci do pěti let od stanovení diagnózy [5]. Pokročilá stadia STS se historicky vyznačují špatnou prognózou s mediánem délky celkového přežití (overall survival, OS) 12‒16 měsíců a četností dvouletého přežití u metastatického onemocnění okolo 30 % [6,7]. Od sedmdesátých let minulého století nebyl zaznamenán žádný pokrok v iniciální léčbě pokročilých STS, který by vedl k prodloužení OS. Standardem systémové léčby v první linii je již 40 let pro většinu pacientů monoterapie doxorubicinem [6,8]. Kombinační režimy chemoterapie ve srovnání s monoterapií nezaznamenaly přínos v délce přežití, pouze navýšení toxicity [6,8].
Mechanismus účinku
Buněčná signální dráha
zprostředkovaná růstovým faktorem odvozeným z trombocytů
(platelet derived growth factor, PDGF) a příslušnými
receptory (PDGFR) hraje důležitou roli v biologii pojivové
tkáně, včetně diferenciace a růstu mezenchymálních
kmenových buněk a procesů angiogeneze. Aberantní signalizace
na drahách PDGF–PDGFR může modulovat nádorové
mikroprostředí, ovlivňovat růst nádorů a zvyšovat
schopnost metastazování u mnoha typů nádoru včetně STS
(obr. 1) [9].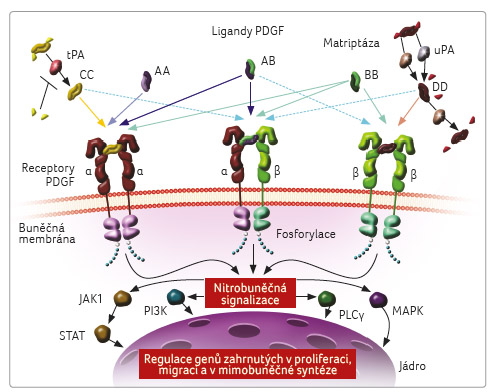
Olaratumab je plně humánní IgG1 monoklonální protilátka, antagonista receptoru alfa růstového faktoru odvozeného z trombocytů (PDGFRα) exprimovaného na nádorových a stromálních buňkách, která se specificky váže na PDGFRα a v podmínkách in vitro inhibuje signalizaci prostřednictvím dráhy PDGFRα v nádorových a stromálních buňkách (obr. 2) [10].
Klinické studie
Olaratumab (přípravek LartruvoTM) byl
v závěru minulého roku na základě výsledků studie
fáze Ib/II zrychlenou procedurou podmínečně
registrován jako tzv. breakthrough therapy Úřadem
pro kontrolu potravin a léčiv (Food and Drug
Administration, FDA) ve Spojených státech amerických
a následně v listopadu 2016, taktéž zrychlenou
procedurou, podmínečně registrován pro systémovou léčbu
pokročilého sarkomu měkkých tkání i Evropskou lékovou
agenturou (European Medicines Agency, EMA) v členských státech
Evropské unie. Podmínečná 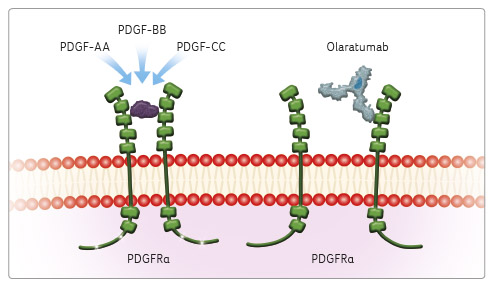 registrace je platná po dobu 12
měsíců při splnění podmínek dalšího ověření
bezpečnosti/účinnosti přípravku a je vázána na každoroční
přezkoumání. V současnosti probíhá studie fáze III,
do níž byl příjem pacientů již ukončen a jejíž
první výsledky je možné očekávat nejdříve v roce 2019.
Probíhají studie fáze II s dalšími cytostatiky, dokončuje
se příprava studie s přidáním olaratumabu
k radioterapii.
registrace je platná po dobu 12
měsíců při splnění podmínek dalšího ověření
bezpečnosti/účinnosti přípravku a je vázána na každoroční
přezkoumání. V současnosti probíhá studie fáze III,
do níž byl příjem pacientů již ukončen a jejíž
první výsledky je možné očekávat nejdříve v roce 2019.
Probíhají studie fáze II s dalšími cytostatiky, dokončuje
se příprava studie s přidáním olaratumabu
k radioterapii.
Do uvedené registrační studie fáze II (NCT01185964) bylo zařazeno 133 dospělých pacientů s pokročilým inoperabilním metastatickým sarkomem měkkých tkání a s výkonnostním stavem 0‒2 podle škály ECOG (Eastern Cooperative Oncology Group), kteří neměli kontraindikace pro léčbu antracykliny, ale dosud nebyli antracykliny léčeni. Přípustné bylo předléčení jakýmkoliv počtem režimů systémové terapie vyjma antracyklinů. Pacienti byli v poměru 1 : 1 randomizováni ke kombinované léčbě olaratumabem v dávce 15 mg/kg i.v. v den 1 a 8 každého třítýdenního cyklu a doxorubicinem v dávce 75 mg/m2 v den 1 každého třítýdenního cyklu nebo ke standardní léčbě monoterapií doxorubicinem ve výše uvedeném dávkovacím schématu, v obou ramenech až do osmi cyklů podané léčby (od 5. cyklu doxorubicinu pacienti dostávali dexrazoxan ke snížení rizika kardiotoxicity terapie). Pacienti v experimentálním rameni s kombinovanou léčbou pokračovali v případě dobré snášenlivosti terapie a absence progrese onemocnění po osmi cyklech léčby (popřípadě po dřívějším vysazení doxorubicinu) v monoterapii olaratumabem do progrese choroby nebo do výskytu neakceptovatelné toxicity. Pacienti v kontrolním rameni s monoterapií doxorubicinem měli možnost při progresi onemocnění po ukončení léčby doxorubicinem přejít na monoterapii olaratumabem do progrese choroby nebo do výskytu neakceptovatelné toxicity. Primárním cílovým ukazatelem v této studii fáze II bylo přežití bez progrese (progression free survival, PFS), s predefinovanou hladinou významnosti dvoustranné α 0,2 (udává pravděpodobnost statistické chyby). Sekundárními cílovými ukazateli byly OS, objektivní odpověď na léčbu (objective response rate, ORR), hodnocení bezpečnosti léčby a farmakokinetiky olaratumabu [9].
Pacienti ve studijní populaci měli střední hodnotu věku 58,5 roku v rameni s olaratumabem a doxorubicinem, resp. 58 let v rameni s monoterapií doxorubicinem, mírně převažovaly ženy (61 %, resp. 51 %), většina nemocných byla kavkazské rasy (83 %, resp. 90 %), výkonnostního stavu ECOG 0‒1 (94 % v každém rameni), skupina zahrnovala jak pacienty, kteří dosud nebyli léčeni pro pokročilé stadium onemocnění (41 %, resp. 46 %), tak již předléčené nemocné (59 %, resp. 54 %). Z histologických subtypů byl nejvíce zastoupen leiomyosarkom (36 % v rameni olaratumab/doxorubicin, resp. 40 % v rameni s monoterapií doxorubicinem), dále liposarkom (12 %, resp. 22 %) a pleiomorfní sarkom (15 %, resp. 21 %). Medián počtu podaných cyklů kombinace doxorubicin/olaratumab byl 7 (v rozmezí 1‒8) s dosaženým mediánem kumulativní dávky doxorubicinu 487,6 mg/m2. Medián podaných cyklů monoterapie doxorubicinem byl 4 (v rozmezí 1‒8) s mediánem kumulativní dávky 299,6 mg/m2. Celkem 34 z původních 64 pacientů léčených kombinačním režimem pokračovalo v další monoterapii olaratumabem do progrese nemoci nebo do výskytu neakceptovatelné toxicity, se středním počtem podaných cyklů 4,5 (v rozmezí 1‒34). Pacienti, kteří byli léčeni monoterapií doxorubicinem a po ukončení léčby při progresi akceptovali nabídku monoterapie olaratumabem (celkem 30 z původních 65 osob), obdrželi střední počet dvou cyklů (v rozmezí 0,5–40,5). Relativně vyšší počet nemocných v rameni s kombinací olaratumabu a doxorubicinu byl po ukončení studijní terapie léčen dalšími režimy chemoterapie (67 % vs. 49 %). Post hoc analýzy citlivosti v případě OS s ohledem na podávanou následnou léčbu (s cenzurováním dat při zahájení jakékoliv následné léčby a při zahájení vybrané následné léčby) však byly konzistentní s primární analýzou ve studii, ovlivnění výsledků hodnocení v parametru OS následnou terapií není tedy pravděpodobné [9].
Studie splnila primární cíl
a prokázala statisticky významné prodloužení PFS při léčbě
kombinací olaratumab/doxorubicin oproti monoterapii doxorubicinem.
Bylo dosaženo prodloužení mediánu PFS o 2,5 měsíce
(6,6 měsíce versus 4,1 měsíce; HR [poměr
rizik] 0,672; 95% CI [interval spolehlivosti] 0,442‒1,021;
p = 0,0615)
a pozorovaný efekt byl potvrzen konzistentními výsledky
zaslepené nezávislé, retrospektivní kontrolní analýzy PFS
ve studii s dosažením téměř shodné hodnoty HR
ve srovnání s původním hodnocením zkoušejících
(8,2 měsíce versus 4,4 měsíce; HR 0,670; 95% CI
0,40‒1,12; p = 0,1208).
U kombinačního režimu bylo oproti monoterapii doxorubicinem
dosaženo numericky, nikoliv však statisticky významně vyšší
četnosti ORR (18,2 % [95% CI 9,8‒29,6] vs. 11,9 %
[95% CI 5,2‒22,0]; p = 0,3421).
Nejzajímavějším výsledkem sledování však bylo dosažení
vysoce statisticky i klinicky významného prodloužení OS
v případě kombinačního režimu olaratumab/doxorubicin
oproti monoterapii doxorubicinem. Při kombinované léčbě
s olaratumabem bylo dosaženo prodloužení délky střední
doby OS o 80 %, což v léčené populaci představovalo
téměř jeden rok (26,5 měsíce vs. 14,7 měsíce) a zajistilo
pacientům v tomto rameni studie střední dobu OS přesahující
dva roky. Kombinovaná léčba též vedla k více než 53%
redukci relativního rizika úmrtí oproti standardní léčbě
monoterapií doxorubicinem (HR 0,463; 95% CI 0,301‒0,710;
p = 0,0003)
(graf 1). Přínos
prodloužení doby OS byl dle předem plánované podskupinové
analýzy konzistentní napříč analyzovanými podskupinami, mj.
s ohledem na pozitivitu, resp. negativitu
imunohistochemické exprese PDGFRα, na počet předchozích
linií léčby (0 vs. ≥ 1), histologický subtyp
leiomyosarkom vs. ostatní subtypy nebo na hodnotu výkonnostního
stavu dle škály ECOG 0 vs. 1 [9].![doxoGRAF 1 kaplanovy–Meierovy křivky celkového přežití pro olaratumab/doxorubicin (výzkumné rameno) oproti doxorubicinu v monoterapii (kontrolní rameno); podle [9] – Tap, et al., 2016. Ci – interval spolehlivosti, confi dence interval; hr – poměr rizik, hazard ratio; p – pravděpodobnost](https://www.remedia.cz/photo-a-31220---.jpg)
Přidání olaratumabu k doxorubicinu
vedlo ve studii ve srovnání s monoterapií
doxorubicinem ke zvýšení hematologické toxicity, včetně
neutropenie stupně ≥ 3 (53 % vs. 23 %), avšak bez
nárůstu výskytu febrilní neutropenie (12,6 % vs. 14 %) nebo
infekcí (8 % vs. 11 %) a k mírnému nárůstu výskytu
některých nehematologických toxicit, především stupně
závažnosti 1 a 2. Přehled vybraných nežádoucích účinků
ve studii shrnuje tabulka 1.
Přidání olaratumabu k doxorubicinu nevedlo i přes delší
expozici léčbě a navzdory dosažení vyšší kumulativní
dávky doxorubicinu (při použití dexrazoxanu od 5. cyklu
léčby) k významnému zvýšení výskytu srdeční dysfunkce
ve srovnání s monoterapií 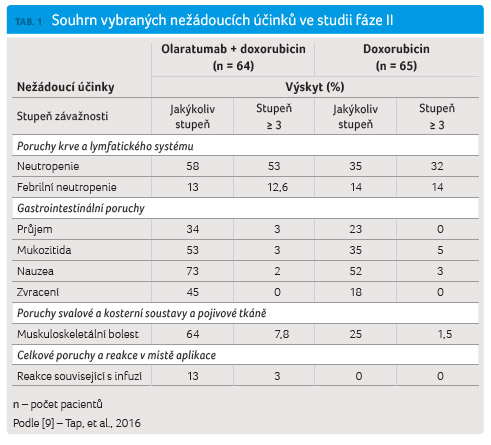 doxorubicinem (8 % vs. 6 %,
vyjma periferních otoků). V kombinačním režimu
doxorubicin/olaratumab přerušilo kvůli nežádoucím účinkům
léčbu méně pacientů než při užívání monoterapie
doxorubicinem (13 % versus 18 %). Nejčastější nežádoucí
příhodou vedoucí k ukončení terapie doxorubicinem bylo
snížení ejekční frakce levé srdeční komory, a to u tří
(5 %) ze 64 pacientů v kombinačním režimu
olaratumab/doxorubicin a u čtyř (6 %) z 64
pacientů užívajících monoterapii doxorubicinem. Nejčastější
nežádoucí příhodou vedoucí k ukončení léčby
olaratumabem byla reakce související s infuzí u dvou
(3 %) ze 64 pacientů [9].
doxorubicinem (8 % vs. 6 %,
vyjma periferních otoků). V kombinačním režimu
doxorubicin/olaratumab přerušilo kvůli nežádoucím účinkům
léčbu méně pacientů než při užívání monoterapie
doxorubicinem (13 % versus 18 %). Nejčastější nežádoucí
příhodou vedoucí k ukončení terapie doxorubicinem bylo
snížení ejekční frakce levé srdeční komory, a to u tří
(5 %) ze 64 pacientů v kombinačním režimu
olaratumab/doxorubicin a u čtyř (6 %) z 64
pacientů užívajících monoterapii doxorubicinem. Nejčastější
nežádoucí příhodou vedoucí k ukončení léčby
olaratumabem byla reakce související s infuzí u dvou
(3 %) ze 64 pacientů [9].
Vedle splnění primárního cílového ukazatele dosáhl navíc olaratumab přidaný k doxorubicinu ve srovnání s monoterapií doxorubicinem statisticky významného zlepšení střední doby OS bez zvýšení závažné toxicity léčby. Navzdory vyšší kumulativní dávce doxorubicinu v kombinačním rameni terapie měly olaratumab s doxorubicinem akceptovatelný a monitorovatelný bezpečnostní profil, včetně kardiovaskulární bezpečnosti.
Aktuální situace
V zemích Evropské unie včetně České republiky je olaratumab v kombinaci s doxorubicinem registrován a schválen k léčbě dospělých pacientů s pokročilým sarkomem měkkých tkání, kteří nemohou podstoupit kurativní léčbu operací nebo radioterapií a nebyli dříve léčeni doxorubicinem. Jedinou kontraindikací terapie je přecitlivělost na léčivou látku nebo na pomocné látky přípravku. Doporučená dávka olaratumabu je 15 mg/kg podávaná intravenózní infuzí ve dnech 1 a 8 každého třítýdenního cyklu do progrese onemocnění nebo do výskytu nepřijatelné toxicity. Přípravek je možné podávat v kombinaci s doxorubicinem po dobu 6‒8 léčebných cyklů, resp. do bezpečné kumulativní dávky antracyklinu dle aktuálního stavu srdečního svalu. Pacienti, u nichž nebyla zaznamenána progrese nemoci, poté mohou pokračovat v monoterapii olaratumabem. Ve dnech 1 a 8 prvního cyklu je žádoucí všem pacientům 30–60 minut před infuzí olaratumabu podat intravenózně premedikaci antagonistou H1 receptorů a dexametazonem (či ekvivalentními přípravky). V dalších cyklech je žádoucí 30–60 minut před každou infuzí podat intravenózně premedikaci antagonistou H1 receptorů, během podávání je nutné monitorovat u pacientů výskyt příznaků reakcí souvisejících s infuzí. Před podáním olaratumabu v den 1 a den 8 každého cyklu je nutné zkontrolovat počet neutrofilů a krevních destiček. V průběhu léčby olaratumabem a doxorubicinem je počet neutrofilů monitorován a dle místních zvyklostí pracoviště má být podávána podpůrná terapie v podobě antibiotik nebo růstových faktorů. Pro minimalizaci kardiotoxicity související s doxorubicinem je nutno u všech pacientů před začátkem a v průběhu celé léčby zvážit a plánovat použití vhodných kardioprotektivních opatření. Sledování možné kardiotoxicity je samozřejmostí [10].
Olaratumab je dostupný v České republice od dubna 2017. O jeho úhradě z prostředků veřejného zdravotního pojištění dosud nebylo rozhodnuto. Kombinační režim je již součástí léčebných doporučení evropských, amerických i národních [10‒13].
Závěr
Kombinace olaratumab/doxorubicin je první systémovou terapií pokročilého sarkomu měkkých tkání, u níž bylo zaznamenáno v registrační studii významné prodloužení celkového přežití léčených pacientů oproti již 40 let používanému a stále platnému standardu léčby, kterým je monoterapie doxorubicinem. Rozdíly v celkovém přežití jsou natolik dramatické, že s napětím očekáváme výsledky probíhající fáze III klinického hodnocení. Než však budou tyto výsledky k dispozici, mohou mít celosvětově stovky či tisíce pacientů z této nové léčby prospěch. Kombinační režim tak představuje novou naději pro nemocné s tímto obtížně léčitelným onemocněním. Budou li výsledky registrační studie potvrzeny, pak se může stát v nejbližších letech novým zlatým standardem iniciální léčby pokročilých sarkomů měkkých tkání.
Seznam použité literatury
- [1] Fletcher CDM, Bridge JA, Hogendoorn PCW, et al. World Health Organization classification of tumours of soft tissue and bone, 4. vyd. Lyon: IARC Press, 2013, 468 s.
- [2] Stiller CA, Trama A, Serraino D, et al, for the RARECARE Working Group. Descriptive epidemiology of sarcomas in Europe: report from the RARECARE project. Eur J Cancer 2013; 49: 684–695.
- [3] Ústav zdravotnických informací a statistik ČR, Národní onkologický registr (NOR). Dostupné na: http://www.uzis.cz/registry‑nzis/nor [navštíveno 16. 6. 2017]
- [4] Mužík J, Uher M, Malúšková D, et al. Přehled epidemiologie zhoubných nádorů měkkých tkání z dat Národního onkologického registru. Ortopedie 2016; 11: 65–68.
- [5] Italiano A, Mathoulin‑Pelissier S, Cesne A, et al. Trends in survival for patients with metastatic soft‑tissue sarcoma. Cancer 2011; 117: 1049–1054.
- [6] Judson I, Verweij J, Gelderblom H, et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first‑line treatment of advanced or metastatic soft tissue sarcoma: a randomised controlled phase 3 trial. Lancet Oncol 2014; 15: 415–423.
- [7] Ryan CW, Schoffski P, Merimsky O, et al. PICASSO 3: a phase 3 international randomized double blind placebo‑controlled study of doxorubicin plus palifosfamide vs. doxorubicin plus placebo for patients in first‑line for metastatic soft tissue sarcoma. Eur J Cancer 2013; 49 (Suppl 2): S876 (Abstr 3802).
- [8] Ravi V, Patel S, Benjamin RS. Chemotherapy for Soft‑Tissue Sarcomas. Oncology (Williston Park) 2015; 29: 43–50. Dostupné na: http://www.cancernetwork.com/oncology‑journal/chemotherapy‑soft‑tissue‑sarcomas
- [9] Tap WD, Jones RL, Van Tine BA, et al. Olaratumab and doxorubicin versus doxorubicin alone for treatment of soft‑tissue sarcoma: an open‑label phase 1b and randomised phase 2 trial. Lancet 2016; 338: 488–497.
- [10] Lartruvo (olaratumab). Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv, listopad 2016. Dostupné na: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/004216/human_med_002036.jsp&mid= WC0b01ac058001d124
- [11] http://www.esmo.org/Guidelines/Sarcoma‑and‑GIST/Soft‑Tissue‑and‑Visceral‑Sarcomas/eUpdate‑Treatment‑Recommendations [navštíveno 16. 6. 2017]
- [12] NCCN Clinical Practice Guidelines in Oncology, verze 1.2017, Soft Tissue Sarcoma. Dostupné na: https://www.nccn.org/professionals/physician_gls/pdf/sarcoma.pdf [navštíveno 16. 6. 2017]
- [13] Zhoubný novotvar měkkých tkání (C36, C38, C47–49). Modrá kniha České onkologické společnosti ČLS JEP. Dostupné na: http://www.linkos.cz/informace‑pro‑praxi/modra‑kniha/9‑zhoubny‑novotvar‑mekkych‑tkani‑c36‑c38‑47‑49/ [navštíveno 16. 6. 2017]