Optimální léčba chronické HCV infekce s použitím přímo působících virostatik
V posledních dvou letech nastala významná změna v možnostech léčby chronické virové hepatitidy C. Kombinace pegylovaných interferonů a ribavirinu je v případech opakovaně léčených osob postupně nahrazována trojkombinací pegylovaného interferonu, ribavirinu a bocepreviru či telapreviru. Tyto dvě nové látky patří do skupiny tzv. přímo působících virostatik, která přímo inhibují replikační enzymy viru hepatitidy C. Trojkombinace znamená významné zvýšení účinnosti protivirové léčby. Prakticky ve všech podskupinách pacientů s chronickou HCV (hepatitis C virus) infekcí dochází ke zvýšení účinnosti léčby o zhruba 20 % (hodnoceno pomocí setrvalé virologické odpovědi). V přehledovém článku se věnujeme skutečnostem a studiím, které byly publikovány v období po zveřejnění výsledků registračních studií obou zmíněných virostatik. Nastíněny jsou i možnosti a zásady správného výběru pacientů indikovaných k zahájení trojkombinační léčby s ohledem na aktuální doporučené postupy.
Úvod
V posledních přibližně deseti letech byla standardní terapie chronické infekce virem hepatitidy C (hepatitis C virus, HCV) založena na podání kombinace pegylovaných interferonů α (PEG-IFN) s ribavirinem (RBV) [1]. Délka léčby byla 48 týdnů v případech chronické HCV infekce vyvolané genotypem 1 a 24 týdnů v případech infekce vyvolané genotypy 2 a 3. Účinnost této kombinační terapie – hodnocená jako tzv. setrvalá virologická odpověď (SVR, viz tab. 1) – je  u genotypu 1 40–60 %, u genotypu 2 a 3 kolem 80 % [2, 3]. Pokroky na poli bazálního výzkumu HCV infekce, především charakterizace virových nestrukturálních proteinů, umožnily v posledních letech úspěšný a rychlý vývoj mnoha nízkomolekulárních látek, které se dnes označují jako přímo působící
u genotypu 1 40–60 %, u genotypu 2 a 3 kolem 80 % [2, 3]. Pokroky na poli bazálního výzkumu HCV infekce, především charakterizace virových nestrukturálních proteinů, umožnily v posledních letech úspěšný a rychlý vývoj mnoha nízkomolekulárních látek, které se dnes označují jako přímo působící 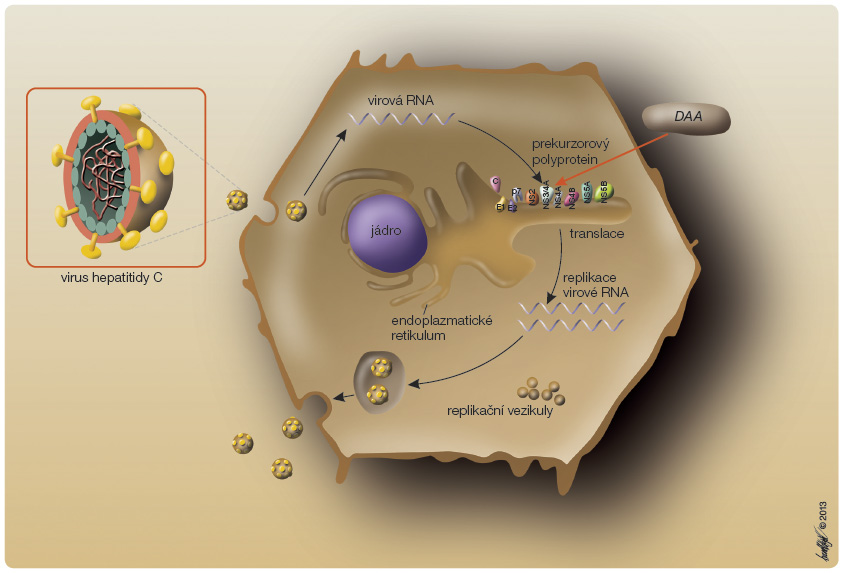
virostatika (DAA, directly acting antivirals), obr. 1. Všechny tyto látky mají velký potenciál zvýšit procento dosažené SVR, především u genotypu 1, a přitom zkrátit trvání protivirové léčby. Látek ze skupiny DAA je v současné době zkoušeno v různých fázích klinického vývoje několik desítek, a je proto velmi obtížné odhadnout, které z těchto molekul nebo možných režimů jejich podávání a vzájemných kombinací mají největší perspektivu.
V současnosti pronikly do léčby HCV infekce vyvolané genotypem 1 první dvě látky ze skupiny DAA, a sice boceprevir (BOC) a telaprevir (TPV). V roce 2011 jsme v publikovaném článku podrobně informovali o uspořádání a výsledcích jednotlivých registračních studií, na základě kterých byly tyto přípravky schváleny k užití v terapii chronické HCV infekce vyvolané genotypem 1 u pacientů v minulosti neúspěšně léčených i dosud neléčených [4]. V obou těchto základních indikacích se oba přípravky používají v kombinaci s PEG-IFN a RBV. České doporučené postupy pro diagnostiku a léčbu chronické HCV infekce [5] doporučují použití DAA v kombinaci s PEG-IFN a RBV jako postup volby pro pacienty v minulosti neúspěšně léčené. Této indikaci a posledním dostupným informacím získaným především podrobnými analýzami zmíněných registračních studií se proto budeme věnovat v následujícím textu.
V článku jsou opakovaně používány termíny převzaté z angličtiny, které v češtině neznějí nijak libozvučně (relapséři, non-respondéři). Nicméně jejich jednoduchý český překlad neexistuje a několikaslovné opisy způsobují, že výsledný text je prakticky nesrozumitelný a nejednoznačný. Za použití „nečeských“ termínů se omlouvám,
význam použitých termínů ukazuje v přehledu tab. 1.
Telaprevir
![Obr. 2 Design studie REALIZE; podle [6] – Zeuzem, et al., 2011. Pbo – placebo; PEG-IFN – pegylovaný interferon α; RBV – ribavirin; SVR – setrvalá virologická odpověď; TPV – telaprevir Léčebné režimy: PR48 – kontrolní větev: pegylovaný interferon α a ribavirin 48 týdnů léčby; LIT12/PR48 – lead-in fáze 4 týdny, následně 12 týdnů telaprevir, pegylovaný interferon α a ribavirin celkem 48 týdnů léčby; T12/PR48 – 12 týdnů telaprevir, pegylovaný interferon α a ribavirin 48 týdnů léčby.](https://www.remedia.cz/photo-a-29187---.jpg) Ve studii REALIZE [6] (obr. 2), která zkoumala úspěšnost léčby pomocí trojkombinace PEG-IFN + RBV + TPV u pacientů již v minulosti neúspěšně léčených, bylo SVR dosaženo v 65 % případů, v kontrolní větvi léčené standardní kombinací PEG-IFN + RBV pouze v 17 % případů. Kromě větve pacientů, kteří byli léčeni trojkombinací TPV + PEG-IFN + RBV od samého počátku léčby, a kromě komparativní větve pacientů léčených standardní dvojkombinací obsahovala studie i větev s tzv. lead-in fází, kdy byl TPV doplněn ke kombinaci PEG-IFN + RBV ve 4. týdnu a celková doba podávání trojkombinace byla 12 týdnů (tj. do 16. týdne od zahájení léčby). V žádném hodnoceném parametru nebylo dosaženo významného rozdílu mezi větví s lead-in fází a bez lead-in fáze. Na základě těchto výsledků je tedy TPV podáván v trojkombinaci od samého počátku léčby.
Ve studii REALIZE [6] (obr. 2), která zkoumala úspěšnost léčby pomocí trojkombinace PEG-IFN + RBV + TPV u pacientů již v minulosti neúspěšně léčených, bylo SVR dosaženo v 65 % případů, v kontrolní větvi léčené standardní kombinací PEG-IFN + RBV pouze v 17 % případů. Kromě větve pacientů, kteří byli léčeni trojkombinací TPV + PEG-IFN + RBV od samého počátku léčby, a kromě komparativní větve pacientů léčených standardní dvojkombinací obsahovala studie i větev s tzv. lead-in fází, kdy byl TPV doplněn ke kombinaci PEG-IFN + RBV ve 4. týdnu a celková doba podávání trojkombinace byla 12 týdnů (tj. do 16. týdne od zahájení léčby). V žádném hodnoceném parametru nebylo dosaženo významného rozdílu mezi větví s lead-in fází a bez lead-in fáze. Na základě těchto výsledků je tedy TPV podáván v trojkombinaci od samého počátku léčby.
![Graf 1 Výsledky studie REALIZE v jednotlivých podskupinách léčených osob; podle [23] – SPC Incivo, 2013. SVR – setrvalá virologická odpověď Léčebné režimy: PR48 – kontrolní větev: pegylovaný interferon α a ribavirin 48 týdnů léčby; LIT12/PR48 – lead-in fáze 4 týdny, následně 12 týdnů telaprevir, pegylovaný interferon α a ribavirin celkem 48 týdnů léčby; T12/PR48 – 12 týdnů telaprevir, pegylovaný interferon α a ribavirin 48 týdnů léčby.](https://www.remedia.cz/photo-a-29188---.jpg) Překvapivé nebylo ani zjištění, že nejvyšší procento dosažené SVR bylo doloženo ve skupině pacientů, u nichž došlo k relapsu onemocnění – tzv. relapsérů (86 %), a naopak nejméně účinná byla trojkombinace u pacientů, kteří neodpovídali na předchozí protivirovou léčbu – tzv. null-respondérů (31 %), graf 1. Poněkud překvapivě už ale vyznívá zjištění, že mezi relapséry nebyla jaterní cirhóza faktorem negativně asociovaným s léčebným účinkem trojkombinace. Avšak mezi pacienty s jaterní cirhózou, kteří odpovídali na léčbu jen částečně – tzv. parciálními respondéry, již byla dosažená SVR snížena na 34 % a mezi cirhotiky null-respondéry dokonce na 14 %. Podrobná analýza větve studie s lead-in fází poskytla také zajímavé údaje o významu poklesu viremie v těchto prvních čtyřech týdnech léčby (graf 2) [7]. Mezi relapséry byla SV
Překvapivé nebylo ani zjištění, že nejvyšší procento dosažené SVR bylo doloženo ve skupině pacientů, u nichž došlo k relapsu onemocnění – tzv. relapsérů (86 %), a naopak nejméně účinná byla trojkombinace u pacientů, kteří neodpovídali na předchozí protivirovou léčbu – tzv. null-respondérů (31 %), graf 1. Poněkud překvapivě už ale vyznívá zjištění, že mezi relapséry nebyla jaterní cirhóza faktorem negativně asociovaným s léčebným účinkem trojkombinace. Avšak mezi pacienty s jaterní cirhózou, kteří odpovídali na léčbu jen částečně – tzv. parciálními respondéry, již byla dosažená SVR snížena na 34 % a mezi cirhotiky null-respondéry dokonce na 14 %. Podrobná analýza větve studie s lead-in fází poskytla také zajímavé údaje o významu poklesu viremie v těchto prvních čtyřech týdnech léčby (graf 2) [7]. Mezi relapséry byla SV![Graf 2 Setrvalá virologická odpověď podle poklesu hodnot HCV RNA ve 4. týdnu proti- virové léčby – analýza větve lead-in; podle [24] – Zeuzem, et al., 2011. SVR – setrvalá virologická odpověď, HCV RNA – ribonukleová kyselina viru hepatitidy C](https://www.remedia.cz/photo-a-29189---.jpg) R 62 % u osob s poklesem viremie nižším než o 1 log10 ve 4. týdnu. U osob s poklesem větším než o 1 log10 byla SVR 94 %. Mezi parciálními respondéry dosahovala SVR hodnocená pomocí stejných kritérií 56 % a 50 %. Největší rozdíl byl ale zjištěn mezi null-respondéry – 15 % a 54 %.
R 62 % u osob s poklesem viremie nižším než o 1 log10 ve 4. týdnu. U osob s poklesem větším než o 1 log10 byla SVR 94 %. Mezi parciálními respondéry dosahovala SVR hodnocená pomocí stejných kritérií 56 % a 50 %. Největší rozdíl byl ale zjištěn mezi null-respondéry – 15 % a 54 %.
Pro TPV, stejně jako pro ostatní DAA, je podstatným rizikem jejich podávání možnost vzniku virologické rezistence. Rezistentní varianty viru jsou obvykle detekovatelné u pacientů se selháním léčby nebo s rozvojem tzv. virologického breakthrough fenoménu (viz tab. 1) během léčby s TPV/DAA. Z logických důvodů se proto dostala do popředí i otázka, jakým způsobem se budou tyto rezistentní varianty HCV chovat z dlouhodobého pohledu. Pokud by tyto rezistentní varianty dlouhodobě přetrvávaly a byly dominantními, mohly by teoreticky ohrožovat efekt dalších možných léčebných cyklů obsahujících inhibitory proteáz nebo možná i jiné třídy DAA.
K dlouhodobému sledování osob, které byly zařazeny do studií fáze II či III s TPV, byla zorganizována studie EXTEND, trvající tři roky. Tato studie prokázala, že dosažená SVR je po léčbě zahrnující DAA trvalá (99 %) a že během přibližně 25 měsíců dochází k opětovné dominanci tzv. divokých variant (wild type) HCV u pacientů, u kterých se vyvinula rezistentní populace HCV [8].
Celkem 117 osob, které byly v registračních studiích randomizovány do kontrolních větví k léčbě kombinací PEG-IFN + RBV a které nedosáhly tímto postupem SVR, bylo zařazeno do navazující studie uspořádané tak, aby bylo možno určit, zda existuje skupina osob, u níž by postačovala 24týdenní léčba. Výhodou této studie byla přesná metodika určení typu odpovědi na předchozí kombinaci PEG-IFN + RBV. Všechny osoby bez rozdílu byly léčeny 12 týdnů trojkombinací a dalších 12 týdnů kombinací PEG-IFN + RBV (týden 24 od zahájení léčby). V dalším období se už léčba lišila. Null-respondéři byli léčeni dvojkombinací PEG-IFN + RBV ještě dalších 24 týdnů, tj. do týdne 48 od zahájení léčby. Všichni ostatní pacienti byli rozděleni podle efektu léčby: osoby, které měly ve 4. a 12. týdnu negativní HCV RNA (ribonukleová kyselina viru), byly léčeny pouze 24 týdnů; osoby s pozitivním nálezem HCV RNA ve 4. nebo 12. týdnu byly léčeny až do týdne 48 (stejně jako null-respondéři). Při tomto léčebném schématu dosáhla SVR 37 % mezi null-respondéry, 55 % mezi parciálními respondéry, 75 % mezi osobami s breakthrough fenoménem a 97 % mezi relapséry. O výsledky této studie je tedy opřeno doporučení léčit pacienty bez jaterní cirhózy v případě dosažení tzv. eRVR (negativní HCV RNA ve 4. i 12. týdnu léčby) pouze 24 týdnů. Tento závěr nebylo možno učinit na základě výsledků studie REALIZE.
Jedním ze závažných nežádoucích účinků protivirové léčby v jakémkoli léčebném režimu je rozvoj anémie z multifaktoriálních příčin. Kombinuje se zde především myelosupresivní efekt PEG-IFN s hemolýzou vyvolanou kumulací RBV v erytrocytech. Výsledkem může být pokles hladiny hemoglobinu až pod 80 g/l a rozvoj symptomatické anémie. Onemocnění anémií patří mezi nejčastější příčiny redukce dávek jednotlivých přípravků. Nezřídka je i příčinou předčasného ukončení léčby. Relativně dobře lze řešit anémii podáním erytropoetinu, nicméně ve většině zemí není tento postup v běžné rutinní praxi akceptován. Stejně je tomu i v České republice. Z těchto důvodů je dlouhodobě diskutován problém, zda je možno redukovat denní dávku RBV proti doporučenému dávkování bez rizika snížení účinnosti celé protivirové kombinace, tj. bez snížení pravděpodobnosti dosažení SVR.
Vzhledem k tomu, že anémie patřila k nejčastějším NÚ i ve studiích s trojkombinací obsahující TPV (32 %), byla provedena řada analýz zaměřených tímto směrem [9]. Také v tomto ohledu se soustředíme na poznatky získané sledováním skupiny osob, které byly v minulosti již léčeny.
![Graf 3 Subanalýza studie REALIZE – redukce dávky ribavirinu nevede ke snížení účinnosti kombinované léčby s telaprevirem; podle [25] – Roberts, et al., 2011. RBV – ribavirin, SVR – setrvalá virologická odpověď, TPV – telaprevir](https://www.remedia.cz/photo-a-29190---.jpg) Základní srovnání účinnosti léčby (míra dosažení SVR) u pacientů léčených kombinací s TPV a standardní kombinací PEG-IFN + RBV s redukcí RBV a bez redukce RBV ukazuje graf 3. Při léčbě kombinací obsahující TPV byla dávka RBV redukována u 39 % relapsérů, u 31 % parciálních respondérů a u 18 % null-respondérů. Relapséři, u kterých byla dávka RBV redukována na 600 mg a méně, dosáhli SVR v 90 %, při redukci na 800–1000 mg denně byla SVR 84 %, zatímco relapséři bez nutnosti redukce RBV dosáhli SVR v 82 % případů. U parciálních respondérů byla SVR při redukci dávky RBV na 600 mg a méně 62 %, při redukované dávce 800–1000 mg 50 % a ve skupině bez redukce dávky byla SVR 62 %. U null-respondérů dosáhla SVR ve stejných podskupinách podle redukce dávky 22 %, 50 % a 31 %. Všechny tyto výsledky jsou tedy interpretovány tak, že redukce dávky RBV nijak výrazně nekompromituje pravděpodobnost dosažení SVR ve skupině opakovaně léčených osob.
Základní srovnání účinnosti léčby (míra dosažení SVR) u pacientů léčených kombinací s TPV a standardní kombinací PEG-IFN + RBV s redukcí RBV a bez redukce RBV ukazuje graf 3. Při léčbě kombinací obsahující TPV byla dávka RBV redukována u 39 % relapsérů, u 31 % parciálních respondérů a u 18 % null-respondérů. Relapséři, u kterých byla dávka RBV redukována na 600 mg a méně, dosáhli SVR v 90 %, při redukci na 800–1000 mg denně byla SVR 84 %, zatímco relapséři bez nutnosti redukce RBV dosáhli SVR v 82 % případů. U parciálních respondérů byla SVR při redukci dávky RBV na 600 mg a méně 62 %, při redukované dávce 800–1000 mg 50 % a ve skupině bez redukce dávky byla SVR 62 %. U null-respondérů dosáhla SVR ve stejných podskupinách podle redukce dávky 22 %, 50 % a 31 %. Všechny tyto výsledky jsou tedy interpretovány tak, že redukce dávky RBV nijak výrazně nekompromituje pravděpodobnost dosažení SVR ve skupině opakovaně léčených osob.
V běžné praxi tvoří velmi významnou část osob, které jsou v současné době kandidáty opakování protivirové léčby s použitím DAA, pacienti s pokročilou jaterní fibrózou či s již plně rozvinutou jaterní cirhózou. Registrační studie však do léčby zařadily relativně malé procento pacientů s takto pokročilými stadii jaterního postižení. Interpretace výsledků registračních studií dosažených v této podskupině je proto krajně obtížná. Přitom dosažení SVR u pacientů s jaterní cirhózou může vést k významně pozitivnímu ovlivnění jejich dlouhodobé prognózy (snížení rizika vzniku hepatocelulárního karcinomu, snížení rizika rozvoje dekompenzace s oddálením progrese či s úplným zabráněním pokračování do stadia indikovaného k transplantaci jater).
S velkými nadějemi jsou proto očekávány výsledky každé studie zaměřené na léčbu pacientů s jaterní cirhózou. Populárním zdrojem informací na toto téma jsou analýzy francouzského programu časného přístupu k DAA (CUPIC Study, [10]). Do této studie jsou zařazeni pacienti s jaterní cirhózou funkční klasifikace Child-Pugh A, kteří jsou léčeni kombinací TPV či BOC s PEG-IFN a RBV. Dosud byly zveřejněny výsledky léčby 169 pacientů, jimž byla podávána medikace obsahující TPV; u 51 % z těchto pacientů došlo během léčby k závažné nežádoucí reakci (SAE, Serious Adverse Effect). Léčba byla přerušena u 12 % pacientů, významná anémie byla pozorována u 46 % pacientů. Více než polovině pacientů byl pro anémii podáván erytropoetin a 19 % pacientů byly podány transfuze. Významná trombocytopenie se vyskytla ve 22 % případů, těžké kožní projevy byly pozorovány u 7 % osob a dvě osoby během protivirové terapie zemřely.
Z pohledu adherence pacientů k terapii je velkou nevýhodou TPV (ale i BOC) poměrně složité dávkovací schéma a řada doporučení, která se týkají především nutnosti současného užívání těchto léčiv s potravinami obsahujícími větší množství tuku. Jako velmi zajímavá se proto jeví studie, která se zaměřila na srovnání účinnosti, tolerance, bezpečnosti a farmakokinetiky TPV při obvyklém dávkování, tj. 750 mg 3krát denně v 8hodinovém intervalu, a dávkování 1125 mg 2krát denně ve 12hodinovém intervalu. Srovnáváno bylo i podání TPV v kombinaci s PEG-IFN α-2b a PEG-IFN α-2a [11]. Studie sledovala naivní – dosud neléčené – pacienty a ukázala, že dávkování 2krát denně je ve všech parametrech srovnatelné s dávkováním 3krát denně a že není rozdíl ani mezi kombinací obsahující PEG-IFN α-2a a PEG-IFN α-2b. V současné době jsou tyto výsledky ověřovány studiemi s větším počtem pacientů a také s osobami v minulosti neúspěšně léčenými.
Boceprevir
BOC je druhým v současné době schváleným DAA pro léčbu pacientů s chronickou HCV infekcí. I v tomto případě se soustředíme na problematiku osob dříve neúspěšně léčených, protože pouze v této indikaci lze v dané chvíli BOC použít v České republice.
![Obr. 3 Doporučený léčebný režim s použitím bocepreviru – možnosti individualizace; podle [26, 27] – SPC VICTRELIS, 2013, Massoumy, Manns, 2013. BOC – boceprevir; HCV RNA – ribonukleová kyselina viru hepatitidy C; PEG-IFN – pegylovaný interferon α; RBV – ribavirin; SPC – souhrn údajů o přípravku](https://www.remedia.cz/photo-a-29191---.jpg) Doporučované schéma podávání BOC u osob dříve neúspěšně léčených ukazuje obr. 3. Pro relapséry je doporučováno stejné schéma léčby jako pro dosud neléčené osoby. Null-respondéři a všichni nemocní s jaterní cirhózou musí být léčeni 48 týdnů včetně lead-in fáze, trojkombinace se tedy podává 44 týdnů. Je zajímavé, že výsledky registračních studií byly různě interpretovány americkou FDA (Food and Drug Administration) a Evropskou lékovou agenturou (EMA, European Medicines Agency). Pro parciální respondéry a relapséry doporučuje EMA podávat léčbu trvající celkem 48 týdnů: 4 týdny lead-in fáze, poté 32 týdnů trojkombinace PEG-IFN + RBV + BOC a následně 12 týdnů dvojkombinace PEG-IFN + RBV. Při léčbě je třeba dodržovat tzv. ukončovací kritéria (stopping rules), to znamená ukončit léčbu, pokud je hodnota HCV RNA ve 12. týdnu léčby ≥ 100 IU/ml nebo je HCV RNA detekovatelná ve 24. týdnu léčby, neboť tito pacienti nemají reálnou naději na dosažení SVR [12, 13].
Doporučované schéma podávání BOC u osob dříve neúspěšně léčených ukazuje obr. 3. Pro relapséry je doporučováno stejné schéma léčby jako pro dosud neléčené osoby. Null-respondéři a všichni nemocní s jaterní cirhózou musí být léčeni 48 týdnů včetně lead-in fáze, trojkombinace se tedy podává 44 týdnů. Je zajímavé, že výsledky registračních studií byly různě interpretovány americkou FDA (Food and Drug Administration) a Evropskou lékovou agenturou (EMA, European Medicines Agency). Pro parciální respondéry a relapséry doporučuje EMA podávat léčbu trvající celkem 48 týdnů: 4 týdny lead-in fáze, poté 32 týdnů trojkombinace PEG-IFN + RBV + BOC a následně 12 týdnů dvojkombinace PEG-IFN + RBV. Při léčbě je třeba dodržovat tzv. ukončovací kritéria (stopping rules), to znamená ukončit léčbu, pokud je hodnota HCV RNA ve 12. týdnu léčby ≥ 100 IU/ml nebo je HCV RNA detekovatelná ve 24. týdnu léčby, neboť tito pacienti nemají reálnou naději na dosažení SVR [12, 13].
Při detailním rozboru uspořádání registračních studií a v nich použitých pravidel pro ukončení léčby dojdeme k závěru, že pravidla pro ukončení léčby obsažená v souhrnu údajů o přípravku (SPC) a schválená regulačními úřady nereflektují zcela přesně zásady použité ve studiích fáze III. Při analýzách významu lead-in fáze pro jednotlivé skupiny pacientů ve vícero studiích se ukázalo, že opakovaně léčení pacienti s jaterní cirhózou, u kterých došlo ve 4. týdnu léčby (tj. na konci lead-in fáze) k poklesu HCV RNA < 1 log10, mají pravděpodobnost dosažení SVR < 10 %. Proto by toto kritérium mělo být uváženo jako rozhodující pro ukončení opakované léčby obsahující DAA. Celková pravděpodobnost dosažení SVR při opakované léčbě obsahující DAA je pro null-respondéry s jaterní cirhózou přibližně 15 % [7].
Ve studii RESPOND-2 (neúspěšně léčené osoby) byla léčba ukončena, pokud byla HCV RNA ve 12. týdnu detekovatelná (tj. nad limitem kvalitativní detekce, bez kvantifikace) [14, 15]. Ve studii RESPOND-2 mělo ve 12. týdnu viremii detekovatelnou, ale s hodnotou ≤ 100 IU/ml celkem 7 pacientů. Z těchto sedmi pacientů jich pět dosáhlo SVR [16].
![Obr. 4 Režim podávání telapreviru u opakovaně léčených osob; podle [23] – SPC Incivo, 2013. HCV RNA – ribonukleová kyselina viru hepatitidy C; PEG-IFN – pegylovaný interferon α; RBV – ribavirin; TPV – telaprevir](https://www.remedia.cz/photo-a-29192---.jpg) Naopak ve standardech není „stopping rule“ pro týden 8 léčby (tj. 4. týden podávání trojkombinace). Přitom ze studií vyplývá, že HCV RNA ≥ 1000 IU/ml v 8. týdnu léčby je asociována s velmi malou šancí na SVR. Při kumulaci dat studií RESPOND-2 a SPRINT-2 (naivní osoby) splnilo toto kritérium 88 osob, ale pouze 5 z nich dosáhlo SVR (SVR 5,5 %) [12, 13]. Další analýza ukázala, že pokud by jako kritérium ukončení léčby v 8. týdnu byl akceptován pokles HCV RNA < 3 log10, ukončilo by léčbu 53 pacientů a pouze dva z nich by byli ochuzeni o dosažení SVR. Jinak řečeno: z osob, které měly v 8. týdnu léčby pokles HCV RNA < 3 log10, dosáhlo SVR ve studiích pouze 3,7 % osob. Kritérium poklesu 3 log10 se tedy jeví jako racionální pravidlo pro ukončení léčby v 8. týdnu, a začíná být proto doporučováno světovými autoritami jako další vodítko při léčbě BOC [16]. Kombinaci standardního režimu, standardních „stopping rules“ a individuálního přístupu s použitím výše rozebraných pravidel, která se nedostala do oficiálních doporučení, ukazuje rovněž obr. 4.
Naopak ve standardech není „stopping rule“ pro týden 8 léčby (tj. 4. týden podávání trojkombinace). Přitom ze studií vyplývá, že HCV RNA ≥ 1000 IU/ml v 8. týdnu léčby je asociována s velmi malou šancí na SVR. Při kumulaci dat studií RESPOND-2 a SPRINT-2 (naivní osoby) splnilo toto kritérium 88 osob, ale pouze 5 z nich dosáhlo SVR (SVR 5,5 %) [12, 13]. Další analýza ukázala, že pokud by jako kritérium ukončení léčby v 8. týdnu byl akceptován pokles HCV RNA < 3 log10, ukončilo by léčbu 53 pacientů a pouze dva z nich by byli ochuzeni o dosažení SVR. Jinak řečeno: z osob, které měly v 8. týdnu léčby pokles HCV RNA < 3 log10, dosáhlo SVR ve studiích pouze 3,7 % osob. Kritérium poklesu 3 log10 se tedy jeví jako racionální pravidlo pro ukončení léčby v 8. týdnu, a začíná být proto doporučováno světovými autoritami jako další vodítko při léčbě BOC [16]. Kombinaci standardního režimu, standardních „stopping rules“ a individuálního přístupu s použitím výše rozebraných pravidel, která se nedostala do oficiálních doporučení, ukazuje rovněž obr. 4.
Dávkování, lékové interakce
Schémata podávání BOC a TPV ukazují obr. 3 a 4. Obvyklé dávkování BOC je 3krát denně 4 tobolky á 200 mg, TPV se dávkuje 3krát denně 2 tablety á 375 mg účinné látky. U obou přípravků je nutné dbát na přísné dodržování 8hodinového intervalu mezi jednotlivými dávkami. Jednou z hlavních zásad pro vedení léčby s těmito DAA je skutečnost, že dávka BOC ani TPV nemá být při výskytu nežádoucích účinků redukována. Redukcí by se významně zvyšovala pravděpodobnost vzniku virové rezistence. Platí tedy pravidlo „všechno, nebo nic“.
DAA přinášejí do léčby chronické virové hepatitidy C zcela nové téma, a sice téma lékových interakcí. BOC i TPV významně inhibují aktivitu CYP3A4/5, takže lze očekávat interakce s léčivy degradovanými tímto systémem, kterých je obrovské množství. Opatrnosti je logicky třeba především u přípravků, u kterých jsou jejich vysoké plazmatické hladiny spojeny s rizikem ohrožení životních funkcí. Jedná se typicky o benzodiazepiny, zejména midazolam (plazmatická koncentrace při současném podání s BOC stoupá až 35krát), triazolam, rizikové je ale současné podání statinů a mnoha antibiotik, antimykotik či imunosupresiv. Základní informace o lékových interakcích lze získat na internetové stránce http://www.hep-druginteractions.org/.
Dostupnost bocepreviru a telapreviru v ČR
Použití BOC i TPV je v indikaci opakované léčby (po selhání kombinace PEG-IFN + RBV) možné podle stávajících pravidel i v České republice. Po dohodě zástupců České hepatologické společnosti (ČHS) a Společnosti infekčního lékařství (SIL) České lékařské společnosti Jana Evangelisty Purkyně (ČLS JEP) s plátci zdravotní péče byla trojkombinační léčba chronické HCV infekce soustředěna do 17 definovaných pracovišť, která mají v ČR největší zkušenosti s podáváním DAA, tj. tato léčiva byla na těchto pracovištích podávána již v různých fázích klinického vývoje ještě před zavedením těchto přípravků do běžné klinické praxe. Seznam zmíněných pracovišť lze nalézt na stránkách ČHS ČLS JEP (www.ces-hep.cz) nebo na stránkách SIL ČLS JEP (www.infekce.cz).
Zahájení a urgence protivirové léčby
Při rozhodování o zahájení protivirové léčby obsahující DAA je potřeba vždy uvážit řadu faktorů. Udělat správné rozhodnutí není vždy zcela jednoduché. V současné době se nachází v různě pokročilých stadiích vývoje větší množství DAA novějších generací [17]. U těchto je předpoklad podávání v jednodušších schématech (např. 1krát denně), budou mít pravděpodobně i lepší bezpečnostní profil a nižší incidenci nežádoucích účinků. Navíc je velká pravděpodobnost, že relativně brzo budou dostupné tzv. interferon-free režimy založené na kombinaci několika virostatik různých tříd. Z tohoto pohledu není příliš jisté ani postavení RBV [18].
Podstatným momentem, který je třeba vždy zhodnotit individuálně při rozhodování o zahájení protivirové léčby, je aktuální stadium jaterní fibrózy a predikce jejího vývoje (progrese). Vývoj jaterní cirhózy u chronické HCV infekce je proces značně pomalý. Osoby s žádnou nebo jenom minimální fibrózou mohou pravděpodobně vyčkat, až budou nové léky dostupné. Nicméně optimální strategii je třeba vždy uvážit přísně individuálně. Je nutno vzít v úvahu přítomnost či absenci rizikových faktorů progrese jaterní fibrózy při chronické HCV infekci, jako např. steatózu či vyšší věk. V našich podmínkách je bohužel stále obtížně realizovatelné doporučení monitorovat individuální progresi jaterní fibrózy pomocí neinvazivních metod, zejména pomocí elastografie. I když je nutno vzít v úvahu, že i tato moderní metoda má své značné limitace, a to zejména u precirhotických stadií jaterního postižení [19, 20]. Nezanedbatelné faktory, které je třeba mít na zřeteli při rozhodování o podání protivirové léčby, představuje také motivace jedince k zahájení léčby, epidemiologická hlediska a projevy či rizika rozvoje extrahepatálních manifestací HCV.
Podle současných hledisek má ideální kandidát protivirové léčby obsahující DAA tyto charakteristiky:
- jaterní fibróza F2/F3 (dle METAVIR skóre),
- relaps po předchozí léčbě PEG-IFN + RBV,
- absence významných komorbidit.
Při splnění těchto podmínek je poměr přínos-riziko léčby příznivý a také se jeví jako reálné dosažení SVR. Bohužel, jde vpravdě o ideální charakteristiky, které ve skutečném životě nejsou vždy splnitelné. V řadě případů, kde se v tuto chvíli očekává podání trojkombinační terapie s DAA, se jedná o pacienty s pokročilou jaterní fibrózou, často s jaterní cirhózou, vyššího věku a s řadou komorbidit. Léčba těchto pacientů patří mezi rizikové a vždy by ji měl vést odborník s dlouhodobými zkušenostmi v oblasti trojkombinační protivirové léčby.
Boceprevir, nebo telaprevir?
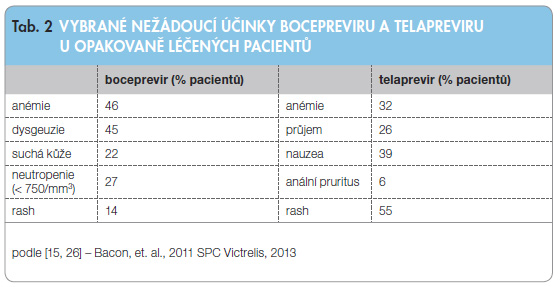 Pokud dojde k rozhodnutí zahájit protivirovou terapii s použitím DAA, nabízí se logicky otázka, kdy volit BOC a kdy TPV. Je třeba konstatovat, že v současné době přirozeně nejsou k dispozici studie přímo srovnávající oba přípravky. Ve studiích fáze III prokázaly oba přípravky srovnatelný celkový účinek a pouze v jejich bezpečnostních profilech byly patrny malé rozdíly, viz tab. 2 [6, 14, 15, 21]. Rozhodování se může poněkud lišit u pacientů naivních a pacientů léčených opakovaně a s pokročilejší fibrózou (až cirhózou). Podle interim analýzy studie CUPIC (16. týden léčby) je TPV asociován s lehce vyšším rizikem vedlejších reakcí (častější infekce) a léčba je provázena vyšší mortalitou než podávání BOC. Pravdou ale je, že jde o analýzu dat v ukončeném 16. týdnu léčby, tedy o období 4 týdny po skončení celé plánované délky podávání TPV, avšak dříve než v polovině plánované doby podávání BOC [10]. Těmito údaji se tedy nelze zcela jednoznačně řídit. Prevalence anémie je stejná pro BOC i TPV [6, 14, 15, 23].
Pokud dojde k rozhodnutí zahájit protivirovou terapii s použitím DAA, nabízí se logicky otázka, kdy volit BOC a kdy TPV. Je třeba konstatovat, že v současné době přirozeně nejsou k dispozici studie přímo srovnávající oba přípravky. Ve studiích fáze III prokázaly oba přípravky srovnatelný celkový účinek a pouze v jejich bezpečnostních profilech byly patrny malé rozdíly, viz tab. 2 [6, 14, 15, 21]. Rozhodování se může poněkud lišit u pacientů naivních a pacientů léčených opakovaně a s pokročilejší fibrózou (až cirhózou). Podle interim analýzy studie CUPIC (16. týden léčby) je TPV asociován s lehce vyšším rizikem vedlejších reakcí (častější infekce) a léčba je provázena vyšší mortalitou než podávání BOC. Pravdou ale je, že jde o analýzu dat v ukončeném 16. týdnu léčby, tedy o období 4 týdny po skončení celé plánované délky podávání TPV, avšak dříve než v polovině plánované doby podávání BOC [10]. Těmito údaji se tedy nelze zcela jednoznačně řídit. Prevalence anémie je stejná pro BOC i TPV [6, 14, 15, 23].
Velmi důležitým parametrem je genotyp HCV. Oba přípravky byly schváleny pouze pro léčbu infekce vyvolané genotypem HCV 1. Nicméně TPV má určitou protivirovou aktivitu i proti genotypu HCV 2, avšak nikoliv proti genotypu HCV 3 [22]. BOC má rovněž limitovanou účinnost, ale přece jen o něco vyšší než TPV u genotypu HCV 3. V ČR v současné době nelze tato virostatika použít pro jiné genotypy než pro HCV 1.
Zcela novou skutečností, se kterou se u DAA setkáváme, jsou jejich lékové interakce. Ty mohou být v řadě případů limitující a omezovat jejich podání. Určitou výhodu TPV lze spatřovat v tom, že je podáván po dobu 12 týdnů, a tudíž doba, po kterou je léčený pacient ohrožen lékovými interakcemi a kdy je třeba být ve střehu, je relativně krátká, významně kratší než při léčbě BOC. Tento faktor může hrát roli zejména v případě pacientů s komorbiditami, kdy je třeba současně podávat i jinou chronickou medikaci. Naopak BOC má příznivější interakce s imunosupresivy u pacientů po transplantaci jater.
V běžné situaci jsou tedy z odborného pohledu dobře použitelná obě virostatika. Pacient nicméně může mít pohled odlišný. Někteří pacienti mohou považovat striktní 8hodinový interval doporučovaný u BOC za obtížný, stejně tak může být výhodou podávání TPV pouze po dobu 12 týdnů. Navíc se zdá, jak bylo již zmíněno, že i 12hodinový interval podávání TPV je rovnocenný standardně doporučovanému 8hodinovému. Nevýhodou TPV může být ale nutnost jeho podávání spolu s tučnou potravou, což je podmínkou jeho optimální absorpce. Některým pacientům může vadit porucha chuti (dysgeuzie pozorovaná při podávání BOC) více nežli nezávažná vyrážka (při podávání TPV), někdy tomu může být zase přesně naopak. Je proto jasné, že před každým zahájením léčby je třeba všechny tyto momenty s pacientem probrat a zohlednit jeho názor a pohled na věc. Jen tímto způsobem je možno zajistit adekvátní spolupráci a adherenci k obtížné, kvalitu života významně snižující léčbě.
Závěr
Objev a zavedení DAA do léčby chronické HCV infekce vyvolané genotypem 1 je nutno považovat za skutečný milník ve vývoji léčby této závažné infekce. Vzhledem k ceně přípravků, jejich četným nežádoucím účinkům a dalším rizikům (lékové interakce) je však nezbytně nutná správná selekce pacientů, kteří jimi budou léčeni. Léčba by měla striktně probíhat na specializovaných pracovištích. V současnosti platná doporučení pro léčbu a její vedení jsou založena na výsledcích rozsáhlých registračních studií. I tak ale nebyly dosud zodpovězeny všechny otázky, se kterými se během léčby a rozhodování o jejím zahájení setkáváme. Další subanalýzy registračních studií, z nichž některé byly probrány výše, se proto v posledních přibližně dvou letech stávají významným zdrojem informací, jež mohou vést k upřesnění jak indikačních kritérií, tak pravidel pro ukončení léčby. Mohou také poskytnout určitý návod, kdy který přípravek použít.
Zdá se, že DAA jsou třídou léků, která v brzké době vytlačí stávající standardní postup, tj. léčbu kombinací PEG-IFN a RBV, alespoň tedy v případě infekce vyvolané genotypem 1. Účinnost BOC i TPV a mnoha dalších zkoušených virostatik je nyní do značné míry genotypově úzce specifikovaná, omezená většinou na genotyp 1. Ideální virostatikum by přitom mělo účinkovat proti všem genotypům, mělo by se podávat maximálně 1krát denně a přirozeně by nemělo vyvolávat nežádoucí účinky či lékové interakce. Takové virostatikum je však pravděpodobně mnohem vzdálenější budoucností než možnost vynechání PEG-IFN (případně RBV) z léčby chronické HCV infekce.
Seznam použité literatury
- [1] Urbánek P, Husa P, Galský J, et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Cas Lek Cesk 2008; 147: příloha I–XII.
- [2] Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975–982.
- [3] Hadziyannis SJ, Sette H, Morgan TR, et al. Peginterferon-alfa2a and ribavirin combination therapy in chronic hepatitis C. Ann Intern Med 2004; 140: 346–355.
- [4] Urbánek P. Novinky v terapii chronické infekce virem hepatitidy C. Remedia 2011; 21: 380–385.
- [5] Urbánek P, Husa P, Galský J, et al. Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV). Gastroenterol Hepatol 2012; 66: 214–229.
- [6] Zeuzem S, Andreone P, Pol S, et al. Telaprevir for retreatment of HCV infection. N Engl J Med 2011; 364: 2417–2428.
- [7] Foster GR, Zeuzem S, Andreone P, et al. Subanalyses of the telaprevir lead-in arm in the REALIZE study: response at week 4 is not a substitute for prior null response categorization. J Hepatol 2011; 54 (Suppl. 1): S3–4.
- [8] Zeuzem S, Sulkowski M, Zoulim F, et al. Long-term follow-up of patients with chronic hepatitis C treated with telaprevir in combination with peginterferon alfa-2a and ribavirin: interim analysis of the EXTEND study. 61st Annual Meeting of the AASLD. Hepatology 2010; 52 (Suppl.): 436A.
- [9] Sulkowski MS, Roberts S, Afdhal NH, et al. Ribavirin dose modification in treatment-naive and previously treated patients who received telaprevir combination treatment: no impact on sustained virologic response in phase 3 studies. J Hepatol 2012; 56 (Suppl. 2): S459–460.
- [10] Hezode C, Dorival C, Zoulim F, et al. Safety of telaprevir or boceprevir in combination with peginterferon/ribavirin, in cirrhotic nonresponders. First results of the French early access probram (ANRS CO20-CUPIC). J Hepatol 2012; 56 (Suppl. 2): S4.
- [11] Marcellin P, Forns X, Goeser T, et al. Telaprevir is effective given every 8 or 12 hours with ribavirin and peginterferon alfa-2a or -2b to patients with chronic hepatitis C. Gastroenterology 2011; 140: 459–468.
- [12] Food and Drug Administration. Victrelis label information, 2011. Dostupné na: http://www.accessdata.fda.gov/drugsatfda_docs/label/2011/202258lbl.pdf (citováno 30. ledna 2013).
- [13] CHMP Assessment Report Victrelis, 2011. Dostupné na: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002332/WC500109789.pdf (citováno 30. ledna 2013).
- [14] Poordad F, McCone JJ, Bacon BR, et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med 2011; 364: 1195–1206.
- [15] Bacon BR, Gordon SC, Lawitz E, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med 2011; 364: 1207–1217.
- [16] Jacobson IM, Marcelin P, Zeuzem S, et al. Refinement of stopping rules during treatment of hepatitis C genotype 1 infection with boceprevir and peginterferon/ribavirin. Hepatology 2012; 56 (Suppl. 2): S6.
- [17] Asselah T, Marcellin P. Direct acting antivirals for the treatment of chronic hepatitis C: one pill a day for tomorrow. Liver Int 2012; 32 (Suppl. 1): 88–102.
- [18] Lok AS, Gardiner DF, Lawitz E, et al. Preliminary study of two antiviral agents for hepatitis C genotype 1. N Engl J Med 2012; 366: 216–224.
- [19] Castera L. Transient elastography and other noninvasive tests to assess hepatic fibrosis in patients with viral hepatitis. J Viral Hepat 2009; 16: 300–314.
- [20] Castera L. Invasive and non-invasive methods for the assessment of fibrosis and disease progression in chronic liver disease. Best Pract Res Clin Gastroenterol 2011; 25: 291–303.
- [21] Jacobson IM, McHutchison JG, Dusheiko G, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med 2011; 364: 2405–2416.
- [22] Foster GR, Hezode C, Bronowicki JP, et al. Telaprevir alone or with peginterferon and ribavirin reduces HCV RNA in patients with chronic genotype 2 but not genotype 3 infections. Gastroenterology 2011; 141: 881–889.
- [23] Incivo: Souhrn údajů o přípravku. Dostupné na: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002313/WC500115529.pdf (citováno 30. ledna 2013).
- [24] Zeuzem S, Foster GR, Andreone P, et al. Different likelihood of achieving SVR on a telaprevir-containing regimen among null responders, partial responders and relapsers irrespective of similar responses after a peginterferon/ribavirin 4-week lead-in phase: REALIZE study subanalysis. Hepatology 2011; 54 (Suppl. S1): 986A.
- [25] Roberts SK, Andreone P, Pol S, et al. Impact of anemia and ribavirin dose reduction on svr to a telaprevir-based regimen in patients with hcv genotype 1 and prior peginterferon/ribavirin treatment failure in the phase III realize study. Hepatology 2011; 54: 1007A–1008A.
- [26] Victrelis: Souhrn údajů o přípravku. Dostupné na http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002332/WC500109786.pdf (citováno 30. ledna 2013).
- [27] Maasoumy B, Manns MP. Optimal treatment with boceprevir for chronic HCV infection. Liver International 2013; 33 (Suppl. 1): 14–22.