Osteoporóza u mužů
Muži vstupují do období dospělosti s vyšší hodnotou kostní hmoty než ženy a k jejímu úbytku souvisejícímu s věkem dochází o několik let později než u žen. Tato známá skutečnost spolu s převahou počtu starších žen nad muži je pravděpodobně jedním z důvodů, proč osteoporózu u mužů diagnostikujeme méně často. Přitom v celkovém počtu fraktur femuru tvoří muži třetinu postižených, s vyšší následnou morbiditou a mortalitou. Rozdíly v patofyziologii mechanismu vzniku mužské osteoporózy, v jejím denzitometrickém hodnocení i v terapeutických možnostech činí tuto problematiku otevřenou dalším poznatkům, které by měly směřovat k tvorbě praktických doporučených postupů.
Úvod
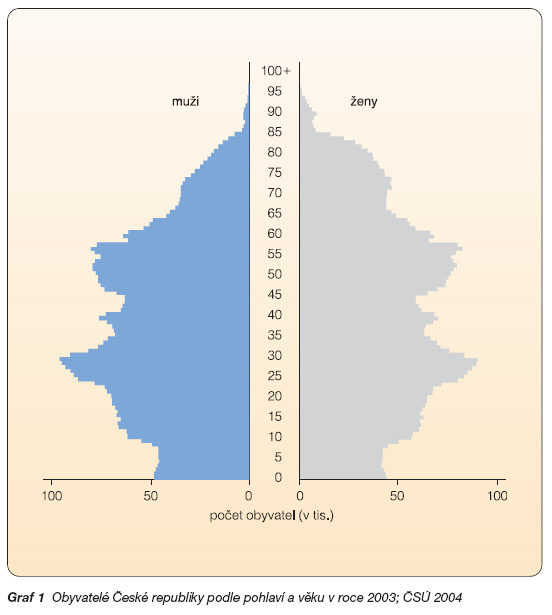
V roce 2005 tvořili muži 48,7 % z celkového počtu obyvatel České republiky (k 1. 5. 2005); 11 % z nich bylo starších 65 let. V tomto věkovém období stoupá v populaci incidence fraktur komplikujících senilní osteoporózu. Převaha počtu starších žen, kterou dokládají údaje Českého statistického úřadu (graf 1), je jednou z příčin, proč mužská osteoporóza často uniká naší pozornosti.
Charakteristika účinku hormonů ovlivňujících kostní metabolismus u mužů
Androgeny
Účinek androgenů je zprostředkován vazbou na androgenní receptor, který je řazen mezi steroidní receptory se třemi funkčními doménami. Testosteron s relativní androgenní aktivitou rovnou 100 je secernován Leydigovými buňkami varlete, pouze biologicky dostupný testosteron (volný a vázaný na albumin) je schopný difundovat do buňky. Androgenem s větší potencí (androgenní aktivita = 300) je 5-a-dihydrotestosteron, který vzniká z testosteronu působením reduktázy. V kůře nadledvin vznikají složitějšími enzymatickými cestami (za účasti 17-a-hydroxylázy a 3-b-steroid-dehydrogenázy) slabší androgeny o 19 uhlících – androstendion s androgenní aktivitou 10 a dehydroepiandrosteron a jeho sulfát s androgenní aktivitou rovnou 5. Jsou substrátem pro vznik testosteronu v periferii, protože nadledviny testosteron secernují v minimálním množství [1]. Androgeny také představují prekurzory pro extraglandulární formaci estrogenů cestou aromatázy, která je přítomna v řadě tkání včetně kostní tkáně (osteoblasty). Právě polymorfismus genu pro aromatázu byl označen za nezávislý prediktor kostní hmoty s pozitivním vlivem na objem kortikální kosti u mladých mužů [2]. Přes androgenní receptor přítomný na osteoblastech zprostředkují androgeny promoci, proliferaci a diferenciaci osteoblastů, produkci růstových faktorů, cytokinů, produkci proteinů kostní matrix (kolagenu typu I, osteokalcinu, osteopontinu), lokální štěpení IGFBP-3, snížení sekrece interleukinu 6 (IL-6), prostaglandinu E2 a přes signální faktory osteoblastů také nepřímo ovlivňují osteoklasty. Testosteron také přímo reguluje apoptózu osteocytů.
Estrogeny
Estrogeny mají rovněž důležitou roli ve skeletálním metabolismu u mužů stejně jako u žen, také zde probíhá periferní aromatizace androgenů na estrogeny. Aromatázu obsahují mimo jiné i osteoblast-like buňky a osteoblasty. Estrogen reguluje apoptózu osteocytů a jeho receptory jsou přítomny na osteoblastech i na osteoklastech. Ovlivňují tedy přímo osteoklastickou funkci, suprimují i produkci kostních resorpčních cytokinů (IL-1, IL-6) a ve vztahu k regulaci kostní resorpce jsou u stárnoucích mužů pravděpodobně dominantním sexuálním steroidem. Důležitost role estrogenů v mužském skeletálním vývoji demonstrují literární údaje o nálezu osteopenie u mužů s mutací genu pro estrogenový receptor a nebo genu pro aromatázu [3, 4].
Inzulinu podobný růstový faktor (IGF-I)
Inzulinu podobný růstový faktor (IGF-I) je syntetizován v mnoha tkáních včetně skeletu (patří mezi největší skupinu růstových faktorů produkovaných osteoblasty), kde působí jako lokální regulátor kostního metabolismu. Zvyšuje počet osteoblastů, stimuluje jejich diferenciaci a zvyšuje remodelaci kosti, syntézu kostní matrix a kolagenu. V játrech je tvořen pod vlivem růstového hormonu, v periferii je jeho syntéza závislá na dalších hormonech, například parathormonu (glukokortikoidy jeho syntézu inhibují). Bioaktivita IGF v kostní tkáni je modulována několika IGFBP (IGF vázající proteiny), především IGFBP-3, -4 a -5. Nejdůležitější je jeho vazba na IGFBP-3, v kostní tkáni stimuluje syntézu kostní matrix, kolagenu, buněk osteoblastické řady i počet osteoblastů. IGF se pravděpodobně podílejí na spojení kostní resorpce a formace a jejich koncentrace v kosti klesá s věkem [5].
Parathormon (PTH)
Parathormon (PTH) je aktivním regulátorem kalciové homeostázy, stimuluje uvolňování kalcia a fosforu z kosti, v ledvinách reabsorpci kalcia (reabsorpci fosforu snižuje), má rovněž stimulační efekt na 1-a-hydroxylázu a zvýšenou tvorbou 1,25-dihydroxy-vitaminu D3 zvyšuje intestinální vstřebávání obou minerálů. Receptory má na osteoblastech, kromě nich stimuluje i jejich prekurzory [6]; nepřímo pak podněcuje expresi osteoklasty diferencujícího faktoru (ODF, RANKL), aktivuje jejich vývoj a zvyšuje aktivitu osteoklastické resorpce. Bylo také prokázáno, že kombinovaný deficit androgenů a estrogenů zvyšuje u mužů skeletální odpověď na resorpční efekt infuzně podaného PTH.
Hormony štítné žlázy
Hormony štítné žlázy se podílejí na skeletálním růstu, T3 (trijodtyronin) je pravděpodobně nezbytný pro proliferaci a maturaci růstové chrupavky. Efekt hormonů štítné žlázy může být zčásti zprostředkován stimulací produkce IGF-I. Receptory pro tyreoidální hormony jsou přítomny na osteoblastech, jejichž aktivitu a proliferaci zvyšují, osteoklasty ovlivňují pak touto cestou pravděpodobně nepřímo. Celkově stimulují kostní remodelaci, hladiny markerů kostního metabolismu korelují s hladinami tyreoidálních hormonů [7].
Vitamin D
Hlavním cirkulujícím metabolitem vitaminu D je kalcidiol (25-hydroxy-vitamin D), jehož koncentrace odráží nutriční stav vitaminu D. Po hydroxylaci v ledvinách z něj vzniká kalcitriol (1,25-dihydroxy-vitamin D3), jehož produkce je ovlivněna nejen hladinou vitaminu D, kalcia, fosfátu, ale i estradiolem, prolaktinem a růstovým hormonem. Má receptory na osteoblastech, zvyšuje sekreci alkalické fosfatázy a osteokalcinu z osteoblastů, zahajuje mineralizaci osteoidu a deponuje vápník do kostní matrix. Nepřímo pak ovlivňuje i osteoklasty. Studie in vitro prokázaly, že androgeny (dihydrotestosteron) a 1,25-dihydroxy-vitamin D3 působí synergicky na humánní prostatické androgen-responzivní karcinomové buňky [8].
Sexuální dimorfismus skeletu
Rozdílnost v konstituci i metabolismu skeletu mezi oběma pohlavími je určována převahou androgenů v mužském organismu, i když, jak bylo již výše uvedeno, i androgeny jsou aromatizovány na estrogeny a ovlivňují jejich receptory [9].
Maxima kostní hmoty bývá u mladých mužů, na rozdíl od dívek, dosaženo již ve IV. pubertálním stadiu [10]. Muži dosahují vyššího maximálního množství kostní hmoty pod vlivem androgenů působících na kostní metabolismus během dospívání, i když uzávěr růstových štěrbin je zprostředkován estrogeny [11]. Byl prokázán negativní vztah mezi hladinou volného estradiolu a pozitivní vztah mezi hladinou volného testosteronu a velikostí trabekulární kosti v období dosažení maxima kostní hmoty. Muži dosahují větší velikosti kostí, například obratlová těla mají větší řeznou plochu na stejnou výšku, a proto jsou mechanicky více odolná.
Novější práce poukazují na složitější vztah nadledvinových androgenů ke kostnímu metabolismu. Bylo prokázáno, že mladí muži s anamnézou nižší porodní hmotnosti mají na rozdíl od dívek nižší hladinu DHEA-S (dehydroepiandrosteron-sulfát) a tato snížená hladina vede následně k nižšímu metabolickému kostnímu obratu [12].
V dalším období života dochází u mužů po fázi plateau k fyziologickému poklesu kostní hmoty, jenž začíná později než u ženy, je pozvolnější a dosahuje nižšího procenta z celkového množství hmoty než u žen (pokles kostní hmoty v kortikální kosti o 25 %, v trabekulární kosti o 50 %) [13]. Na rozdíl od žen je trabekulární úbytek kostní hmoty způsoben ztenčením trabekul a teprve druhotně perforací s rozpojením procesu kostní formace a resorpce. V kortikální kosti není tak výrazné ztenčení pod vlivem endokortikální resorpce, protože dochází k větší periostální kostní formaci jak v osovém, tak končetinovém skeletu. Androgeny ovlivňují tedy především axiální skelet, periferní je více pod vlivem růstového hormonu [14].
Charakteristika osteoporózy u mužů
Osteoporóza u mužů je stejně jako u žen charakterizována nízkou denzitou kostní hmoty a poruchou mikroarchitektury kostní tkáně vedoucí k její nestabilitě s tendencí ke vzniku fraktur.
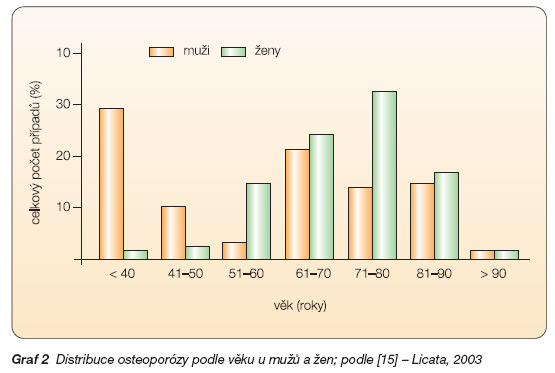
Exponenciální nárůst počtu osteoporotických fraktur s věkem je pozorován u obou pohlaví, u mužů přibližně o deset let později než u žen. Mezi 65.–70. rokem života pozorujeme u mužů obdobné ztráty množství kostní hmoty jako u žen, ale po 90. roce věku jsou již rozdíly v počtu osteoporotických fraktur markantní – vznikají u 32 % všech žen a 12 % mužů. Distribuce počtu pacientů s osteoporózou je však u mužů bimodální. První vrchol před 40. rokem života je podmíněn osteoporózou sekundární, druhý pak především osteoporózou primární [15] (graf 2).
Poměr mezi počtem pacientů s primární a sekundární osteoporózou je u obou pohlaví rozdílný. Zatímco u žen se setkáváme především s osteoporózou primární, u mužů představuje 50–70 % případů onemocnění osteoporóza sekundární.
Primární osteoporóza
Pod pojmem primární osteoporóza rozumíme úbytek kostní hmoty neznámé příčiny před 65. rokem života (idiopatická osteoporóza) nebo související s věkem (senilní osteoporóza). Idiopatická osteoporóza u mužů mladšího a středního věku je často spojována s možnou poruchou funkce osteoblastů. U mužů s idiopatickou osteoporózou byla prokázána dysfunkce osteoblastů se sníženou tvorbou osteokalcinu (ukazatele kostní novotvorby) a se zvýšenou tvorbou faktorů stimulujících aktivaci osteoklastů [16].
Jiní autoři zjistili u vyšetřovaných mužů s idiopatickou osteoporózou nižší hodnoty volného (nevázaného na vitamin D-binding protein) vitaminu D oproti kontrolní skupině [17] nebo považují za jeden z možných faktorů vzniku mužské osteoporózy mutaci genu pro LDL receptor-related protein 5 [18].
Příčinou senilní osteoporózy je nedostatečný příjem vápníku a jeho snížená absorpce ze střeva a porucha metabolismu vitaminu D při snížení renálních funkcí [19]. Tyto faktory vedou k rozvoji sekundární hyperparatyreózy, jejímž výsledkem je zrychlené odbourávání kosti, poškození novotvorby kosti a zvýšené riziko zlomenin [20]. Je popisováno, že u starších mužů ovlivňuje nedostatek vitaminu D skelet navíc i nepřímo – negativním působením na množství a funkce svalové hmoty (lean mass) [21].
Sekundární osteoporóza
Příčiny vzniku sekundární osteoporózy známe – a většina mužů má v anamnéze často více než jednu z nich. Patří mezi ně chybný životní styl, riziková medikace a přidružené choroby [22].
Riziková medikace
Na seznamu léčiv, která mají negativní dopad na kalciový a kostní metabolismus, dominují perorální glukokortikoidy. Vznik fraktur po několika měsících terapie není vzácný, je popisován pokles kostní denzity o 10 % v prvním roce léčby [23]. Riziko vzniku osteoporotické fraktury je pravděpodobně závislé na denní, ne kumulativní dávce podávaného glukokortikoidu [24]. U většiny pacientů je dávka 5 mg prednisonu denně spojována s minimálním úbytkem kostní hmoty a dávka vyšší než 10 mg prednisonu denně je spojována se signifikantním úbytkem kostní hmoty. Při podávání dávky v rozmezí 5–10 mg denně mohou někteří, i když ne všichni pacienti, rovněž ztrácet kostní hmotu [23]. Také inhalační glukokortikoidy mají za určitých podmínek nepříznivý systémový efekt na skelet s mírným zvýšením rizika osteoporotické fraktury, zejména při léčbě vysokými dávkami nebo dávkami nižšími, ale dlouhodobě podávanými [25, 26].
Méně často je ve vztahu ke kostní denzitě zmiňována terapie antipsychotiky. Podávání některých z nich může vést sekundárně k rozvoji hypogonadismu, navíc vzestup prolaktinu při dlouhodobém účinku na skelet ovlivňuje negativně kostní hmotu [27]. Některá antikonvulziva ze skupiny AEDS (enzyme-inducing antiepileptic drugs) snižují hladinu 25-hydroxy-vitaminu D a zvyšují metabolický kostní obrat [28].
Pokles kostního minerálu a zvýšené riziko vzniku fraktury byly popsány po více než 2 letech podávání této terapie [29].
Přidružené choroby
U mužů se často setkáváme s vývojem osteoporózy při onemocnění gastrointestinálního traktu (jaterní cirhóza, nespecifické střevní záněty, malabsorpce), při neurologických onemocněních, při systémovém onemocnění pojiva, při hematologických onemocněních (gamapatie, mnohočetný myelom), také při ortopedických diagnózách s genetickým postižením (Marfanův syndrom, osteogenesis imperfecta, hypofosfatázie) a v neposlední řadě při renálním postižení. Renální příčina vzniku osteoporózy patří do samostatné kapitoly metabolických kostních chorob u pacientů s chronickou renální insuficiencí, pacientů dialyzovaných nebo po transplantaci ledviny s imunosupresivní terapií.
Vztah osteoporózy a urolitiázy u mužů není popisován jednotně. Nižší kostní denzita bývá spojována s hyperkalciurií, ale může být zachycena i u normokalciurických pacientů s nefrolitiázou. Patogeneticky se na poklesu kostní denzity může podílet mírná metabolická acidóza, cytokiny a prostaglandiny i polymorfismus genu pro VDR (vitamin D receptor) [30].
Některé publikace však souvislost hyperkalciurie a nižší kostní denzity u mužů nepotvrdily [31].
Z endokrinních chorob, které mají úzký vztah ke kostnímu metabolismu, je hypertyreóza často udávána jako rizikový faktor pro vznik osteoporózy. Většinou je diagnostikována dlouho předtím, než dojde k sekundárnímu snížení kostní hmoty pod vlivem endogenních tyreoidálních hormonů. Také vliv supresní terapie tyroxinem po operaci pro karcinom štítné žlázy, tak často zkoumaný na skeletu postmenopauzálních žen, není dosud u mužů ověřen [32].
Prolaktinom může nepříznivě působit na kostní denzitu u mužů, její parametry jsou popisovány v signifikantním vztahu k hladině prolaktinu a k sekundárně snížené hladině testosteronu [33].
Incidence primární hyperparatyreózy je u mužů nižší než u žen, poměr mezi muži a ženami je udáván až 1 : 5,5 [34]. U více než 80 % probíhá symptomaticky [35].
Pokles kostní denzity je jedním z indikačních kritérií pro chirurgické řešení adenomu příštítného tělíska u těchto pacientů (T-skóre ≤ -2 SD).
Na sekundární a terciární hyperparatyreózu při renálním onemocnění se pomýšlí, nemusí být diagnostickým problémem, ale je problémem terapeutickým, zvláště u pacientů po transplantaci ledviny.
S osteoporózou u endogenního hyperkortisolismu se v praxi setkáváme méně často, pouze 5 % pacientů má diagnostikovánu osteoporózu.
Hypogonadismus v období puberty, kdy je tvořena kostní hmota, s níž muž vstupuje do období dospělosti (peak bone mass), ovlivňuje její množství negativně. U dospělých mužů po chemické nebo chirurgické orchiektomii odpovídá tento stav ženské menopauze se stejným poklesem kostní hmoty a s rizikem fraktury. Otázka „fyziologické" mírné formy hypogonadismu stárnoucích mužů (LOH – late onset hypogonadism) a kostní denzity není zcela prověřena, pravděpodobně je jedním z méně významných faktorů úbytku kostní hmoty ve stáří [36–40].
Osteoporóza je také důležitou komplikací androgen-deprivační terapie (ADT) při léčbě karcinomu prostaty. Bilaterální orchiektomie a léčba agonisty GnRH snižují kostní denzitu a zvyšují riziko osteoporotické fraktury [41].
Epidemiologie mužské osteoporózy
Muži tvoří přibližně 20 % všech pacientů s diagnostikovanou osteoporózou. Pro padesátiletého muže existuje 13–50% riziko vzniku jakékoli osteoporotické fraktury (femur, obratel, předloktí) v průběhu jeho dalšího života [42].
Pokud dojde ke vzniku osteoporotické fraktury u muže, její důsledky jsou závažnější než u žen – ve smyslu zvýšené morbidity a mortality [43].
Přestože z celkového počtu fraktur proximálního femuru jich připadá na muže 25–30 %, mortalita v prvním roce po takové prodělané fraktuře je dvojnásobně vyšší než u žen. Vyšší mortalita je však popisována i u mužů s frakturami obratlových těl. Tuto skutečnost můžeme vysvětlit vyšším věkem mužů v době vzniku fraktur a přidruženými onemocněními. Je však pravděpodobné, že mužské pohlaví je samostatným rizikovým faktorem vyšší mortality (30–50 % u mužů v. 20 % u žen) po prodělané fraktuře [44].
Diagnostika osteoporózy
Přesná diagnostická kritéria týkající se vztahu kostní denzity k frakturám u mužů postrádáme. Používáme kritéria WHO pro postmenopauzální ženy kavkazské rasy. Nelze však jednoznačně zohlednit odlišné biomechanické vlastnosti kostí u obou pohlaví, navíc volumetrické rozměry kosti jsou u mužů větší než u žen. Podle některých studií je riziko fraktury u obou pohlaví obdobné při stejné hodnotě BMD. Tyto výsledky opravňují k dosavadnímu užívání stejných kritérií pro muže [45].
Podle studie MrOS (The Osteoporotic Fractures in Men Study), do níž bylo zahrnuto 6000 mužů starších 65 let, mají však ženy při stejném věku a stejné denzitě kostního minerálu v oblasti proximálního femuru riziko fraktury vyšší než muži.
Je také zmiňována skutečnost, že užití kritéria T-skóre ≤ -2,5 SD u mužů může vést k podhodnocení prevalence osteoporózy u mužů.
Podle International Society for Clinical Densitometry jsou v doporučeních pro denzitometrické vyšetření dospělých zahrnuti i muži, a to v následujících indikacích:
– ‑muži ≥ 70let;
– ‑dospělí s osteoporotickou frakturou;
– ‑dospělí s onemocněním asociujícím s nízkou kostní hmotou nebo s úbytkem kostní hmoty;
– ‑dospělí s medikací asociující s nízkou kostní hmotou nebo s úbytkem kostní hmoty;
– ‑každý pacient před zahájením terapie osteoporózy;
– ‑každý pacient, u něhož je doporučeno monitorování terapie osteoporózy;
– ‑každý, kdo neužívá terapii, ale další úbytek kostní hmoty by vedl k jejímu zahájení.
Pro diagnostické účely je u mužů prováděno měření v oblasti femuru (hodnoty celkové a krčku femuru) a v oblasti bederní páteře (L1–L4 v zadopřední projekci), viz obr. 1.
Předloktí je měřeno ve výjimečných případech, kdy není možno interpretovat výsledky získané na femuru a páteři, dále u velmi obézních pacientů s hmotností nad limitem vyšetřovacího stolu a při primární hyperparatyreóze. Hodnotíme pouze distální třetinu radia.
Navrhované hodnocení denzitometrického vyšetření u mužů [46]:
K hodnocení využíváme T-skóre (porovnání hodnot s mladou zdravou populací, získaná hodnota je udávána ve směrodatných odchylkách) nebo Z-skóre (porovnání hodnot s vrstevníky).
Pod 50 let věku preferujeme hodnocení Z-skóre.
– Z-skóre ≤ -2 SD by mělo být označeno jako hodnoty pod očekávaným rozmezím pro daný věk.
– Z-skóre > -2 SD by mělo být označeno jako hodnoty v očekávaném rozmezí pro daný věk.
Diagnóza osteoporózy by však neměla být stanovena pouze na základě denzitometrických kritérií.
U pacientů mezi 50–65 lety preferujeme hodnocení v T-skóre při aplikaci denzitometrické klasifikace osteoporózy WHO.
– T-skóre ≤ -2,5 SD je považováno za osteoporózu.
– T-skóre mezi -2,5 SD a -1 SD je označováno jako nízká kostní denzita (osteopenie).
U pacientů nad 65 let věku zohledňujeme Z-skóre.
Pro monitorování terapie je preferováno hodnocení celkové denzity proximálního femuru.
Terapie osteoporózy u mužů
Důslednou edukací pacienta je možno zlepšit jeho přístup k prevenci a terapii osteoporózy [47]. Terapie osteoporózy je u mužů totiž obecně nedostatečná. Podle Kiebzakovy práce bylo jen 4,5 % mužů po prodělané fraktuře proximálního femuru propuštěno s medikací osteoporózy a v průběhu dalších 5 let byli tito muži léčeni většinou podáváním kalcia a vitaminu D bez aktivní terapie osteoporózy [48].
Hodnota kostní denzity pro zahájení terapie mužské osteoporózy není jednoznačně stanovena. Jistě by měli být léčeni muži s již prodělanou osteoporotickou frakturou a ti, kteří mají T-skóre ≤ -2 SD s dalšími rizikovými faktory pro vznik fraktury, včetně terapie glukokortikoidy.
Nelze však s jistotou určit bezpečné T-skóre, při kterém pacient nemusí být ještě léčen, resp. není ohrožen vznikem fraktury. Proto především v případech s T-skóre mezi -1 až -2 SD je nutno zohlednit další pomocné vyšetřovací metody s důrazem na vyšetření klinické [49].
K monitorování terapie osteoporózy je vhodné využít marker kostní resorpce, jeho suprese po více než třech měsících antiresorpční terapie asociuje s redukcí rizika osteoporotické fraktury dříve než změny BMD při denzitometrickém vyšetření.
Adekvátní léčba sekundárního onemocnění, které u muže osteoporózu vyvolalo, je základní podmínkou při zahájení terapie osteoporózy.
Fyzická aktivita
Nezbytná fyzická aktivita pomáhá zajišťovat svalovou sílu, koordinaci, flexibilitu, a přispívá tak k redukci rizika pádů. Doporučovány jsou cviky, při kterých svaly a kosti pracují proti gravitaci – chůze, jogging, chůze do schodů, týmové sporty, zdvihání činek a odporová cvičení.
Nízká a střední fyzická aktivita má příznivý vliv na kostní metabolismus u mužů středního věku [50].
Suplementace kalcia, vitaminu D
Nedílnou součástí terapie je vyvážená dieta se zastoupením prvků důležitých pro tvorbu kosti, především kalcia.
Vztah utváření maxima kostní hmoty a příjmu kalcia byl opakovaně potvrzen, výsledky zjištěné kostní denzity v oblasti lumbální páteře a proximálního femuru u mužů středního věku korelují s jejich příjmem kalcia v období růstového spurtu [51]. Mezi 25.–65. rokem života muži potřebují nejméně 1200 mg kalcia denně, u mužů starších 65 let je nutno zvýšit příjem na 1500 mg denně. Edukace pacienta o úpravě životosprávy se zvýšením příjmu kalcia je nedílnou součástí prevence a terapie osteoporózy [52].
Nedostatek vitaminu D vede k akcelerovanému úbytku kostní hmoty. Bylo prokázáno, že u mužů s hodnotou kalcidiolu ≤ 25 mg/ml je úbytek kostní hmoty dvojnásobně vyšší oproti těm, kteří mají hladinu vitaminu D v normě. Doporučená dávka vitaminu D ≥ 800 IU denně [53] je hrazena především cholekalciferolem ve formě parenterální nebo perorální. Aktivní metabolity vitaminu D ponecháváme pro terapii pacientů špatně reagujících na léčbu cholekalciferolem, zvláště pro muže s kortikoterapií. Suplementace vitaminu D také příznivě ovlivňuje neuromuskulární funkci, a pomáhá tím předcházet pádům s rizikem zlomenin [54].
Testosteron
Indikace k užití testosteronu k prevenci a terapii mužské osteoporózy (TRT – testosterone replacement therapy) nejsou v současné době ještě jasně stanoveny. Poměr riziko-přínos této léčby bude muset být ověřen dalšími prospektivními studiemi. Příznivý efekt léčby testosteronem na kostní denzitu byl potvrzen u mladších hypogonádních mužů, byl však prokázán i u pacientů nad 65 let věku [55, 56]. Obecně z léčby profitují muži s hypogonadismem [57]. Je popisován vliv suplementace testosteronu na pokles tukové tkáně a vzestup netukové měkké tkáně (lean mass, reprezentovaná svalovou hmotou) v celotělovém složení, s variabilními údaji o příznivém vlivu na kognitivní funkce u mužů starších 60 let [58].
Po aplikaci testosteronu také dochází k úpravě architektury trabekulární kosti [59].
Existuje řada dalších studií zkoumajících vliv terapie testosteronem na kostní denzitu u mužů. Metaanalýzou těch, při nichž byl substituován testosteron intramuskulárně minimálně 1 rok, byl zjištěn 8% vzestup BMD v oblasti bederní páteře a nesignifikantní 4% vzestup BMD v oblasti krčku femuru (s 26% diferencí mezi studiemi). Efekt transdermálně aplikovaného testosteronu neměl na kostní denzitu signifikantní vliv [60]. Testosteron může být podáván ve formě hluboko aplikovaných intramuskulárních injekcí, v perorální formě, ale i transdermálně ve formě gelu nebo bukálně. Léčené muže je nutno důsledně monitorovat laboratorně (jaterní funkce, hemoglobin) a klinicky včetně urologických kontrol s digitálním vyšetřením prostaty a stanovením hladiny prostatického antigenu. Toto vyšetření je nezbytné před zahájením substituční léčby testosteronem, dále za 3–6 měsíců a u mužů nad 40 let pak jedenkrát ročně [61, 62].
Mírné zvýšení PSA (prostatický specifický antigen), ale ještě v pásmu normálních hladin, je pozorováno až u 96 % pacientů [63]. Indikaci léčby testosteronem je nutno zvážit i pro vyšší incidenci nediagnostikovaného karcinomu prostaty ve vyšší věkové skupině a nezahajovat tuto léčbu u mužů s hraničně nízkou hladinou testosteronu bez klinických příznaků hypogonadismu [64]. Jsou také zkoumány možnosti současného podávání medikace, která by riziko stimulace prostaty testosteronem eliminovala [65].
Výsledky dostupných studií vedou ke shodnému závěru – chybí evidence-based dokumentace o klinickém přínosu podávání androgenů u mužů s normální nebo mírně sníženou hladinou testosteronu týkající se morbidity nebo kvality života. U starších mužů by měla být substituce testosteronem vyhrazena pouze pro pacienty s jasnými klinickými symptomy hypogonadismu a se skutečně nízkou hladinou testosteronu [66].
Bisfosfonáty
Terapie bisfosfonáty vykazuje u mužů s osteoporózou účinek na zvýšení kostní minerální denzity obdobný jako u žen. Alendronát je prvním léčivem, jehož účinnost (zvýšení skeletální denzity) byla prokázána v dobře kontrolovaných studiích u mužů srovnatelně s výsledky u žen [67]. U mužů s osteoporózou bylo potvrzeno, že perorální podávání 10 mg alendronátu denně zvyšuje signifikantně BMD v oblasti lumbální páteře, proximálního femuru a celotělově a vede ke snížení incidence vertebrálních fraktur [68, 69, 70]. Je doporučováno současné užívání kalcia 1200–1500 mg a 800 IU vitaminu D denně. Nepodařilo se však identifikovat skupinu mužů, kteří by byli pro terapii vhodnými kandidáty na základě biochemických či hormonálních ukazatelů nebo předchozí vertebrální fraktury [71]. Na preklinické úrovni bylo prokázáno, že alendronát inhibuje vystupňovanou kostní resorpci se zachováním mechanických vlastností kosti u kastrovaných zvířat [72]. Novější práce ukazují na příznivý efekt alendronátu na BMD lumbální páteře a ukazatele metabolického kostního obratu u mužů s revmatoidní artritidou léčených nízkými dávkami kortikoidu [73]. Terapie risedronátem byla také vyhodnocena jako vysoce efektivní v terapii mužské osteoporózy, především při kortikoterapii, se snížením rizika vertebrálních fraktur [74].
Bisfosfonáty nacházejí rovněž uplatnění v prevenci a terapii osteoporózy při ADT (androgen-deprivační terapii) u mužů s karcinomem prostaty [75].
Kalcitonin
Je předepisován u mužů s akutně vzniklou frakturou, se Sudeckovou osteodystrofií s předpokladem stejného účinku na kostní hmotu jako u žen. K potvrzení tohoto efektu chybí však větší randomizované studie u mužů s primární osteoporózou. Při intranazální aplikaci 200 IU kalcitoninu denně v kombinaci s vitaminem D a kalciem byl popsán signifikantní vzestup kostní denzity v oblasti lumbální páteře a proximálního femuru (o 3,5 %), ne však v oblasti radia u mužů s idiopatickou osteoporózou bez fraktur [76].
Parathormon
Rekombinantní humánní parathormon (PTH 1-34) je v současné době jediným schváleným anabolickým působkem pro léčbu osteoporózy. Anabolickým proto, že primárně stimuluje kostní novotvorbu. Zvyšuje kostní objem; zvýšením tloušťky trabekul (kostních trámců) a počtu spojení mezi trabekulami upravuje kostní strukturu a mikroarchitekturu [77], makroarchitekturu a geometrii kosti [78]. Při léčbě parathormonem dochází ke zvýšení skeletální denzity u mužů [79].
PTH 1-34 (teriparatid) je schválen FDA pro terapii primární a sekundární mužské osteoporózy zvláště tam, kde pacient nereaguje na jinou terapii osteoporózy a má vysoké riziko vzniku osteoporotické fraktury.
Signifikantně snižuje riziko osteoporotické fraktury [77]. Z pěti studií, které zkoumaly vliv terapie 20 mg nebo 40 mg teriparatidu denně na bolest zad (jedna z nich byla cílena na muže s idiopatickou nebo hypogonadální osteoporózou), byl prokázán jeho příznivý efekt na bolest zad [80].
Intermitentně podáván stimuluje kostní formaci a efekt terapie popisují někteří autoři již po třech měsících léčby v oblasti lumbální páteře, proximálního femuru a v množství kostního minerálu (celotělové BMD) [81–83].
Kombinace terapie parathormonem, který stimuluje kostní formaci i resorpci, a alendronátem, který tlumí kostní resorpci, podle některých studií vedla u mužů s osteoporózou k menšímu přírůstku BMD v oblasti lumbální páteře i proximálního femuru ve srovnání s monoterapií parathormonem samotným [84], jiné studie prokazují příznivý efekt kombinace obou léčiv na pokles ukazatelů kostní resorpce [85]. Prospěšnost této kombinované terapie by ale mohla přinést sekvenční léčba PTH-bisfosfonáty.
Bude třeba ještě dořešit optimální doporučenou délku terapie a mechanismus možného vzniku rezistence na jeho efekt po 18–24 měsících podávání [78].
Thiazidy
Účelnost podávání thiazidových diuretik vychází ze skutečnosti, že u 20 % osteoporotických mužů je přítomna hyperkalciurie. Thiazidy upravují kostní denzitu a používají se k terapii při osteoporóze, k preventivnímu podávání u mužské osteoporózy chybí důkazy pro ovlivnění rizika fraktur [86].
Další terapeutické postupy v klinických studiích
Stroncium ranelát, přípravek, jehož efekt na snížení rizika vzniku vertebrálních i nevertebrálních osteoporotických fraktur byl prokázán u žen, by mohl být v budoucnosti podáván i u jiného typu osteoporózy, včetně mužské [87].
Selektivní modulátory estrogenních receptorů užívané v terapii postmenopauzální osteoporózy mají efekt u mužů s osteoporózou a nízkou hladinou estradiolu [88]. Jeho pozitivní vliv na snížení ukazatelů kostní resorpce u mužů mezi 60–70 lety byl ale popsán pouze při výrazném vzestupu hladiny sérového estradiolu a testosteronu, provázeném signifikantním nárůstem hladiny PSA [89].
Slibnou budoucí terapeutickou skupinou jsou selektivní modulátory androgenních receptorů (SARMs), které působí preventivně proti úbytku kostní hmoty, působí anabolicky na kostní tkáň a svalovou hmotu a mohou příznivě ovlivnit i libido u léčených mužů [90].
Studie se suplementací dehydroepiandrosteronu u mužů středního a staršího věku neprokázaly příznivý vliv normalizace hladin tohoto androgenu na kostní metabolismus [91].
Prevence a terapie glukokortikoidy indukované osteoporózy u mužů
Postupem volby by mělo být nasazení perorálně podávaných bisfosfonátů. Při jejich intoleranci je třeba indikovat terapii metabolity vitaminu D a kalciem; samotné kalcium nezajistí prevenci rapidního úbytku kostní hmoty po zahájení léčby glukokortikoidy. Je-li u mužů potvrzen hypogonadismus, je zapotřebí zahájit substituci testosteronem s pravidelnými kontrolami laboratorních parametrů a urologickými kontrolami, jak je uvedeno v kapitole o terapii testosteronem. Protože je po započetí terapie glukokortikoidy očekáván až 10% úbytek kostní hmoty již během prvního roku léčby, zvažujeme její zahájení při denzitometrických hodnotách nad diagnostickým prahem pro osteoporózu [23].
Závěr
V terapii mužské osteoporózy není ještě k dispozici tak široké spektrum léčiv jako u žen. I proto klademe hlavní důraz na prevenci jejího vzniku. Výstavba kostní hmoty probíhá u mužů již v období puberty. V té době je třeba zajistit správnou skladbu výživy a optimální fyzickou aktivitu. Předpokladem pro přiměřený vývoj mužského skeletu v tomto období je přítomnost odpovídající hladiny androgenů i estrogenů. V pozdějším věku je nutno dodržovat zásady prevence osteoporózy a případně správně vést terapii onemocnění, které by osteoporózu mohlo způsobovat. Denzitometrické vyšetření a zahájení terapie u muže s podezřením na osteoporózu jsou limitovány ne zcela přesnými diagnostickými kritérii. Riziko fraktury u muže hodnotíme tedy i podle dalšího klinického vyšetření s vědomím, že kostní denzita je jen jedním z rizikových faktorů jejího vzniku.
Graf 1 Obyvatelé České republiky podle pohlaví a věku v roce 2003; ČSÚ 2004
Graf 2 Distribuce osteoporózy podle věku u mužů a žen; podle [15] – Licata, 2003
Obr. 1 Vyšetřované oblasti bederní páteře a proximálního femuru (DEXA)
Seznam použité literatury
- [1] Nelson DH. The adrenal cortex: Physiological function and disease. Philadelphia, WB Saunders, 1988: 1122.
- [2] Lorentzon M, et al. Polymorphism in the aromatase gene predict areal BMD as a result of affected cortical bone size: the GOOD study. J Bone Miner Res 2006; 21: 332–339.
- [3] Smith EP, Boyd J, Frank GR, et al. Estrogen resistance cause by a mutation in the estrogen-receptor gene in a man. N Engl J Med 1994; 331: 1056–1061.
- [4] Carani C, Qin K, Simoni M, et al. Effect of testosterone and estradiol in a man with aromatase deficiency. N Engl J Med 1997; 337: 91–95.
- [5] Jenšovský J. Účinky růstového hormonu na kostní tkáň. In: Jenšovský, et al. Růstový hormon. Galén, Semily, 2000.
- [6] Bringhurst FR, Demay MB, Kronenberg HM. Hormones and disorders of mineral metabolism. In: Wilson JD. Williams textbook of endocrinology. 9th edition, Philadelphia, London. W. B. Saunders Company 1998; kap. 24: 1161.
- [7] Baqui L, Payer J, Killinger Z. Tyreoidálne hormony a kosť. Osteol Bull 2003; 8: 33–43.
- [8] Zhao XY, et al. 1 alpha 25-dihydroxyvitamin D3 actions in LNCaP human prostate cancer cells are androgen-dependent. Endocrinology 1997; 138: 3290–3298.
- [9] Van der Schueren D, Boonen S, Bouillon R. Action of androgens versus estrogens in male skeletal homeostasis. Bone 1998; 23: 391–394.
- [10] Yilmaz D, et al. Bone mineral density in girls and boys at different pubertal stages: relation with gonadal steroids, bone formation markers, and growth parameters. J Bone Miner Metab 2005; 23: 476–482.
- [11] Graeme RF. Role of estrogen and androgen in pubertal skeletal physiology. Med Pediatr Oncol 2003; 41: 217–221.
- [12] Bardoczy Z, et al. Independent effect of endogenous dehydroepiandrosterone-sulphate levels and birth weight on bone turnover parameters in young adults. J Bone Miner Metab 2005; 23: 483–487.
- [13] Sotorník R. Osteoporóza u mužů. DMEV 2000; 4: 264–272.
- [14] Seeman E. Advances in the study of osteoporosis in men. In: Meunier, P. E. Osteoporosis: Diagnosis and management. London, Dunitz, 1998.
- [15] Licata A. Osteoporosis in men. Suspect secondary disease first. Cleveland Clinic Journal of Medicine 2003; 70: 247–254.
- [16] Pernow Y, Granberg B, Saaf M, Weidenhielm L. Osteoblast dysfunction in male idiopathic osteoporosis. Calcif Tissue Int 2006; 78: 90–97.
- [17] Al-Oanzi ZH, Tuck SP, Raj N, Natrop JS, et al. Assessment of vitamin D status in male osteoporosis. Clin Chem 2006; 52: 248–254.
- [18] Ferrari SL, Deutsch S, Baudoin C, et al. LRP5 gene polymorphism and idiopathic osteoporosis in men. Bone 2005; 37: 770–775.
- [19] Kanis JA. Osteoporosis, Nutritional causes of osteoporosis, Blackwell Science Ltd, Oxford, 1994.
- [20] Broulík P. Osteoporóza. Praha, Maxdorf 1999; kap. Vitamin D.
- [21] Arabi A, Baddoura R, Awada H, et al. Hypovitaminosis D osteopathy: Is it mediated through PTH, lean mass, or is it a direct effect? Bone 2006; 20: 268–275.
- [22] Tomkova S. Osteoporóza u mužov. In: Rovenský, J. (edit.): Reumatológia v teórii a praxi VI. Martin, Osveta, 2004.
- [23] Sambrook PN. How to prevent steroid induced osteoporosis. Annals of the Rheumatic Diseases 2005; 64:176–178.
- [24] Staa Van TP, Leufkens HGM, Abenhaim L, et al. Use of oral glucocorticoids and risk of fractures. J Bone Miner Res 2000; 15: 993–1000.
- [25] Lipworth BJ. Systemic adverse effects of inhaled corticosteroid therapy: a systematic review and meta analysis. Arch Intern Med 1999; 159: 941–955.
- [26] Bonay M, Bancal C, Crestani B. The risk/benefit of inhaled corticosteroids in chronic obstructive pulmonary disease. Expert Opin Drug Saf 2005; 4: 251–271.
- [27] Haefliger T, Bonsack C. Atypical antipsychotics and sexual dysfunction: five case-reports associated with risperidone. Encephale 2006; 32: 97–105.
- [28] Mintzer S, Boppana P, Toguri J, DeSantis A. Vitamin D levels and bone turnover in epilepsy patients taking carbamazepine or oxcarbazepine. Epilepsia 2006; 47: 510–515.
- [29] Petty SJ, Paton LM, O´Brien TJ, et al. Effect of antiepileptic medication on bone mineral measures. Neurology 2005; 65: 1358–1365.
- [30] Cauderella R, Vescini F, Buffa A, et al. Bone mass loss in calcium stone disease: focus on hypercalciuria and metabolic factors. J Nephrol 2003; 16: 260–266.
- [31] Tsuji H, Umekawa T, Kurita T, et al. Analysis of bone mineral density in urolithiasis patients. Int J Urol 2005; 12: 335–339.
- [32] Heijckmann AC, Huijberts MS, Geusens P. Hip bone mineral density, bone turnover and risk of fracture in patients on long-term suppressive L-thyroxine therapy for differentiated thyroid carcinoma. Eur J Endocrinol 2005; 153: 23–29.
- [33] Naliato EC, Farias ML, Braucks GR, et al. Prevalence of osteopenia in men with prolactinoma. J Endocrinol Invest 2005; 28:12–17.
- [34] Hamiti S, Soltani A, Hedayat A, Kamalian N. Primary hyperparathyroidism: a review of 177 cases. Med Sci Monit 2006; 12: CR86–89.
- [35] Bilezikian JP, Potts JT jr. Asymptomatic primary hyperparathyroidism: new issues and new questionsbridging the past with the future. J Bone Miner Res 2002; 17 (Suppl 2): N57–67.
- [36] Beld van den AW, et al. Measures of bioavailable serum testosterone and estradiol and their relationships with muscle strength, bone density and body composition in elderly men. J Clin Endocrin Metab 2000; 85: 3276–3282.
- [37] Beld van den AW, Lamberts SW. The male climacterium: clinical signs and symptoms of a changing endocrine environment. Prostate Suppl 2000; 10: 2–8.
- [38] Gennari L, et al. Longitudinal association between sex hormone levels, bone loss and bone turnover in elderly men. J Clin Endocrinol Metabol 2003; 88: 5327–5333.
- [39] Gould DC, PettyR. The male menopause – does it exist? BMJ 2000; 320: 858–861.
- [40] Heaton JP, Morales A. Andropause – a multisystem disease. Ca J Urol 2001; 8: 1213–1222.
- [41] Smith MR. Osteoporosis during androgen deprivation therapy for prostate cancer. Urology 2002; 60: 79–85. Discussion 86.
- [42] Looker AC, Orwoll ES, Johnston CC, et al. Prevalence of low femoral bone density in older US adults from the NHANES III. J Bone Miner Res 1997; 12: 1761–1783.
- [43] Center JR, Nguyen TV, Schneider D, et al. Mortality after all major types of osteoporotic fracture in men and women: an observational study. Lancet 1999; 353: 878–882.
- [44] Melton LJ. Epidemiology of fractures. Osteoporosis: Etiology, Diagnosis and Management, Second Edition, BL Riggs and LJ Melton (Eds.). Lippincott-Raven Publishers, Philadelphia 1995; 225–247.
- [45] De Laet CE, Van Hout BA, Burger H, et al. Hip fracture prediction in elderly men and women: validation in the Rotterdam study. J Bone Miner Res 1998; 13: 1587–1593.
- [46] Official positions of the International Society for Clinical Densitometry. J Clin Densitom 2004; 7: 1–5.
- [47] Salomon DH, Finkelsterin JS, Polinami JM, et al. A randomized controlled trial of mailed osteoporosis education to older adults. Osteoporos Int 2006; 17: 760–767
- [48] Kiebzak GM, Beinart GA, Perser K, et al. Undertreatment of osteoporosis in men with hip fracture. Arch Intern Med 2002; 162: 2217–2222.
- [49] Orwoll ES. Evaluation and Therapy In: Orwoll ES, ed. Osteoporosis in Men. The Effects of Gender on Skeletal Health. Academic Press, 1999.
- [50] Remes T, Vaisanen SB, Mahonen A, et al. The association of bone metabolism with bone mineral density, serum sex hormone concentrations, and regular exercise in middle aged men. Bone 2004; 35: 439–447.
- [51] Yoshimura N, Oka H. Osteoporosis and nutrition: trends of calcium intake and bone mineral den-sities. Clin Calc 2006; 16: 103–109.
- [52] Foldi MA, Belgeri MT, Perry HM, Gaebelein CJ.The effect of patient education on calcium intake in elderly men at risk for osteoporosis. Consult Pharm 2005; 20: 1032–1035.
- [53] Boomem S, Vanderschueren D, Haetjens P, Lips P. Calcium and vitamin D in the prevention and treatment of osteoporosis- a clinical update. J Intern Med 2006; 259: 539–552.
- [54] Staud R. Vitamin D: more than just affecting calcium and bone. Curr Rheumatol Rep 2005; 7: 356–364.
- [55] Benito M, Vasilic B, Wehrli FW, et al. Effect of testosterone replacement on trabecular architecture in hypogonadal men. J Bone Miner Res 2005; 20: 1785–1791.
- [56] Snyder PJ, Peachey H, Hannoush P, et al. Effect of testosterone treatment on bone mineral density in men over 65 years of age. J Clin Endocrinol Metab 1999; 84: 1966–1972.
- [57] Kamel HK. Male osteoporosis: new trends in diagnosis and therapy. Drugs Aging 2005; 22: 741–748.
- [58] Gruenewald DA, Matsumoto AM. Testosterone supplementation therapy for older men: potential benefits and risks. J An Geriatr Soc 2003; 51: 101–115.
- [59] Finkelstein JS, Klibanski A, Neer RM, et al. Increase in bone density during treatment of men with idiopathic hypogonadotropic hypogonadism. J Clin Endocrinol Metab 1999; 4: 1966–1975.
- [60] Tracz MJ, Sideros K, Bolona ER, et al. Testosterone use in men and its effects on bone health. A systematic review and meta-analysis of randomized placebo-controlled trials. J Clin Endocrinol Metab 2006; 91: 2011–2016.
- [61] Bert T. Clinical experiences with testosterone therapy: prostate safety. Aging Male 2004; 7: 304–311.
- [62] Kawaciuk I. Substituce testosteronu u stárnoucích hypogonadálních mužů. Int Med 2002; 1: 7–9.
- [63] Nicholas Mc T, Ong T. Review of Testim gel. Expert Opin Pharmacother 2006; 7: 477–484.
- [64] Gruenewald DA, Matsumoto AM. Testosterone supplementation therapy for older men: potential benefits and risks. J An Geriatr Soc 2003; 51:101–115.
- [65] Amory JK, Watts NB, Easley KA, et al. Exogenous testosterone or testosterone with finasteride increases bone mineral density in older men with low serum testosterone. J Clin Endocrinol Metab 2004; 98: 503–510.
- [66] Kaufman JM, Vermeulen A.The Decline of Androgen Levels in Elderly Men and Its Clinical and Therapeutic Implications. Endocrine Reviews 2005; 26: 833–876.
- [67] Iwamoto J, Takeda T, Sato Y, Uzawa M. Comparison of the effect of alendronate on lumbar bone mineral density and bone turnover in men and postmenopausal women with osteoporosis. Clin Rheumatol 2006; 25: Epub ahead of print.
- [68] Orwoll ES, Ettinger M, Weiss S, et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med 2000; 343: 604–610.
- [69] Ringe JD, Orwoll E, Daifotis A, Lombardi A. Treatment of male osteoporosis: recent advances with alendronate. Osteoporos Int 2002; 13: 195–199.
- [70] Sawka AM, Papaioannou A, Adachi JD, Gafni A, et al. Does alendronate reduce the risk of fracture in men? A meta-analysis incorporating prior knowledge of anti-fracture efficacy in women. BMC Musculoskelet Disord 2005; 11: 39.
- [71] Drake WM, Kendler DL, Rosen CJ, Orwoll ES. An investigation of the predictors of bone mineral density and response to therapy with alendronate in osteoporotic men. J Clin Endocr Metab 2003; 88: 5759–5765.
- [72] Broulík P, Rosenkrancová J, Růžička P, Sedláček R. Effect of alendronate administration on bone mineral density and bone strength in castrated rats. Horm Metab Res 2005; 37: 414–418.
- [73] Lems WF, Lodder MC, Lips P, et al. Positive effect of alendronate on bone mineral density and markers of bone turnover in patient with rheumatoid arthritis chronic treatment with low-dose prednisone: a randomized, double-blind, placebo-controlled trial. Osteoporos Int 2006; 17: 716–723.
- [74] Wallach S, Cohen S, Reid DM, et al. Effects of risedronate treatment on bone density and vertebral fracture in patients on corticosteroid therapy. Calcif Tissue Int 2000; 67: 277–285.
- [75] Bernat MM, Pasini J, Marekovic Z. Changes in bone mineral density in patients with prostate cancer treated with androgen deprivation therapy. Coll Antropol 2005; 29: 589–591.
- [76] Toth E, Csupor E, Meszaros S, et al. The effect of intranasal salmon calcitonin therapy on bone mineral density in idiopathic male osteoporosis without vertebral fractures – an open label study. Bone 2005; 36: 47–51.
- [77] Lems WF, Hamdy NA, Netelenbos JC. Teriparatide: an anabolic drug for the treatment of patiens with osteoporosis. Ned Tijdschr Geneeskd 2006; 21: 132–137.
- [78] Cosman F. Anabolic therapy for osteoporosis: parathyroid hormone. Curr Osteoporos Rep 2005; 3: 143–149.
- [79] Slovik DM, Rosenthal DI, Doplely SH, et al. Restoration of spinal bone in osteoporotic men by treatment with human parathyroid hormone (1-34) and 1,25-dihydroxyvitamin D. J Bone Miner Res 1986; 1: 377–381.
- [80] Seeman E. Advances in the study of osteoporosis in men. In: Meunier, P. E. Osteoporosis: Diagnosis and management. London, Dunitz, 1998; 211–232.
- [81] Finkelstein JS, Hayes A, Hunzelman JL, et al. The effects of parathyroid hormone and alendronate alone or both in men with osteoporosis. N Engl J Med 2003; 349: 1216–1226.
- [82] Kurland ES, Cosman F, McMahon DJ, et al. Para-thyroid Hormone as a Therapy for Idiopathic Osteoporos in Men: Effects on Bone Mineral Density and Bone Markers. J Clin Endocrinol Metab 2000; 85: 3069–3076.
- [83] Orwoll ES, Scheele WH, Paul S, et al. The effect of teriparatide [human parathyroid hormone (1-34) therapy on bone density in men with osteoporosis. J Bone Miner Res 2003; 18: 9–17.
- [84] Rosen CJ, Rackoff PJ. Emerging anabolic treatments for osteoporosis. Rheum Dis Clin North Ame 2001; 27: 215–233.
- [85] Finkelstein JS, Leder BZ, Burnett SA, Wyland JJ, et al. Effects of teriparatide, alendronate, or both on bone turnover in osteoporotic men. J Clin Endocrinol Metab. 2006; 9: Epub ahead of print.
- [86] Adams JS, Song CF, Kantorovich V. Rapid recovery in bone mass in hypercalciuric, osteoporotic men treated with hydrochlorothiazide. Ann Intern Med 1999; 130: 658.
- [87] Dimai HP. Strontium ranelate: a novel concept for the treatment of osteoporosis. Wien Klin Wochenschr 2005; 117: 728–738.
- [88] Ebeling ER. Idiopathic or hypogonadal osteoporosis in men:current and future treatment options. Treat Endocrinol 2004; 3: 381–391.
- [89] Duschek EJJ, Gooren LJ, Netelenbos C. Effects of raloxifene on gonadotrophins, sex hormones, bone turnover and lipids in healthy elderly men. Eur J End 2004; 150: 539–546.
- [90] Rosen CJ, Negro-Vilar A. Novel, non-steroidal, selective androgen receptor modulators (SARMs) with anabolic activity in bone and muscle and improved safety profile. J Musculoskelet Neuronal Interact 2002; 2: 222–224.
- [91] Kahn AJ, Halloran B. Dehydroepiandrosterone supplementation and bone turnover in modele-aged to elderly men. JCEM 2002; 87: 1544–1549.