Papilomaviry a jejich role v patogenezi karcinomu děložního hrdla
Soustavným výzkumem v oblasti molekulárně-biologické, imunologické a epidemiologické bylo prokázáno, že etiologickým faktorem vzniku karcinomu děložního hrdla (KDH) jsou onkogenní typy lidských papilomavirů (HPV), které infikují genitální trakt člověka. KDH je závažné onemocnění, ve srovnání se zeměmi EU je jeho incidence a mortalita v České republice poměrně vysoká, i když lze identifikovat a léčit léze, které jeho rozvoji předcházejí. Úsilí vědců zabývajících se v posledních 25 letech studiem HPV vyústilo ve vývoj preventivních HPV vakcín schopných zabránit infekci vakcinálními typy HPV a rovněž vzniku závažných lézí s těmito typy spojených. Výzkum HPV rovněž ukázal, že stejné typy HPV jsou spojeny s částí nádorových onemocnění v anogenitální oblasti a také v oblasti hlavy a krku. Můžeme tedy očekávat, že očkování proti HPV povede nejen ke snížení incidence KDH, ale také ke snížení četnosti výskytu malignit v dalších anatomických lokalitách.
Úvod
Karcinom děložního hrdla (KDH) je v celosvětovém měřítku druhým nejčastějším maligním onemocněním u žen [1]. Každý rok onemocní téměř půl milionu žen a více než 270 000 jich na následky KDH zemře. Nejhorší situace je v rozvojových zemích, na které připadají více než čtyři pětiny případů. Přes veškeré pokroky v onkologické léčbě se však poměr mezi počtem nových případů a úmrtí v rozvinutých a rozvojových zemích příliš neliší (48 % vs. 57 %) [2].
Již v polovině 19. století si italský lékař Rigoni-Stern při analýze úmrtních listů pacientek, které ve Veroně zemřely v letech 1760–1839 na nádorová onemocnění, povšiml, že úmrtí na KDH byla velice vzácná u jeptišek a panen v porovnání s vdanými ženami a vdovami. Svá pozorování zveřejnil [3], nicméně až do poloviny minulého století jeho studie upadla v zapomnění. V té době se totiž začaly objevovat první z řady epidemiologických studií, které ukazovaly, že vznik KDH souvisí se stylem sexuálního života, především s jeho zahájením v raném věku a s počtem sexuálních partnerů [4, 5], a je tedy s nejvyšší pravděpodobností vyvolán nějakým sexuálně přenosným infekčním agens. Snaha vědců takový patogen identifikovat ukázala koncem 60. let na herpes simplex virus typu 2 (HSV2), který se přenáší pohlavním stykem a způsobuje často se opakující onemocnění – genitální herpes. Výsledky séroepidemiologických studií provedených v různých zemích světa ukazovaly, že protilátky proti HSV2 se daleko častěji vyskytují v sérech nemocných žen než v sérech kontrolních zdravých osob [6]. Všechny tyto studie však byly retrospektivní, sledovaly výskyt protilátek u žen již nemocných, a tak byla v polovině 70. let v Praze započata prospektivní studie zahrnující 10 000 žen, jejímž cílem bylo potvrdit předchozí pozorování. Její výsledky však byly překvapivé pro všechny zúčastněné. Prevalence protilátek proti HSV2 byla ve skupině zdravých žen, u kterých se v průběhu studie objevila na děložním hrdle závažná intraepiteliální léze, stejná jako u skupiny pečlivě vybraných kontrolních žen, které po celou dobu sledování zůstaly bez jakéhokoliv atypického nálezu. Studie tedy vyloučila, že HSV2 je etiologickým faktorem vzniku KDH [7].
V době ukončení prospektivní studie se objevily první dva články, které popisovaly nález DNA lidských papilomavirů (HPV) v buňkách KDH. Jednalo se o dva zcela nové typy – HPV16 a 18 [8, 9]. Do té doby byly HPV považovány za původce víceméně neškodných bradavic – kožní bradavice a jejich různá morfologie byly známy již z dob starého Říma, genitální bradavice, jejichž výskyt byl spojován s „nečistými" sexuálními, ponejvíce homosexuálními praktikami, z dob Hippokratových.
Výzkum HPV doznal v průběhu několika let od původního pozorování přítomnosti HPV DNA v buňkách KDH bouřlivý rozvoj. Hlavním cílem bylo shromáždit důkazy o etiologickém vztahu mezi HPV a KDH a v případě kladného výsledku připravit vakcínu, která by umožnila/usnadnila eliminaci tohoto závažného onemocnění.
Papilomaviry
Papilomaviry (PV) jsou malé onkogenní DNA nádorové viry, v současné době řazené do samostatné čeledi Papillomaviridae. V roce 2000 byly vyňaty z taxonomické čeledi Papovaviridae, kam byly tradičně řazeny společně s polyomaviry na základě morfologické podobnosti, nepřítomnosti obalu a virové genetické informace ve formě dvouvláknové uzavřené molekuly DNA. Ukázalo se totiž, že se značně odlišují velikostí svého genomu a virově specifické proteiny nejsou homologní.
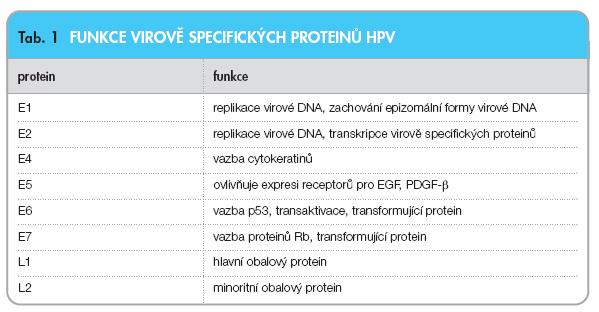
Papilomavirovou DNA o velikosti 7400–8200 párů bazí dělíme do 3 oblastí – oblast E (early), která kóduje až 7 časných proteinů E1–E7, oblast L (late) kódující dva obalové proteiny L1 a L2 a nekódující oblast LCR (long control region), v níž jsou uloženy sekvence, které řídí životní cyklus viru a interagují s různými buněčnými proteiny. Všechny kódující sekvence jsou uloženy na jednom vlákně virové DNA. Promotory pro transkripci všech genů jsou uloženy v LCR (p97 – časný) a E6 a E7 oblasti (p670 – pozdní) a všechny transkripty jsou poté upraveny sestřihem. Funkce jednotlivých virově specifických proteinů HPV jsou uvedeny v tab. 1.
Nejdůležitější z hlediska vzniku nádorových onemocnění jsou proteiny E6 a E7 vysokorizikových typů HPV (viz níže). Do centra zájmu se dostaly poté, co se ukázalo, že se jejich vlastnosti podobají vlastnostem onkoproteinů jiných nádorových DNA virů. DNA-vazebný protein E6 se váže na buněčný antionkoprotein p53 a inaktivuje ho – komplex E6/p53 je rychle degradován ubiquitin-proteázovou dráhou. Další studie ukázaly, že E6 interaguje i s dalšími buněčnými proteiny; výsledkem je zablokování přirozené smrti buňky – apoptózy, zvýšení telomerázové aktivity, změny v buněčné transkripci, prodloužení doby života buňky atd. Vazba jaderného proteinu E7 na antionkoprotein pRb105 a příbuzné proteiny brání jeho vazbě s E2F transkripčními faktory bez ohledu na přítomnost vnějších růstových faktorů, které jsou v neinfikované tkáni nutné pro přechod buněčného cyklu do S-fáze. Buňka tedy přechází do S-fáze pouze díky přítomnosti E7 [10]. Všechny tyto jevy mohou přispívat k nekontrolovatelné proliferaci a maligní transformaci postižené buňky.
Klasifikace
PV infikují většinu vyšších obratlovců a jsou druhově nepřenosné. Jednotlivé typy jsou rozlišeny na základě genomu, liší se od sebe více než 10 % nukleotidové sekvence genu pro hlavní obalový protein L1. V rámci jednotlivých typů jsou dále definovány subtypy s 2–10% rozdílem nukleotidové sekvence, které jsou poměrně vzácné, a varianty se sekvencí rozdílnou v méně než 2 %. Vzácný výskyt subtypů u člověka je pravděpodobně způsoben genetickou stálostí jednotlivých typů, které existovaly pravděpodobně již v době, kdy se druh Homo sapiens na Zemi objevil. Naopak varianty jsou poměrně časté, mutace se nejčastěji vyskytují v nekódující oblasti genomu. Nyní je známa alespoň částečná sekvence asi 300 typů PV, z nichž asi 120 typů infikuje člověka.
Kromě druhové specifity jsou PV také tkáňově specifické. Infikují exkluzivně epiteliální buňky, k infekci jsou vnímavé nezralé buňky v bazální vrstvě epitelu. Viry do nich vstupují přes mikroskopická poranění; zvláště náchylné k infekci je rozhraní mezi cylindrickým a dlaždicovým epitelem, které se nachází na děložním hrdle, v anální oblasti a na epiglotis.
Životní cyklus
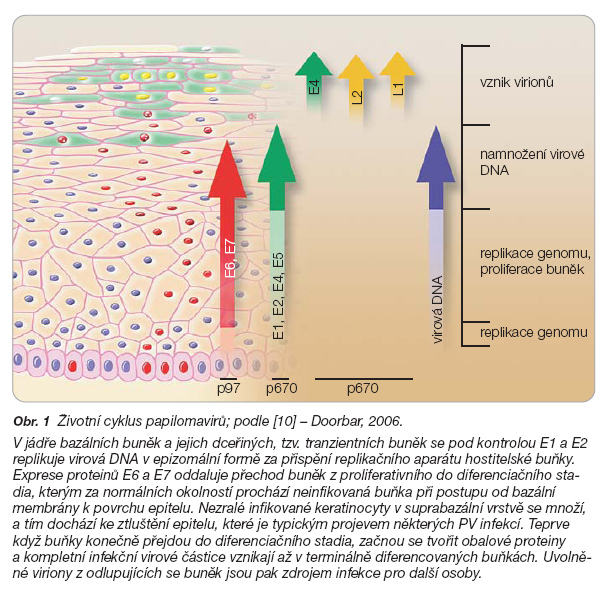
Replikační cyklus PV je úzce svázán s diferenciací stratifikovaného epitelu. Fáze životního cyklu od replikace virové DNA v jádře bazálních buněk až po uvolnění virionů jsou znázorněny a detailněji popsány na obr. 1.
Podle tkáňové specifity dělíme PV na kožní a slizniční a podle schopnosti indukovat nádorové bujení na nízkorizikové (low-risk, LR) a vysokorizikové (onkogenní, high-risk, HR). Genitální trakt člověka infikuje přibližně 40 typů HPV, jejichž onkogenní potenciál je uveden v tab. 2.
Epidemiologie
Genitální typy HPV se šíří především sexuálním stykem, nelze vyloučit ani přenos z matky na novorozence. Ve vyspělých zemích jsou v současnosti papilomaviry nejčastějším sexuálně přenosným virovým agens [11]; až 80 % sexuálně aktivních lidí je v průběhu života nakaženo alespoň jedním typem. Infekční potenciál HPV je srovnatelný s bakteriálními patogeny přenosnými sexuální cestou. Další virové patogeny se stejným způsobem přenosu (HIV, HSV2) jsou mnohem méně infekční [12].
Prevalence genitálních infekcí HPV u žen s normálním cytologickým nálezem se v celosvětovém měřítku udává v rozmezí 2–44 % [13, 14]. Široké rozmezí je dáno technikami použitými pro detekci HPV DNA, různými věkovými skupinami vyšetřovaných žen, geografickými rozdíly atd. HPV prevalence vztažená k věku je globálně 10,41 %, ale mezi jednotlivými regiony existují značné rozdíly (od Asie – 7,95 % a Evropy – 8,08 % po Afriku – 22,1 %). Každý rok se infikuje HPV asi 300 milionů žen, z toho odhadem asi 100 milionů typy 16 a 18 [12]. Infekce HPV vrcholí u sexuálně aktivních žen před dosažením 25. roku věku (15–40 %), poté klesá a po 35. roce věku je infikováno 5–10 % žen.
Rizikovými faktory pro infekci jsou časné započetí sexuálního života a krátká doba mezi menarché a sexuálním stykem [15] a počet sexuálních partnerů. Riziko infekce HPV žen stoupá rovněž se zvyšující se sexuální promiskuitou jejich mužských partnerů [16].
Imunita
Protože je infekce HPV omezena na epiteliální buňky a infekční cyklus je zcela závislý na kompletním diferenciačním programu vnímavých buněk, je prezentace virově specifických antigenů imunitnímu systému velice omezena. Papilomaviry jsou navíc schopné imunitnímu dohledu účinně unikat. Infikované buňky nedestruují – uvolňují se z odlupujících se terminálně diferencovaných keratinocytů, které jsou naprogramovány k buněčné smrti bez ohledu na přítomnou virovou infekci. Zánik infikovaných buněk tedy není doprovázen zánětem, který by signalizoval organismu přítomnost patogenu a stimuloval nespecifickou a následně specifickou imunitní odpověď. Profesionální antigen prezentující buňky epitelu, Langerhansovy buňky, sice viriony pohlcují, ale tímto procesem se neaktivují. A konečně PV jsou jako další DNA viry schopné inhibovat tvorbu účinných antivirových imunostimulačních molekul interferonů a a b. Všemi těmito mechanismy oddalují PV vznik účinné specifické imunitní odpovědi. Nová generace virionů se uvolňuje asi měsíc po infekci – je to doba potřebná k přechodu nezralého keratinocytu do plně diferencovaného stadia, nicméně buněčná imunitní odpověď se objevuje až půl roku po infekci a protilátky až 9 měsíců po infekci. Navíc detekovatelné množství protilátek se netvoří u všech infikovaných a jejich hladiny většinou závisí na virové náloži a době perzistence [17, 18]. Protilátky přetrvávají dlouhou dobu, ale nikterak neovlivňují současnou přítomnost infekce, eventuálně asociovaných lézí.
Klinické příznaky infekcí HPV
U většiny mladých žen je infekce genitálními typy HPV asymptomatická a lze ji zjistit pouze metodami molekulární biologie – detekcí HPV DNA [19]. Taková infekce bývá pouze přechodná. Výsledky studie, která se zabývala pravděpodobností infekce a dobou jejího trvání u mladých dívek, ukázaly dvouleté kumulativní riziko incidentní infekce HPV bez ohledu na typ u dívek HPV negativních při vstupu do studie 36,4 %, pro HR typy 29 % a pro LR typy 23,7 % [20]. Infekce HR typy HPV přetrvávala déle (průměrně 18,3 měsíců pro HPV16) než infekce LR typy (průměrně 6,5 měsíců pro HPV6). Po roce sledování zůstalo přibližně 60 % incidentně infikovaných žen HPV DNA pozitivních. Hranice mezi perzistující a přechodnou infekcí není stále zcela jednoznačně definována. Varovným signálem pro infekce, které mají vyšší potenciál ke vzniku závažných klinických nálezů, by mohl být opakovaný pozitivní nález ve vzorcích odebraných v šestiměsíčních či ročních intervalech, doplněný o určení přítomného typu.
Condylomata accuminata – genitální bradavice – jsou klinickým projevem infekce LR HPV, především typy 6 a 11, v daleko menší míře ještě typy 40, 42, 43, 54 a dalšími. Stejné typy se uplatňují při vzniku rekurentní laryngeální papilomatózy, obtížného a někdy život ohrožujícího onemocnění, které postihuje především děti. Tyto typy se pouze vzácně vyskytují v buňkách nádorů spojených s HPV, a to většinou v kombinaci s nějakým onkogenním typem.
Za přispění dalších faktorů mohou latentní perzistující infekce HPV vyvolat vznik intraepiteliálních lézí. Taková infekce definovaná trvalou replikací viru v epiteliálních buňkách je často doprovázena velkou virovou náloží [21, 22]. Hlavní a nejvýznamnější příčinou přetrvávání infekce HPV, která předchází vzniku prekancerózních a nádorových lézí, je neschopnost imunitního systému virovou infekci zlikvidovat. Lehké léze (low-grade intraepithelial lesion – LSIL), které jsou jako genitální bradavice projevem produktivní infekce HPV, u mladých žen většinou spontánně zmizí stejně jako samotná infekce HPV. Pouze malá část z nich přechází do závažných forem (HSIL – high-grade intraepithelial lesion), skutečného prekurzoru KDH. Tyto léze jsou charakteristické extenzivní replikací nezralých epiteliálních buněk ve spodních vrstvách epitelu, které už dále nediferencují a kumulují se v nich další genetické změny, jež posléze mohou vést až k malignímu fenotypu. Podkladem je zpravidla rozštěpení virové DNA a její integrace do genomu buňky. K rozštěpení dochází v oblasti genu E2, jehož produkt při normální replikaci viru tlumí expresi genů E6 a E7. Inaktivací genu E2 se ztrácí kontrola nad geny E6 a E7 (viz výše). Z pohledu viru je to však „nehoda"; v transformované buňce se tvoří pouze časné proteiny, životní cyklus viru není dokončen a infekční potomstvo se netvoří. Bez adekvátního ošetření po různě dlouhé době HSIL přecházejí v invazivní KDH.
V závislosti na tíži léze se zužuje původní spektrum typů HPV. S KDH je spojeno 15–18 HR HPV typů, především typy 16 a 18 (celosvětově přibližně 70 % případů), vzácněji pak typy jako 31, 33, 35, 39, 45 a další. Typ 16 se nejčastěji vyskytuje ve všech intraepiteliálních lézích děložního hrdla [23, 24]. Další rizikové faktory vzniku KDH jsou kromě nezbytně nutné perzistující infekce onkogenními typy HPV stejné jako v případě infekcí HPV. Je to v prvé řadě sexuální chování žen i jejich sexuálních partnerů, dále pak kouření [25], infekce HIV, velký počet porodů (> 7) [26], dlouhodobé užívání perorální antikoncepce [27] a současná infekce dalšími sexuálně přenosnými patogeny (přítomnost protilátek proti Chlamydia trachomatis, HSV2 [28, 29]). Pro poslední tři jmenované faktory je třeba zdůraznit, že tato pozorování nejsou konzistentní [30].
Prevence karcinomu děložního hrdla
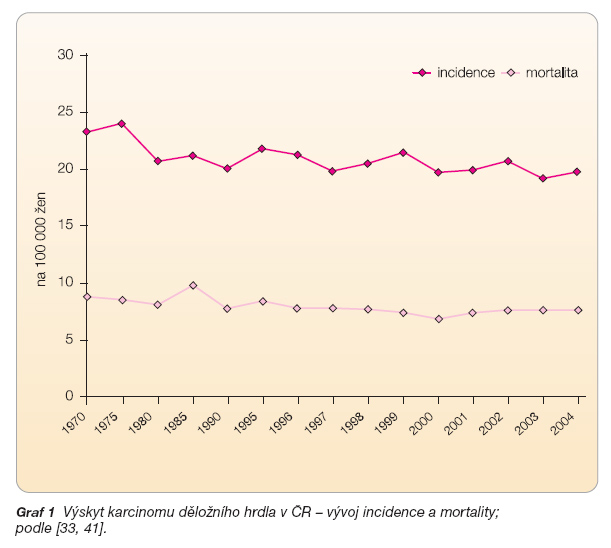
V současné době je znám hlavní etiologický faktor vzniku KDH a je rovněž známo, že jeho rozvoji předchází vznik klinicky patrných lézí. Od primární infekce ke vzniku nádoru uplynou řádově desítky let, v průběhu kterých lze premaligní stadia rozpoznat a odstranit. Jde tedy o onemocnění, jehož výskyt lze podstatně snížit preventivními programy. V současné době je hlavní metodou prevence KDH cytologický screening, který detekuje ve stěru z děložního hrdla abnormální buňky. Cytologická diagnostika změn na děložním hrdle byla vyvinuta již ve 20. letech minulého století Papanicolaouem [31]. Po roce 1940 byla tato metoda zavedena do široké klinické praxe a díky jejímu využití poklesl v padesátých letech ve Spojených státech počet úmrtí žen ve věku 35–40 let na následky KDH na polovinu. Zavedení organizovaného screeningu, jehož se účastní alespoň 80 % ženské populace v určitém věkovém rozmezí, přičemž je zajištěna účinná kontrola kvality práce na všech úrovních (cytologická laboratoř, gynekologická praxe, léčba), snížilo incidenci KDH ve Finsku ze 14,9/100 000 žen v 60. letech na 3,3/100 000 žen v roce 2005 [32]. V zemích Evropské unie byla v roce 2002 incidence 12,2/100 000 a v České republice se incidence dlouhodobě pohybuje kolem 20/100 000 žen (graf 1) [33, 41].
HPV vakcíny
Od okamžiku rozpoznání infekčního agens zodpovědného za vznik KDH směřovalo úsilí vědců angažovaných ve výzkumu HPV k vývoji vakcíny, která by zabránila vstupu HPV do vnímavých buněk nebo by umožnila likvidaci buněk infikovaných nebo buněk již v důsledku infekce pozměněných. Výzkum papilomavirů je obecně v důsledku jejich biologických vlastností nesnadný, jeho pokroky jsou zcela závislé na metodologii molekulární biologie a stejné postupy bylo třeba uplatnit i při vývoji vakcín. HPV vakcíny lze rozdělit do dvou skupin – vakcíny preventivní, jejichž aplikace navodí v organismu tvorbu neutralizačních protilátek schopných zabránit infekci, a vakcíny terapeutické, které indukují tvorbu specifických imunitních buněk namířených proti časným virově specifickým proteinům, exponovaným na povrchu infikovaných/ pozměněných buněk. Klíčovou úlohu hrají cytotoxické T lymfocyty, které infikovanou/pozměněnou buňku rozpoznají právě díky přítomnosti těchto proteinů a zničí ji. Preventivní vakcíny by měly obsahovat složky virové kapsidy, která na sobě nese neutralizační epitopy. V těžkých lézích na děložním hrdle se už obalové proteiny netvoří, takže vakcíny na nich založené nemohou účinnou buněčnou imunitní odpověď vyvolat. Nejdůležitějšími proteiny, proti kterým by terapeutická vakcína měla být namířena, jsou onkoproteiny E6 a E7, eventuálně protein E2.
Největšího pokroku se podařilo dosáhnout v oblasti preventivních HPV vakcín. Jejich příprava byla podnícena poznáním, že hlavní obalový protein L1 produkovaný ve velkém množství v různých rekombinantních systémech (virus vakcínie [34], hmyzí baculoviry [35], kvasinky [36]), vytváří spontánně tzv. viru podobné částice (VLP, kapsidy). Ty jsou morfologicky nerozeznatelné od infekčních virionů, které nenesou virovou DNA, a tudíž nemohou infikovat vnímavé buňky, ale na svém povrchu mají neutralizační epitopy. Po úspěšných experimentálních pokusech na zvířatech započaly v polovině 90. let minulého století první klinické studie. V průběhu let se takové vakcíny ukázaly jako neškodné, imunogenní, schopné zabránit jak perzistující infekci, tak vzniku klinicky patrných lézí spojených s typy HPV obsaženými ve vakcínách. Nejžhavějšími kandidáty na preventivní vakcínu byly HPV typy 16 a 18 spojené s více než 70 % případů KDH. Jsou obsaženy ve vakcíně již dostupné pod komerčním názvem Gardasil, která je distribuována v České republice pod názvem Silgard, a rovněž ve druhé vakcíně, která je u nás komerčně dostupná od října 2007 pod názvem Cervarix. Vakcína Silgard (Gardasil) obsahuje kromě dvou zmíněných HR typů HPV ještě kapsidy LR typů 6 a 11 zodpovědných za více než 90 % případů genitálních bradavic. Obě vakcíny obsahují vysoce purifikované VLP, kromě složení se liší ještě v několika dalších parametrech (tab. 3).
V klinických studiích byly obě vakcíny bezpečné, zabránily téměř 100 % perzistentních infekcí definovaných jako opakovaný nález vakcinálního typu viru po šesti měsících a 100 % HSIL na děložním hrdle spojených s vakcinálními typy. V pětiletém sledování se ochranný efekt po aplikaci obou vakcín nezměnil [37, 38]. Sérokonverze u očkovaných jedinců je 100 %. Hladiny protilátek proti typům HPV obsaženým ve vakcínách dosahují vrcholu 7. měsíc po podání první dávky, poté poklesnou a od 18. měsíce zůstávají na stejné úrovni [39].
Z výsledků klinických studií vyplývá, že preventivní HPV vakcíny jsou maximálně účinné u dívek a žen, které se s infekcí typy HPV, jež jsou součástí vakcíny, dosud nesetkaly. U žen s probíhající infekcí (HPV DNA+, séronegativní) studie prokázaly pouze malou účinnost ve smyslu rozvoje lézí, ženy s perzistentní infekcí (HPV DNA+, séropozitivní) chráněny nebyly. Sledování těchto skupin je však krátkodobé a jejich počty jsou poměrně nízké, takže se pozorované účinky mohou změnit. Je však vysoce pravděpodobné, že vakcíny nebudou schopny potlačit přetrvávající infekci.
Očekávání spojená s HPV vakcínami
Vakcíny jsou tedy mimořádně účinným nástrojem primární prevence lézí, které předcházejí vzniku KDH a které jsou vyvolány infekcí vakcinálními typy HPV. Jejich ochranný efekt vyjádřený poklesem incidence KDH se však může projevit v horizontu desetiletí, v kratším časovém horizontu můžeme očekávat snížení výskytu abnormálních nálezů (ASC, až 19 % spojeno s HPV16/18), LSIL (až 24 %) a HSIL (57 %) [40]. V případě vakcíny Silgard by pokles abnormálních a LSIL nálezů mohl být ještě vyšší díky přítomnosti VLP LR typů HPV 6/11 ve vakcíně. Navíc by v poměrně krátké době došlo k radikálnímu snížení incidence genitálních bradavic. Kromě závažných změn na děložním hrdle je infekce HR typy HPV spojena s dalšími nádorovými onemocněními v anogenitální oblasti a také v oblasti hlavy a krku. Nelze opominout také rekurentní laryngeální papilomatózu, velice úporné onemocnění vyvolané LR typy HPV6 a 11. Preventivní očkování proti HPV by tedy snížilo nejen výskyt KDH, ale i nádorů v dalších anatomických lokalitách. Je třeba zdůraznit, že k významnému poklesu výskytu výše uvedených chorob dojde pouze v případě, že bude proočkována majoritní část populace. Toho lze ovšem dosáhnout pouze v rámci povinného očkování dětí. Pokud budou imunizováni pouze jednotlivci, bude pokles z celospolečenského hlediska nevýznamný. Jak již bylo uvedeno, vakcíny jsou namířeny pouze proti typům HPV spojeným se 70 % KDH. Zbývajících 30 % případů je spojeno s dalšími onkogenními typy, proti kterým vakcíny nejsou účinné. Každá očkovaná žena tedy musí být důrazně poučena o tom, že je nezbytně nutné, aby se i nadále účastnila programu prevence KDH.
Vývoj HPV vakcín není zdaleka ukončen. Je třeba pracovat na zdokonalení vakcín současných ve smyslu ochrany proti širšímu spektru typů HPV a rovněž pokračovat ve vývoji vakcín terapeutických. Ještě dlouhou řadu let bude totiž v populaci mnoho žen infikovaných HR typy HPV, a tím ohrožených vznikem KDH. Terapeutické vakcíny založené na časných virově specifických proteinech by toto riziko mohly snížit na minimum.
Práce je podporována grantem IGA MZ ČR reg. č. NR/8852–3.
Seznam použité literatury
- [1] Parkin DM. The global health burden of infection-associated cancers in the year 2002. Int J Cancer 2006; 118: 3030–3044.
- [2] Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin 2005; 55: 74–108.
- [3] Rigoni-Stern D. Fatti statistici relativi alle malattie cancerose. Gior Servire Progr Pathol Terap 1842; 2: 507–517.
- [4] Gagnon F. Contribution to the study of the etiology and prevention of cancer of the cervix of the uterus. Am J Obstet Gynecol 1950; 60: 516–522.
- [5] Rotkin ID. Relation of adolescent coitus to cervical cancer risk. JAMA 1962; 179: 486–491.
- [6] Melnick JL, Adam E. Epidemiological approaches to determining whether herpesvirus is the etiological agent of cervical cancer. Prog Exp Tumor Res 1978; 21: 49–69.
- [7] Vonka V, Kaňka J, Roth Z. Herpes simplex type 2 virus and cervical neoplasia. Adv Cancer Res 1987; 48: 149–191.
- [8] Dürst M, Gissmann L, Ikenberg H, zur Hausen H. A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions. Proc Natl Acad Sci USA 1983; 80: 3812–3815.
- [9] Boshart M, Gissmann L, Ikenberg H, et al. A new type of papillomavirus DNA, its presence in genital cancer biopsies and in cell lines derived from cervical cancer. EMBO J 1984; 3: 1151–1157.
- [10] Doorbar J. Molecular biology of human papillomavirus infection and cervical cancer. Clin Sci (Lond) 2006; 110: 525–541.
- [11] Cates W, Jr. Estimates of the incidence and prevalence of sexually transmitted diseases in the United States. American Social Health Association Panel. Sex Transm Dis 1999; 26: S2–S7.
- [12] Burchell AN, Winer RL, de SS, Franco EL. Chapter 6: Epidemiology and transmission dynamics of genital HPV infection. Vaccine 2006; 24 (Suppl. 3): S52–S61.
- [13] Bosch FX, de SS. Chapter 1: Human papillomavirus and cervical cancer-burden and assessment of causality. J Natl Cancer Inst Monogr 2003; 3–13.
- [14] Baseman JG, Koutsky LA. The epidemiology of human papillomavirus infections. J Clin Virol 2005; 32 (Suppl. 1): S16–S24.
- [15] Kahn JA, Rosenthal SL, Succop PA, et al. The interval between menarche and age of first sexual intercourse as a risk factor for subsequent HPV infection in adolescent and young adult women. J Pediatr 2002; 141: 718–723.
- [16] Winer RL, Lee SK, Hughes JP, et al. Genital human papillomavirus infection: incidence and risk factors in a cohort of female university students. Am J Epidemiol 2003; 157: 218–226.
- [17] Nonnenmacher B, Pintos J, Bozzetti MC, et al. Epidemiologic correlates of antibody response to human papillomavirus among women at low risk of cervical cancer. Int J STD AIDS 2003; 14: 258–265.
- [18] Ho GYF, Studentsov YY, Bierman R, Burk RD. Natural history of human papillomavirus type 16 virus-like particle antibodies in young women. Cancer Epidemiol Biomarkers Prev 2004; 13: 110–116.
- [19] Garland SM. Human papillomavirus update with a particular focus on cervical disease. Pathology 2002; 34: 213–224.
- [20] Richardson H, Kelsall G, Tellier P, et al. The natural history of type-specific human papillomavirus infections in female university students. Cancer Epidemiol Biomarkers Prev 2003; 12: 485–490.
- [21] Ho GY, Burk RD, Klein S, et al. Persistent genital human papillomavirus infection as a risk factor for persistent cervical dysplasia. J Natl Cancer Inst 1995; 87: 1365–1371.
- [22] Mun~oz N, Bosch FX, de Sanjose S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003; 348: 518–527.
- [23] Clifford GM, Smith JS, Aguado T, Franceschi S. Comparison of HPV type distribution in high-grade cervical lesions and cervical cancer: a meta-analysis. Br J Cancer 2003; 89: 101–105.
- [24] Clifford GM, Rana RK, Franceschi S, et al. Human papillomavirus genotype distribution in low-grade cervical lesions: comparison by geographic region and with cervical cancer. Cancer Epidemiol Biomarkers Prev 2005; 14: 1157–1164.
- [25] IARC. IARC Monographs on the Evaluation on the Carcinogenic Risks to Humans. Tobacco smoke and Involuntary Smoking, ed. Lyon: IARC Press, 2004.
- [26] Mun~oz N, Franceschi S, Bosetti C, et al. Role of parity and human papillomavirus in cervical cancer: the IARC multicentric case-control study. Lancet 2002; 359: 1093–1101.
- [27] Moreno V, Bosch FX, Mun~oz N, et al. Effect of oral contraceptives on risk of cervical cancer in women with human papillomavirus infection: the IARC multicentric case-control study. Lancet 2002; 359: 1085–1092.
- [28] Smith JS, Mun~oz N, Herrero R, et al. Evidence for Chlamydia trachomatis as a human papillomavirus cofactor in the etiology of invasive cervical cancer in Brazil and the Philippines. J Infect Dis 2002; 185: 324–331.
- [29] Smith JS, Herrero R, Bosetti C, et al. Herpes simplex virus-2 as a human papillomavirus cofactor in the etiology of invasive cervical cancer. J Natl Cancer Inst 2002; 94: 1604–1613.
- [30] Castle PE, Wacholder S, Lorincz AT, et al. A prospective study of high-grade cervical neoplasia risk among human papillomavirus-infected women. J Natl Cancer Inst 2002; 94: 1406–1414.
- [31] Papanicolaou GN. New cancer diagnosis. Battle Creek, Michigan: Race Betterment Foundation; 1928.
- [32] http://www.cancerregistry.fi/stats/eng/veng0006i0. html
- [33] Novotvary 2003 CR; Cancer Incidence 2003 in the Czech Republic. UZIS CR, NOR CR, 2006.
- [34] Zhou J, Sun XY, Stenzel DJ, Frazer IH. Expression of vaccinia recombinant HPV 16 L1 and L2 ORF proteins in epithelial cells is sufficient for assembly of HPV virion-like particles. Virology 1991; 185: 251–257.
- [35] Kirnbauer R, Booy F, Cheng N, et al. Papillomavirus L1 major capsid protein self-assembles into virus-like particles that are highly immunogenic. Proc Natl Acad Sci USA 1992; 89: 12 180–12 184.
- [36] Sasagawa T, Pushko P, Steers G, et al. Synthesis and assembly of virus-like particles of human papillomaviruses type 6 and type 16 in fission yeast Schizosaccharomyces pombe. Virology 1995; 206: 126–135.
- [37] Villa LL, Costa RLR, Petta CA, et al. High sustained efficacy of a prophylactic quadrivalent human papillomavirus types 6/11/16/18 L1 virus-like particle vaccine through 5 years of follow-up. Br J Cancer 2006.
- [38] Harper DM, Franco EL, Wheeler CM, et al. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised control trial. Lancet 2006; 367: 1247–1255.
- [39] Villa LL, Ault KA, Giuliano AR, et al. Immunologic responses following administration of a vaccine targeting human papillomavirus Types 6, 11, 16, and 18. Vaccine 2006; 24: 5571–5583.
- [40] Clifford G, Franceschi S, Diaz M, et al. Chapter 3: HPV type-distribution in women with and without cervical neoplastic diseases. Vaccine 2006; 24 (Suppl. 3): S26–S34.
- [41] http://www.uzis.cz