Parkinsonova nemoc, antiparkinsonika a kognitivní funkce
Parkinsonova nemoc (PN) je neuro-degenerativní onemocnění postihující 100 až 150 pacientů na 100 000 obyvatel. Onemocní asi 1 % osob starších 60 let.
Patologie
Parkinsonský syndrom je převážně, i když ne výlučně, zapříčiněn poruchou dopaminergní inervace striata vedoucí k poruše funkce zpětnovazebních okruhů zvaných extrapyramidový systém. U PN je konstantním nálezem zánik neuronů a makroskopicky zřejmá depigmentace v substantia nigra pars compacta. Přežívající neurony obsahují málo melaninu nebo žádný melanin. PN (podobně jako demence s Lewyho tělísky – DLB) patří mezi tzv. synukleinopatie, tj. proteinopatie, které se vyznačují patologickým ukládáním proteinu a-synukleinu v neuronech a buňkách glie ve specifických oblastech kůry a podkoří. Protein a-synuklein je obsažen v Lewyho tělískách (patologický marker pro diagnózu PN a DLB), dystrofických Lewyho neuritech a/nebo v neuronálních a gliových inkluzích. Nejvýznamnějším biochemickým nálezem je snížení obsahu dopaminu v bazálních gangliích, zejména ve striatu, které je důsledkem atrofie pigmentových neuronů v substantia nigra. Dopamin je totiž transmiterem nigrostriatální dráhy. Deficit dopaminu je příčinou hlavních parkinsonských syndromů, což je podkladem léčebného účinku farmakologického posílení dopaminergního systému. Ve striatu vzniká také relativní hyperfunkce cholinergních neuronů, jejichž terapeutická korekce anticholinergiky byla zavedena již v předminulém století jako první racionální terapie parkinsonského syndromu. Naproti tomu u části pacientů, u nichž se vedle parkinsonské symptomatiky vyskytuje i demence, byla zjištěna degenerace cholinergních neuronů v substantia innominata (nucleus basalis Meynerti) [13, 29–31].
Diagnostika PN
Pro klinickou diagnózu PN (UK Parkinson´s Disease Society Brain Bank Clinical Diagnostic Criteria, [12]) musí být přítomna:
– ‑bradykineze (progresivní snížení rychlosti a amplitudy všech pohybů, porucha iniciace volního pohybu)
a nejméně jeden z následujících příznaků:
– ‑svalová rigidita
– ‑klidový třes (4–6 Hz)
– ‑posturální instabilita nezpůsobená primární poruchou zrakovou, vestibulární, mozečkovou nebo proprioceptivní.
Diagnózu PN dále podporují tyto příznaky:
– ‑jednostranný začátek
– ‑přítomnost klidového třesu
– ‑progresivní průběh
– ‑přetrvávající asymetrie s těžším postižením na začátku
– ‑významná odpověď na L-dopa (70–100% zlepšení)
– ‑výrazná chorea po dávce L-dopa
– ‑klinické trvání 10 let a více.
Zároveň je nutné vyloučit jiná onemocnění projevující se parkinsonským syndromem (zhodnocení zpochybňujících a vylučujících kritérií PN, viz tab. 1).
Tato kritéria jsou pomocná, nejsou absolutní, nepřipouštějí možnost koincidence více onemocnění.
Časté, i když méně než předchozí, jsou u PN další skupiny příznaků:
– ‑poruchy funkce vegetativního systému
– ‑poruchy psychické (např. anxieta, deprese, halucinace, psychóza, kognitivní porucha, demence)
– ‑poruchy senzitivní a senzorické
– ‑poruchy spánku.
Na kvalitě života se pochopitelně podílí hybné postižení, avšak ještě větší význam mohou hrát psychické faktory, jako např. deprese nebo kognitivní deficit [34].
Kognitivní porucha u pacientů s PN
U všech pacientů s PN dochází k degeneraci dopaminergních buněk v substantia nigra pars compacta (buněčný komplex A9), která je u většiny pacientů v menším rozsahu kombinována také s degenerací dopaminergních buněk ve ventrálním tegmentu (buněčný komplex A10) a s degenerací buněk noradrenergních (locus coeruleus), cholinergních (nucleus basalis Meynerti) a serotoninergních (nuclei dorsales rapheae) [5, 29, 32].
Jestliže dojde pouze k zániku buněk komplexu A9, klinické symptomy jsou převážně motorické, avšak zároveň se mohou objevit i drobné kognitivní poruchy, které jsou obvykle lehkého stupně, ohraničené, diskrétní a selektivní. Jedná se o tzv. poruchy exekutivních funkcí, které se uplatňují při úkonech směřujících k určitému cíli (naplánování, iniciace, zaměření a udržení pozornosti, monitorování provádění úkolu za účelem dosažení určitého specifického cíle). Charakteristicky se projeví v testu třídění karet (Wisconsin Card Sorting Test), který vyšetřuje pracovní paměť, pozornost a schopnost rychlé změny „vnitřní" strategie [5, 17, 23]. U pacientů s PN bez demence lze obecně pozorovat narušené provádění úkolů bez vnějších stimulů (např. senzorických). Poruchy může částečně kompenzovat chování řídící se vnějšími podněty. Toto platí i v případě poruchy chůze: pacientovi se lépe jde po schodech nežli po rovině. Nácvik senzorických triků (např. počítání, rytmická hudba, překračování čar na podlaze) se proto uplatňuje při rehabilitaci pacientů s PN. Také časné paměťové deficity lze chápat v tomto smyslu: je poškozena volná výbavnost – free recall – (tak jak ji vyšetřuje například test verbální fluence), nikoli však výbavnost po nápovědě – cued recall (pacient je schopen rozpoznat zapamatovaná slova na seznamu). Některé recentní studie prokazují, že časné selektivní frontální dysfunkce mají prediktivní hodnotu pro rozvoj demence (např. časné poruchy v testu verbální fluence) [18, 25]. Tzv. prefrontální syndrom se projevuje nejen poruchou motoriky a kognitivní poruchou, ale i behaviorálními symptomy. Především ze studií s použitím funkčních zobrazovacích metod je známo, že v rámci prefrontálního syndromu jsou poruchy exekutivních funkcí anatomicky vázány na dorzolaterální prefrontální kortex, dezinhibiční chování s imitací a utilizací na orbitofrontální kortex a zvýšená apatie, snížení zájmu a chudost pohybů na přední cingulum [4, 32].
Kognitivní poruchy mohou progredovat do demence u 20–40 % pacientů. Rozvoj demence u PN snižuje kvalitu života, zvyšuje stres pečovatele, zkracuje dobu setrvání pacienta v kruhu rodiny a urychluje jeho umístění do ústavu s ošetřovatelskou péčí. Demence významně zkracuje dobu přežití pacientů s PN (způsobuje dvojnásobný nárůst mortality) [3, 30, 32]. Patofyziologicky se pravděpodobně uplatňuje jednak současný úbytek buněk v buněčném komplexu A10, jednak rozsáhlejší degenerativní procesy včetně zániku především cholinergních, ale i adrenergních a serotoninergních buněk a přerušení jejich vzestupných drah [3, 32]. Neuropsychologický profil demence u PN je charakterizován progresivním dysexekutivním syndromem s paměťovým deficitem a poruchou abstraktního myšlení. Riziko rozvoje demence u pacientů s PN je 1,7–5,9krát vyšší než u běžné populace stejného věku, vzdělání a pohlaví. Rizikové faktory zahrnují věk pacienta (spíše nežli věk v počátku onemocnění), tíži parkinsonského syndromu (především akineze a axiální symptomatiky), nízký dosažený stupeň vzdělání, familiární výskyt demence, přítomnost psychotické poruchy navozené medikací a podle některých studií i přítomnost deprese [3, 30, 32].
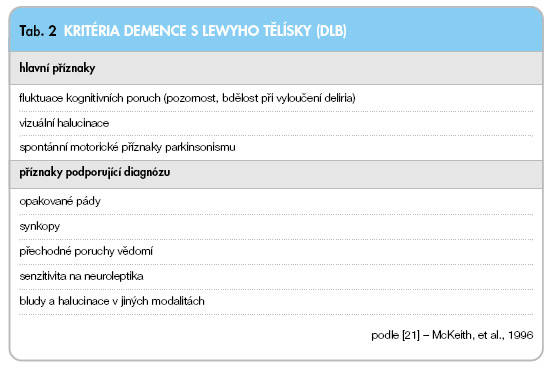
Od demence při PN je třeba odlišit demenci s Lewyho tělísky (DLB), viz též tab. 2. Pro DLB jsou charakteristické fluktuace kognitivních funkcí, spontánní příznaky parkinsonismu a časné vizuální halucinace.
Pakliže se objeví parkinsonský syndrom jako první příznak, demence následuje rozvoj hybných příznaků maximálně do 2 let. Diagnózu podporuje senzitivita na neuroleptika (tj. život ohrožující nežádoucí účinky charakterizované přítomností útlumu, zvýšením rigidity, posturální instabilitou, pády a zmateností), přechodné poruchy vědomí, opakované pády, synkopy, bludy a halucinace v jiných než vizuálních modalitách a abnormní chování v REM spánku [3, 21, 30, 32].
Na rozdíl od PN jsou uváděny těžší časné poruchy vizuopercepčních, vizuokonstruktivních a vizuoprostorových schopností, které lze vyšetřit např. testem hodin nebo testem Reyovy figury. Morfologicky se u DLB nacházejí Lewyho tělíska převážně v limbickém kortexu a neokortikálně, přítomny jsou spongiformní změny a také amyloidové plaky a v menší míře i neurofibrilární klubka typická pro Alzheimerovu nemoc [3, 32].
Dopaminomimetika a kognitivní funkce
Z hlediska kognitivních funkcí a možných vyvolávajících faktorů kognitivní poruchy doposud zůstává kontroverzním tématem dlouhodobá terapie léky modulujícími dopaminergní systém. Ascendentní striatoprefrontální dopaminergní projekce pravděpodobně hrají důležitou roli v rozvoji kognitivní poruchy [23], jak například dokládá i studie s použitím pozitronové emisní tomografie (PET) [4]. Tato studie prokazuje korelaci mezi sníženým vychytáváním L-dopa v nucleus caudatus a frontálním kortexu a výkonem v neurokognitivních testech hodnotících verbální fluenci, pracovní paměť a pozornost. Zatímco výkon v některých testech hodnotících exekutivní funkce a pracovní paměť se zlepšuje v souvislosti s dopaminergní medikací [6, 9, 15, 16, 22], jiné studie tento pozitivní efekt dopaminergní medikace neprokazují. Podle některých autorů zůstávají kognitivní funkce nezměněny [10, 35], nebo se dokonce popisuje i zhoršení kognitivního výkonu po dopaminergní terapii [11, 14, 22, 26]. Ze studií s použitím funkční magnetické rezonance vyplývá, že pacienti s PN v časném stadiu onemocnění aktivují při jinak bezchybném provádění kognitivní úlohy rozsáhlejší oblasti prefrontálního kortexu než zdravé věkově vázané kontroly. Tato pravděpodobně kompenzatorně zvýšená aktivace se upravuje po zahájení dopaminergní medikace [19]. Podle Kulisevskyho může souviset efekt dopaminergní léčby se stadiem onemocnění: zatímco L-dopa a agonista dopaminových receptorů navodil zlepšení kognitivních funkcí u de novo doposud neléčených pacientů s PN, u pacientů s fluktuacemi hybného stavu v rámci pokročilé PN byla dopaminergní medikace spojena se zhoršením kognitivního výkonu [14, 15]. Pro tuto hypotézu nesvědčí ovšem práce Taylora a kol. [35], kteří naopak popisovali srovnatelný kognitivní výkon u pacientů s fluktuacemi a dyskinezemi a u doposud neléčených pacientů či pacientů s dobrou odpovědí na dopaminergní medikaci.
V naší randomizované prospektivní multicentrické studii [27] jsme se zaměřili na porovnání profilu kognitivních funkcí u pacientů s PN a probíhající depresivní epizodou před a osm měsíců po nasazení agonistů dopaminových receptorů (pramipexolu a pergolidu) ke stávající léčbě preparáty L-dopa. Jednalo se o skupinu 41 nedementních pacientů v pokročilém stadiu PN s přítomností fluktuací a dyskinezí, kteří byli opakovaně vyšetřeni baterií kognitivních testů hodnotících paměť a exekutivní funkce (použité testy: Trail Making Test, Stroopův test a některé vybrané subtesty z Wechslerovy inteligenční škály – Wechsler Adult Intelligence Scale-revised – WAIS-R). Naše práce nepotvrdila vliv dlouhodobé terapie agonisty dopaminových receptorů pramipexolem nebo pergolidem na kognitivní funkce u pacientů s pokročilou PN bez kognitivního deficitu, zatímco v obou skupinách (pacientů užívajících pramipexol nebo pergolid) došlo ke zlepšení hybných funkcí, pozdních hybných komplikací a v případě pramipexolu i k pozitivnímu ovlivnění deprese.
Jelikož různé oblasti prefrontálního kortexu jsou různou měrou aktivovány různými úlohami, lze si představit, že pouze při provádění určitých kognitivních úloh se na aktuálním výkonu pacienta negativně projeví hypotetický fenomén tzv. overstimulation, tj. patologicky zvýšené dopaminergní stimulace v určitých oblastech prefrontálního kortexu [11, 14]. Zajdeme-li ještě dále, můžeme hypotetizovat i o vznikající dysbalanci mezi dopaminem a acetylcholinem v určitých oblastech mozkové kůry. Zda jsou tyto hypotézy správné, nebo ne, bude ještě nutno v budoucnu ověřit.
Dopaminomimetika v léčbě PN:
1. Prekurzor dopaminu: L-DOPA
2. Agonisté dopaminových receptorů
3. Léky snižující odbourávání DA (inhibitory MAO-B, inhibitory COMT)
Příklady léků v jednotlivých skupinách:
L-DOPA: Madopar®, Isicom®, Nakom®, Sinemet®, Stalevo® (spolu s inhibitorem COMT). Agonisté dopaminových receptorů: Mirapexin®, Requip®, Permax®, Hizest®. Inhibitory COMT: Comtan®, Stalevo® (spolu s L-dopa v jedné tabletě), Tasmar®.
Léky ovlivňující cholinergní systém
Neurochemicky a z hlediska terapie je významné výrazné snížení kortikální cholinergní aktivity, které je v případě DLB a demence při PN dokonce výraznější nežli u Alzheimerovy nemoci, a deficit kortikální acetylcholintransferázy koreluje s tíží kognitivního deficitu a vizuálních halucinací [3]. Cholinergní deficit je výraznější také u pacientů s PN a demencí ve srovnání s pacienty s PN bez demence, jak demonstrují klinicko-patologické studie (prokazující degeneraci nucleus basalis Meynerti) [13].
Také některé léky (anticholinergika, amantadin, tricyklická antidepresiva a hypnotika) mohou svým především anticholinergním působením navodit nebo zhoršit symptomy demence, především dezorientaci, poruchy paměti, pozornosti, myšlení, chování a somnolenci [2].
Z recentních studií vyplývá, že pacienti dlouhodobě léčení anticholinergiky mají nejen klinicky významnější poruchy paměti a exekutivních funkcí oproti pacientům neléčeným anticholinergiky [6, 7], ale dle klinicko-patologických studií koreluje blokáda muskarinových receptorů u PN s nálezem neurofibrilárních klubek a neuritických plak, patognomických pro Alzheimerovu nemoc [24].
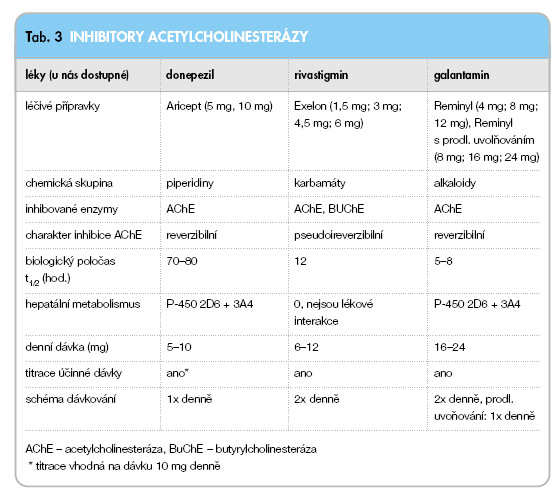
Jak postupovat v případě léčby již stávající kognitivní poruchy při PN/DLB? V prvé řadě je třeba vyloučit jiné typy demence, delirium a depresi (tzv. pseudodemence při depresi) a vyhodnotit kognitivní deficit pomocí soustavy neuropsychologických testů hodnotící funkce frontálních laloků, paměť a kognitivní tempo. Nejdříve je nutné postupně vysadit léky s anticholinergním účinkem (biperiden, benztropin, procyclidin, amantadin, tricyklická antidepresiva). V případě nutnosti zvyšování dopaminergní medikace není indikována terapie agonisty dopaminových receptorů vzhledem k vyššímu riziku navození psychotických komplikací. Vznikne-li dopaminomimetická psychotická porucha, musíme postupně snižovat dávky až vysadit další antiparkinsonskou medikaci v pořadí amantadin, selegilin a agonisté dopaminových receptorů [30, 32]. Není dostupná kauzální léčba, a proto hlavním cílem je oddálit deterioraci kognitivních funkcí a snížit rychlost jejího postupu, léčit behaviorální poruchy, depresi, anxietu a zlepšit provádění běžných denních aktivit. Tato kritéria alespoň částečně splňuje terapie inhibitory acetylcholin-esterázy (iAChE) [3]. Na našem trhu jsou k dispozici 3 preparáty z této třídy určené pro léčbu Alzheimerovy nemoci (AN) – donepezil, rivastigmin a galantamin (viz tab. 3).
Multicentrická dvojitě slepá placebem kontrolovaná studie sledovala efekt rivastigminu v dávce do 12 mg/den také u 120 pacientů s pravděpodobnou diagnózou DLB [20]. Přibližně dvojnásobný počet pacientů lečených rivastigminem ve srovnání se skupinou dostávající placebo vykázal po 20 týdnech prospektivního hodnocení minimálně třicetiprocentní pokles (tj. zlepšení) ve škále NPI hodnotící behaviorální a psychické symptomy (BPSD). Přítomnost vizuálních halucinací predikovala lepší odpověď na léčbu. Navíc efekt léčby byl demonstrován po dobu 96 týdnů (otevřené pokračování studie u části pacientů), během kterých nedošlo ke změně ve škále MMSE (Minimental State Examination) ani NPI. Popisované celkové zlepšení u pacientů s DLB je při terapii iAChE obecně výraznější než u AN [3]. V poslední době bylo provedeno několik studií s použitím iAChE u PND (pro přehled viz [3, 32]). Jedná se vesměs o otevřené studie zahrnující malé počty pacientů (n = 7–21) lišící se vstupními kritérii pro zařazení pacientů do studie, užívaným preparátem (rivastigmin, donepezil, galantamin, dokonce i tacrin, který byl již stažen z trhu pro svou hepatotoxicitu) a použitými hodnotícími škálami. Přestože z výše uvedeného vyplývá, že srovnání těchto studií je obtížné, lze obecně shrnout, že použité iAChE byly účinné na hodnocené kognitivní a neuropsychiatrické symptomy pacientů s PND a nedošlo k výraznému zhoršení parkinsonské symptomatiky, ačkoliv zhoršení třesu bylo zaznamenáno u několika pacientů. První randomizovanou, placebem kontrolovanou studií u pacientů s PND je práce Aarslanda a spolupracovníků [1], kteří použili křížový design (každý pacient je sám sobě kontrolou) pro hodnocení efektu donepezilu v dávce 5–10 mg/den ve srovnání s placebem u 14 pacientů s PND. Po desetitýdenní léčbě donepezilem došlo k signifikantnímu zlepšení ve škále MMSE a CIBIC+ (Clinician´s interview based impression of change plus caregiver input), zatímco nedošlo k žádné změně ve škále NPI. Během aktivní léčby nedošlo ke zhoršení příznaků parkinsonismu. Efekt donepezilu v dávce 5–10 mg/den se nelišil ve skupině pacientů s PND a AN, v PND skupině nedošlo ke zhoršení parkinsonismu (výsledky naší pilotní otevřené studie, [28]). Mezinárodní multicentrické dvojitě slepé placebem kontrolované studie s použitím iAChE u PND probíhají. První z nich již byla publikována [8], jedná se o studii s rivastigminem u 541 pacientů s PND. Výsledky studie svědčí pro statisticky signifikantní efekt rivastigminu na paměť a exekutivní funkce u pacientů s PND ve srovnání s placebem.
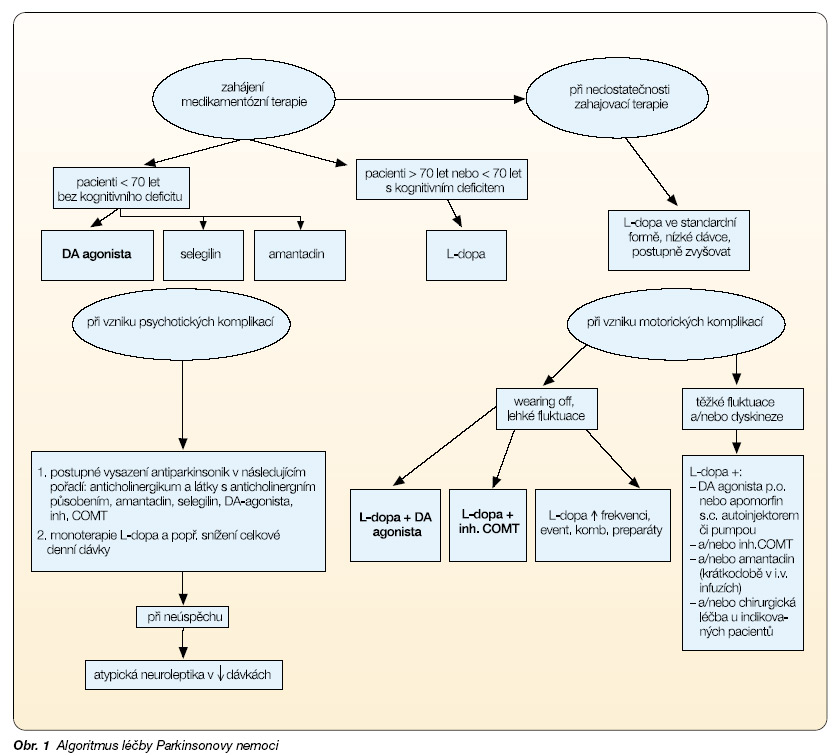
Algoritmus medikamentózní terapie
DA agonisté, selegilin, amantadin – především u pacientů mladších 70 let a bez kognitivního deficitu (obr. 1).
Zahájení léčby preparáty L-dopa méně obvyklé, v monoterapii vhodné u starších pacientů, obzvláště je-li přítomen kognitivní deficit. (Zahájení terapie anticholinergiky se obecně nedoporučuje, přesto jsou někde podávána mladým pacientům s tremor-dominantní formou, bez známek kognitivního deficitu).
Při nedostatečnosti zahajovací terapie:
K výše uvedené terapii přidáváme L-dopa ve standardní formě, v nízké dávce, postupně zvyšujeme.
Při vzniku motorických komplikací (fluktuace, dyskineze):
– ‑Při vzniku wearing off (zkracování délky účinku jednotlivých dávek) a lehkých fluktuací lze modulovat vlastní terapii preparáty L-dopa (tj. zvýšit frekvenci podávání standardní L-dopa, event. převést na kombinovanou léčbu preparáty standardní, solubilní a retardované L-dopa). Doporučujeme však spíše včasnou kombinovanou terapii preparáty L-dopa + DA agonisty nebo L-dopa + inhibitoru COMT (možno i L-dopa a entacapone v jedné tabletě).
– ‑Při vzniku těžších fluktuací a/nebo dyskinezí: kombinovaná p.o. terapie L-dopa + DA agonista a/nebo inhibitor COMT a/nebo amantadin (především ve formě infuzní kúry), apomorfin s.c. bolusově autoinjektorem nebo kontinuálně pumpou, chirurgická léčba (oboustranná chronická stimulace ncl. subthalamicus).
Při vzniku psychotických komplikací:
– ‑Postupné vysazení anticholinergik a látek s anticholinergním působením obecně (např. TCA), amantadinu, selegilinu, DA agonistů, inhibitorů COMT.
– ‑Monoterapie přípravky L-dopa a dle možností snížení její celkové denní dávky.
– ‑Při neúspěchu: nasazení atypických neuroleptik v nízkých dávkách (clozapin, quetiapin).
Seznam použité literatury
- [1] Aarsland D, Laake K, Larsen JP, Janvin C. Donepezil for cognitive impairment in Parkinson´s disease: a randomised controlled study. J Neurol Neurosurg Psychiatry 2002; 72: 708–712.
- [2] Bedard MA, Pillon B, Dubois B, Duchesne N, Masson H, Agid Y. Acute and long-term administration of anticholinergics in Parkinson´s disease: specific effects on the subcorticofrontal syndrome. Brain Cogn 1999; 40: 289–313.
- [3] Burn DJ, McKeith IG. Current treatment of dementia with Lewy bodies and dementia associated with Parkinson´s disease. Mov Disord 2003; 18 (Suppl 6): 72–79.
- [4] Burn DJ, O´Brien JT. Use of functional imaging in parkinsonism and dementia. Mov Disord 2003; 18 (Supl 6): 88–95.
- [5] Cools R, Swainson R, Owen AM, et al. Cognitive dysfunction in non-demented Parkinson´s disease. In: Wolters ECh, Scheltens PH and Berendse HW (eds). Mental Dysfunction in Parkinson´s disease II. Amsterdam: Academic Pharmaceutical Productions 1999; 142–164.
- [6] Cooper JA, Sagar HJ, Doherty SM, Jordan N, Tidswell P, Sullivan EV. Different effects of dopaminergic and anticholinergic therapies on cognitive and motor function in Parkinson´s disease. Brain 115:1701–1725.
- [7] Dubois B, Danze F, Pillon B, Cusimano G, Lhermitte F, Agid Y. Cholinergic dependent cognitive deficits in Parkinson´s disease. Ann Neurol 1987; 22: 26–30.
- [8] Emre M, Aarsland D, Albanese A, Byrne EJ, Deuschl G, et al. Rivastigmine for dementia associated with Parkinson´s disease. N Engl J Med 2004; 351: 1518–2509.
- [9] Girotti F, Carella F, Grassi MP, Soliveri P, Marano R, Caraceni T. Motor and cognitive performances of Parkinsonian patients in the on and off phases of the disease. J Neurol Neurosurg Psychiatry 1986; 49: 657–660.
- [10] Growdon JH, McDermott MP, Panisst M, Friedman JH. Levodopa improves motor function without impairing cognition in mild non-demented Parkinson´s disease patients. Neurology 1998; 50: 1327–1331.
- [11] Gotham AM, Brown RG, Marsden CD. Frontal cognitive function in patients with Parkinson´s disease „on“ and „off“ levodopa. Brain 1988; 111: 299–321.
- [12] Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson´s disease: a clinicopathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992; 55: 181–184.
- [13] Jellinger KA. What is new in degenerative dementia disorders? Wien Klin Wochenschr 1999; 17: 682–704.
- [14] Kulisevsky J, Avila A, Barbanoi M, Antonijoan R, Berthier ML, Gironell A. Acute effects of levodopa on neuropsychological performance in stable and fluctuating Parkinson´s disease patients at different levodopa plasma levels. Brain 1996; 119; 2121–2132.
- [15] Kulisevsky J, García-Sánches C, Berthier ML, Barbanoj M, Pascual-Sedano B, Gironell A, Esteves-Gonzalez A. Chronic effects of dopaminergic replacement on cognitive function in Parkinson´s disease: A two-year follow-up study of previously untreated patients. Mov Disord 2000; 15: 613–626.
- [16] Lange KW, Robbins TW, Marsden CD, James M, Owen AM, Paul GM. L-dopa withdrawal in Parkinson´s disease selectively impairs cognitive performance in tests sensitive to frontal lobe dysfunction. Psychopharmacology 1992; 107: 394–404.
- [17] Lees AJ, Smith E. Cognitive deficits in the early stages of Parkinson´s disease. Brain 1983; 106: 257–270.
- [18] Mahieux F, Fenelon G, Flahault A, Manifacier MJ, Michelet D, Boller F. Neuropsychological prediction of dementia in Parkinson´s disease. J Neurol Neurosurg Psychiatry 1998; 64: 178–183.
- [19] Mattay VS, Tessitore A, Callicott JH, et al. Dopaminergic modulation of cortical function in patients with Parkinson´s disease. Ann Neurol 2002; 51:156–164.
- [20] McKeith IG, Del Ser T, Spano P, et al. Efficacy of rivastigmine in dementia with Lewy bodies: a randomised, double-blind, placebo-controlled international study. Lancet 2000; 356: 2031–2036.
- [21] McKeith IG, Galasko D, Kosaka P, et al. Consensus guidelines for the clinical and pathological diagnosis of dementia with Lewy bodies (DLB): Report of the consortium on DLB international workshop. Neurology 1996; 47: 1113–1124.
- [22] Nieoullon A. Dopamine and the regulation of cognition and attention. Prog Neurobiol 2002; 67: 53–83.
- [23] Owen AM, Sahakian B, Hodges JR, et al. Dopamine-dependent frontostriatal planning deficits in early Parkinson´s disease. Neuropsychology 1995; 9: 126–140.
- [24] Perry EK, Kilford L, Lees AJ, Burn DJ, Perry RH. Increased Alzheimer pathology in Parkinson´s disease related to antimuscarinic drugs. Ann Neurol 2003; 54: 235–238.
- [25] Piccirilli M, D´Alessandro P, Finali G, et al. Early frontal impairment as a predictor of dementia in Parkinson´s disease [letter]. Neurology 1997; 48: 546–547.
- [26] Poewe W, Berger W, Benke TH, Schelosky L. High-speed memory scanning in Parkinson´s disease: adverse effects of levodopa. Ann Neurol 1991; 29: 670–673.
- [27] Rektorová I, Rektor I, Bareš M, Dostál V, Ehler E, Fanfrdlová Z. Cognitive functions in people with Parkinson´s disease [PWPD] and mild or moderate depression: effects of dopamine agonists in an add-on to L-dopa therapy. Mov Disord 2002; 17 (Suppl. 5): S 125.
- [28] Rektorová I, Rektor I. Efekt donepezilu v léčbě demence u Parkinsonovy nemoci a Alzheimerovy nemoci – pilotní studie. Neurologie pro praxi 2003; 4 (Suppl 2.): 10–11.
- [29] Rektorová I, Rektor I. Parkinsonský syndrom. In: Rektor I, Rektorová I, et al. Centrální poruchy hybnosti v praxi. Movement disorders. Praha, Triton, 2003.
- [30] Rektorová I. Demence u Parkinsonovy nemoci a jiných extrapyramidových onemocnění. In: Růžička E, et al. Diferenciální diagnostika a léčba demencí. Příručka pro praxi. Praha, Galén, 2003.
- [31] Rektorová I. Parkinsonova nemoc – diagnostika a klinický obraz heterogenního onemocnění. Geront rev 2004; 2: 14–23.
- [32] Rektorová I. Kognitivní a behaviorální poruchy u demence při Parkinsonově nemoci a u demence s Lewyho tělísky. Neurol pro praxi 2004; 1: 15–21.
- [33] Rektorová I. Parkinson´s Disease. Pharmacy and Therapeutics. In: Hospital Prescriber Europe. Mike Meakin ed., Campden Publishing Ltd, London 2001; 65–67.
- [33] Schrag A, Jahanshahi M, Quinn NP. What contributes to quality of life in patients with Parkinson´s disease? J Neurol Neurosurg Psychiatry 2000; 69: 289–290.
- [35] Taylor AE, Saint-Cyr JA, Lang AE. Cognitive changes in relation to treatment response. Brain 1987; 110: 35–51.