Péče o metabolický stav pohybového aparátu ‒ klíč k dlouhověké samostatnosti
Souhrn:
Novosad P, Hrdý P, Fojtík P. Péče o metabolický stav pohybového aparátu ‒ klíč k dlouhověké samostatnosti. Remedia 2021; 31: 311–320.
Pozitivní vliv pohybu na délku i kvalitu života je znám už od starověku. Po dlouhou dobu však nebylo toto poznání možno podložit moderními exaktními medicínskými argumenty. Bylo zcela zřejmé, že vývoj jedinců se sedavým způsobem života je odlišný od vývoje jedinců fyzicky aktivních. Až po roce 2000 v souvislosti s odhalením spojitosti mezi interleukinem 6 a pohybem svalu započalo intenzivní studium této problematiky. V současné době je těchto svalových působků (myokinů) známo přibližně šest set. Podobně jsou nacházeny u tkáně tukové (adipokiny) a kostní (osteokiny). Svalová tkáň tak s ostatními souvisí nejen mechanisticky, ale tvoří s nimi humorální soulad. Tento jev má význam v patofyziologii chronického, tzv. nízkoprahového zánětu, při úbytku svaloviny, vzniku a rozvoji chronických onemocnění, na něž umírá zhruba 75 % populace. Řešení problému výrazně zatěžuje nákladovou efektivitu zdravotnictví i státní ekonomiku. Daným poznatkům je nutné přizpůsobit terapeutická doporučení a celou strategii zdravotnické péče. Doposud nejsou známy vhodné léky, které by problematiku úbytku svaloviny řešily. Z tohoto důvodu je o to více nutno dbát doporučení pohybového a dietního režimu. Na základě poznatků jsme pro naše pacienty sestavili komplexní diagnostický a léčebný program, který byl prezentován na světovém kongresu IOF‑ESCEO 2020 v Barceloně i na celostátním kongresu v Bratislavě a který představujeme včetně předběžných výsledků.
Summary:
Novosad P, Hrdy P, Fojtik P. Caring for a metabolic status of the musculoskeletal system – the key to long‑term self‑sufficiency. Remedia 2021; 31: 311–320.
The positive effect of movement on the length and quality of life is known since the prehistoric times. For a long time, it was not possible to support this claim with modern exact medical arguments. It was quite evident that the development of individuals with a sedentary lifestyle is different from the development of physically active ones. Only after 2000 when the connection between interleukin 6 and muscle movement was discovered, intensive study of this problem was initiated. Currently, approximately 600 of these muscle substrates (myokines) are known. Similarly, they have been discovered in adipose (adipokines) and skeletal (osteokines) tissues. So muscle tissue is related to other tissues not only mechanistically, but it also creates a humoral homeostasis. This phenomenon is significant in pathophysiology of a low‑grade chronic inflammation, during muscle atrophy, the origin and the development of chronic diseases, deadly to approximately 75% of the population. Solving the problem markedly burdens the cost efficiency of health care and state economics. Current knowledge needs to influence the therapeutical recommendations and the whole strategy of health care. No appropriate drugs that would solve the problem of muscle atrophy currently exist. For this reason, it is pertinent to rely even more on recommendations of the movement and diet regimen. Based on the accumulated knowledge, we created a complex diagnostic and treatment programme for our patients that was presented on the world IOF‑ESCEO 2020 congress in Barcelona and on the statewide congress in Bratislava, including preliminary results.
Key words: quality of life – muscle tissue – interleukin 6 – myokines – low‑grade inflammation – chronic disease – diagnostic and treatment programme.
Úvod
Během první poloviny 21. století – v letech 2000 až 2050 – se počet světového obyvatelstva ve věku nad 60 let pravděpodobně zvýší z 11 % na 22 %, z přibližně 5 605 milionů na více než dvě miliardy [1]. Předpokládá se, že v tu samou časovou periodu počet lidí starších 80 let vzroste až na 395 milionů. Skupina starších obyvatel je velmi heterogenní a jejich zdravotní stav je závislý na genetickém, biologickém a environmentálním základu, stejně tak jako na jiných fyzických, psychologických a sociálních faktorech. Z tohoto důvodu budou jednotliví lidé se stejným chronologickým věkem rozdílní ve smyslu věku biologického.
Ze studií ekonomické efektivity zcela jednoznačně vyplývá, že stát není schopen ani ve velmi vyspělých zemích zvládnout zdravotní péči o tuto skupinu obyvatel na úrovni nejnovějších medicínských poznatků. Roční náklady ve Spojených státech amerických se v uvedené oblasti pohybují kolem 20‒30 miliard dolarů [2]. V České republice nejsou známy. Současná starší populace trpí nejčastěji chronickými onemocněními, osteoporózou, sarkopenií, onkologickými onemocněními, obezitou a s tím souvisejícím diabetes mellitus 2. typu, srdečními poruchami a poruchami kognitivními.
S technologickým pokrokem se dožíváme vyššího věku, přibývá složité medicínské problematiky a výrazně stoupají ekonomické náklady. Je tedy třeba hledat cestu, kdy bude pacient vyžadovat pokud možno co nejnižší náklady. Bude samostatný jak fyzicky, tak duševně do vysokého věku, nebude potřebovat hospitalizace, asistenty, ošetřovatele atd. Důraz je nutné položit na prevenci. Problematika stáří by měla být považována za jednu z velkých eticko medicínských, ale rovněž ekonomických výzev do budoucna. Praktický zdravotnický nebo sociální program, který by tento problém na úrovni primární prevence řešil, v České republice ani na Slovensku zatím nefunguje, v příštích letech budou k dispozici výstupy z některých souvisejících projektů. Na našem pracovišti jsme proto pro naše pacienty vytvořili modelový program, který je obecně použitelný a jehož první konkrétní výsledky budou prezentovány na letošním kongresu European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO).
Věk dožití se v poslední době dramaticky zvyšuje. V České republice činí podle dat Českého statistického úřadu z roku 2020 průměrná doba dožití 79,2 roku ‒ u mužů 76,2 a u žen 82,1 roku [3]. Medicína, která prodlužuje věk, je dnes velmi rozvinutá ve všech oborech, naše očekávání se tedy postupně mohou naplňovat do věku výrazně vyššího. Je však třeba položit si otázku týkající se kvality a důstojnosti života v jeho posledních dekádách – s ohledem na samostatnost rozhodování, vnímání světa kolem či na důstojné postavení v hierarchii společnosti.
Fyzická aktivita jako prevence chronických onemocnění
Nejvýznamnější rizikový faktor pro většinu populace z hlediska dlouhověkosti představují chronická onemocnění ovlivňující jak morbiditu, tak mortalitu. Pro stanovení pilíře dlouhověkosti jsou důležité otázky metabolismu, zárodečných buněk a regenerace, stability bílkovin, adaptace na stres, zánětu, makromolekulárních poruch a epigenetiky [4].
Lidský genový pool byl víceméně stabilizován před 440 000 lety. V tu dobu převažovali neandrtálci. Zhruba před 250 000 lety je nahradil přizpůsobivější druh Homo sapiens. Neandrtálec měl statnou postavu a krátké kosti, Homo sapiens je charakteristický gracilní postavou. Nový druh se přizpůsobil mnohem více denní potřebě přežití, neboť jeho podstatnou činností byl lov. Fyziologicky se adaptoval na dlouhé běhy potřebné při lovu, poté následoval přechod na agrární a posléze na industriální způsob života. Dosažitelnost potravy vedla postupně ke zvyšování objemu tukové tkáně, k obezitě a sedavému způsobu života. Tento aktuálně velmi často se vyskytující životní styl však rozhodně nepředstavuje vhodné pokračování předpokladů rozvoje.
Přirozenou součástí života a předpokladem pro další rozvoj je jistě pohyb. Definice pohybu podle US Centers for Diseases Control and Prevention (CDC) vychází z předpokladu že: 1. cvičení/fyzická aktivita je prevencí proti chronickým onemocněním, 2. ztráta fyzické aktivity je primární příčinou, která způsobuje chronické onemocnění [5]. Chronická onemocnění zapříčiňují dle CDC přibližně 72‒75 % všech úmrtí. Tato onemocnění pak vedou k zásadním životním limitacím u zhruba jedné z 10 osob a jejich základní příčinou je fyzická inaktivita. Od roku 2002 se o těchto nemocech mluví dle definice Světové zdravotnické organizace (WHO) jako o epidemii nepřenosných chorob (epidemic of non communicable diseases, NCDs). Mají stejnou příčinnou podstatu, trvají dlouhou dobu a mají pomalou progresi.
Chronická onemocnění jsou ovlivnitelná prevencí. Prevence se z lékařského hlediska dělí na: a) primární, která redukuje pravděpodobnost onemocnění, b) sekundární, která klade důraz na detekci a management presymptomatického onemocnění, c) terciární, která klade důraz na léčbu symptomů a zpomalování progrese a je oprávněná i po vypuknutí akutní nemoci [6]. Pokud do běhu svého života aktivně nezasahujeme, neovlivňujeme svoji tělesnou hmotnost nebo fyzický stav organismu, na nějž negativně působí styl života a vnější podmínky, musíme ve vysokém procentu počítat s postupným rozvojem některého typu chronického onemocnění. Od věku 25‒35 let se v našem organismu začínají formovat procesy, které po 60. roce života začínají definovat jeho další stav. Zcela odlišně se vyvíjí organismus jedince se sedavým způsobem života a špatnou stravou, resp. s jejím přebytkem vedoucím k obezitě, a zcela jinak pak organismus jedince zachovávajícího ve svém režimu pohyb, resp. fyzickou zátěž a tomu odpovídající stravu. Celkový obraz fyzické inaktivity ukazuje možné postižení mnoha orgánů [7]. Geny byly vývojem nastaveny optimálně tak, že jejich fyziologická funkce, tj. udržování homeostatických mezí, jsou plně funkční při určité úrovni fyzické zátěže. Proto při poklesu pod určitou úroveň tohoto druhu zátěže dochází k disrupci genových funkcí na mnoha místech organismu. To má za následek snížení kvality života, resp. již zmíněný rozvoj chronického onemocnění, nebo – při závažnějších a akutnějších poruchách – předčasnou smrt.
V případě organismu jedince, který má ve svém režimu fyzickou zátěž po určitou dobu, jsou zcela jednoznačně prokázány mnohé zdravotní benefity: prodloužení chronologického věku, změny funkcí a struktury arterií, zmírnění obezity a nadváhy u dětí i dospělých, snížení rizika náhlé smrti [6,8−12]. Celkový přehled změn po snížení fyzické aktivity nabízejí Booth a kol. ve studii, která uvádí, že inaktivita zhoršuje například inzulinovou rezistenci [7]. Jednoznačně byl význam fyzické aktivity demonstrován u monozygotních dvojčat [13].
Metabolická role svalové tkáně
Smyslem fyzické aktivity je vybudování
fyziologické kapacity tak, aby organismus byl schopen vyrovnat se
s denním režimem. Předpokladem této kapacity je vybudování
kvalitní (jak kvantitativně, tak kvalitativně) svalové tkáně.
Ta prodělává významné změny související s věkem. Mění
se počet svalových fibril, objevuje se jejich atrofie,
intramuskulární tuk, fibróza, denervace a mění se cévní
zásobování [14]. Základní funkcí pro přežití se tedy zdá
být pohyb. Svalová tkáň kromě zajištění pohybu funguje také
jako robustní metabolický orgán (tab. 1). Molekulární
mechanismy, které se uplatňují v řízení svalového
mechanismu, jsou poměrně složité. Za hlavní se považuje
signální dráha mTOR (mammalian target of rapamycin) formovaná
dvěma odlišnými komplexy mTORC1 a mTORC2 [15]. Za normálních
fyziologických podmínek síť vzájemných signálů slouží jako
kontrola ke koordinaci hypertrofie a atrofie, která
kulminuje do delikátní rovnováhy mezi proteinovou syntézou
a proteolýzou. Z hlediska stárnutí svaloviny jsou
významné metabolické pochody pro metabolickou homeostázu. Jejich
porucha se projevuje zejména zvýšenou inzulinovou rezistencí
a vznikem diabetes mellitus 2. typu. Při tvorbě
a odbourávání bílkovin se uplatňují další proteolytické
systémy ‒ ubikvitin proteázový systém a autofágová
a lysozomová cesta [16]. Zásadní struktury pro regeneraci
svalu představují tzv. satelitní buňky [17]. Molekulární
struktura a funkce svalu jsou podrobně popsány v práci,
jejímiž autory jsou Mukund a kol. [18].
Z výše popsaného pohledu se svaly jeví jako klíčový orgán pro přežití, protože zabraňují rozvinutí základních chronických chorob, resp. jejich aktivaci. U dětí ve věku přibližně do 13‒15 let tato problematika zatím není jasná. V případě jedinců se sedavým způsobem života tuková tkáň oproti fyzicky aktivní populaci zřetelněji a rychleji nahrazuje v kostní dřeni mezenchymální buňky. Dále se usazuje v podkoží, nejvíce v abdominální krajině, ale i v samotných svalech, případně v jiných tkáních a orgánech. Vzniká někdy klinicky zřetelná, někdy nezřetelná obezita. Tuková tkáň začíná destruovat jak zárodečné buňky, tak samotný pohybový aparát. Poklesem pohybové aktivity, který následuje, se proces dostává do patologického kruhu. Vývoj obezity klinického rázu je v poslední době velmi zřetelný jak u dětí, tak u dospělých. Za posledních 50 let prevalence obezity vlivem sedavého způsobu života stoupla o 27 % u dospělých a o 47 % u dětí. Léčbě obezity je aktuálně věnována velká pozornost v podobě nejrůznějších režimových a dietních opatření či vývoje nových léků (např. analog GLP 1 liraglutid) a různých typů bariatrických operačních zákroků.
Obezita zvyšuje riziko vzniku diabetes mellitus 2. typu a kardiovaskulárních i onkologických onemocnění. Fyzicky tento stav jedince jednak limituje v pohybu, jednak na buněčné úrovni pomáhá navozovat chronický, tzv. nízkoprahový zánět (low grade inflammation, LGI). V kostní dřeni dochází ke vzestupu kostní resorpce, je narušena diferenciace mezenchymálních a hematopoetických zárodečných buněk, a tudíž imunitní odpověď. Záleží pak na dalším vývoji obezity, jakým směrem se chronický zánět bude ubírat. Pokračující obezita jej může velmi významným způsobem akcelerovat. V tomto případě je nejvíce riziková obezita abdominální. Počínajícím stresorem mohou však kromě obezity být také chronické infekty (cytomegalovirus, zánět periodoncia), narušené buňky či oxidované proteiny, často vliv porušené střevní mikroflóry. V kombinaci s vysokým nutričním příjmem se mění zánětlivé prostředí buněk a orgánů, což způsobuje komplikace kardiologické, respirační či diabetické. V chronickém průběhu mají postprandiální lipoproteiny bohaté na triglyceridy za následek akutní aktivaci buněk, jež zvyšují koncentrace adhezních molekul, cytokinů a oxidativní stres a počíná vlastní zánět. Studium problematiky cytokinů ukazuje, že tato otázka je velmi komplexní. Modulace počáteční odpovědi na stresor je za některých patologických jednotek velmi nejednotná. Daná imunitní odpověď se stává velmi fragilní a někdy je těsně svázána s věkem. Velmi často se zde rovněž objevuje ztráta cytokinové rovnováhy mezi prozánětlivou a protizánětlivou kontrolou vztažená k věku. Ačkoliv uvedený proces není zatím zcela objasněn, je možno již nyní konstatovat, že ztráta této kontroly představuje klíčový mechanismus ve vztahu chronický zánět‒věk‒chronické onemocnění. Jak již bylo uvedeno, tyto procesy se začínají formovat mezi 25.–35. rokem života. Proces LGI pak může pokračovat dlouhodobě [19].
Důsledky fyzické inaktivity
Klíčovou roli pro další vývoj zde hraje úbytek nebo zachování svalového aparátu na dostatečné úrovni. V oblasti hierarchie kompartmentů se dnes studium procesu stárnutí soustřeďuje na svalovinu, jíž se všechny ostatní kompartmenty v průběhu života přizpůsobují svou funkcí a kapacitou. Proces stárnutí lze vzhledem k fyzické aktivitě, resp. inaktivitě považovat za velmi individuální záležitost.
Je zřejmé, že u všech procesů
vedoucích ke stimulaci LGI je přítomen úbytek svaloviny,
a to především u jedinců, kteří jsou považováni
za inaktivní. Kritérii inaktivity dle WHO jsou fyzická zátěž
trvající kratší dobu než 150 minut za týden a úroveň
nižší než lehká (2‒2,9 MET; 3‒5,9 MET; MET = metabolický
ekvivalent zátěže, metabolic equivalent of task,
1 MET = 3,5 ml/kg/min; maximální objem kyslíku
využitý při fyzické aktivitě [VO2max]). Takto
definovaná inaktivita představuje největší riziko rozvoje NCDs.
Podrobný seznam klinických jednotek v důsledku inaktivity
shrnuje tabulka 2 [6,20]. Za nejdůležitější dle WHO
jsou považovány čtyři typy NCDs: kardiovaskulární onemocnění
(srdeční infarkt, cévní mozkové příhody), onkologická
onemocnění, chronická respirační onemocnění (chronická
obstrukční plicní nemoc a astma) a diabetes mellitus
2. typu. Tato onemocnění jsou globálně příčinou 10‒15 %
předčasných úmrtí [21].
kteří jsou považováni
za inaktivní. Kritérii inaktivity dle WHO jsou fyzická zátěž
trvající kratší dobu než 150 minut za týden a úroveň
nižší než lehká (2‒2,9 MET; 3‒5,9 MET; MET = metabolický
ekvivalent zátěže, metabolic equivalent of task,
1 MET = 3,5 ml/kg/min; maximální objem kyslíku
využitý při fyzické aktivitě [VO2max]). Takto
definovaná inaktivita představuje největší riziko rozvoje NCDs.
Podrobný seznam klinických jednotek v důsledku inaktivity
shrnuje tabulka 2 [6,20]. Za nejdůležitější dle WHO
jsou považovány čtyři typy NCDs: kardiovaskulární onemocnění
(srdeční infarkt, cévní mozkové příhody), onkologická
onemocnění, chronická respirační onemocnění (chronická
obstrukční plicní nemoc a astma) a diabetes mellitus
2. typu. Tato onemocnění jsou globálně příčinou 10‒15 %
předčasných úmrtí [21].
Pozitivní efekt fyzické zátěže
Uvedenou problematiku výrazně ovlivňují některé biologické mechanismy a jejich metabolické principy, z nichž jsou to především: 1. zlepšení fyzického stavu zahrnující redukci abdominální obezity a tělesné hmotnosti; 2. zlepšení lipoproteinového profilu, zejména redukce hodnot triglyceridů, lipoproteinů o nízké hustotě (low density lipoprotein, LDL) a zvýšení hodnot lipoproteinů o vysoké hustotě (high density lipoprotein, HDL); 3. zvýšení efektivity glukózové homeostázy a inzulinové senzitivity; 4. snížení krevního tlaku; 5. redukce systémového zánětu (inflamace) hodnocená podle poměrů cytokinů; 6. zlepšení kardiální funkce.
Endokrinní funkce skeletálního svalstva
Fyzická zátěž představuje důležitou nefarmakologickou léčbu, ne pouze preventivní agens u výše zmíněných nemocí. Mechanismus zahrnuje přínosy, které fyzická zátěž generuje. Po dekády je znám přímý vztah mezi obezitou, snížením svalové hmotnosti, zánětem a rozvojem NCDs. Pokud bylo uvažováno svalstvo jako přímý modulující agens vytvářející prospěch ze svalové zátěže, resp. změny po svalové zátěži, jde v tomto kontextu o příčně pruhovanou (skeletální) svalovinu.
Dlouhou dobu nebylo přesně známo, co
je vlastní podstatou pozitivního účinku fyzické zátěže.
Na přelomu tisíciletí po objevení faktu, že sval při
kontrakci uvolňuje peptidy – myokiny (cytokiny) ‒, byl
přijat koncept svalu jako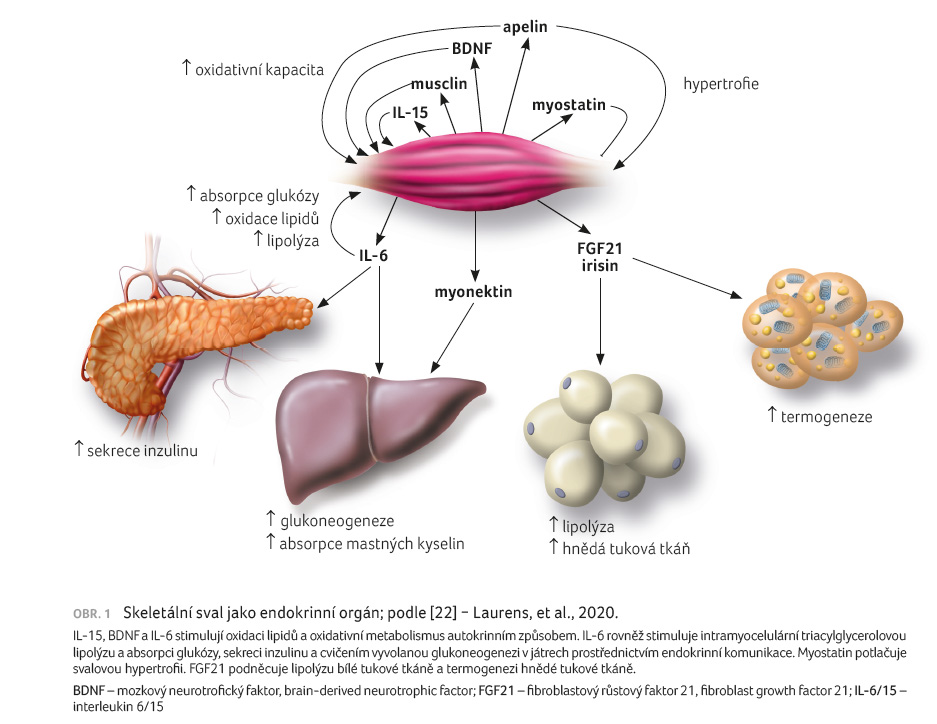 endokrinního orgánu. Tyto myokiny
vytvářejí můstky a chemické kontakty mezi svaly, orgány
a tkáněmi. Teprve toto paradigma tedy přineslo vysvětlení
souvislosti mezi fyzickou aktivitou a rozvojem chronických
onemocnění. Na obrázku 1 je sval znázorněn jako
sekretorní orgán mnoha myokináz ovlivňující různé orgány
a tkáně [22]. Skeletální sval je klíčem pro oxidaci
lipidů, podílí se na produkci energie a na její
spotřebě, a má proto velký vliv na celkovou energii
organismu. Skeletální sval je složen z několika typů buněk
‒ svalová vlákna, zárodečné buňky, fibroblasty, pericyty,
adipocyty, motorické neurony a pojivová tkáň. Satelitní
buňky hrají důležitou roli v signalizačním procesu
sousedících buněk, a jsou tak bioaktivním faktorem. Již
téměř půl století je známa hypotéza, že svalové buňky
produkují humorální faktor, který je aktivován zvýšenou
potřebou glukózy v průběhu svalové kontrakce. Jako jeden
z prvních proteinů byl objeven myostatin ‒ transformující
růstový faktor beta (transforming growth factor beta, TGFβ), jedna
z prvních molekul identifikovaná ve svalu, která je
schopna indukovat signály, jež regulují buněčný růst,
regeneraci, diferenciaci, transformaci, ale také buněčnou smrt.
Myostatin je spojen s kontrolou svalového růstu a metabolismu,
vylučuje se v průběhu embryonálního rozvoje. Jeho funkce
limituje svalový růst ve fyziologických situacích v průběhu
vývoje. Nicméně je prokázána jeho účinnost i v dospělosti.
Význam myostatinu je zcela mimořádný [23,24].
endokrinního orgánu. Tyto myokiny
vytvářejí můstky a chemické kontakty mezi svaly, orgány
a tkáněmi. Teprve toto paradigma tedy přineslo vysvětlení
souvislosti mezi fyzickou aktivitou a rozvojem chronických
onemocnění. Na obrázku 1 je sval znázorněn jako
sekretorní orgán mnoha myokináz ovlivňující různé orgány
a tkáně [22]. Skeletální sval je klíčem pro oxidaci
lipidů, podílí se na produkci energie a na její
spotřebě, a má proto velký vliv na celkovou energii
organismu. Skeletální sval je složen z několika typů buněk
‒ svalová vlákna, zárodečné buňky, fibroblasty, pericyty,
adipocyty, motorické neurony a pojivová tkáň. Satelitní
buňky hrají důležitou roli v signalizačním procesu
sousedících buněk, a jsou tak bioaktivním faktorem. Již
téměř půl století je známa hypotéza, že svalové buňky
produkují humorální faktor, který je aktivován zvýšenou
potřebou glukózy v průběhu svalové kontrakce. Jako jeden
z prvních proteinů byl objeven myostatin ‒ transformující
růstový faktor beta (transforming growth factor beta, TGFβ), jedna
z prvních molekul identifikovaná ve svalu, která je
schopna indukovat signály, jež regulují buněčný růst,
regeneraci, diferenciaci, transformaci, ale také buněčnou smrt.
Myostatin je spojen s kontrolou svalového růstu a metabolismu,
vylučuje se v průběhu embryonálního rozvoje. Jeho funkce
limituje svalový růst ve fyziologických situacích v průběhu
vývoje. Nicméně je prokázána jeho účinnost i v dospělosti.
Význam myostatinu je zcela mimořádný [23,24].
Ovlivnění imunity
Poznatky o tom, že skeletální sval produkuje látky zasahující do imunity, se objevují v odborné literatuře již kolem roku 2000 [25,26]. Tyto látky se nazývají cytokiny. Cytokiny, které produkuje sval, jsou označovány jako myokiny (v případě tukové tkáně jsou to adipokiny a u kostní tkáně osteokiny). Objev role skeletálního svalstva jako endokrinního a parakrinního orgánu podnítil další úvahy o tom, že sval, nervová soustava a endokrinní orgány se podílejí synergicky na zisku a zpracování energie. V posledních letech bylo v některých studiích velmi dobře prokázáno, že akutní fyzická zátěž je významným mediátorem systémové protizánětlivé odpovědi. Svalová kontrakce indukovaná fyzickou zátěží má za následek genovou expresi a sekreci myokinů, kterých je dodnes známo již přibližně šest set [27,28]. Schopnost skeletálního svalstva sekretovat tyto myokiny po svalové kontrakci se nazývá „pracovní stimul“ nebo „pracovní faktor“, resp. „zátěžový faktor“. Bylo prokázáno, že ovlivnění dalších orgánů zde probíhá jinou než nervovou cestou. Toto je první krok k pochopení fyzické zátěže jako protektivního faktoru proti nemocem.
Určení exaktní funkce jednotlivých cytokinů je velmi komplikované, neboť na jejich funkci má vliv buněčný typ, odpověď jednotlivého buněčného typu a fáze buněčné odpovědi. Interleukiny (IL) představují typ cytokinu, který může být tvořen mnoha různými buňkami lidského organismu [29]. Za prozánětlivé jsou považovány IL 6, IL 1β, IL 1, IL 8, TNFα (tumor nekrotizující faktor alfa), IFNγ (interferon gama), VEGF (vaskulární endoteliální růstový faktor) ad. a za protizánětlivé IL 2, IL 4, IL 10, IL 13 ad. Mezi interleukiny uvolňované při střední svalové zátěži (3‒5,9 MET) patří IL 6, IL 7, IL 8, IL 10, IL 15, BDNF (brain derived neurotrophic factor), irisin, LIF (leukemický inhibiční faktor), IGF 1 (insulin like growth factor 1), VEGF, neopterin. Obezita pak zvyšuje hodnoty prozánětlivých cytokinů, jako jsou leptin, resistin, TNFα, IL 6 a RBP4 (retinol binding protein 4). Protizánětlivými adipokiny jsou adiponektin, FGF21 (fibroblastový růstový faktor 21) a SFR5 [30]. Svalovou tkáň ovlivňují zatím dva známé osteokiny ‒ osteokalcin (OCN) a antianabolický faktor inhibující osteoblastogenezi (Sost) [31].
Nejednoduchou interpretaci procesů při fyzické zátěži lze demonstrovat na nejstarším známém IL 6, který je obecně klasifikován jako prozánětlivý cytokin. Interleukin 6 je vylučován T lymfocyty a makrofágy a podporuje imunitní systémovou aktivaci vedoucí k zánětu v klidu při zátěži < 2 MET. Bylo však prokázáno, že proteiny akutní fáze indukované IL 6 mají protizánětlivý a imunosupresivní efekt, pokud pocházejí ze skeletálního svalu při zátěži > 2 MET (2‒8,7 MET). Snižují tak prozánětlivou odpověď imunitního systému. U vrcholového sportu (> 8,8 MET) je interpretace individuální, tyto rozdíly byly prokázány indukcí fyzickou zátěží. Hodnota cirkulujícího IL 6 se velmi výrazně zvyšuje v odpovědi na akutní dlouhotrvající fyzickou zátěž (např. maratonský běh) až 100krát. Toto zvýšení je nezávislé na porušení svalstva, je však v těsné souvislosti s intenzitou a trváním zátěže a se svalovou hmotou zahrnutou do zátěže. Zvýšení není lineární a nastává bezprostředně po ukončení zátěže. Rovněž bývá vyšší, pokud je přítomna deplece glykogenu ve svalu [32].
Úbytek svalové hmoty
Jak bylo zmíněno, 72‒75 % světové populace umírá na NCDs, jejichž základem je chronický LGI charakterizovaný perzistentně zvýšenou koncentrací prozánětlivých cytokinů. Za hlavní příčinu je považován úbytek svalů. Maximum fyzické kapacity svalů spadá do věku mezi 20‒30 lety. Skeletálních svalů je 600 a tvoří 40‒50 % celkové tělesné hmotnosti. Příčinou jejich úbytku mohou být ztráta pravidelné fyzické aktivity, malnutrice, změny endokrinního prostředí (snížení koncentrace růstového hormonu a testosteronu, estrogenu a IGF 1, změny hodnot myostatinu, aktivinu, irisinu, snížení hodnot kostních morfogenních proteinů, zvýšení hodnot kortizolu). Následkem zvýšené aktivace proteinových degradačních systémů je svalová reorganizace s denervací, resp. reinervací a mitochondriální dysfunkce s narušením proteinového systému syntéza/degradace a s tím spojená porucha signalizace pro mTOR systém jako hlavního regulátora proteinové syntézy. Může také docházet k porušení transportu zejména rozvětvených aminokyselin přes buněčnou membránu.
K hlubším ztrátám svalové hmoty dochází po 50. roce života (ročně 1‒2 %, úbytek svalové síly 1,5‒5 %). Obecně lze tvrdit, že mezi 20.‒80. rokem života se ztratí 20‒40 % svalové síly. Někdy v tomto směru nepomůže ani návrat hmotnosti svalu. Je třeba zdůraznit, že existují stavy, kdy je zvýrazněna jen jedna složka, a to síla, která ubývá jako první, ale ne vždy je zde jednoznačný diagnostický náhled. Stav při úbytku síly, kdy nedochází ihned ke ztrátě svalů jejich kvantitativním úbytkem, se nazývá dynapenie [33]. Pokles funkcí jednotlivých tkání, orgánů a celých kompartmentů začíná hypoteticky po 40. roce života. Pokles funkcí je mnohem rychlejší než ztráta hmoty, což ukazuje, že funkce jako takové jsou mnohem citlivější na věk. Dlouhodobé studie ukazují zcela jednoznačně, že ve věku mezi 60‒80 lety je tento pokles významný u 5‒13 % osob a ve věku nad 80 let u 11‒50 % osob, stoupá tedy s věkem. Samozřejmě zde dochází také ke změnám v tukové tkáni. Při úbytku 0,5 kg svaloviny se tuk zvyšuje o stejnou hmotnost. Proto při snaze diagnostikovat tento proces zcela selhává hmotnostní parametr.
Svalová atrofie z fyzické inaktivity
Nejtěžší formu úbytku svalů
představuje skeletální svalová atrofie způsobená
fyzickou inaktivitou. Počáteční příznaky se jeví jako
ztráta svalové tenze a ztráta svalové funkce, která ji
dobře charakterizuje. Méně je známo o buněčných příčinách
tohoto procesu. Příčinou je z klinického pohledu nečinnost,
nepoužívání svalu např. při imobilizaci,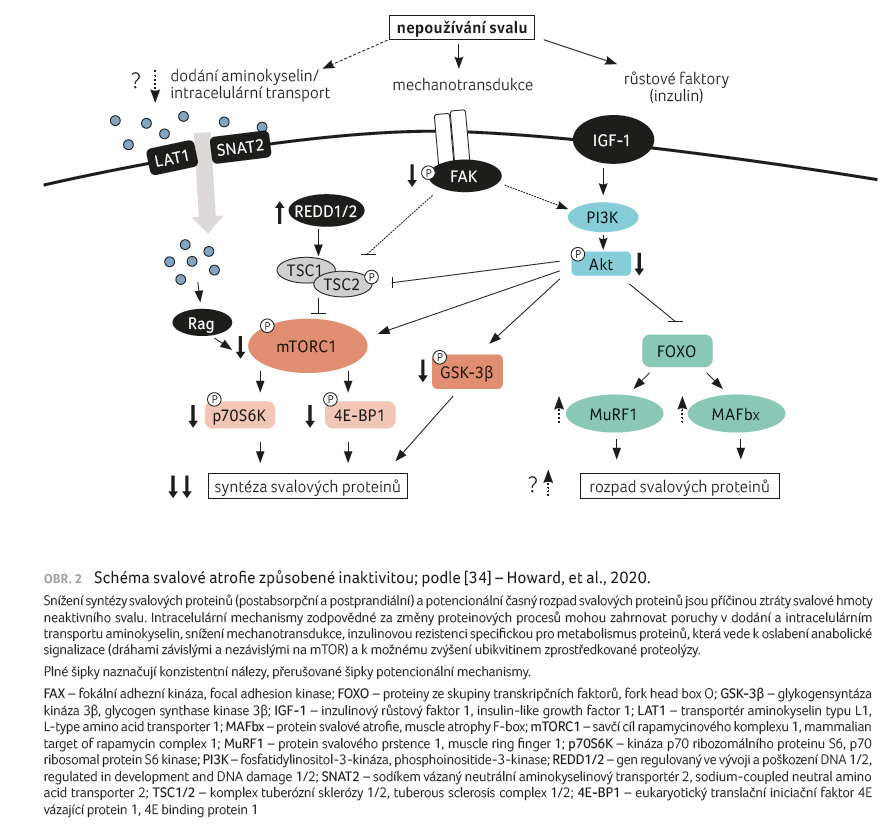 denervaci, hladovění,
ale i množství klinických stavů, při nichž vzniká jiný
typ atrofie – kachexie. Nehledě na základní příčinu je
svalová atrofie charakterizována snížením proteinového obsahu,
svalového průměru, poklesem produkce síly a únavovou
rezistencí. Rozdílné podmínky produkující atrofii navozují
samozřejmě rozdílné iniciační a signální cesty pro
devastaci svalu. Molekulární mechanismus znázorňuje obrázek 2
[34]. Pokud bychom to srovnávali s kachexií u některých
chorob, můžeme nalézt některé společné prvky, nicméně
iniciační znaky u atrofie z nečinnosti jsou zde méně
jasné. Jak bylo řečeno, kaskáda příznaků vedoucí k atrofii
z nečinnosti začíná redukovanou svalovou tenzí a rozsáhlým
efektem na proteinovou syntézu a degradaci. Je zde známo
několik faktorů, které mohou být označeny za iniciační.
Tyto poznatky pramení vesměs z experimentu. Iniciační
molekulou tak může být v první řadě myostatin (superrodina
TGFβ), dále syntetické glukokortikoidy (dexamethason) nebo TNFα
a jiné cytokiny. V případě kachexie jsou k dispozici
např. signifikantní literární doklady o zvýšených
hodnotách TNFα, IL 1, resp. IL 6 a NFκB (nukleární
faktor kappa B). Za velmi výraznou složku vzniku svalové
atrofie je třeba považovat rovněž oxidativní stres vznikající
generováním reaktivních sloučenin kyslíku (ROS) v atrofovaném
svalu. K podrobné patofyziologii svalové atrofie odkazujeme
na literaturu [35–37].
denervaci, hladovění,
ale i množství klinických stavů, při nichž vzniká jiný
typ atrofie – kachexie. Nehledě na základní příčinu je
svalová atrofie charakterizována snížením proteinového obsahu,
svalového průměru, poklesem produkce síly a únavovou
rezistencí. Rozdílné podmínky produkující atrofii navozují
samozřejmě rozdílné iniciační a signální cesty pro
devastaci svalu. Molekulární mechanismus znázorňuje obrázek 2
[34]. Pokud bychom to srovnávali s kachexií u některých
chorob, můžeme nalézt některé společné prvky, nicméně
iniciační znaky u atrofie z nečinnosti jsou zde méně
jasné. Jak bylo řečeno, kaskáda příznaků vedoucí k atrofii
z nečinnosti začíná redukovanou svalovou tenzí a rozsáhlým
efektem na proteinovou syntézu a degradaci. Je zde známo
několik faktorů, které mohou být označeny za iniciační.
Tyto poznatky pramení vesměs z experimentu. Iniciační
molekulou tak může být v první řadě myostatin (superrodina
TGFβ), dále syntetické glukokortikoidy (dexamethason) nebo TNFα
a jiné cytokiny. V případě kachexie jsou k dispozici
např. signifikantní literární doklady o zvýšených
hodnotách TNFα, IL 1, resp. IL 6 a NFκB (nukleární
faktor kappa B). Za velmi výraznou složku vzniku svalové
atrofie je třeba považovat rovněž oxidativní stres vznikající
generováním reaktivních sloučenin kyslíku (ROS) v atrofovaném
svalu. K podrobné patofyziologii svalové atrofie odkazujeme
na literaturu [35–37].
Úbytek svaloviny z inaktivity zasahuje do života pacienta mnoha způsoby. Jednak jsou to účinky psychologické a psychosociální, které pramení z neschopnosti vyrovnat se nezávisle s požadavky běžného dne a se souvisejícími depresemi. Jednak jsou to změny metabolické, např. změna senzitivity inzulinu u diabetes mellitus 2. typu, zvýšení infiltrace tuku v pojivové tkáni a svalu, velmi významná je redukce protizánětlivé obrany proti akutním i chronickým infektům a špatná pooperační a poúrazová regenerace. Většinou se také jedná o zvýšení hodnot prozánětlivých cytokinů. Pokud je přítomna zároveň obezita, mohou nastat některé přidružené metabolické účinky, kdy se excesivní množství volných mastných kyselin akumuluje ektopicky a v závěru způsobuje lipotoxický efekt. Dochází k narušení mitochondrií a nahromadění ROS, k porušení mitofagie, resp. k redukci biogeneze. Změny mitochondriální dynamiky jsou někdy považovány za příčinu inzulinové rezistence. Metabolickým působením obezity dochází i k rychlejšímu úbytku svalů.
Sarkopenie
Úbytek svalů na 30‒50 % výchozí hodnoty nazýváme sarkopenie a tento úbytek může vyústit až ve stav snižující kapacitu pro nezávislý život, tzv. frailty syndrom (pokles na 20‒30 %). Epidemiologická data o sarkopenii se vyskytují v mnoha pracích a epidemiologická čísla nejsou zcela jednotná. Průměrně můžeme říci, že v osmé dekádě života se pokles objemu svaloviny na úroveň sarkopenie pohybuje u mužů kolem 18 % a u žen kolem 27 %. Většinou dochází k nesymetrickému poklesu objemu svalstva, k vyššímu ve spodní části těla, kde dosahuje přibližně 15 %. Co se týká úbytku svalstva, jedná se o změny hlavně ve vláknech typu II, která se jeví jako více vulnerabilní. Etiologie sarkopenie se dnes považuje za etiologii komplexního charakteru, zahrnuje centrální a periferní nervový systém, změny hormonální, nutriční, imunologické a změny ve fyzické aktivitě. Je definována od roku 2010 skupinou European Working Group on Sarcopenia in Older People (EWGSOP). Poslední revize byla provedena v roce 2018.
Diagnostická kritéria a metody měření
Diagnostická kritéria jsou v podstatě kombinací čtyř kritérií, která jsou snadno proveditelná v klinické praxi:
- Zhodnocení redukce fyzické kapacity pacienta (resp. jeho slabosti). Dle EWGSOP mezní hodnota tzv. grip strength (svalové síly, kterou je člověk schopen působit na dané těleso po určitou dobu) činí pro muže < 30,0 kg a pro ženy < 20,0 kg.
- Zda je pacient hospitalizovaný, nebo v domácím ošetřování a zda je, nebo není schopen vstát ze židle.
- ‒4. Zhodnocení habituální rychlosti pacienta, s jakou ujde 4 metry. Pacient s habituální rychlostí < 1,0 m/s pro ženy, resp. < 0,8 m/s pro muže (mezní kritéria EWGSOP) by měl mít změřenou kvantitativně tělesnou kompozici pomocí DXA (dual energy X ray absorptiometry). Dalším kritériem, které se zde používá, je chůze na 400 metrů nebo šestiminutový test chůze ve spojení s měřením DXA.
Svalová hmota je velmi dobře charakterizována metodou DXA založenou na měření absorpce dvou rentgenových fotonů o energii blízko hodnoty 40‒47 KeV a 70‒80 KeV. Měření transmise těchto dvou fotonů umožňuje zjistit diferenci mezi kostí, tukovou hmotou a měkkou tkání. DXA je pro hodnocení komplexního složení organismu vhodnou metodou i z hlediska své nákladnosti. Při hodnocení tuku ve středu trupu může být v některých případech požadováno vyšetření výpočetní tomografií (CT) nebo magnetickou rezonancí (MRI) z důvodu přítomnosti abdominálních solidních orgánů a střev a z důvodu, že na základě uvedeného vyšetření lze vyhodnotit nejen kvantitu, ale i kvalitu tkání a odhalit rovněž přítomnost intramuskulárních lipidů. Přesto je DXA podle European Society for Clinical and Economic Aspects (ESCEA) považována za referenční standard pro měření svalové hmoty, nikoliv však za zlatý standard, jímž je MRI. Používání ultrasonografie je v tomto případě zatíženo velkou subjektivní chybou. Velkou výhodou DXA je rovněž nízká radiace 0,001 mSv při jedné expozici, což je mnohem méně než u standardního rentgenologického vyšetření hrudníku. Klíčovým indexem při vyšetření DXA je tzv. relativní svalový index, k jehož výpočtu je použita výška, výjimečně u obézních jedinců body mass index (BMI) [38], který při sarkopenii klesá u mužů pod 7,26 kg/m2 a u žen pod 5,45 kg/m2 (kritéria dle EWGSOP).
Prevence a léčba
Prevenci a léčbu popsaného stavu sarkopenie představují fyzická aktivita a správná strava. Je možné popsat několik intervenčních možností, které však prozatím nepřestoupily možnosti experimentu [39]. Z terapeutického a preventivního pohledu je nejjednodušší terapií sarkopenie intervence ve smyslu změny životního stylu, tj. fyzická aktivita a nutrice. Pojmem fyzická aktivita se rozumí tělesný pohyb produkovaný kontrakcí skeletálních svalů s výsledkem zvýšení energetického vývoje nad klidovou úroveň. Inaktivita odpovídá klidovému stavu a za sedavý způsob života považujeme vydání energie méně než 1,5 MET (výdej produkovaný při poloze vsedě nebo vleže). Různé druhy cvičení (např. vytrvalostní, rezistenční, aerobní vs. anaerobní, trvalé nebo přerušované) odlišně ovlivňují homeostázu a tím adaptační odpověď organismu. Adaptace na cvičení zahrnuje jak primární odpověď, tak sekundární odpověď, kdy uvolněný faktor působí ve třetí tkáni, a dále mechanické zlepšení a odpověď endokrinní a metabolickou. Opakované cvičení (trénink) redukuje základní chronický zánět a také akutní zánětlivou odpověď na akutní zánětlivý podnět [40]. Důležitá je otázka intenzity fyzické zátěže a jejího zařazení do denního programu. Optimální pro zdraví jedince se jeví být střední zátěž (3‒5,9 MET), resp. opakované cvičení na této úrovni ve smyslu tréninku. Délka fyzické zátěže u starších osob má být podle WHO 150 min/týden a doporučuje se v ranních hodinách, neboť v tuto dobu stimuluje robustně anabolické metabolické pochody. Je dnes plně akceptováno, že kromě fyzické zátěže longitudinální (běh, plavání, jízda na kole atd.) ve smyslu pravidelného vytrvalostního tréninku má velký význam rezistenční cvičení, tj. cvičení proti tlaku (zejména u starších jedinců), při němž nedochází ke svalové kontrakci. Základním principem tohoto typu cvičení je tzv. over stimul pro sval bez kontrakce. Jak u mladších jedinců, tak u starších osob tak dochází ke zvýšení síly a k nárůstu svalové hmoty [41].
Rezistenční cvičení představuje potentní anabolický stimul. Svalová proteinová syntéza se zvyšuje během 2‒3 hodin po rezistenčním cvičení a zůstává vyšší po dobu 24 hodin u trénovaného jedince a po dobu 48 hodin u netrénovaného jedince. Přínos rezistenčního cvičení nespočívá jen ve zvětšení svalové hmoty a zvýšení svalové síly, ale i ve zlepšení funkčnosti v neuromuskulární oblasti. Velmi zásadní pro úspěch rezistenčního tréninku je jeho frekvence, intenzita a objem [32].
Dietní opatření
Inaktivita je spojena se změnami proteinového metabolismu. Zde je třeba zmínit, že inaktivita znamená ztrátu svaloviny a ztráta svaloviny znamená změnu rovnováhy syntézy aminokyselin, které vytvářejí svalovou hmotu. Nabízí se otázka, jak tuto ztrátu nahradit, protože není známo přesné množství převahy odbourání aminokyselin ani jejich složení. Pro řešení celého problému se doporučuje celkový dietní program, který má dvě základní složky: 1. základní denní stravu a 2. doplnění bílkovin. V problematice dietního opatření u základní stravy je třeba se zaměřit na tzv. zánětlivý index celkového dietního režimu. Dietní komponenty modulují zánětlivý status organismu. Tomuto problému je v poslední době věnována velká pozornost. Za optimální z uvedeného pohledu se považuje dieta středomořská, která vyvolává tzv. hormetický efekt, jímž stimuluje faktor Nrf2 (erythroid 2 related factor 2), a další četné myoprotektivní vlivy [42,43]. Podobný typ diety představuje rovněž dieta z ostrova Okinawa v Japonsku. Dále byl také zkoumán vliv diet na zánětlivé markery (tj. na C reaktivní protein, IL 1β, IL 4, IL 6, IL 10 a TNFα) i na další markery – homocystein, chemerin, fibrinogen, komplement C3, leukocyty, interferony, intracelulární adhezní molekuly a vaskulární adhezní molekuly. Podle odezvy byly konstruovány optimální diety [44]. Zde je třeba zdůraznit, že tato otázka velmi úzce souvisí s probiotickým stavem zažívacího traktu [45,46].
V základní syntéze a odbourávání bílkovin nejsou rozdíly mezi mladými a staršími jedinci. Neoptimální diety u starších lidí mohou způsobit ztrátu svaloviny. Neadekvátní příjem proteinů může způsobit ztrátu svalové síly kvůli malé stimulaci proteinové syntézy. Kromě toho u starších lidí je též narušena absorpce aminokyselin. Přítomnost aminokyselin ve smyslu kvantitativním i kvalitativním v cirkulaci může být porušena i absorpcí v tenkém střevě. Podobně u různých proteinů může být ovlivněno jejich vstřebání a to, že mají rozdílnou retenci. Schopnost svalu konvertovat trávený protein a tím vznikající aminokyseliny konstituovat do myofibril a ostatní myocelulární struktury je velmi přesně regulována (maximum proteinů schopných inkorporace je přibližně 30 g, ostatní jsou pak oxidovány a jinak zpracovány). Proto se doporučuje do jednoho jídla zařadit ke konzumaci maximálně 30 g bílkovin. Kromě toho syntéza svalového proteinu nemá schopnost probíhat permanentně za hyperaminoacidemie. Syntéza proteinu se vrací k bazálním hodnotám i v případě, že již v tu dobu přidáváme další aminokyseliny. Tento fyziologický fakt při doplňování proteinů velmi ztěžuje postup a je nutno zvýšit frekvenci příjmu proteinů [47,48].
Další otázkou je, nakolik pomůže zvýšení příjmu bílkovin nárůstu svaloviny. Z populačních studií jednoznačně vyplývá, že pokud je příjem bílkovin pod 0,8 g/kg/den, dochází k úbytku svaloviny a uvedené skupiny pacientů mají méně svaloviny měřené metodou DXA. Další zvyšování objemu bílkovin nad 1,1‒1,8 g/kg/den nemá pro nárůst svaloviny žádný význam (kromě skupiny osob mladších 45 let [47]. Z prací na téma vhodného typu proteinů vyplývá zcela jednoznačně, že optimální protein představuje syrovátka [49]. Co se týče kvantitativních poměrů, je za optimum považováno 25‒30 g kvalitního proteinu se 2,5‒2,8 g leucinu pro příznivou stimulaci svalové proteinové syntézy. Toto optimální složení spolu s rezistenčním cvičením se vzájemně potencují ve smyslu syntézy proteinů ve svalu [50,51]. Ve sportovní medicíně se uvedené dávkování používá zhruba 1 hodinu po zátěži. U starších jedinců doporučuje aktuální literatura také dávku bílkovin na noc.
V závěru je třeba zmínit vitamin D vzhledem k jeho pleiomorfnímu účinku a účinku na samotný sval. Ve studiích na toto téma panuje velká heterogenita a řada konfliktních výsledků. Exaktní role vitaminu D v prevenci a léčbě úbytku svalů je prozatím nejistá a jsou potřebné intervenční studie k optimálnímu a exaktnímu vysvětlení dobré fyziologické funkce [52,53].
Závěr – praktické výstupy
Za smysluplnou reakci na výše uvedené poznatky jsme považovali jejich zahrnutí do péče o pacienty. Proto jsme vypracovali komplexní diagnostický a léčebný program, který byl prezentován na světovém kongresu IOF ESCEO (World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases) 2020 v Barceloně i na celostátním kongresu v Bratislavě a který prakticky uskutečňujeme již od podzimu 2019. Program (prozatím realizovaný ze soukromých prostředků bez podpory státu) nelze dosud validně statisticky vyhodnotit, můžeme deklarovat pouze předběžné výsledky, protože jeho průběh byl narušen pandemií nemoci COVID 19.
Program zahrnuje:
- Poučení pacientů – před omezením způsobeným pandemií byly organizovány přednášky určené různým věkovým skupinám pacientů, nyní poučení probíhá pouze na individuální úrovni.
- Pacient vyplňuje dotazník SarQol (Sarcopenia and Quality of Life), na jehož základě získáme informace především o subjektivním vnímání pohybu a jeho případných změn [54]. Dotazník je užíván v české verzi se souhlasem sarqol.org.
- Změření tzv. grip strength standardizované dle protokolu Southhamptonské univerzity dynamometrem Jamar. U českých pacientek byly zaznamenány statisticky významně nižší hodnoty v porovnání s německou a britskou populací (hodnoceno u n = 82). Pokles síly během roku je rovněž významný, ale pohybuje se nad hodnotami pro sarkopenii, která u žen činí 20 kg.
- Určení relativního skeletálního indexu metodou DXA. Pouze u dvou pacientek (n = 82) byly zaznamenány údaje nižší než sarkopenická hodnota 5,45 kg/m2. Statisticky významné byly poklesy po roční kontrole (5‒11 %/rok) u části pacientek (n = 23) a významný rozdíl byl zachycen mezi skupinou pacientů dodržujících doporučené režimy a těmi, kteří je z různých důvodů dodržet nemohli.
- Vyšetření tandemového postoje a chůze a rychlosti chůze u všech pacientů. Kromě běžných laboratorních vyšetření podstupují kontrolní skupiny pacientů rovněž monitoraci hodnot IL 6 a vysoce senzitivního CRP (hsCRP). Hromadný test chůze na 400 metrů musel být kvůli epidemiologické situaci vynechán.
Všichni pacienti dostávají po prvním vyšetření brožuru s komplexními informacemi o dietním režimu a režimu fyzického pohybu s obrazovým materiálem (k dispozici ke stažení na: www.mediekosambulance.cz/ke stazeni/).
Koncept programu plně odpovídá evropskému pojetí. Předběžné individuální výsledky svědčí pro jeho smysluplnost a nutnost zavedení v širším měřítku, kdy by měl být prováděn v odpovídajících věkových skupinách a v odpovídajícím rozsahu.
Smysl tohoto programu vidíme v dlouhodobém udržení samostatnosti a kvality života, odklonění starší populace od nemocničních a ústavních pobytů a při jeho rozšíření v kontinuálním snižování nákladů a zvyšování nákladové efektivity českého zdravotnictví.
Seznam použité literatury
- [1] WHO. World Report on Ageing and Health 2015. Dostupné na: https://www.who.int/ageing/events/world‑report‑2015‑launch/en/
- [2] Physical Activity Guidelines for Americans, 2nd edition. U.S. Department of Health and Human Services, 2018. Dostupné na: https://health.gov/sites/default/files/2019‑09/Physical_Activity_Guidelines_2nd_edition.pdf
- [3] ČSÚ. Věkové složení obyvatelstva 2020. Dostupné na: https://www.czso.cz/csu/czso/vekove‑slozeni‑obyvatelstva‑2020
- [4] Kennedy BK, Berger SL, Brunet A, et al. Geroscience: Linking Aging to Chronic Disease. Cell 2014; 159: 709‒713.
- [5] Booth FW, Roberts CK, Thyfault JP, et al. Role of inactivity in chronic diseases: Evolutionary insight and pathophysiological mechanisms. Physiol Rev 2017; 97: 1351‒1402.
- [6] Booth F W, Roberts C K, Laye MJ. Lack of exercise is a major cause of chronic diseases. Compr Physiol 2012; 2: 1143‒1211.
- [7] Booth F W, Laye MJ. Lack of adequate appreciation of physical exercise’s complexities can pre‑empt appropriate design and interpretation in scientific discovery. J Physiol 2009; 587: 5527‒5540.
- [8] Tanaka H, Seals DR. Physiology in Aging. Invited Review: Dynamic exercise performance in Masters Athletes: insight into the effects of primary human aging on physiological functional capacity. J Appl Physiol 2003; 95: 2152‒2162.
- [9] Strasser B, Volaklis K, Fuchs D, Burtscher M. Role of Dietary Protein and Muscular Fitness on Longevity and Aging. Aging Dis 2018; 9: 119–132.
- [10] Pearson SJ, Young A, Macaluso A, et al. Muscle function in elite master weightlifters. Med Sci Sports Exerc 2002; 34: 1199‒1206.
- [11] Thijssen DHJ, Majorana AJ, O’Driscoll G, et al. Impact of inactivity and exercise on the vasculature in humans. Eur J Appl Physiol 2010; 108: 845‒875.
- [12] Ogden CL, Yanovski SZ, Carroll MD, Flegal KM. The epidemiology of obesity. Gastroenterology 2007; 132: 2087‒2102.
- [13] Carlsson S, Andersson T, Lichtenstein P, et al. Physical Activity and Mortality: Is the Association Explained by Genetic Selection? Am J Epidemiol 2007; 166: 255‒259.
- [14] Aversa Z, Zhang X, Fielding RA, et al. The clinical impact and biological mechanisms of skeletal muscle aging. Bone 2019; 127: 26‒36.
- [15] Wei X, Luo L, Chen J. Roles of mTOR Signaling in Tissue Regeneration. Cells 2019; 8: 1075.
- [16] Bonaldo P, Sandri M. Cellular and molecular mechanisms of muscle atrophy. Dis Model Mech 2013; 6: 25‒39.
- [17] Alway SE, Myers MJ, Mohamed JS. Regulation of satellite cell function in sarcopenia. Front Aging Neurosci 2014; 6: 246.
- [18] Mukund K, Subramaniam S. Skeletal muscle: A review of molecular structure and function in health and disease. Wiley Interdiscip Rev Syst Biol Med 2020; 12: e1462.
- [19] Leal LG, Lopes MA, Batista ML Jr. Physical Exercise‑Induced Myokines and Muscle‑Adipose Tissue Crosstalk: A review of Current Knowledge and the Implication for Health and Metabolic Diseases. Front Physiol 2018; 9: 1307.
- [20] Pedersen BK, Saltin B. Exercise as medicine‑evidence for prescribing exercise as therapy in 26 different chronic diseases. Scand J Med Sci Sports 2015; 25(Suppl 3): 1‒72.
- [21] WHO. Global Status Report on Noncommunicable Diseases 2014. Dostupné na: https://www.who.int/nmh/publications/ncd‑status‑report‑2014/en/
- [22] Laurens C, Bergouignan A, Moro C. Exercise‑Released Myokines in the Control of Energy Metabolism. Front Physiol 2020; 11: 91.
- [23] Sharma M, Langley B, Bass J, Kambadur R. Myostatin in Muscle Growth and Repair. Exerc Sport Sci Rev 2001; 29: 155‒158.
- [24] Elkina Y, von Haehling S, Anker SD, et al. The role of myostatin in muscle wasting: an overview. J Cachexia Sarcopenia Muscle 2011; 2: 143‒151.
- [25] Pedersen BK. Muscles and their myokines. J Exp Biol 2011; 214: 337‒346.
- [26] Pedersen BK, Febbraio MA. Muscles, exercise and obesity: skeletal muscle as a secretory organ. Nat Rev Endocrinol 2012; 8: 457‒465.
- [27] Gonzales‑Gil A, Elizondo‑Montemayor L. The Role of Exercise in the Interplay between Myokines, Hepatokines, Osteokines, Adipokines and Modulation of Inflammation for Energy Substrate Redistribution and Fat Mass Loss: A Review. Nutrients 2020; 12: 1899.
- [28] Severinsen MCK, Pedersen BK. Muscle‒Organ Crosstalk: The Emerging Roles of Myokines. Endocr Rev 2020; 41: 594‒609.
- [29] Brocker C, Thompson D, Matsumoto A, et al. Evolutionary divergence and functions of the human interleukin (IL) gene family. Hum Genomics 2010; 5: 30‒55.
- [30] Oh KJ, Lee DS, Kim WK, et al. Metabolic Adaptation in Obesity and Type II Diabetes: Myokines, Adipokines and Hepatokines. Int J Mol Sci 2017; 18: 8.
- [31] Pagnoti GM, Styner M, Uzer G, et al. Combating osteoporosis and obesity with exercise: leveraging cell mechanosensitivity. Nat Rev Endocrinol 2019; 15: 339‒355.
- [32] Scheffer da Luz D, Latini A. Exercise‑induced immune system response: Anti‑inflammatory status on peripheral and central organs. Biochim Biophys Acta Mol Basis Dis 2020; 1866: 165823.
- [33] Clark BC, Manini TM. Sarcopenia ≠ Dynapenia. Journals of Gerontology 2008; 63A: 829‒834.
- [34] Howard EE, Pasiakos SM, Fussell MA, Rodriguez NR. Skeletal Muscle Disuse Atrophy and the Rehabilitative Role of Protein in Recovery from Musculo‑skeletal Injury. Adv Nutr 2020; 11: 989‒1001.
- [35] Powers SK, Smuder AJ, Criswell DS. Mechanistic Links Between Oxidative Stress and Disuse Muscle Atrophy. Antioxid Redox Signal 2011; 15: 2519‒2528.
- [36] Jackman RW, Kandarian SC. The molecular basis of skeletal muscle atrophy. AM J Physiol Cell Physiol 2004; 287: C834‒C843.
- [37] Hyatt H, Deminice R, Yoshihara T, Powers SK. Mitochondrial dysfunction induces muscle atrophy during prolonged inactivity: a review of the causes and effects. Arch Biochem Biophys 2019; 662: 49‒60.
- [38] Lee K, Shin Y, Huh J, et al. Recent Issues on Body Composition Imaging for Sarcopenia Evaluation. Korean J Radiol 2019; 20: 205‒217.
- [39] Park SS, Kwon ES, Kwon KS. Molecular mechanisms and therapeutic interventions in sarcopenia. Osteoporosis and Sarcopenia 2017; 3: 117‒122.
- [40] Kirk B, Feehan J, Lombardi G, Duque G. Muscle, Bone and Fat Crosstalk: the biological Role of myokines, Osteokines and Adipokines. Current Osteoporos Res 2020; 18: 388‒400.
- [41] Lavin KM, Roberts BM, Fry CS, et al. The Importance of Resistance Exercise Training to Combat Neuromuscular Aging. Physiology (Bethesda) 2019; 34: 112‒122.
- [42] Martucci M, Ostan R, Biondi F, et al. Mediterranean diet and inflammaging within the hormesis paradigm. Nutr Rev 2017; 75: 442‒455.
- [43] Pall ML, Levine S. Nrf2, a master regulator of detoxification and also antioxidant, anti‑inflammatory and other cytoprotective mechanisms, is raised by health promoting factors. Acta Physiologica Sinica 2015; 67: 1‒18.
- [44] Corley J, Shivappa N, Hébert JR, et al. Associations between Dietary Inflammatory index Scores and Inflammatory Biomarkers among Older Adults in the Lothian Birth Cohort 1936 Study. J Nutr Health Aging 2019: 23: 628‒636.
- [45] Biagi E, Franceschi C, Rampelli S, et al. Gut Microbiota and extreme Longevity. Curr Biol 2016; 26: 1480‒1485.
- [46] Hughes RL. A Review of the Role of the Gut Microbiome in Personalized Sports Nutrition. Front Nutr 2020; https://doi.org/10.3389/fnut.2019.00191.
- [47] Mittendorfer B, Klein S, Fontana L. The Response of Muscle Protein Anabolism to Combined Hyperaminoacidemia and Glucose‑Induced Hyperinsulinemia Is Impaired in the Elderly. J Clin Endocrinol Metab 2020; 85: 4481‒4490.
- [48] Burd NA, Tang JE, Moore DR, Philips SM. Exercise training and protein metabolism: influences of contraction, protein intake, and sex‑based differences. J Appl Physiol 2009; 106: 1692−1701.
- [49] Nakayama K, Tagawa R, Saito Y, Sanbongi C. Effects of whey protein hydrolysate ingestion on post‑exercise muscle protein synthesis compared with intact whey protein in rats. Nutrition & Metabolism 2019; 16: 90.
- [50] Xia Z, Cholewa J, Zhao Y, et al. Targeting Inflammation and Downstream Protein Metabolism in Sarcopenia: A Brief Up‑Dated Description of Concurrent Exercise and Leucine‑Based Multimodal Intervention. Front Physiol 2017; 8: 434.
- [51] Liao CH‑De, Tsauo JY, Wu YT, et al. Effects of protein supplementation combined with resistance exercise on body composition and physical function in older adults: a systematic review and meta‑analysis. Am J Clin Nutr 2017; 106: 1078‒1091.
- [52] Remelli F, Vitali A, Zurlo A, Volpato S. Vitamin D deficiency and Sarcopenia in Older Persons. Nutrients 2019; 11: 2861.
- [53] Hassan‑Smith ZK, Jenkonson C, Smith DJ, et al. 25‑hydroxyvitamin D3 and 1,25‑dihydroxyvitamin D3 exert distinct effects on human skeletal muscle function. PLOS One 2017; 12: e0170665.
- [54] Beaudart C, Biver E, Reginster J‑Y, et al. Development of a self‑administrated quality of life questionnaire for sarcopenia in elderly subjects: the SarQoL. Age Ageing 2015; 44: 960–966.