Péče o nemocné s diabetem a postižením ledvin
Diabetické onemocnění ledvin (DOL) je závažnou sekundární komplikací diabetu a v současné době je hlavní příčinou chronického selhání ledvin v rozvinutých zemích. Průběh DOL je charakterizován postupně zvýšením albuminurie (mikroalbuminurie), proteinurií s hypertenzí a klesající renální funkcí. Současně s progresí DOL dochází i k nárůstu výskytu a k rozvoji dalších mikro- a makrovaskulárních komplikací diabetu. Screening DOL směřuje k časnému záchytu onemocnění s cílem zvrátit, nebo alespoň významně zpomalit jeho průběh.
Léčba je zaměřena na ovlivnění dosud známých hlavních rizikových faktorů vzniku a progrese DOL, kterými jsou dlouhodobá hyperglykemie, hypertenze, proteinurie, dyslipidemie a kouření. Práce shrnuje aktuální léčebné postupy, mezi něž patří metabolická kompenzace diabetu, léčba hypertenze, inhibice systému renin-angiotenzin, hypolipidemická terapie a zanechání kouření
Definice a epidemiologie diabetického onemocnění ledvin
Pojem diabetické onemocnění ledvin (DOL; z anglického diabetic kidney disease, DKD) je novějším označením chorobné jednotky dosud známé jako diabetická nefropatie, jejímiž hlavními klinickými projevy jsou trvalá proteinurie, hypertenze a postupující ztráta renální funkce. V řadě rozvinutých zemí představuje DOL v současné době hlavní příčinu vzniku chronického selhání ledvin. V České republice bylo podle údajů Ústavu zdravotnických informací a statistiky v roce 2011 diabetické onemocnění ledvin přítomno u více než 95 tisíc (11,6 %) nemocných s diabetem, z nichž se 34 % nacházelo již v různých fázích chronické renální insuficience.
Klinický průběh
K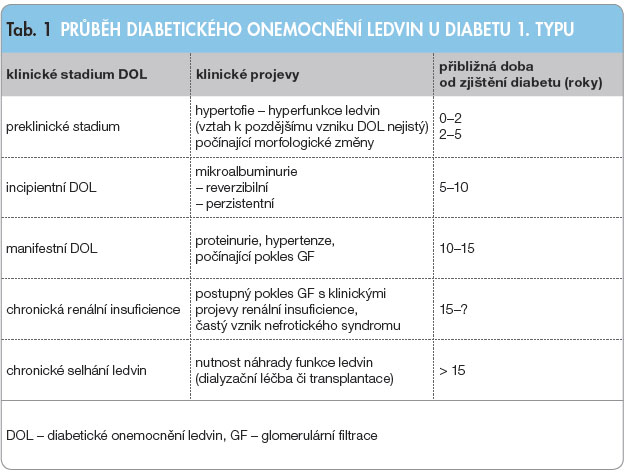 lasické rozdělení průběhu DOL u diabetu 1. typu do jednotlivých stadií se objevilo v klinické praxi v 80. letech díky pracím Mogensena a kol. (tab. 1). Je dosud sporné, zda lze renální hypertrofii a hyperfunkci (hyperfiltraci) popisovanou krátce po vzniku diabetu u některých nemocných skutečně pokládat za počínající DOL [1]. Naproti tomu trvale zvýšené močové vylučování albuminu (mikroalbuminurie) již signalizuje riziko vzniku nefropatie s proteinurií a riziko výskytu vaskulárních komplikací. Některými autory byla prokázána již ve fázi mikroalbuminurie i možnost poklesu renální funkce [2]. V posledních letech se ovšem ukazuje, že zejména nižší úrovně mikroalbuminurie mohou v některých případech i spontánně regredovat. Zcela nepochybná je pak možnost zvratu vývoje DOL ve stadiu mikroalbuminurie a časné proteinurie vlivem intenzivní antihypertenzní a antidiabetické léčby [3, 4].
lasické rozdělení průběhu DOL u diabetu 1. typu do jednotlivých stadií se objevilo v klinické praxi v 80. letech díky pracím Mogensena a kol. (tab. 1). Je dosud sporné, zda lze renální hypertrofii a hyperfunkci (hyperfiltraci) popisovanou krátce po vzniku diabetu u některých nemocných skutečně pokládat za počínající DOL [1]. Naproti tomu trvale zvýšené močové vylučování albuminu (mikroalbuminurie) již signalizuje riziko vzniku nefropatie s proteinurií a riziko výskytu vaskulárních komplikací. Některými autory byla prokázána již ve fázi mikroalbuminurie i možnost poklesu renální funkce [2]. V posledních letech se ovšem ukazuje, že zejména nižší úrovně mikroalbuminurie mohou v některých případech i spontánně regredovat. Zcela nepochybná je pak možnost zvratu vývoje DOL ve stadiu mikroalbuminurie a časné proteinurie vlivem intenzivní antihypertenzní a antidiabetické léčby [3, 4].
Na druhou stranu je velmi pravděpodobné, že od určité fáze je již renální postižení ireverzibilní a zahájení intenzifikované intervence může další průběh pouze zpomalit, a nikoli zastavit či zvrátit. Klinicky se zlomové období projeví výrazným vzestupem proteinurie nad hodnotu kolem 1 g/24 hodin. Naprostá většina nemocných s diabetem 1. typu, kteří pokročí do fáze renální insuficience a chronického selhání ledvin, projde fází významné proteinurie [5]. Rychlost poklesu renální funkce u osob s proteinurií je až 19krát vyšší než u diabetických pacientů s normálními hodnotami odpadu albuminu do moči [6].
Zvláštnosti DOL u diabetu 2. typu
Možnost včasného záchytu nefropatie a intervence u nemocných s diabetem 2. typu je značně ovlivněna specifiky v klinickém průběhu diabetu. Charakteristický je iniciální dlouhý inaparentní průběh diabetu, jehož předchozí trvání do okamžiku zjištění bývá odhadováno na 8–10 let. Rovněž zjištění hypertenze často předchází stanovení diagnózy diabetické metabolické poruchy o řadu let a hypertenze má tak spíše charakter hypertenze idiopatické, esenciální a nikoli sekundární (až v důsledku rozvoje nefropatie), jak tomu bývá u diabetu 1. typu. Je proto zřejmé, že v okamžiku záchytu diabetu mohou být u části nemocných již přítomna iniciální, nebo dokonce pokročilá stadia orgánových komplikací. Jejich screening by proto měl být zahájen ihned od stanovení diagnózy diabetické metabolické poruchy.
U nemocných s diabetem 2. typu a chronickým onemocnění ledvin je nutno také častěji než u diabetu 1. typu počítat s možností alternativní příčiny renálního postižení. Svědčí pro to i informace, že oba klasické průvodní projevy diabetické nefropatie, albuminurie a retinopatie, nejsou přítomny až u 30 % nemocných s diabetem 2. typu a ledvinnou nedostatečností [7]. U nemocných, kteří mají neproteinurické selhání ledvin, patří mezi hlavní příčiny ledvinového selhávání různé typy vaskulárních nefropatií, jejichž vznik ovlivňuje významným způsobem hypertenze, případně poruchy lipidového metabolismu. Skutečnou velikost podílu nediabetických nefropatií u těchto nemocných lze ovšem jen obtížně odhadovat, protože souhrnné analýzy výsledků morfologických vyšetření jsou pochopitelně zkresleny tím, že k biopsiím prakticky nejsou indikováni nemocní s typickými klinickými projevy, ale jen ti, kde již lze z klinicko-laboratorního obrazu soudit na možnou alternativní etiologii renálních změn.
DOL jako rizikový faktor
Negativně prognostický význam zjištění DOL není omezen jen na riziko budoucí ztráty funkce ledvin a vzniku jejich chronického selhání. Rozvoj diabetické nefropatie se zhoršováním renální funkce je mj. pravidelně provázen i zhoršováním metabolické kontroly diabetu včetně nárůstu lability s rizikem hypoglykemií, poruch v lipidovém spektru a akcentací hypertenze. Důsledkem je i dramatická progrese aterosklerózy a nárůst výskytu vaskulárních komplikací, které jsou hlavní příčinou značné morbidity a mortality nemocných s DOL. Široký prognostický význam renálního postižení vyplývá i z řady studií, které ukazují, že zvrat nebo redukce mikroalbuminurie či proteinurie je indikátorem snížení jak renálního, tak i kardiovaskulárního rizika u nemocných s oběma hlavními typy diabetu [8, 9].
DOL také urychluje rozvoj sekundárních mikrovaskulárních komplikací diabetu. Nález na očním pozadí patří k vyšetřením běžně využívaným u diabetických pacientů v diferenciální diagnostice typu primárního onemocnění ledvin, protože výskyt diabetické nefropatie izolovaně bez nálezu minimálně prosté retinopatie je jen zcela výjimečný. Nemocní s pokročilými stadii nefropatie mají rovněž prakticky vždy těžké formy diabetické periferní neuropatie s vysokým rizikem vzniku defektů dolních končetin a dalších projevů syndromu diabetické nohy. U pacientů s diabetem a nefropatií se často u různých orgánových systémů vyskytují příznaky a projevy autonomní neuropatie, jejíž přítomnost v kardiální oblasti navíc u diabetu 1. typu nezávisle predikuje zvýšenou kardiovaskulární morbiditu a mortalitu [10].
Screening DOL
Vzhledem k prognostické závažnosti DOL má prevence jejího vzniku pomocí intenzivní metabolické kontroly diabetu a léčby hypertenze, případně alespoň včasný záchyt pomocí screeningu ještě ve stadiích, která lze zvrátit léčbou, naprosto zásadní význam pro osud nemocných s diabetem. Aktuální screeningová doporučení zahrnují následující kroky:
•Detekce zvýšeného vylučování albuminu do moči (mikroalbuminurie) – nejvýhodněji pomocí poměru albumin/kreatinin (ACR – albumin/creatinine ratio) v ranním vzorku moči (norma < 2,5 mg albuminu/mmol kreatininu).
Zejména u nemocných s diabetem 2. typu je nutno počítat i s možností již přítomné klinické formy nefropatie s trvalou proteinurií při vstupním vyšetření; naopak u diabetu 1. typu lze se screeningem vyčkat až do 5. roku po vzniku diabetu.
•Detekce snížení renální funkce pomocí stanovení sérového kreatininu a výpočtu odhadované glomerulární filtrace (eGFR – estimated glomerular filtration rate).
Ke klasifikaci chronické nemoci ledvin (CKD – chronic kidney disease) se standardně používá dělení do 5 funkčních stadií podle americké National Kidney Foundation; za již jednoznačně klinicky velmi významné je nutno pokládat snížení renální funkce od stadia CKD 3 při eGFR < 1,0 ml/s.
Záchyt iniciálních stadií nefropatie je indikací zejména k intenzifikaci léčby diabetu a hypertenze v diabetologické ordinaci; stadium CKD 4 (eGFR < 0,5 ml/s) pak rovněž k dispenzarizaci v nefrologické ambulanci.
Léčba
Základním cílem léčebných opatření u nemocných s DOL je zvrat již vzniklých postižení a poruch, případně alespoň stabilizace stavu s prevencí progrese. Volba léčebných postupů se opírá o možnost ovlivnění prokazatelných rizikových faktorů vzniku a rozvoje DOL, kterými jsou hyperglykemie, hypertenze, proteinurie, poruchy lipidového spektra a kouření. Kromě příznivého ovlivnění vývoje renálního postižení by však intervence měla vést i ke snížení rizika vzniku vaskulárních komplikací a mortality, čehož bylo např. v dánské studii STENO-2 u pacientů s diabetem 2. typu a mikroalbuminurií dosaženo pomocí multifaktoriální intervence se současným užitím více různě zaměřených léčiv a změnami životosprávy [11].
Léčba hyperglykemie
Rozhodujícím ukazatelem pro sledování úrovně metabolické kontroly diabetu je glykovaný hemoglobin (HbA1c) s cílovými hodnotami < 5,3 % (53 mmol/mol hemoglobinu). Pokročilejší stadia DOL se snížením renální funkce však disponují nemocné ke zvýšení lability diabetu a rizika hypoglykemie. Příčinami jsou zde mj. změny v metabolismu inzulinu a některých perorálních antidiabetik, snížení renální glukoneogeneze a přítomnost autonomní neuropatie s poruchou kontraregulačních mechanismů v odpovědi na hypoglykemii. Cílové hodnoty HbA1c tak mohou být v individuálních případech zmírněny (na hodnotu < 6–6,5 %); špatná metabolická kompenzace však jednoznačně zhoršuje prognózu nemocných i ve fázi chronického selhání ledvin [12].
S postupující redukcí glomerulární filtrace je vhodné denní dávky inzulinu u pacientů s diabetem 1. typu snižovat, v pokročilých stadiích CKD až o 25–50 %. Úpravy dávkování by však měly být prováděny zcela individuálně na základě průběžných kontrol glykemie, v případě diabetu 2. typu je nutno počítat s přítomností inzulinové rezistence. Při inzulinoterapii se v této fázi onemocnění mohou výhodně uplatnit inzulinová analoga, s jejichž podáváním je ve srovnání s humánními inzuliny spojen předpoklad nižšího výskytu hypoglykemií. Srovnávací studie takto specificky zaměřené však dosud nejsou k dispozici.
Léčiva zvyšující účinek inzulinu – inzulinové senzitizéry
Základní perorální antidiabetikum pro nemocné s diabetem 2. typu – biguanid metformin – redukuje jaterní produkci glukózy a je odstraňováno převážně glomerulární filtrací. Užití metforminu u značně snížené renální funkce (eGFR < 0,5 ml/s) je jednoznačně kontraindikováno pro riziko vzniku laktátové acidózy. Vzhledem k mimořádným výhodám léčby metforminem, které zahrnují snižování výskytu vaskulárních komplikací a dle některých údajů i malignit, však dochází k určité liberalizaci v přístupu k podávání u mírnějších stadií CKD (při eGFR > 1,0 ml/s lze podávat bez omezení, při eGFR 0,5–1,0 ml/s se doporučuje snížit dosavadní dávku na polovinu a nezahajovat léčbu nově) [13]. Ve skupině thiazolidindionů (TZD; glitazonů) zvyšujících účinnost inzulinu v cílových tkáních je aktuálně dostupný pouze pioglitazon, léčivo s dobrým účinkem na parametry glukózového metabolismu, které je metabolizováno v játrech. K dispozici jsou data o možném příznivém ovlivnění albuminurie/proteinurie a kardiovaskulární bezpečnosti léčby pioglitazonem u nemocných s diabetem a CKD [14]. Na druhou stranu jsou kontraindikací léčby pioglitazonem srdeční selhání a kostní změny, údaje o užití ve stadiu chronického selhání ledvin nejsou dosud dostatečné.
Léčiva zvyšující sekreci inzulinu – inzulinová sekretagoga
Z derivátů sulfonylurey bychom se měli při renální insuficienci vzhledem k riziku hypoglykemie jednoznačně vyhnout užití léčiv s dlouhým poločasem (především glibenklamidu) nebo s možností kumulace vlastní léčivé látky či aktivních, ledvinami eliminovaných metabolitů (v terminálních stadiích CKD se to týká většiny derivátů sulfonylurey kromě gliquidonu, ev. gliklazidu). Repaglinid, u nás jediný dostupný zástupce skupiny glinidů, je pro svůj rychlý a krátký účinek používán zejména k ovlivnění prandiálních glykemií. Při své naprosto převažující jaterní eliminaci je použitelný ve všech fázích DOL.
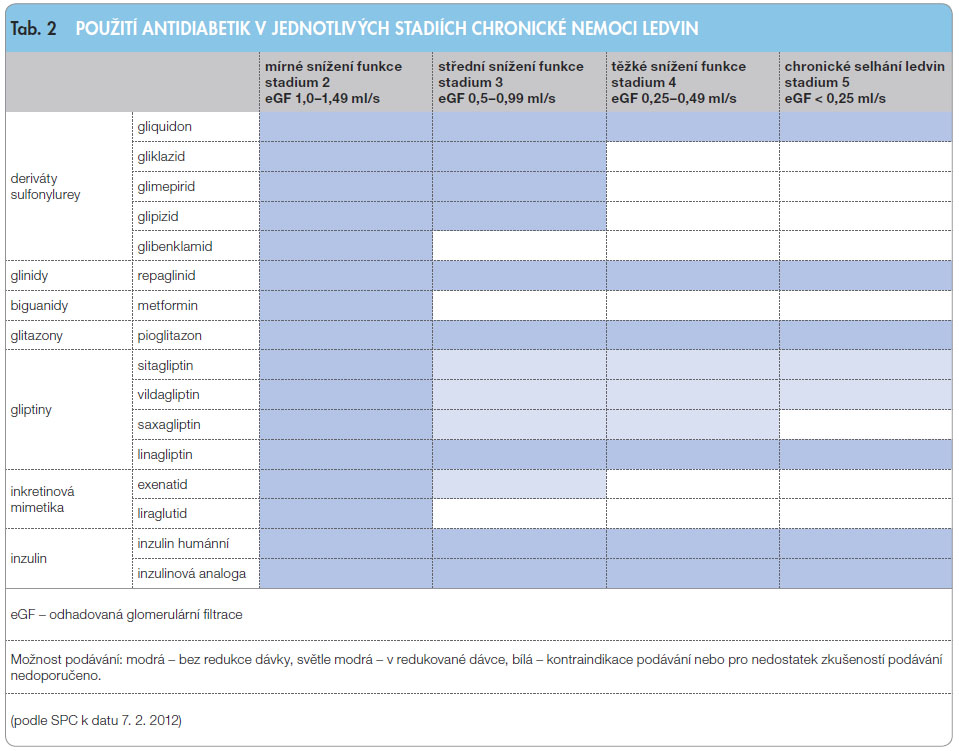 Novějšími skupinami inzulinových sekretagog jsou inkretinová mimetika (agonisté receptoru pro glucagon-like peptide 1, GLP-1) a inhibitory enzymu dipeptidylpeptidázy 4 (DPP-4), gliptiny. Inkretinová mimetika určená k podkožní aplikaci působí stejným mechanismem jako endogenní GLP-1 (zejména stimulace výdeje inzulinu, inhibice výdeje glukagonu, snížení chuti k jídlu), jsou však odolná k inaktivaci enzymem DPP-4. Inhibitory DPP-4 zvyšují hladinu endogenního GLP-1. Hlavní výhodou obou těchto skupin léčiv je nízké riziko vzniku hypoglykemie a hmotnostních přírůstků, případně přímo efekt na snížení hmotnosti. Z inkretinových analog je použitelný u středně snížené renální funkce exenatid, v případě gliptinů je u všech s výjimkou linagliptinu nutná redukce dávky u pacientů s CKD ve stadiu 3 a vyšším. Zajímavé jsou nové informace o možném příznivém účinku na renální postižení, přesahujícím efekty očekávané při snížení glykemie (redukce albuminurie při léčbě linagliptinem v dodatečné analýze 7 randomizovaných, placebem kontrolovaných studií [15]).
Novějšími skupinami inzulinových sekretagog jsou inkretinová mimetika (agonisté receptoru pro glucagon-like peptide 1, GLP-1) a inhibitory enzymu dipeptidylpeptidázy 4 (DPP-4), gliptiny. Inkretinová mimetika určená k podkožní aplikaci působí stejným mechanismem jako endogenní GLP-1 (zejména stimulace výdeje inzulinu, inhibice výdeje glukagonu, snížení chuti k jídlu), jsou však odolná k inaktivaci enzymem DPP-4. Inhibitory DPP-4 zvyšují hladinu endogenního GLP-1. Hlavní výhodou obou těchto skupin léčiv je nízké riziko vzniku hypoglykemie a hmotnostních přírůstků, případně přímo efekt na snížení hmotnosti. Z inkretinových analog je použitelný u středně snížené renální funkce exenatid, v případě gliptinů je u všech s výjimkou linagliptinu nutná redukce dávky u pacientů s CKD ve stadiu 3 a vyšším. Zajímavé jsou nové informace o možném příznivém účinku na renální postižení, přesahujícím efekty očekávané při snížení glykemie (redukce albuminurie při léčbě linagliptinem v dodatečné analýze 7 randomizovaných, placebem kontrolovaných studií [15]).
Možnost užití jednotlivých antidiabetik v různých stadiích CKD udává tab. 2.
Léčba hypertenze a albuminurie/proteinurie
Dramatický příznivý efekt tehdy dostupných antihypertenziv na vývoj renální funkce u DOL byl zaznamenán již v 80. letech [16, 17], ještě před zavedením inhibitorů systému renin-angiotenzin (RAS) do klinické praxe. To svědčilo pro přímý efekt snížení krevního tlaku (TK) na vývoj diabetické nefropatie a vedlo k požadavku intenzivní antihypertenzní terapie až k nízkým cílovým hodnotám (obvykle < 130/80 mm Hg, u nemocných s proteinurií > 1 g/24 hodin až k TK < 125/75 mm Hg). Antihypertenzní terapie vede u významné části pacientů k regresi onemocnění se snížením rychlosti poklesu glomerulární filtrace až k úrovni odpovídající běžnému vlivu stárnutí [18].
Přestože v důsledku nepříznivých výsledků některých recentních studií, zejména studie ACCORD (Action to Control Cardiovascular Risk in Diabetes) [19], došlo v posledním období u diabetické populace jako celku ke „změkčení“ cílových hodnot (na TK < 140/90 mm Hg), zůstávají pro nemocné s projevy orgánových komplikací, zejména diabetické nefropatie, v platnosti dosavadní přísnější doporučení [20]. Nepochybně však platí, že je vždy nutno léčbu přizpůsobit klinickému stavu konkrétního pacienta s respektováním všech možných rizik, například závažné ortostatické hypotenze u starších nemocných či vzniku nové koronární příhody u osob s vysokým kardiovaskulárním rizikem.
Hypertenze (zvláště systolická) při diabetické nefropatii je často rezistentní k terapii a vyžaduje použití rozsáhlé kombinace léčiv. Základními antihypertenzivy jsou standardně inhibitory RAS (viz dále), v následných krocích však lze léčbu doplnit léčivy prakticky ze všech skupin antihypertenziv. Úvodní kombinace obvykle zahrnuje kromě inhibitorů RAS kalciové blokátory a diuretika s pozdějším přidáním antihypertenziv z dalších skupin (centrální sympatolytika, beta- a alfablokátory, případně kombinovaná sympatolytika). Velmi významná úloha v léčbě přísluší diuretikům – iniciálně thiazidovým, v pozdějších fázích nefropatie (s poklesem eGFR k úrovni < 0,75 ml/s) diuretikům kličkovým. Nezařazení diuretik do kombinace, zejména u nemocných s projevy retence tekutin, patří k hlavním příčinám neúspěchu v dosažení cílových hodnot krevního tlaku. Diuretika jsou také velice efektivním prostředkem ke korekci možné hyperkalemie, k níž mají nemocní s diabetem a nefropatií, kteří jsou navíc pravidelně léčeni inhibitory RAS, významný sklon. Aktuální podrobný přehled antihypertenzní terapie při DOL poskytuje monografie Diabetická nefropatie [21].
Inhibitorům RAS, na jejichž renoprotektivním efektu se pravděpodobně podílí zejména snížení intraglomerulárního kapilárního tlaku při preferenční dilataci eferentní arterioly a ovlivnění aktivity některých trofických faktorů, patří v prevenci a léčbě diabetické nefropatie zvláštní místo. Vyšší účinnost inhibitorů angiotenzin konvertujícícho enzymu (ACEI) a blokátorů AT1 receptoru pro angiotenzin II (ARB; sartanů) z hlediska vlivu na progresi diabetické nefropatie ve srovnání s ostatními antihypertenzivy byla prokázána v několika známých studiích u obou typů diabetu [22–24]. Vzájemná srovnání obou skupin inhibitorů RAS také svědčí pro přibližně stejný léčebný účinek [25].
Významným renoprotektivním mechanismem účinku inhibitorů RAS je snížení, případně úplná remise albuminurie/proteinurie. To je patrné v širokém rozmezí zvýšeného vylučování albuminu/proteinu do moči – od mikroalbuminurie [23] přes klinickou proteinurii, a dokonce až po proteinurii nefrotické úrovně, u níž lze přes již nepochybnou přítomnost pokročilých strukturálních změn ledvin inhibicí RAS dosáhnout u části nemocných remise se zpomalením progrese a zlepšením prognózy [26]. Kvantitativní hodnocení albuminurie/proteinurie proto patří k základním vyšetřením při průběžné monitoraci efektu terapie.
Především díky intenzivní léčbě hypertenze zahrnující inhibitory RAS a zlepšení kontroly glykemie se do poloviny minulého desetiletí podařilo prodloužit medián přežívání nemocných s diabetem 1. typu a nefropatií z původních 5–7 let na téměř 22 let [27]. Přesto však zůstává prognóza většiny těchto nemocných a osud jejich ledvin podstatně horší než u osob bez proteinurie, což vyžaduje hledání dalších nových přístupů. Zkoušena tak byla například úplnější inhibice RAS pomocí vzájemné kombinace ACEI/ARB [28] nebo přidáním antagonistů aldosteronu [29] či přímých inhibitorů reninu [30]. Podrobnější rozbor dosavadních studií s těmito postupy přesahuje rámec tohoto textu, avšak pro jejich většinou nedostatečný rozsah a trvání či rizika vzniku závažných nežádoucích účinků (hyperkalemie, hypotenze aj.) nelze žádný z těchto postupů pokládat za vhodný pro širší použití v běžné praxi. Vzhledem k informacím o větší nefroprotektivní účinnosti některých inhibitorů RAS [31] nebo vyšších denních dávek [32] lze tak v individuálních případech doporučit namísto podání kombinace léčiv zkusit dosavadní dávku léčiva zvýšit nebo zaměnit účinnou látku.
Ostatní léčebně-preventivní postupy
Omezení příjmu proteinů jako prostředek zpomalení progrese renálního postižení je dnes obecně zdůrazňováno mnohem méně, než tomu bylo v minulosti. Platí to i pro nemocné s diabetickou nefropatií, i když zde byly v menších studiích zaznamenány jisté příznivé efekty na proteinurii a pokles renální funkce. Vzhledem k riziku možné malnutrice by však příjem proteinů rozhodně neměl poklesnout na hodnotu nižší než 0,6–0,8 g/kg/den.
Hypolipidemická terapie statiny je stejně jako u osob bez nefropatie zaměřena především na snížení rizika vaskulárních komplikací, zatímco efekt na zpomalení progrese nefropatie je méně jistý. Ve studii SHARP (Study of Heart and Renal Protection) zaměřené na nemocné v různých stadiích chronické nemoci ledvin byl u účastníků s diabetem léčených kombinací simvastatin/ezetimib zaznamenán signifikantně nižší výskyt vaskulárních příhod ve srovnání s placebovou skupinou [33]. Určité pozitivní účinky na rozvoj DOL byly zjištěny i ve studiích s fibráty, u kterých však dosud chybí jasné důkazy účinnosti na snížení výskytu makrovaskulárních komplikací.
Příznivý efekt na vývoj nefropatie a vznik aterosklerotických komplikací má zanechání kouření.
Současné do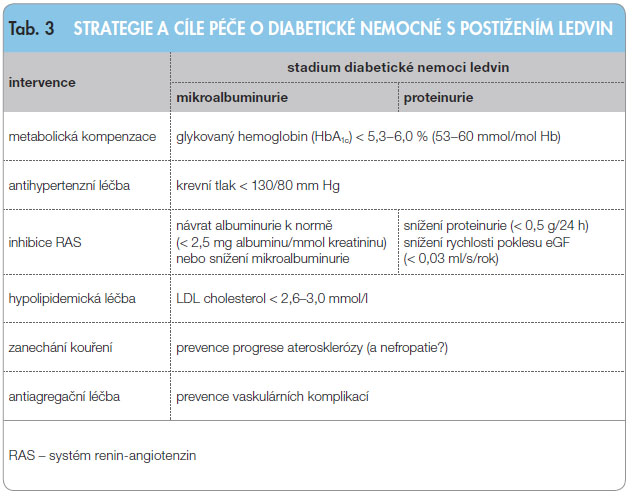 poručené léčebné postupy a cílové ukazatele shrnuje tab. 3.
poručené léčebné postupy a cílové ukazatele shrnuje tab. 3.
Léčba pokročilé renální insuficience (při eGFR ? 0,5 ml/s; zcela orientačně při hladině sérového kreatininu ? 200 µmol/l) probíhá v ambulanci nefrologa, který je rovněž odpovědný za přípravná opatření pro náhradu funkce ledvin. Optimální léčebnou metodou pro nemocné s diabetem a chronickým selháním ledvin je transplantace ledviny (případně kombinovaná transplantace ledviny a pankreatu u nemocných s diabetem 1. typu), která jim zajišťuje nejdelší dobu přežití při nejlepší kvalitě života.
Závěr
Diabetické onemocnění ledvin je prognosticky velmi závažnou pozdní komplikací obou základních typů diabetu. Nezbytnou součástí péče o diabetické nemocné je proto intenzivní preventivní kontrola ovlivnitelných rizikových faktorů DOL, zejména hyperglykemie a hypertenze, a její pravidelný screening. Intenzivní léčbou je aktuálně možno dosáhnout zvratu iniciálních a významného zpomalení progrese pokročilých forem DOL se současnou redukcí výskytu vaskulárních komplikací.
Seznam použité literatury
- [1] Thomas MC, Moran JL, Harjutsalo V, et al. Hyperfiltration in type 1 diabetes: does it exist and does it matter for nephropathy? Diabetologia 2012; 55: 1505–1513.
- [2] Perkins BA, Ficociello LH, Ostrander BE, et al. Microalbuminuria and the risk for early progressive renal function decline in type 1 diabetes. J Am Soc Nephrol 2007; 18: 1353–1361.
- [3] de Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: an analysis of the DCCT/EDIC cohort. Arch Intern Med 2011; 171: 412–420.
- [4] Perkins BA, Ficociello LH, Silva KH, et al. Regression of microalbuminuria in type 1 diabetes. N Engl J Med 2003; 348: 2285–2293.
- [5] Costacou T, Ellis D, Fried L, Orchard TJ. Sequence of progression of albuminuria and decreased GFR in persons with type 1 diabetes: a cohort study. Am J Kidney Dis 2007; 50: 721–723.
- [6] Mathiesen ER, Hommel E, Hansen HP, et al. Randomised, controlled trial of long term efficacy of captopril on preservation of kidney function in normotensive patients with insulin dependent diabetes and microalbuminuria. BMJ 1999; 319: 24–25.
- [7] Kramer HJ, Nguyen QD, Curhan G, Hsu CY. Renal insufficiency in the absence of albuminuria and retinopathy among adults with type 2 diabetes mellitus. JAMA 2003; 289: 3273–3277.
- [8] Marcovecchio ML, Dalton RN, Schwarze CP, et al. Ambulatory blood pressure measurements are related to albumin excretion and are predictive for risk of microalbuminuria in young people with type 1 diabetes. Diabetologia 2009; 52: 1173–1181.
- [9] Mauer M, Zinman B, Gardiner R, et al. Renal and Retinal Effects of Enalapril and Losartan in Type 1 Diabetes. N Engl J Med 2009; 361: 40–51.
- [10] Astrup AS, Tarnow L, Rossing P, et al. Cardiac autonomic neuropathy predicts cardiovascular morbidity and mortality in type 1 diabetic patients with diabetic nephropathy. Diabetes Care 2006; 29: 334–339.
- [11] Gaede P, Lund-Andersen H, Parving HH, Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008; 358: 580–591.
- [12] Drechsler C, Krane V, Ritz E, et al. Glycemic control and cardiovascular events in diabetic hemodialysis patients. Circulation 2009; 120: 2421–2428.
- [13] Lipska KJ, Bailey CJ, Inzucchi SE. Use of metformin in the setting of mild-to-moderate renal insufficiency. Diabetes Care 2011; 34: 1431–1437.
- [14] Schneider CA, Ferrannini E, DeFronzo R, et al. Effect of pioglitazone on cardiovascular outcome in diabetes and chronic kidney disease. J Am Soc Nephrol 2008; 19: 182–187.
- [15] Groop PH, Cooper ME, Perkovic V, et al. Effects of the DPP-4 inhibitor linagliptin on albuminuria in patients with type 2 diabetes and diabetic nephropathy. Diabetologia 2012; 55 (Suppl. 1): S20–S21.
- [16] Mogensen CE. Long-term antihypertensive treatment inhibiting progression of diabetic nephropathy. BMJ 1982; 285: 685–688.
- [17] Parving HH, Andersen AR, Smidt UM, et. al. Early aggresive antihypertensive treatment reduces rate of decline in kidney function in diabetic nephropathy. Lancet 1983; 1: 1175–1179.
- [18] Hovind P, Rossing P, Tarnow L, et al. Remission and regression in the nephropathy of type 1 diabetes when blood pressure is controlled aggressively. Kidney Int 2001; 60: 378–379.
- [19] ACCORD Study Group, Cushman WC, Evans GW, Byington RP, et al. Effects of intensive blood--pressure control in type 2 diabetes mellitus. N Engl J Med 2010; 362: 1575–1585.
- [20] Mancia G, Laurent S, Agabiti-Rosei E, et al. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hypertens 2009; 27: 2121–2158.
- [21] Bouček P. Diabetická nefropatie – průvodce ošetřujícího lékaře. Praha: Maxdorf, 2011.
- [22] Lewis EJ, Hunsicker LG, Bain RP, et al. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med 1993; 329: 1456–1462.
- [23] Parving HH, Lehnert H, Brochner-Mortensen J, et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med 2001; 345: 870–878.
- [24] Brenner BM, Cooper ME, de Zeeuw D, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345: 861–869.
- [25] Barnett AH, Bain SC, Bouter P, DETAIL Study Group. Angiotensin-receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy. N Engl J Med 2004; 351: 1952–1961.
- [26] Rossing K, Christensen PK, Hovind P, Parving HH. Remission of nephrotic-range albuminuria reduces risk of end-stage renal disease and improves survival in type 2 diabetic patients. Diabetologia 2005; 48: 2241–2247.
- [27] Astrup AS, Tarnow L, Rossing P, et al. Improved prognosis in type 1 diabetic patients with nephropathy: a prospective follow-up study. Kidney Int 2005; 68: 1250–1257.
- [28] Mogensen CE, Neldam S, Tikkanen I, et al. Randomised controlled trial of dual blockade of renin-angiotensin system in patients with hypertension, microalbuminuria, and non-insulin dependent diabetes: the Candesartan and Lisinopril Microalbuminuria (CALM) study. B M J 2000; 321: 1440–1444.
- [29] Schjoedt KJ, Rossing K, Juhl TR, et al. Beneficial impact of spironolactone in diabetic nephropathy. Kidney Int 2005; 68: 2829–2836.
- [30] Parving HH, Persson F, Lewis JB, et al. Aliskiren combined with losartan in type 2 diabetes and nephropathy. N Engl J Med 2008; 358: 2433–2446.
- [31] Bakris GL, Burgess E, Weir M, et al. Telmisartan is more effective than losartan in reducing proteinuria in patients with diabetic nephropathy. Kidney Int 2008; 74: 364–369.
- [32] Hollenberg NK, Parving HH, Viberti G, et al. Albuminuria response to very high-dose valsartan in type 2 diabets mellitus. J Hypertens 2007; 25: 1921–1926.
- [33] Baigent C, Landray MJ, Reith C, et al., SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011; 377: 2182–2192.