Pembrolizumab – přehled indikací
Souhrn:
Büchler T, Rozsypalová A. Pembrolizumab – přehled indikací. Remedia 2019; 29: 326–328.
Pembrolizumab je humanizovaná monoklonální protilátka IgG4 proti receptoru PD‑1 (programmed cell death protein 1). Tento receptor se nachází na povrchu T lymfocytů a funguje jako negativní regulátor jejich aktivity. Článek přináší přehled aktuálních indikací pembrolizumabu s výjimkou plicních tumorů, jimž je věnován samostatný text aktuálního čísla časopisu.
Summary:
Buchler T, Rozsypalova A. Pembrolizumab – indication overview. Remedia 2019; 29: 326–328.
Pembrolizumab is a humanized monoclonal IgG4 antibody directed against the surface receptor PD‑1 (programmed cell death‑1). Activated PD‑1 negatively regulates T‑cell activation and plays a key role in tumor evasion from host imunity. This article provides an overview of current indications of pembrolizumab, except for lung tumors which are addressed in another article in this issue.
Key words: pembrolizumab ,melanoma, urothelial carcinoma ,head and neck
squamous cell carcinoma.
Úvod
Pembrolizumab je humanizovaná
monoklonální protilátka IgG4 proti receptoru PD 1
(programmed cell death protein 1). V současnosti je
na základě údajů z klinických studií již
registrovaná v řadě indikací a klinické zkušenosti
s jejím používáním se rychle rozšiřují (tab. 1). Receptor PD 1 se nachází na povrchu T
lymfocytů a funguje jako negativní regulátor jejich aktivity.
Pembrolizumab vazbou na receptor PD 1 na povrchu T
lymfocytu brání interakci s jeho ligandy –
proteiny PD L1, které jsou o exprimovány ve zvýšené
míře na povrchu nádorových buněk a buněk nádorového
mikroprostředí, a s proteiny PD L2 nacházejícími
se na povrchu antigen prezentujících buněk. Zablokováním
vazby receptoru PD 1 s PD L1/PD L2 se zvýší
aktivita T lymfocytu a tím i jeho protinádorové
působení.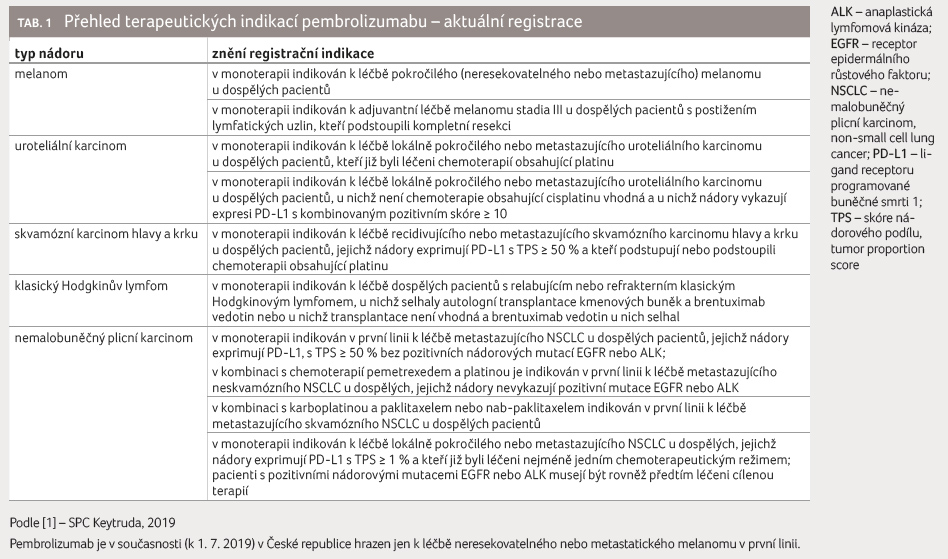
Melanom
Maligní melanom je v centru zájmu imunoterapie už desetiletí. S příchodem imunomodulačních léků došlo k dramatické změně prognózy pacientů s pokročilým maligním melanomem. Mezi tyto léky, tzv. checkpoint inhibitory (látky vstupující do komunikace mezi nádorovou buňkou a imunitním systémem), patří blokátory antigenu CTLA 4 (cytotoxic T lymphocyte antigen 4; monoklonální protilátka ipilimumab) a blokátory receptoru PD 1 (monoklonální protilátky nivolumab, pembrolizumab), které se uplatňují v řízení imunitních reakcí [2].
Dle provedených studií dosahuje pembrolizumab vyšší četnosti odpovědí i menší toxicity než ipilimumab. Přínos léčby pembrolizumabem byl prokázán jak u pacientů dříve předléčených ipilimumabem, tak u pacientů, kteří předtím ipilimumabem nebyli léčeni [2].
KEYNOTE 001 – multikohortová otevřená studie fáze Ib ‒ hodnotila účinnost pembrolizumabu u 276 pacientů s pokročilým maligním melanomem, kteří byli rozděleni do dvou kohort. Jedna zahrnovala pacienty již předléčené ipilimumabem, případně také inhibitory BRAF nebo MEK, pokud měli pozitivní BRAF mutaci, a druhá zahrnovala pacienty ipilimumabem nepředléčené. Nemocní byli náhodně rozděleni do skupin s rozdílnými dávkami pembrolizumabu ‒ 2 mg/kg každé tři týdny, nebo 10 mg/kg každé tři týdny. Jednalo se o značně předléčenou skupinu nemocných. Pembrolizumab prokázal účinnost bez ohledu na dávku a v obou skupinách bylo dosaženo dlouhodobé léčebné odpovědi [1]. Podle recentní analýzy po pěti letech sledování žilo 34 % všech pacientů a 41 % pacientů nepředléčených. Medián celkového přežití (overall survival, OS) činil 23,8 měsíce (95% interval spolehlivosti [CI] 20,2‒30,4), resp. 38,6 měsíce (95% CI 27,2‒nedosaženo). Odhadovaná pětiletá míra přežití bez progrese byla 21 % u všech pacientů a 29 % u nepředléčených pacientů. Medián přežití bez progrese (progression free survival, PFS) činil 8,3 měsíce (95% CI 5,8‒11,1) a 16,9 měsíce (95% CI 9,3‒35,5) [3].
KEYNOTE 002 – multicentrická randomizovaná studie fáze II ‒ sledovala pacienty s pokročilým melanomem, kteří již byli předléčeni ipilimumabem a v případě pozitivity na BRAF mutaci V600 byli léčeni inhibitory BRAF nebo MEK. Nemocní byli randomizováni v poměru 1 : 1 : 1 do skupiny s pembrolizumabem v dávce 2 mg/kg (n = 180) nebo v dávce 10 mg/kg (n = 181) každé tři týdny nebo do skupiny s chemoterapií (n = 179; dakarbazin; karboplatina; paklitaxel; temozolomid; karboplatina a paklitaxel) [1]. Nebyl prokázán statisticky signifikantní vliv na OS v ramenech s pembrolizumabem ve srovnání s chemoterapií, medián OS představoval 13,4 měsíce (95% CI 11,0‒16,4) a 14,7 měsíce (95% CI 11,3‒19,5) versus 11,0 měsíce (95% CI 8,9‒13,8). Parametry PFS, objektivní léčebné odpovědi (objective response rate, ORR) i doba trvání odpovědi byly v ramenech s pembrolizumabem, bez ohledu na dávku, lepší ve srovnání s chemoterapií [4].
KEYNOTE 006 – multicentrická randomizovaná studie fáze III ‒ hodnotila pacienty s pokročilým maligním melanomem dosud nepředléčené ipilimumabem. Nemocní byli randomizováni v poměru 1 : 1 : 1 do skupiny s pembrolizumabem v dávce 10 mg/kg každé dva týdny (n = 279) nebo každé tři týdny (n = 277) nebo s ipilimumabem v dávce 3 mg/kg každé tři týdny (n = 278). Pembrolizumab dosáhl vyšší ORR, signifikantního prodloužení PFS a OS oproti ipilimumabu [1]. Mediánu OS ve skupině léčené pembrolizumabem nebylo dosaženo, ve skupině s ipilimumabem činil 16,0 měsíce. Poměr rizik (hazard ratio, HR) úmrtí dosáhl 0,68 (95% CI 0,53‒0,87) u pembrolizumabu podávaného každé dva týdny oproti ipilimumabu (p = 0,0009) a 0,68 (95% CI 0,53‒0,86) u pembrolizumabu podávaného každé tři týdny oproti ipilimumabu (p = 0,0008). Celková míra přežití v délce trvání 24 měsíců činila 55 % ve skupině s dvoutýdenním intervalem, 55 % ve skupině s třítýdenním intervalem a 43 % ve skupině s ipilimumabem [5].
Všechny tři studie prokázaly, že pembrolizumab je účinný jak v první, tak ve druhé linii terapie a že má smysl léčit i pacienty, jejichž onemocnění progredovalo při léčbě ipilimumabem. Účinnost byla prokázána také bez ohledu na status BRAF rovněž u pacientů s PD L1 negativním tumorem.
KEYNOTE 054 – multicentrická randomizovaná, dvojitě zaslepená studie kontrolovaná placebem ‒ proběhla u pacientů s kompletně resekovaným melanomem stadia IIIA, IIIB, IIIC. Nemocní byli randomizováni v poměru 1 : 1 (celkem 1 019 osob) do skupiny léčené pembrolizumabem v dávce 200 mg každé tři týdny nebo do skupiny s placebem. Pacienti museli v průběhu 13 týdnů před zahájením léčby podstoupit disekci lymfatických uzlin, a pokud to bylo indikováno, také radioterapii. U nemocných v rameni s pembrolizumabem bylo v celkové populaci všech resekovaných melanomů stupně III (dle 7. vydání AJCC) prokázáno ve srovnání s placebem statisticky významné zlepšení přežití bez recidivy (recurrence free survival, RFS) ‒ 82 % vs. 73 % po šesti měsících a 72 % vs. 54 % po 18 měsících [1,6].
Uroteliální karcinom
Uroteliální nádory jsou výrazně ovlivnitelné imunoterapií. O tom svědčí efektivita nespecifické imunoterapie ‒ vakcíny Bacillus Calmette Guérin, která je již po mnoho let užívána v adjuvantní terapii vysoce rizikového povrchového karcinomu močového měchýře po jeho odstranění transuretrální resekcí [7].
Význam imunitního systému v patogenezi uroteliálních nádorů, jejichž prognóza koreluje s přítomností lymfocytů CD8+, potvrzují i analýzy nádorového mikroprostředí. Ve studiích byla opakovaně prokázána dobrá korelace mezi expresí PD L1 v nádoru a odpovědí na inhibitory PD 1/PD L1 [7].
KEYNOTE 045 – multicentrická randomizovaná, placebem kontrolovaná studie ‒ sledovala pacienty s lokálně pokročilým či metastatickým uroteliálním karcinomem, u nichž došlo k progresi v průběhu chemoterapie obsahující cisplatinu nebo po méně než 12 měsících po jejím ukončení. Nemocní byli randomizováni do ramene s pembrolizumabem v dávce 200 mg každé tři týdny (n = 270) nebo do skupiny léčené chemoterapií dle výběru zkoušejícího (paklitaxel 175 mg/m2, n = 84; docetaxel 75 mg/m2, n = 84; nebo vinflunin 320 mg/m2, n = 87) každé tři týdny. Primární cílové ukazatele představovaly OS a PFS (hodnoceno pomocí BICR ‒ Blinded Independent Central Review ‒ za využití kritérií RECIST 1.1). Sekundárními cílovými ukazateli byly ORR a trvání odpovědi. Ve skupině s pembrolizumabem nastalo statisticky významné zlepšení OS a ORR. Jednoleté a dvouleté OS bylo vyšší pro pembrolizumab (44,2 %, resp. 26,9 %) ve srovnání s chemoterapií (29,8 %, resp. 14,3 %) [8]. V případě PFS nebyl zaznamenán statisticky významný rozdíl. U pacientů léčených pembrolizumabem bylo pozorováno prodloužení doby do zhoršení celkového zdravotního stavu v porovnání s těmi, kteří byli léčeni chemoterapií [1].
KEYNOTE 052 – multicentrická jednoramenná, otevřená studie fáze II ‒ hodnotila pacienty s lokálně pokročilým nebo metastatickým uroteliálním karcinomem, pro něž nebyla vhodná chemoterapie s cisplatinou. Nemocní dostávali pembrolizumab v dávce 200 mg každé tři týdny, léčba probíhala do nepřijatelné toxicity nebo do progrese, mohla pokračovat i po progresi, pokud byl pacient klinicky stabilní a byl u něj předpoklad přínosu vedené terapie. Pacienti bez progrese mohli být léčeni až 24 měsíců, celkem bylo do studie zařazeno 370 osob. Parametr ORR činil 28,9 % (95% CI 24,3‒33,8), mediánu trvání odpovědi nebylo dosaženo, u 82 % nemocných bylo zaznamenáno trvání odpovědi delší než šest měsíců. Ve skupině pacientů s hodnotou kombinovaného pozitivního skóre (combined positive score, CPS) ≥ 10 (n = 110) představovalo kritérium ORR 47,3 %, medián OS 18,5 měsíce [1,9].
KEYNOTE 361 ‒ probíhající randomizovaná, placebem kontrolovaná otevřená studie fáze III ‒ hodnotí pembrolizumab s kombinovanou chemoterapií s cisplatinou nebo bez ní ve srovnání s chemoterapií v první linii léčby pokročilého nebo metastatického uroteliálního karcinomu. Podle předběžných výsledků se ukazuje snížené přežívání při monoterapii pembrolizumabem u pacientů s expresí PD L1 s CPS < 10 v porovnání s chemoterapií. Z toho důvodu bylo přijímání takových pacientů do ramene s monoterapií pembrolizumabem zastaveno [1].
Na základě dat ze studií, tedy signálů o účinnosti a bezpečnosti monoterapie pembrolizumabem a také atezolizumabem, Evropská léková agentura (EMA) a americký Úřad pro kontrolu potravin a léčiv (FDA) nyní doporučují monoterapii inhibitorem kontrolního bodu jen u pacientů s vyšší expresí PD L1 v nádoru.
Skvamózní karcinom hlavy a krku
Jediným režimem, který prokázal prodloužení OS, je kombinace cisplatina/5 fluorouracil/cetuximab (randomizovaná studie fáze III EXTREME). Ve druhé linii paliativní léčby je možno po selhání cisplatiny použít nivolumab nebo u nádorů s vysokou expresí PD L1 (TPS ≥ 50 %) pembrolizumab v dávce 200 mg každé tři týdny. Randomizované studie fáze III prokázaly vyšší účinnost těchto přípravků ve srovnání se standardní chemoterapií [10].
KEYNOTE 040 ‒ multicentrická otevřená, randomizovaná, placebem kontrolovaná studie ‒ sledovala pacienty s recidivujícím nebo metastazujícím skvamózním karcinomem hlavy a krku (head and neck squamous cell carcinoma, HNSCC), u nichž došlo k progresi onemocnění během chemoterapie obsahující platinu podávanou jako součást indukční, souběžné nebo adjuvantní terapie nebo po ní a kteří nebyli vhodní pro lokální terapii s léčebným záměrem.
Pacienti byli stratifikováni dle exprese PD L1 (TPS ≥ 50 %), přítomnosti lidského papilomaviru (HPV) a výkonnostního stavu dle ECOG (Eastern Cooperative Oncology Group) a poté randomizováni (1 : 1) do skupin léčených pembrolizumabem v dávce 200 mg každé tři týdny (n = 247) nebo k jednomu ze tří standardních postupů léčby (n = 248) ‒ metotrexát v dávce 40 mg/m2 jednou týdně (n = 64), docetaxel v dávce 75 mg/m2 jednou za tři týdny (n = 99), nebo cetuximab v nasycovací dávce 400 mg/m2 a poté v dávce 250 mg/m2 jednou týdně (n = 71).
Medián OS činil při léčbě pembrolizumabem 8,4 měsíce (95% CI 6,4‒9,4) ve srovnání s 6,9 měsíce (95% CI 5,9–8,0) u standardní léčby. V případě pacientů s vysokou expresí PD L1 (TPS ≥ 50 %) představoval medián OS 11,6 měsíce při léčbě pembrolizumabem vs. 6,6 měsíce u standardní léčby [1,11].
Perspektiva a závěr
Pembrolizumab dosahuje nadějných výsledků kromě výše zmíněných indikací také například u hepatocelulárního karcinomu, kde prokázal účinnost u pacientů předléčených sorafenibem (KEYNOTE 224) [12], nebo u pokročilého karcinomu žaludku (KEYNOTE 059) [13,14].
Již schválenou indikací je využití pembrolizumabu v terapii nemocných s klasickým Hodgkinovým lymfomem, u nichž selhala autologní transplantace kmenových buněk a brentuximab vedotin nebo u nichž transplantace není vhodná a brentuximab vedotin u nich selhal (KEYNOTE 087, KEYNOTE 013) [1].
V současné době je pembrolizumab v České republice hrazen ze zdravotního pojištění pouze v monoterapii u dospělých pacientů s lokálně pokročilým neresekovatelným nebo metastatickým melanomem, kteří doposud nebyli léčeni systémovou protinádorovou léčbou pro inoperabilní, pokročilé či metastatické onemocnění za kumulativního splnění podmínek přesně definovaných v Souhrnu údajů o přípravku.
Podpořeno MZ ČR – RVO Thomayerova nemocnice – TN 0064190.
Seznam použité literatury
- [1] SPC Keytruda. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/keytruda‑epar‑product‑information_cs.pdf
- [2] Arenbergerová M. Pembrolizumab – další úspěch imunoterapie v léčbě melanomu. Remedia 2016; 26: 21–26.
- [3] Hamid O, Robert C, Daud A, et al. Five‑year survival outcomes for patients with advanced melanoma treated with pembrolizumab in KEYNOTE‑001. Ann Oncol 2019; 30: 582‒588.
- [4] Hamid O, Puzanov I, Dummer R, et al. Final analysis of a randomised trial comparing pembrolizumab versus investigator‑choice chemotherapy for ipilimumab‑refractory advanced melanoma. Eur J Cancer 2017; 86: 37‒45.
- [5] Schachter J, Ribas A, Long GV, et al. Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised,open‑label phase 3 study (KEYNOTE‑006). Lancet 2017; 390: 1853‒1862.
- [6] Eggermont AMM, Blank CU, Mandala M, et al. Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med 2018; 378: 1789‒1801.
- [7] Büchler T. Imunoterapie karcinomu močového měchýře. Klin Onkol 2017; 30: 6–9.
- [8] Fradet Y, Bellmunt J, Vaughn DJ, et al. Randomized phase III KEYNOTE‑045 trial of pembrolizumab versus paclitaxel, docetaxel, or vinflunine in recurrent advanced urothelial cancer: results of > 2 years of follow‑up. Ann Oncol 2019 May 3. Dostupné na: https://www.ncbi.nlm.nih.gov/pubmed/31050707
- [9] Vuky J, Balar AV, Castellano DE, et al. Updated efficacy and safety of KEYNOTE‑052: A single‑arm phase 2 study investigating first‑line pembrolizumab (pembro) in cisplatin‑ineligible advanced urothelial cancer (UC). J Clin Oncol 2018; 36(Suppl 15): 4524.
- [10] Modrá kniha České onkologické společnosti. Masarykův onkologický ústav, Brno 2019. Dostupné na: https://www.linkos.cz/lekar‑a‑multidisciplinarni‑tym/diagnostika‑a‑lecba/modra‑kniha‑cos/aktualni‑vydani‑modre‑knihy/25‑1‑zhoubne‑novotvary‑hlavy‑a‑krku‑c00‑14‑c30‑32/
- [11] Cohen EEW, Soulières D, Le Tourneau C, et al. Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head‑and‑neck squamous cell carcinoma (KEYNOTE‑040): a randomised, open‑label, phase 3 study. Lancet 2019; 393: 156‒167.
- [12] Zhu AX, Finn RS, Edeline J. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE‑224): a non‑randomised, open‑label phase 2 trial. Lancet Oncol 2018; 19: 940‒952.
- [13] Vrána D, Matzenauer M, Melichar B. Současné postavení checkpoint inhibitorů v léčbě nádorů jícnu a žaludku. Klin Onkol 2018; 31: 35‒39.
- [14] FDA Grants Accelerated Approval to Pembrolizumab for Advanced Gastric Cancer. Dostupné na: https://www.esmo.org/Oncology‑News/FDA‑Grants‑Accelerated‑Approval‑to‑Pembrolizumab‑for‑Advanced‑Gastric‑Cancer