Perspektivy farmakoterapie srdečního selhání
Problematika srdečního selhání, zejména akutní dekompenzace, stále podněcuje k hledání a vývoji nových lékových skupin. V článku jsou uvedeny výsledky klinických studií, v nichž byly hodnoceny natriuretické peptidy, blokátory receptoru pro adenosin, blokátor receptorů pro vazopresin, relaxin a nová pozitivně inotropní látka – omecamtiv mecarbil. I když tyto nové lékové skupiny přinášejí klinické zlepšení, prognózu nemocných většina z nich nezlepšuje.
Srdeční selhání je klinický syndrom charakterizovaný nedostatečnou srdeční činností, v jejímž důsledku dochází nejen ke zhoršení funkce řady orgánů, ale také k aktivaci mnoha humorálních působků a adaptačních mechanismů. Aktivuje se sympatikus, renin-angiotenzin-aldosteronový systém, vazopresin, endoteliny a cytokinový 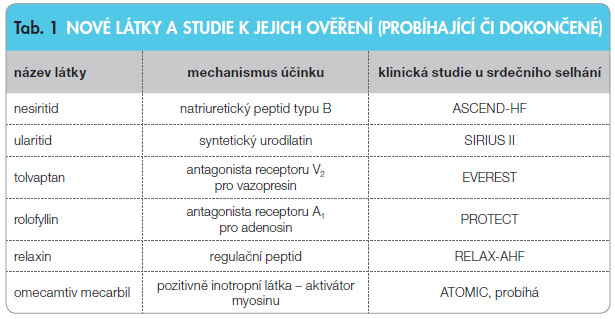 systém, které působí vesměs natrium-retenčně, vazokonstriktivně a proliferativně. Na druhé straně se aktivuje systém natriuretických peptidů, který působí kontraregulačně. Ve farmakoterapii srdečního selhání se uplatňují lékové skupiny, které potlačují tyto negativně působící mechanismy: inhibitory ACE, blokátory receptoru 1 pro angiotenzin II, betablokátory či blokátory aldosteronu. Při hledání dalších možností farmakoterapie srdečního selhání se objevují nové látky, které by mohly nepříznivě působící systémy blokovat: klinickým hodnocením procházely blokátory endotelinových receptorů či anticytokinové látky. Výsledky těchto studií však nebyly pozitivním přínosem pro klinickou praxi. Nicméně výzkum a vývoj nových látek v oblasti srdečního selhání, zejména akutního srdečního selhání, pokračuje dále. Další nedávno ukončené či probíhající studie s novými molekulami uvádí tab. 1.
systém, které působí vesměs natrium-retenčně, vazokonstriktivně a proliferativně. Na druhé straně se aktivuje systém natriuretických peptidů, který působí kontraregulačně. Ve farmakoterapii srdečního selhání se uplatňují lékové skupiny, které potlačují tyto negativně působící mechanismy: inhibitory ACE, blokátory receptoru 1 pro angiotenzin II, betablokátory či blokátory aldosteronu. Při hledání dalších možností farmakoterapie srdečního selhání se objevují nové látky, které by mohly nepříznivě působící systémy blokovat: klinickým hodnocením procházely blokátory endotelinových receptorů či anticytokinové látky. Výsledky těchto studií však nebyly pozitivním přínosem pro klinickou praxi. Nicméně výzkum a vývoj nových látek v oblasti srdečního selhání, zejména akutního srdečního selhání, pokračuje dále. Další nedávno ukončené či probíhající studie s novými molekulami uvádí tab. 1.
Nesiritid – studie ASCEND-HF
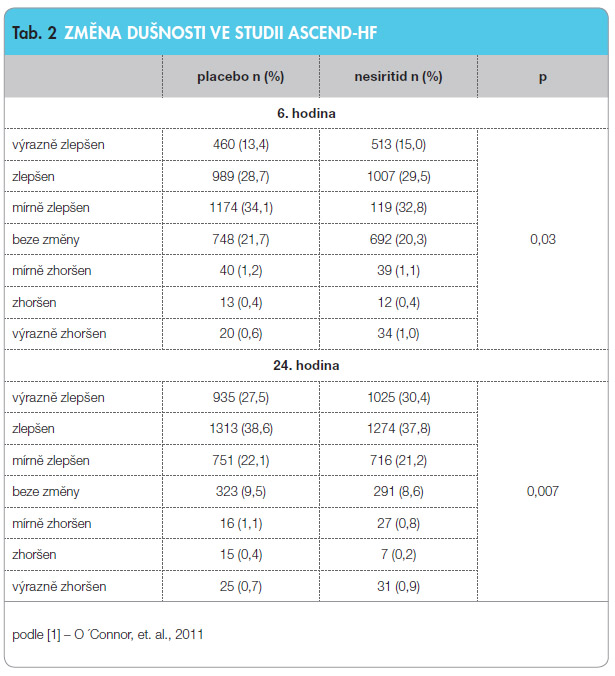 Studie ASCEND-HF (Acute Study of Clinical Effectiveness of Nesiritide in Decompensated Heart Failure) zařadila 7007 nemocných s akutním srdečním selháním, kteří museli být randomizováni do 24 hodin od vzniku příznaků, a ke standardní léčbě byl přidán nesiritid nebo placebo na dobu 24 až 168 hodin. Primárním cílem bylo posouzení dušnosti na 7stupňové škále za 6 a 24 hodin a 30denní mortalita a rehospitalizace pro srdeční selhání. Hlavní výsledek – změnu dušnosti po 6 a 24 hodinách – ukazuje tab. 2.
Studie ASCEND-HF (Acute Study of Clinical Effectiveness of Nesiritide in Decompensated Heart Failure) zařadila 7007 nemocných s akutním srdečním selháním, kteří museli být randomizováni do 24 hodin od vzniku příznaků, a ke standardní léčbě byl přidán nesiritid nebo placebo na dobu 24 až 168 hodin. Primárním cílem bylo posouzení dušnosti na 7stupňové škále za 6 a 24 hodin a 30denní mortalita a rehospitalizace pro srdeční selhání. Hlavní výsledek – změnu dušnosti po 6 a 24 hodinách – ukazuje tab. 2.
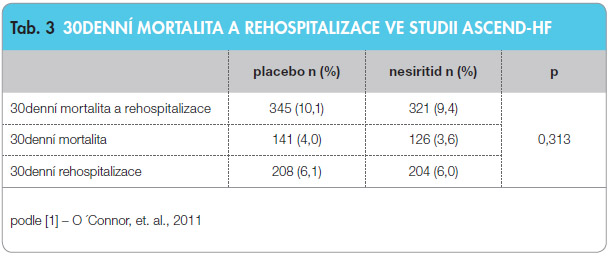 Z pohledu primárního cíle – změny dušnosti – bylo dosaženo pozitivního výsledku, protože statisticky významně více nemocných se zlepšilo při podávání nesiritidu než při podávání placeba. Druhý primární cíl – 30denní mortalita a rehospitalizace – hovoří ve prospěch nesiritidu, avšak bez dosažení statistické významnosti (viz tab. 3).
Z pohledu primárního cíle – změny dušnosti – bylo dosaženo pozitivního výsledku, protože statisticky významně více nemocných se zlepšilo při podávání nesiritidu než při podávání placeba. Druhý primární cíl – 30denní mortalita a rehospitalizace – hovoří ve prospěch nesiritidu, avšak bez dosažení statistické významnosti (viz tab. 3).
Velká pozornost byla věnována bezpečnosti podávání nesiritidu, především výskytu zhoršení renálních funkcí a hypotenze (viz tab. 4).
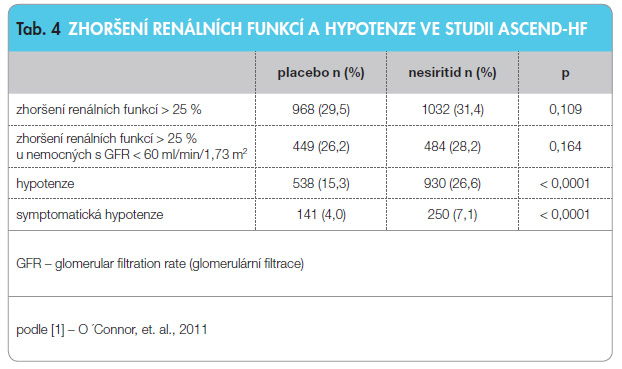
Z tab. 4 je patrné, že nebyl potvrzen negativní vliv nesiritidu na renální funkce a že z tohoto pohledu byl nesiritid bezpečný, a to dokonce i u nemocných s úvodně sníženou rychlostí glomerulární filtrace. Na druhé straně výskyt hypotenze, a to jak symptomatické, tak asymptomatické, byl po léčbě nesiritidem téměř dvojnásobný.
Z dalších závažných příhod je třeba zmínit dvojnásobný výskyt reinfarktu při léčbě nesiritidem (14 vs. 6 případů), který ale nedosáhl statistické významnosti.
Steering committee pak navrhla tyto závěry:
- Nesiritid nesnižuje 30denní rehospitalizace.
- Nesiritid nesnižuje 30denní mortalitu.
- Nesiritid zmírňuje dušnost po 6 a 24 hodinách.
- Nesiritid nezhoršuje renální funkce do 30 dní [1].
Ularitid
Ularitid je syntetická forma urodilatinu, hormonu patřícího mezi natriuretické peptidy, který je produkován v buňkách distálního ledvinného tubulu. Urodilatin reguluje vaskulární a renální homeostázu, navozuje vazodilataci a zvyšuje exkreci sodíku, chloridu a snižuje neurohumorální vazokonstrikční aktivaci. U akutního srdečního selhání je snaha o hemodynamickou stabilizaci pacienta a odstranění symptomů. Terapeutické možnosti zahrnují diuretika, vazodilat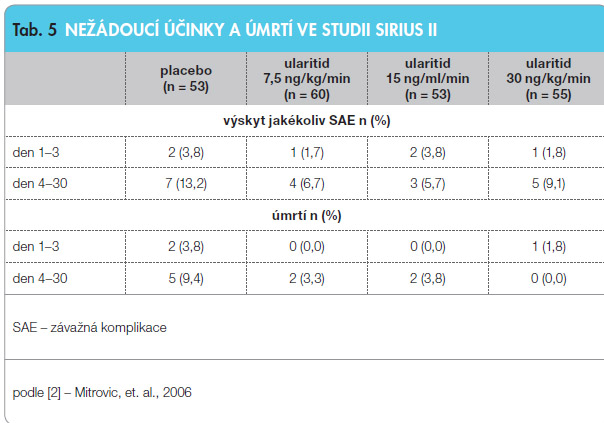 ačně působící látky a pozitivně inotropní agens. Data z metaanalýz poukázala na zvýšené riziko zhoršení renálních funkcí při léčbě nesiritidem. Proto je potřeba najít látku, která by zlepšila hemodynamické parametry a zachovala ledvinné funkce. Ve studii SIRIUS I, v níž byl podáván ularitid pacientům s akutní dekompenzací srdečního selhání, došlo po podání 24hodinové infuze ke snížení tlaku v zaklínění. Studie SIRIUS II sledovala hemodynamické a klinické účinky ularitidu podaného pacientům s dekompenzací srdečního selhání. Jednalo se o randomizovanou dvojitě slepou studii, do které bylo zařazeno 221 pacientů. Čtvrtina pacientů (n = 53) dostávala ke standardní terapii placebo, ularitid v dávce 7,5 ng/kg/min dostávalo 60 pacientů, dávkou 15 ng/kg/min bylo léčeno 53 pacientů a 30 ng/kg/min dostávalo 55 pacientů. Léčivá látka byla podávána ve 24hodinové kontinuální infuzi. Po 6 hodinách podávání došlo ve všech skupinách aktivní léčby ke statisticky významnému poklesu tlaku v zaklínění a ke zmírnění dušnosti oproti placebu. Ularitid v dávce 15 ng/kg/min a 30 ng/kg/min snížil systémovou vaskulární rezistenci a zvýšil srdeční index. Nedošlo ke změně tepové frekvence či koncentrací sérového kreatininu.
ačně působící látky a pozitivně inotropní agens. Data z metaanalýz poukázala na zvýšené riziko zhoršení renálních funkcí při léčbě nesiritidem. Proto je potřeba najít látku, která by zlepšila hemodynamické parametry a zachovala ledvinné funkce. Ve studii SIRIUS I, v níž byl podáván ularitid pacientům s akutní dekompenzací srdečního selhání, došlo po podání 24hodinové infuze ke snížení tlaku v zaklínění. Studie SIRIUS II sledovala hemodynamické a klinické účinky ularitidu podaného pacientům s dekompenzací srdečního selhání. Jednalo se o randomizovanou dvojitě slepou studii, do které bylo zařazeno 221 pacientů. Čtvrtina pacientů (n = 53) dostávala ke standardní terapii placebo, ularitid v dávce 7,5 ng/kg/min dostávalo 60 pacientů, dávkou 15 ng/kg/min bylo léčeno 53 pacientů a 30 ng/kg/min dostávalo 55 pacientů. Léčivá látka byla podávána ve 24hodinové kontinuální infuzi. Po 6 hodinách podávání došlo ve všech skupinách aktivní léčby ke statisticky významnému poklesu tlaku v zaklínění a ke zmírnění dušnosti oproti placebu. Ularitid v dávce 15 ng/kg/min a 30 ng/kg/min snížil systémovou vaskulární rezistenci a zvýšil srdeční index. Nedošlo ke změně tepové frekvence či koncentrací sérového kreatininu.
Nežádoucí účinky byly mírné nebo střední: nejčastěji pokles krevního tlaku (5,4 %), pocení (4,2 %) a slabost (3,0 %). U pacientů léčených ularitidem se vyskytlo méně závažných komplikací (SAE) a úmrtí než u pacientů užívajících placebo (viz tab. 5).
Ve skupině pacientů užívajících ularitid v dávce 15 ng/kg/min a 30 ng/kg/min byla prokázána kratší doba hospitalizace (122 a 158 hod.) ve srovnání s 201 a 192 hodinami při podávání placeba a ularitidu v dávce 7,5 ng/kg/min. Tento rozdíl však nedosáhl statistické významnosti [2]. K potvrzení účinku ularitidu na snížení mortality jsou však třeba výsledky další randomizované studie, která nyní začíná.
Tolvaptan
U srdečního selhání dochází k objemovému přetížení na základě retence tekutin, které je způsobeno zvýšením hladin arginin vazopresinu v séru. Tolvaptan je antagonista receptoru V2 pro vazopresin a tímto způsobem antagonizuje účinky vyvolané aktivací receptoru V2. Randomizovaná, multicentrická, mezinárodní, dvojitě slepá, placebem kontrolovaná studie EVEREST sledovala účinek tolvaptanu u pacientů s dekompenzací srdečního selhání. Celkem bylo zařazeno 4133 pacientů. Pacienti byli randomizováni k užívání 30 mg tolvaptanu nebo placeba ke standardní terapii v trvání minimálně 60 dnů. Duálním primárním cílem byla celková mortalita a kardiovaskulární mortalita nebo hospitalizace pro srdeční selhání. Sekundární cíle zahrnovaly změny v dušnosti, hmotnosti a v městnání. Během sledování (medián 9,9 měsíce) zemřelo 537 (25,9 %) pacientů léčených tolvaptanem a 543 (26,3 %) pacientů v placebové větvi (p = 0,68). Kompozitní cíl kardiovaskulární mortality a hospitalizací pro srdeční selhání se rovněž nelišil (p = 0,55). Podání tolvaptanu vedlo ke zlepšení pacientem hodnocené dušnosti v prvním dni a ke snížení tělesné hmotnosti první den. V laboratorních hodnotách došlo ke zvýšení hladiny sodíku v séru. Z nežádoucích účinků se u pacientů léčených tolvaptanem častěji vyskytla suchost v ústech a žízeň. Lze tedy říci, že použití tolvaptanu u pacientů s akutní dekompenzací srdečního selhání vede v akutním podání ke klinické úlevě, avšak v dlouhodobějším sledování nedochází ke zlepšení prognózy pacientů [3].
Rolofyllin
Rolofyllin je látka, která antagonizuje receptor A1 pro adenosin. Vlivem hypoxie, žilní kongesce a snížené renální perfuze je u pacientů se srdečním selháním koncentrace adenosinu v séru zvýšená. Aktivací receptoru A1 pro adenosin na aferentní arteriole glomerulu dochází ke snížení renálního průtoku a glomerulární filtrace a aktivací receptoru A1 pro adenosin v proximálním tubulu dochází ke zvýšení reabsorpce sodíku a vody [4]. Antagonista receptoru A1 pro adenosin rolofyllin zvyšuje diurézu, glomerulární filtraci a renální průtok u pacientů se srdečním selháním.
Studie PROTECT sledovala účinnost rolofyllinu na renální funkce u pacientů s akutním srdečním selháním a renální dysfunkcí. Do studie bylo zařazeno 2033 pacientů s akutním srdečním selháním, objemovým přetížením, clearance kreatininu v rozmezí 20–80 ml/min a zvýšenou plazmatickou koncentrací natriuretických peptidů. Pacienti byli randomizováni v poměru 2 : 1 k podávání rolofyllinu v dávce 30 mg denně a placeba. Léčba trvala tři dny. Perzistentní zhoršení ledvinných funkcí bylo definováno jako zvýšení hodnot kreatininu o více než 3 mg/dl ve dni 7 nebo 14, nebo jako nutnost hemodialýzy, hemofiltrace či jako úmrtí do dne 7. Změny v hodnotách kreatininu a clearance kreatininu se u placebové skupiny a skupiny léčené rolofyllinem v průběhu studie nelišily ani ve dni 14. Perzistentní zhoršování renálních funkcí se vyskytlo u 13,7 % pacientů v placebové skupině a u 15 % pacientů ve skupině léčené rolofyllinem. Tato studie přinesla zklamání, protože nepotvrdila protektivní účinek rolofyllinu na renální funkce u pacientů hospitalizovaných pro akutní srdeční selhání [5].
Serelaxin
Serelaxin je lidský rekombinantní relaxin-2, původně peptid, který reguluje adaptaci mateřského organismu na těhotenství. Relaxin má několik vlastností, které jsou využitelné v léčbě akutního srdečního selhání: zvyšuje arteriální poddajnost, srdeční výdej a renální průtok.
RELAX-AHF byla mezinárodní dvojitě slepá randomizovaná studie kontrolovaná placebem, která zahrnula celkem 11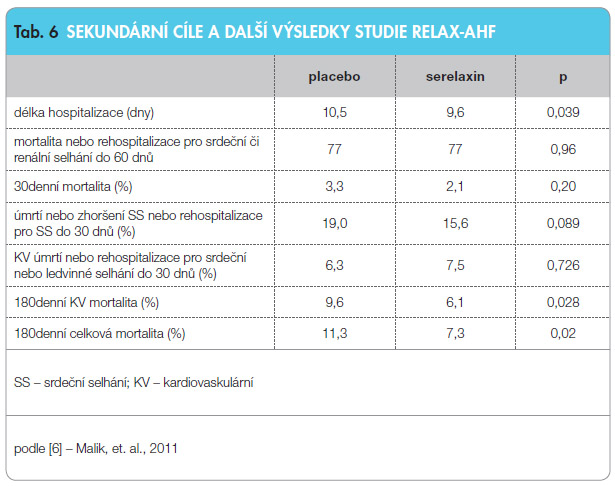 61 pacientů s akutním srdečním selháním: 50 % pacientů dostávalo ke standardní terapii infuzně 48 hodin serelaxin, 50 % placebo. Primárním cílem bylo odstranění dušnosti podle vizuální analogové škály a podle Likertovy škály od počátku léčby do dne 5. Sekundárními cíli bylo hodnocení mortality a hospitalizace ke dni 60 od počátku studie a kardiovaskulární úmrtí nebo rehospitalizace pro srdeční nebo renální selhání do 60. dne od zahájení léčby. Serelaxin zmírnil dušnost pacientů podle vizuální analogové škály (p < 0,007), ale ne podle Likertovy škály (p < 0,7). Neprokázal se vliv serelaxinu na sekundární cíle do 30. dne, avšak prokázalo se zlepšení dlouhodobější prognózy pacientů do 180. dne (viz tab. 6).
61 pacientů s akutním srdečním selháním: 50 % pacientů dostávalo ke standardní terapii infuzně 48 hodin serelaxin, 50 % placebo. Primárním cílem bylo odstranění dušnosti podle vizuální analogové škály a podle Likertovy škály od počátku léčby do dne 5. Sekundárními cíli bylo hodnocení mortality a hospitalizace ke dni 60 od počátku studie a kardiovaskulární úmrtí nebo rehospitalizace pro srdeční nebo renální selhání do 60. dne od zahájení léčby. Serelaxin zmírnil dušnost pacientů podle vizuální analogové škály (p < 0,007), ale ne podle Likertovy škály (p < 0,7). Neprokázal se vliv serelaxinu na sekundární cíle do 30. dne, avšak prokázalo se zlepšení dlouhodobější prognózy pacientů do 180. dne (viz tab. 6).
Pozitivně inotropní látky
Pozitivně inotropní látky původně zvyšovaly kontraktilitu levé komory zvyšováním koncentrace cAMP a tím i koncentraci cytozolového vápníku (sympatomimetika či inhibitory fosfodiesterázy). Akutní krátkodobé podání těchto látek může být pro vybrané pacienty prospěšné, obecně je zvyšování koncentrace cytozolového vápníku u pacientů se srdečním selháním škodlivé. I když se zvýší systolická funkce levé komory, děje se tak na úkor zvýšené spotřeby kyslíku myokardem, což vede jak ke zvýšenému výskytu arytmií, tak k ischemii. Novým přístupem, který by zvýšil srdeční stažlivost bez nutnosti zvýšení koncentrace nitrobuněčného vápníku, je podpora vydatnějšího stahu aktivací samotného proteinu srdečního myosinu.
Omecamtiv mecarbil
Omecamtiv mecarbil je látka, která selektivně aktivuje srdeční myosin. Srdeční myosin je klíčovým elementem k převodu chemické energie na mechanickou sílu nezbytnou pro myokardiální kontrakci. Během kontrakce se myosin váže na aktin – tvoří můstky (cross-bridge), což vede ke zkrácení svalového vlákna. Omecamtiv mecarbil zrychluje přeměnu slabého komplexu aktin-myosin na silně vázanou konfiguraci, která zvyšuje počet myosinových hlavic schopných interakce s aktinovými filamenty a současně potlačuje neproduktivní hydrolýzu ATP. Tento stav, tzn. více myosinových hlavic na aktinovém vlákně, lze přirovnat k situaci více rukou na provaze, čímž dochází k silnějšímu stahu. Tento děj je nezávislý na vápníkové homeostáze a kyslíku. Zlepšení funkce levé komory by tak nemělo být na úkor zvýšení spotřeby energie a arytmogenicity [7].
První studie sledovala podávání této látky u 34 zdravých dobrovolníků, kteří dostávali 6hodinovou infuzi obsahující omecamtiv mecarbil nebo placebo 1krát za týden po dobu 4 týdnů. Primárním cílem bylo stanovení dávky a plazmatických koncentrací omecamtivu mecarbilu. Sekundární cíl zahrnoval farmakodynamiku a farmakokinetiku. Infuze omecamtivu mecarbilu vedla k prodloužení systolické ejekční doby, která byla spojená se zvýšením tepového objemu, frakčního zkrácení a ejekční frakce. Účinek podávané látky byl závislý na zvolené dávce. Nedocházelo ke změnám diastolické funkce. Maximální tolerovaná dávka byla 0,5 mg/kg/h. Ani při podávání této dávky se nevyskytly klinicky závažné vedlejší účinky na vitální funkce, na biochemické ukazatele či na změny EKG [8].
Dalším krokem bylo podání omecamtivu mecarbilu pacientům se srdečním selháním. První taková studie zahrnovala 45 pacientů, kteří dostali 151 infuzí aktivní látky nebo placeba. U aktivně léčených pacientů došlo k prodloužení ejekční doby levé komory a ke zvýšení srdečního tepového objemu, které bylo spojeno s mírným snížením tepové frekvence.
Vyšší plazmatické koncentrace sledované látky byly spojeny se snížením enddiastolického a endsystolického objemu [8].
Vzhledem k těmto příznivým hemodynamickým výsledkům byla zahájena klinická studie ATOMIC s plánovaným zahrnutím 600 pacientů se srdečním selháním. Primárním cílem této studie je zhodnocení dušnosti, sekundárním cílem je mortalita do dne 7, zhoršení srdečního selhání do 7. dne, délka hospitalizace, 30denní přežívání a změna koncentrace natriuretických peptidů. Do budoucna se předpokládá zavedení i perorální formy této látky.
Závěr
Farmakoterapie srdečního selhání, zejména jeho akutní dekompenzace, je bohatá na nové lékové skupiny. Klinické studie zaměřené na symptomatologii či hemodynamiku prokazují u pacientů zlepšení. Z hlediska dlouhodobé prognózy však u většiny těchto lékových skupin pozitivní vliv prokázán nebyl.
Práce byla podpořena European Regional Development Fund – Project FNUSA-ICRC (No.CZ.1.05/1.1.00/02.0123).
Seznam použité literatury
- [1] O ´Connor CM, Starling RC, Hernandez AF, et al. Effect of nesiritide in patients with acute decompensated heart failure. N Engl J Med 2011; 365: 32–43.
- [2] Mitrovic V, Seferovic PM, Simeunovic D, et al. Haemodynamic and clinical effects of ularitide in decompensated heart failure. Eur Heart J 2006; 27: 2823–2832.
- [3] Konstam MA, Gheorghiade M, Burnett JC Jr, et al. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial. JAMA 2007; 297: 1319–1331.
- [4] Funaya H, Kitakaze M, Node K, et al. Plasma adenosine levels increase in patients with chronic heart failure. Circulation 1997; 95: 1363–65.
- [5] Voors AA, Ditrich HC, Massie BM, et al. Effects of the adenosine A1 receptor antagonist rolofylline on renal function in patients with acute heart failure and renal dysfunction: results from PROTECT (Placebo-Controlled Randomized Study of the Selective Adenosine A1 Receptor Antagonist Rolofylline for Patients Hospitalized with Acute Decompensated Heart Failure and Volume Overload to Assess Treatment Effect on Congestion and Renal Function). J Am Coll Cardiol 2011; 57: 1899–1907.
- [6] Teerlink JR, Cotter G, Davison BA, et al. Serelaxin, recombinant human relaxin-2, for treatment of acute heart failure (RELAX-AHF): a randomised, placebo controlled trial. Lancet 2013; 381: 29–39.
- [7] Malik FI, Hartman JJ, Elias KA, et al. Cardiac myosin activation: a potential therapeutic approach for systolic heart failure. Science 2011; 331: 1439–43.
- [8] Teerlink JR, Clarke CP, Saikali KG, et al. Dose-dependent augmentation of cardiac systolic function with the selective cardiac myosin activator, omecamtiv mecarbil: a first-in-man study. Lancet 2011; 378: 667–675.
- [9] Cleland JG, Teerlink JR, Senior R, et al. The effects of the cardiac myosin activator, omecamtiv mecarbil, on cardiac function in systolic heart failure: a double-blind, placebo-controlled, crossover, dose-ranging phase 2 trial. Lancet 2011; 378: 676–683.