Pokroky v léčbě metastatického kolorektálního karcinomu
Kolorektální karcinom patří v České republice k nejčastěji se vyskytujícím zhoubným nádorům. I přes stále se zlepšující výsledky screeningu byla v roce 2010 téměř polovina z těchto novotvarů diagnostikována v pokročilých stadiích. Ačkoli chirurgické řešení stále zůstává základní léčebnou modalitou, lze nyní využitím moderní cílené léčby v kombinaci s chemoterapií dosáhnout dlouhodobé stabilizace onemocnění, a to i v případě pokročilého nádoru, a tak významně prodloužit život těchto pacientů. Kromě přípravků v praxi již běžně užívaných, jako jsou bevacizumab, cetuximab či panitumumab, se objevují zcela nové léky jako aflibercept či regorafenib.
Úvod
Kolorektální karcinom (CRC) je v České republice stále jedním z nejčastěji se vyskytujících zhoubných novotvarů. V roce 2010 dosáhla jeho incidence 95,1/100 000 u mužů a 60,3/100 000 u žen [1]. I přes stále se zlepšující výsledky screeningu byl v uvedeném roce velký počet CRC diagnostikován v pokročilé fázi onemocnění: 23,8 % ve stadiu III a 23 % ve stadiu IV [1].Kolem 20 % onemocnění je diagnostikováno v primárně metastatickém stadiu (mCRC) v podobě synchronních metastáz nejčastěji v játrech [2] a přibližně u 50–60 % pacientů s CRC dojde k pozdní diseminaci a ke vzniku metachronních metastáz [3].
Základem terapie časných stadií CRC je chirurgická léčba, často v kombinaci se systémovou protinádorovou terapií, u karcinomů rekta pak v kombinaci s radioterapií. V případě metastatického a zároveň primárně inoperabilního CRC je klíčovou léčebnou modalitou chemoterapie společně s cílenou léčbou, v případě konverze na resekabilní nález pak doplněná o chirurgický zákrok. U pacientů, kteří podstoupili metastazektomii, je pravděpodobnost celkového pětiletého přežití 40–50 %, pravděpodobnost desetiletého přežití pak kolem 25 % [4, 5]. K chirurgické léčbě jsou indikováni všichni nemocní, u nichž lze podle předoperačních nálezů očekávat radikální (kurativní) výkon odstraňující veškerou nádorovou tkáň (R0 resekce, tj. nejsou ponechány ani mikroskopické zbytky nádoru). Bohužel u více než poloviny pacientů dochází k recidivě, a je tedy vhodné doplnit chirurgickou léčbu o terapii systémovou. Systémová léčba významně prodlužuje dobu přežití bez recidivy onemocnění (relaps-free survival, RFS) při mediánu doby do recidivy 16,3 měsíce a při pětiletém přežití 56,7 % (hazard ratio, HR: 0,56; konfidenční interval, CI: 0,33–0,65) [6].
Každý pacient s mCRC, u nějž lze předpokládat následnou léčbu, by měl být vždy odeslán do onkologického centra s návazností na multidisciplinární onkologický tým za přítomnosti klinického onkologa, radioterapeuta, chirurga, gastroenterologa a radiologa s možností přizvání i dalších specialistů. Na základě posouzení celkového klinického stavu, rozsahu nemoci, cíle léčby a rizikových faktorů a dle preferencí pacienta je pak zváženo podání systémové léčby.
Kombinační terapeutické režimy
V posledních dvaceti letech došlo k významnému pokroku v systémové léčbě CRC. Medián přežití, který byl u neléčeného metastatického onemocnění 3–6 měsíců, se nyní prodlužuje na více než dva roky. Používané kombinační režimy FOLFOX (oxaliplatina v kombinaci s 5-fluorouracilem – 5-FU – a leukovorinem) a FOLFIRI (irinotekan v kombinaci s 5-FU a leukovorinem) mají vyšší účinnost vyjádřenou prodlouženým celkovým přežitím (OS, overall survival) oproti dříve užívané samotné kombinaci FUFA (5-fluorouracil, leukovorin). Navíc lze oba režimy podat navzájem sekvenčně (FOLFOX/FOLFIRI nebo FOLFIRI/FOLFOX). Těmito cytostatiky lze dosáhnout až 50 % objektivních léčebných odpovědí s mediánem přežití kolem 24 měsíců [7–9]. Kombinace 5-FU, oxaliplatiny a irinotekanu v režimu FOLFOXIRI dosáhla ve studii III. fáze signifikantního prodloužení OS proti režimu FOLFIRI (23,4 vs. 16,7 měsíce, p = 0,026). Při léčbě tímto tripletem je nutné počítat s vyšší toxicitou [10].
Pro volbu režimu je bezesporu důležitá i forma podání. Systémovou léčbu lze aplikovat intravenózně, ale i perorálně. Intravénózní 5-FU lze plně nahradit perorálním kapecitabinem, což pozitivně ovlivní kvalitu života pacienta (např. režim XELOX, tj. kapecitabin a oxaliplatina). Režimy s kapecitabinem obvykle nevyžadují centrální žilní přístup, jsou vhodnější pro plně ambulantní podání a pacienti tráví intravenózní aplikací léků výrazně méně času; 5-FU lze pak podat intravenózně v bolusovém režimu či v kontinuální infuzi. V režimech FOLFOX a FOLFIRI je 5-FU podáván kontinuální
infuzí 48 hodin.
Cílená léčba
Pokrokem v systémové léčbě mCRC bylo zavedení cílené léčby. V praxi běžně používáme bevacizumab, cetuximab a panitumumab, nově jsou pro tuto indikaci registrovány aflibercept a regorafenib.
Bevacizumab
Bevacizumab je rekombinantní humanizovaná monoklonální protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF, vascular endothelial growth factor), která zabraňuje interakci VEGF s tyrozinkinázovými receptory VEGFR1 a VEGFR2, jež hrají významnou roli při regulaci angiogeneze. Působení jednotlivých přípravků znázorňuje obr. 1.
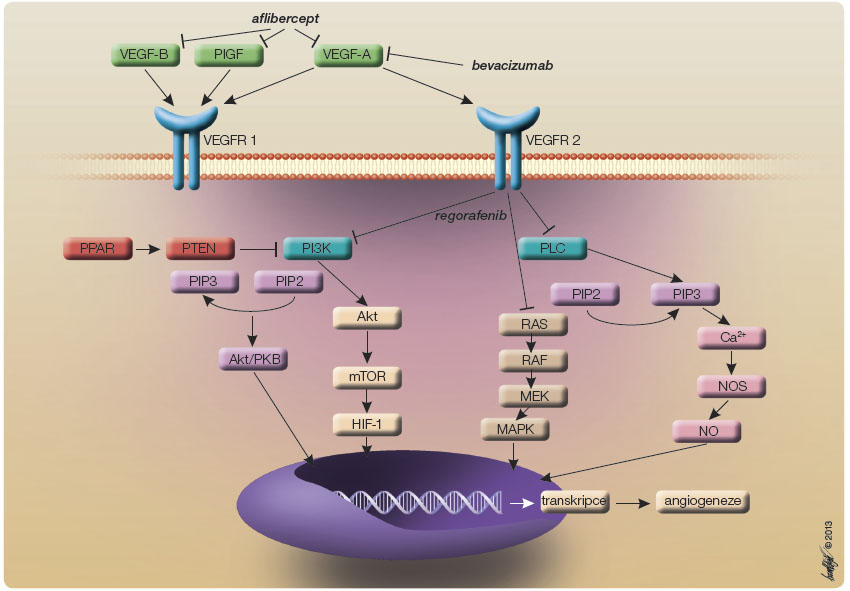
Bevacizumab se podílí na normalizaci struktury a funkce cévního řečiště v nádoru, inhibuje růst jak primárního nádoru, tak i metastáz. Přidání bevacizumabu k chemoterapii vede k prodloužení mediánu OS o 4,7 měsíce [11, 12].
Z nežádoucích účinků se nejčastěji setkáváme s hypertenzí, ta nastupuje již po několika hodinách od zahájení terapie. Zdálo se, že by vznik hypertenze mohl predikovat lepší odpověď na léčbu bevacizumabem, a i když tato domněnka následně nebyla potvrzena v metaanalýze studií ve více kombinačních režimech u několika diagnóz [13], zdá se, že u kolorektálního karcinomu by tento vztah platit mohl [14]. Hypertenze způsobená podáním bevacizumabu by měla být léčena podle obvyklých pravidel. Běžným nežádoucím účinkem je dále proteinurie, která se vyskytuje v klinicky nevýznamné podobě až u 60 % pacientů [15]. Méně častou komplikací léčby jsou kardiovaskulární onemocnění, krvácení či velmi vzácně perforace střeva. Obezřetnost je nezbytná u pacientů léčených antikoagulancii, ale antikoagulační léčba jako taková není kontraindikací pro podání bevacizumabu.
Bevacizumab může negativně ovlivnit hojení, proto je třeba dodržet čtyřtýdenní interval před větším chirurgickým výkonem nebo po něm. Bevacizumab se aplikuje obvykle v kombinaci s chemoterapií v intravenózní infuzi v dávce 5 mg/kg každé dva týdny či 7,5 mg/kg každé tři týdny; při použití bevacizumabu ve druhé linii léčby je doporučena dávka 10 mg/kg podávaná každé dva týdny k režimu FOLFOX4. Podle výsledků studie III. fáze TML (Treatment Across Multiple Lines; ML18147) trvá účinnost bevacizumabu i u pacientů po první progresi, kdy je změněna chemoterapie a bevacizumab ponechán. Tento postup vede oproti samotné chemoterapii druhé linie k prodloužení OS, kdy medián OS v rameni s bevacizumabem byl 11,2 měsíce oproti mediánu 9,8 měsíce v rameni se samotnou chemoterapií (HR 0,81; 95% CI: 0,69–0,94; p = 0,0062) [16].
Na konferenci ASCO 2013 (Americká společnost pro klinickou onkologii) byl prezentován výsledek studie III. fáze, která testovala intenzivní režim FOLFOXIRI/bevacizumab proti režimu FOLFIRI/bevacizumab. Chemoterapie FOLFOXIRI/bevacizumab signifikantně prodloužila dobu přežití bez progrese (PFS, progression free survival) na 11,9 měsíce oproti 9,5 měsíce při podávání kombinace FOLFIRI/bevacizumab (HR 0,72, p = 0,001). Objektivní odpověď byla také vyšší u ramene s režimem FOLFOXIRI (64 % vs. 53 %, p = 0,015) [17]. Na rozdíl od některých dalších biologických přípravků nemá bevacizumab prediktor odpovědi na léčbu.
Inhibitory receptoru pro epidermální růstový faktor
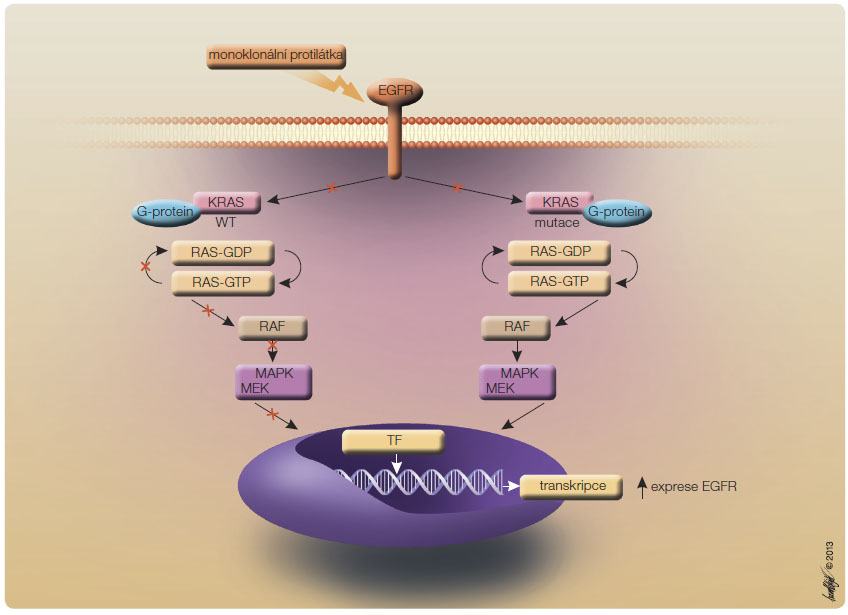 Dalšími cílenými léky jsou inhibitory receptoru pro epidermální růstový faktor (EGFR, epidermal growth factor receptor) cetuximab a panitumumab. Působení těchto přípravků znázorňuje obr. 2.
Dalšími cílenými léky jsou inhibitory receptoru pro epidermální růstový faktor (EGFR, epidermal growth factor receptor) cetuximab a panitumumab. Působení těchto přípravků znázorňuje obr. 2. Cetuximab
Cetuximab je chimérická monoklonální anti-EGFR protilátka IgG1 (imunoglobulin G1), blokuje jeho funkci a tím inhibuje buněčnou proliferaci a indukuje apoptózu. Účinek anti-EGFR terapie lze predikovat na základě vyšetření stavu onkogenů, rodiny RAS (KRAS a NRAS) v nádoru či metastáze. Přibližně u poloviny případů CRC je nalezen nemutovaný (tzv. wild type) RAS (WT RAS) a u druhé poloviny je mutace přítomna − buď u onkogenu KRAS (přibližně 30–40 %) nebo NRAS (přibližně 5 %) [18].
Mutovaná verze RAS (MT RAS) vede k trvalé aktivaci této signální dráhy. V nádorech s WT RAS je protein kódovaný RAS onkogeny pouze přechodně aktivován přes EGFR. Navázáním anti-EGFR protilátky tak dojde k inaktivaci této signální dráhy.
Na kongresu ASCO byla v roce 2013 prezentována studie FIRE-3, která byla zaměřena na první linii léčby mCRC s WT KRAS. Ve studii byl zkoumán účinek cetuximabu v kombinaci s režimem FOLFIRI a srovnávacím ramenem byla kombinace FOLFIRI s bevacizumabem. Léčebná odpověď byla v obou ramenech obdobná (FOLFIRI a cetuximab 62,0 % vs. FOLFIRI a bevacizumab 58,0 %, p = 0,183); také doba přežití bez progrese se významně nelišila (10,0 vs. 10,3 měsíce). Překvapivý však byl statisticky významný rozdíl v celkovém přežití ve prospěch režimu s cetuximabem (28,7 vs. 25,0 měsíce, p = 0,017). Jaká je příčina, není zcela jasné, protože křivky přežití se od sebe oddělují po 24 měsících, přičemž medián doby léčby první linií je v obou ramenech kratší než šest měsíců (4,8 vs. 5,3 měsíce) [19]. Studie testující kombinace FOLFOX s cetuximabem a FOLFOX s bevacizumabem v současné době probíhají.
Prediktivní význam onkogenů RAS v případě cetuximabu také ukazují data rozšířené molekulární analýzy klinické studie III. fáze FIRE-3, která byla prezentována v září 2013 na kongresu ESMO [20]. Bylo prokázáno, že pacienti s MT RAS, tj. jak KRAS, tak i NRAS, nemají z přidání cetuximabu k chemoterapii FOLFIRI žádný prospěch.
U pacientů s WT RAS bylo v obou ramenech dosaženo obdobné odpovědi na léčbu (ORR, overall response rate) i PFS; přežití bylo signifikantně delší v rameni s cetuximabem (33,1 vs. 25,6 měsíce, HR 0,70; 95% CI: 0,53–0,92; p = 0,011). V rámci studie CRYSTAL v první linii léčby mCRC u pacientů s WT KRAS vedlo přidání cetuximabu k chemoterapii FOLFIRI ve srovnání se samotnou chemoterapií FOLFIRI ke zvýšení léčebné odpovědi o 18 %, k prodloužení mediánu doby do progrese o jeden měsíc a mediánu přežití o 3,5 měsíce. Medián přežití pacientů s WT KRAS mCRC dosáhl při terapii kombinací cetuximab/FOLFIRI 23,5 měsíce [21].
Ve studii New EPOC byl však zaznamenán nepříznivý účinek kombinace cetuximabu s režimem FOLFOX v porovnání se samostatnou chemoterapií FOLFOX u primárně resekabilních jaterních metastáz CRC, PFS byl signifikantně horší u pacientů léčených v kombinačním režimu s cetuximabem (14,8 vs. 24,2 měsíce, p < 0,048) [22]. Zdá se, že u pacientů s resekabilním metastatickým onemocněním je chemoterapie samotná výhodnější než v kombinaci s cetuximabem.
Z nežádoucích účinků se při léčbě anti-EGFR přípravky setkáváme převážně s akneiformním exantémem, jehož výskyt bývá spojen s lepší léčebnou odpovědí. Jedná se o následek inhibice EGFR; tento receptor se podílí na tvorbě kožních folikulů a je exprimován keratinocyty, které podléhají abnormální diferenciaci a zvýšené apoptóze s následnou zánětlivou reakcí. Po ukončení anti-EGFR terapie dochází ke zhojení ad integrum. Závažným nežádoucím účinkem je anafylaktoidní reakce při aplikaci, která může být až život ohrožující. Proto je před podáním cetuximabu nutná premedikace antihistaminiky a kortikoidy. Cetuximab se podává v nasycovací dávce 400 mg/m2 a v další dávce se pokračuje obvykle podáváním 250 mg/m2 1krát týdně nebo 500 mg/m2 jednou za 14 dní.
Panitumumab
Panitumumab je druhý inhibitor EGFR. Jedná se o rekombinantní plně humánní monoklonální protilátku IgG2-κ s afinitou k EGFR, jejíž účinnost je omezena na nádory WT RAS. Ve studii III. fáze nazvané PRIME byla testována účinnost kombinace panitumumabu s chemoterapií FOLFOX4 v první linii léčby mCRC proti chemoterapii FOLFOX4 samotné. U pacientů s WT KRAS byl medián PFS v rameni panitumumab plus FOLFOX4 signifikantně delší ve srovnání se samotnou chemoterapií FOLFOX4 (finální analýza: 10,0 vs. 8,6 měsíce, p = 0,01). Rozdíl v ORR byl při finální analýze také statisticky významně příznivější v rameni s panitumumabem (57 % vs. 48 %, p = 0,02). Rozdíl v mediánech OS byl 4,2 měsíce ve prospěch ramene s kombinací panitumumab plus FOLFOX (23,9 vs. 19,7 měsíce, p = 0,07).
Poslední analýza OS byla publikována na konferenci ASCO 2013; v rameni s panitumumabem bylo přežití signifikantně delší o 4,4 měsíce ve srovnání s chemoterapií samotnou (HR 0,83; 95% CI: 0,70–0,98; p = 0,027). U nemocných s WT RAS bylo celkové přežití delší v rameni s panitumumabem o 5,8 měsíce (26,0 vs. 20,2 měsíce, HR 0,78; 95% CI: 0,62–0,99; p = 0,043), podobně byl prodloužen také medián PFS (10,1 vs. 7,9 měsíce, HR 0,72; 95% CI: 0,58–0,90; p = 0,004).
V případě pacientů s MT RAS vedla kombinace panitumumab s režimem FOLFOX4 k signifikantnímu zkrácení OS (HR 1,25; 95% CI: 1,02–1,55; p = 0,034) a také PFS (HR 1,31; 95% CI: 1,07–1,60; p = 0,008) [23, 24].
Z nežádoucích účinků se mohou objevit průjem, hypokalemie, hypokalcemie či hypomagnezemie, proto je nutné monitorovat hladiny iontů. Nejčastější jsou však, podobně jako při podávání cetuximabu, kožní příznaky v podobě vyrážky. Může se vyskytnout také intersticiální pneumonitida či plicní fibróza. Infuzní reakce jsou ve srovnání s léčbou cetuximabem méně časté a méně intenzivní. Panitumumab je aplikován v dávce 6 mg/kg každé dva týdny.
Regorafenib
Regorafenib je perorální multikinázový inhibitor VEGFR, především VEGFR2, ale i dalších receptorů (např. VEGFR1, VEGFR3, TIE2 – tyrozinkinázový receptor), které ovlivňují angiogenezi; dále působí na receptor pro fibroblastový růstový faktor (FGFR, fibroblast growth factor receptor), který se podílí na proliferaci, migraci a diferenciaci nádorových buněk, a rovněž na receptor pro destičkový růstový faktor (PDGFRβ, platelet-derived growth factor receptor), který podporuje stabilizaci cév a společně s FGFR ovlivňuje mikroprostředí nádoru. Inhibovány jsou dále mutované onkogenní kinázy BRAF, KIT, RET a p38 MAP.
Ve studii CORRECT regorafenib prodloužil OS ve srovnání s placebem o 1,4 měsíce (6,4 vs. 5,0 měsíce, HR 0,77; 95% CI: 0,64–0,94; p = 0,005) [25]. Podává se perorálně v dávce 160 mg denně po dobu tří týdnů s následnou týdenní pauzou ve čtyřtýdenních cyklech.
Nejčastějším nežádoucím účinkem je únava, průjem, hypertenze, zhoršené hojení ran a syndrom palmoplantární dysestezie. Toxicita léku je poměrně významná, i když dobře zvladatelná. Vzhledem k tomu, že je indikován ve třetí a dalších liniích léčby u pacientů, u kterých došlo k vyčerpání standardní terapie první, druhé a eventuálně i třetí linie a jejichž prognóza se pohybuje řádově v několika málo měsících, je třeba vždy velmi pečlivě podání tohoto přípravku zvažovat. V každém případě by terapie regorafenibem neměla výrazně snižovat kvalitu života pacientů.
Aflibercept
Aflibercept, označovaný též jako VEGF Trap (doslova „past na VEGF“), je rekombinantní fúzní protein, který se skládá z vazebných částí VEGF tvořených extracelulárními doménami lidských VEGF receptorů 1 a 2 fúzovaných k Fc části lidského IgG1. Tato protilátka váže veškerý cirkulující VEGF a placentární růstový faktor (PlGF, placental growth factor). Mechanismus účinku je tedy obdobný bevacizumabu, stejně tak jako nežádoucí účinky, z nichž se však častěji než u bevacizumabu objevuje leukopenie, neutropenie, průjem či elevace AST. Aflibercept se podává v dávce 4 mg/kg jednou za 14 dní. Ve studii VELOUR byl testován ve druhé linii v kombinaci s režimem FOLFIRI u pacientů po selhání léčby založené na oxaliplatině a rovněž u pacientů léčených bevacizumabem. Prodloužení OS bylo v porovnání s placebem 1,4 měsíce (13,5 vs. 12,1 měsíce, HR 0,82; 95% CI: 0,71–0,94; p = 0,003), PFS 6,90 vs. 4,67 měsíce (p = 0,00007) a celková odpověď na léčbu 19,8 % vs. 11,1 % (p = 0,0001) [26].
Závěr
Pro většinu pacientů s prokázaným mCRC je nepochybně velmi přínosná konzultace v komplexním onkologickém centru. Lze tam kromě protinádorové farmakoterapie zvážit také další modality terapie včetně chirurgické léčby metastáz a intervenčních radiologických metod. Právě komplexní přístup má podstatnou zásluhu na prodlouženém přežívání pacientů s touto závažnou diagnózou.
Tato práce byla financována z institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR Masarykovu onkologickému ústavu v roce 2013.
Seznam použité literatury
- [1] Ústav zdravotnických informací a statistiky ČR, Národní zdravotnický informační systém (NZIS), Národní onkologický registr (NOR), [citace 20. 11. 2013], dostupné z http://www.uzis.cz/katalog/zdravotnicka-statistika/novotvary.
- [2] Muratore A, Zorzi D, Bouzari H, et al. Asymptomatic colorectal cancer with un-resectable liver metastases: immediate colorectal resection or up-front systemic chemotherapy? Ann Surg Oncol 2007; 14: 766–770.
- [3] Alberts SR, Horvath WL, Sternfeld WC, et al. Oxaliplatin, fluorouracil, and leucovorin for patients with unresectable liver-only metastases from colorectal cancer: a North Central Cancer Treatment Group phase II study. J Clin Oncol 2005; 23: 9243–9249.
- [4] Rees M, Tekkis PP, Welsh FK, et al. Evaluation of long-term survival after hepatic resection for metastatic colorectal cancer: a multifactorial model of 929 patients. Ann Surg 2008; 247: 125–135.
- [5] Fong Y, Fortner J, Sun RL, et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1 001 consecutive cases. Ann Surg 1999; 230: 309–321.
- [6] De Jong MC, Pulitano C, Ribero D, et al. Rates and patterns of reccurence following curative intent surgery for colorectal liver metastasis: an international multi-institutional analysis of 1699 patients. Ann Surg 2009; 250: 440–448.
- [7] Rothenberg M, Oza A, Bigelow R, et al. Superiority of oxaliplatin and fluorouracil-leucovorin compared with either therapy alone in patients with progressive colorectal cancer after irinotecan and fluorouracil-leucovorin: Interim results of a phase III trial. J Clin Oncol 2003; 21: 2059–2069.
- [8] Saltz L, Cox JV, Blanke C, et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group. N Engl J Med 2000; 343: 905–914.
- [9] Van Den Eynde M, Hendlisz A. Treatment of colorectal liver metastases: a review. Rev Recent Clin Trials 2009; 4: 56–62.
- [10] Falcone A, Ricci S, Brunetti I, et al. Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol 2007; 25: 1670–1676.
- [11] Hicklin DJ, Ellis LM. Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis. J Clin Oncol 2005; 23: 1011–1027.
- [12] Hurwitz HI, Tebbutt NC, Kabbinavar F, et al. Efficacy and safety of bevacizumab in metastatic colorectal cancer: pooled analysis from seven randomized controlled trials. Oncologist 2013; 18: 1004–1012. doi: 10.1634/theoncologist. 2013-0107.
- [13] Hurwitz HI, Douglas PS, Middleton JP, et al. Analysis of early hypertension (HTN) and clinical outcome with bevacizumab (BV). J Clin Oncol 2010; 28 (Suppl): Abstract 3039.
- [14] Cai J, Ma H, Huang F, et al. Correlation of bevacizumab-induced hypertension and outcomes of metastatic colorectal cancer patients treated with bevacizumab: a systematic review and meta-analysis. World J Surg Oncol 2013; 11: 306.
- [15] Kelly RJ, Billemont B, Rixe O. Renal toxicity of targeted therapies. Target Oncol 2009; 4: 121–133.
- [16] Bennouna J, Sastre J, Arnold D, et al. ML18147 Study Investigators. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. Lancet Oncology 2013; 14: 29–37.
- [17] Falcone A, Cremolini Ch, Masi G, et al. FOLFOXIRI/bevacizumab (bev) versus FOLFIRI/bev as first-line treatment in unresectable metastatic colorectal cancer (mCRC) patients (pts): Results of the phase III TRIBE trial by GONO group. J Clin Oncol 2013; 31 (Suppl): abstract 3505.
- [18] Shen Y, Wang J, Han X, et al. Effectors of Epidermal Growth Factor Receptor Pathway: The Genetic Profiling ofKRAS, BRAF, PIK3CA, NRAS Mutations in Colorectal Cancer Characteristics and Personalized Medicine. PLoS One 2013; 8: e81628.
- [19] Heinemann V, Fischer Von Weikersthal L, Decker T, et al. Randomized comparison of FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment of KRAS-wildtype metastatic colorectal cancer: German AIO study KRK-0306 (FIRE-3). J Clin Oncol 2013 ASCO 2013; 31 (suppl; abstr 3506).
- [20] Stintzing S, Jung A, Rossius L, et al. LATE BREAKING ABSTRACT: Analysis of KRAS/NRAS and BRAF mutations in FIRE-3: A randomized phase III study of FOLFIRI plus cetuximab or bevacizumab as first-line treatment for wild-type (WT) KRAS (exon 2) metastatic colorectal cancer (mCRC) patients. The European Cancer Congress 2013, abstr 17.
- [21] Van Cutsem E, Kohne CH, Hitre E, et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009; 360: 1408–1417.
- [22] Primrose JN, Falk S, Finch-Jones M, et al. A randomized clinical trial of chemotherapy compared to chemotherapy in combination with cetuximab in k-RAS wild-type patients with operable metastases from colorectal cancer: The new EPOC study (abstract). J Clin Oncol 2013; 31 (Suppl): Abstract 3504.
- [23] Douillard JY, Siena S, Tabernero J, et al. Overall Survival (OS) Analysis From PRIME: Randomized Phase 3 Study of Panitumumab (pmab) With FOLFOX4 for 1st-line Metastatic Colorectal Cancer (mCRC). J Clin Oncol 2013 ASCO 2013; 31 (suppl; abstr 3620).
- [24] Douillard JY, Siena S, Cassidy J, et al. Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME Study. J Clin Oncol 2010; 28: 4697–4705.
- [25] Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381: 303–312.
- [26] Van Cutsem E, Tabernero J, Lakomy R, et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012; 30: 3499–3506.