Porovnání klinické účinnosti inhibitorů DPP-4 sitagliptinu a vildagliptinu
Sitagliptin a vildagliptin jsou zástupci nové třídy antidiabetik – gliptinů. Jejich účinek je zprostředkován inhibicí enzymu dipeptidyl peptidáza 4 (DPP-4), čímž se zvýší hladina endogenního glukagonu podobného peptidu 1 (GLP-1) na dvoj- až trojnásobek. Z klinického hlediska je účinek obou inhibitorů DPP-4 na snížení glykemie, hodnocený změnou glykovaného hemoglobinu, shodný. Konzistentní vliv na hladiny lipidů není prokazatelný. Jasný klinický průkaz ovlivnění kardiovaskulárního rizika doposud nebyl přinesen, i když jej lze předpokládat. Riziko vzniku hypoglykemie při monoterapii inhibitorem DPP-4 je srovnatelné s rizikem při podávání placeba a je stejné u obou preparátů.
Úvod
Terapie hyperglykemie u pacientů s diabetem 2. typu je základním krokem pro prevenci pozdních komplikací. V současnosti je obecně přijímaným cílem léčby dosažení normálních hodnot glykemie u většiny pacientů. S výjimkou studie ADVANCE je v klinických studiích dosahováno cílové (těsné) kompenzace pouze u poloviny, maximálně u 60 % nemocných. Jednou z cest, jak zlepšit tyto výsledky, je zavádění nových terapeutických modalit.
Inkretiny
Jako inkretiny jsou označovány hormony secernované střevními buňkami. Jejich sekrece stoupá zejména po jídle. Jsou to polypeptidy, jejichž plazmatický poločas je velmi krátký (2–7 minut). Obvykle jsou mezi ně řazeny glucagon-like peptid 1 (glukagonu podobný peptid 1, GLP-1) a glucose-dependent insulinotropic polypeptid/ gastric inhibitory polypeptid (na glukóze závislý inzulinotropní peptid, GIP). Hlavními mechanismy, kterými inkretiny ovlivňují homeostázu glukózy, jsou ovlivnění sekrece inzulinu závislé na glykemii, postprandiální suprese sekrece glukagonu a ovlivnění evakuace žaludku. Pro terapeutické využití se zatím zdá být perspektivnější GLP-1.
Za bazálních podmínek je koncentrace GLP-1 v krvi relativně nízká, prudce roste po požití potravy, vzestup hladiny je zprostředkován neuroendokrinně a současně přímým stimulačním účinkem potravy na buňky střevní sliznice [1]. GLP-1 zpomaluje vyprazdňování žaludku, zvyšuje citlivost b-buněk k sekrečním podnětům, zvyšuje zejména první fázi inzulinové sekrece, snižuje sekreci glukagonu, a proto snižuje výdej glukózy hepatocyty. Byl prokázán příznivý efekt na proliferaci a diferenciaci b-buněk – GLP-1 snižuje jejich apoptózu, urychluje diferenciaci a dozrávání, zvětšuje celkově objem ostrůvků. GLP-1 také snižuje chuť k jídlu. Ovlivňuje významněji postprandiální glykemii než glykemii nalačno – přehledně viz [2]. Nevýhodou z hlediska jeho terapeutického užití je velmi krátký poločas účinku (2–7 minut), je degradován ubikvitérně přítomným enzymem s názvem dipeptydyl peptidáza 4 (DPP-4; podrobně viz dále) [3].
Účinek na sekreci inzulinu je tzv. glukózo-dependentní. To znamená, že se neprojevuje při normální nebo snížené glykemii, taktéž ustává při poklesu postprandiální glykemie na normální hodnotu. Účinek GLP-1 je zprostředkován receptory, jejichž aktivace zvyšuje intracelulární obsah cAMP. U pacientů s diabetem 2. typu je koncentrace GLP-1 typicky snížená, nicméně jeho účinek je zachován [4]. Porucha nepředchází vznik diabetu, je tedy sekundární. Jednou z možností, jak využít efektu GLP-1, je aplikovat přímé agonisty receptoru pro GLP-1 (exenatid). Tato možnost je již široce klinicky využívána [5–7]. Další z agonistů GLP-1 liraglutid bude pravděpodobně v brzké době dostupný pro klinickou praxi.
DPP-4 je aminopeptidáza, která odštěpuje dvě N-terminální aminokyseliny bioaktivních peptidů (štěpí vazbu, ve které musí být alanin nebo prolin). Je shodná s T lymfocytárním membránovým proteinem CD26. DPP-4 je přítomna v celé řadě tkání např. ledvin, jater, plic, střeva, dále pak v lymfocytech či v kapilárních endoteliích [8]. Extracelulární doména DPP-4 může být odštěpena a při zachování enzymatické aktivity cirkuluje v intravazálním prostoru. Přirozeným substrátem pro DPP-4 jsou chemokiny, cytokiny, endorfiny, hormony – GLP-1, GIP, vazoaktivní intestinální peptid (VIP), somatostatin, neuropeptid Y (NPY). Všechny tyto působky (s výjimkou inkretinů) však mají i jiné cesty katabolismu. Proto je možno inhibicí DPP-4 zvýšit plazmatickou koncentraci GLP-1 na dvoj- až trojnásobek fyziologických hodnot. Látky, které mohou zablokovat aktivní místo enzymu DPP-4, se nazývají inhibitory DPP-4, zkráceně gliptiny [9].
Mechanismus účinku inhibitorů DPP-4
Gliptiny, inhibitory DPP-4, vedou k reverzibilní kompetitivní inhibici aktivního místa DPP-4. Vlastní účinek gliptinů tedy spočívá v prodloužení biologického poločasu GLP-1, protože inhibují jeho degradaci. GLP-1 zvyšuje sekreci inzulinu a snižuje sekreci glukagonu. Akutním efektem gliptinů je tedy snížení glykemie zprostředkované zvýšením sekrece inzulinu, tedy vlastním nejdůležitějším efektorem gliptinů je změna sekrece inzulinu (a glukagonu, jak je uvedeno dále). Prokazatelný je vliv nejen na glykemii nalačno, ale také na výšku postprandiální glykemie. Dalším významným účinkem gliptinů je jejich schopnost znovu nastavit normální citlivost b-buněk ostrůvků a tak obnovit první fázi inzulinové sekrece. Z klinického hlediska je důležité, že snížení glykemie po podání gliptinů je důsledkem nejen ovlivnění sekrece inzulinu, ale také přímým důsledkem snížení sekrece glukagonu; pokles glukagonemie pak vede ke snížení produkce glukózy v játrech. Bylo prokázáno, že právě snížení sekrece glukagonu se podílí významně na snížení postprandiální exkurze glykemie – podrobně viz [4]. DPP-4 je členem celé rodiny aminopeptidáz, které mají významné fyziologické funkce. Při vývoji farmak je proto třeba velmi pečlivě střežit inhibiční selektivitu pouze vůči DPP-4.
Farmakologické vlastnosti gliptinů
Sitagliptin je chemicky popsán jako 7-[(3R)-3-amino-1-oxo-4-(2,4,5-trifluorofenyl)butyl]- 5,6,7,8-tetrahydro-3-(trifluoromethyl)-1,2,4-triazolo[4,3-a]pyrazin fosfát (1 : 1) monohydrát [10]. Sitagliptin je selektivní pro DPP-4 a in vitro neinhibuje aktivitu DPP-8 ani DPP-9 při koncentraci blížící se koncentraci z terapeutických dávek (k inhibici dochází při koncentraci vyšší než 2600násobek terapeutické hladiny). Vazba na DPP-4 je nekovalentní.
V terapeutických dávkách sitagliptin zablokuje aktivitu DPP-4 na dobu 24 hodin. To vede ke dvoj- až trojnásobnému zvýšení koncentrací aktivního GLP-1, ke snížení koncentrace glukagonu a zvýšení odezvy uvolnění inzulinu na sekreční podnět. Sitagliptin má glukózo-dependentní efekt, to znamená, že nezvyšuje sekreci inzulinu, pokud je glykemie pod horní hranicí normální hodnoty. Proto u zdravých osob sitagliptin nevede k hypoglykemii, u pacientů s diabetem nezvyšuje riziko hypoglykemie. Maximální koncentrace sitagliptinu v krvi je dosaženo mezi 1. a 4. hodinou po podání, absolutní biologická dostupnost je 87 %. Vazba na plazmatické proteiny činí 37 %, distribuční objem je 198 litrů. Intraindividuální a interindividuální variabilita farmakokinetických parametrů je velmi nízká. Sitagliptin je metabolizován minimálně, 87 % podané dávky se vylučuje renální exkrecí převážně v nezměněné formě. Eliminační poločas je 12,4 hodiny. [10]. Podle farmakokinetických studií není zapotřebí úprava dávky ve vztahu k indexu tělesné hmotnosti (BMI), pohlaví ani primárně podle věku [10, 11]. Vildagliptin je chemicky (2S)-1-[N-(3-hydroxy-1-adamantyl)glycyl]pyrrolidin-2-karbonitril [12].
Vildagliptin je selektivní pro DPP-4 (inhibuje aktivitu DPP-8 a DPP-9 při koncentraci 32–250krát vyšší, než je koncentrace terapeutická). Vazba na DPP-4 je kovalentní, což představuje rozdíl proti sitagliptinu. Klinický význam tohoto rozdílu není jasný. Po perorálním podání nalačno je vildagliptin rychle absorbován a koncentrace v plazmě dosahuje vrcholu za 1,7 hodiny. Absolutní biologická dostupnost je 85 %. Vazba vildagliptinu na proteiny plazmy je nízká (9,3 %), distribuční objem činí 70,5 litru. Vildagliptin není metabolizován enzymy CYP-450 v jakémkoli kvantifikovatelném rozsahu, ale je poměrně výrazně hydrolyzován (cca 70 %). Po perorálním podání je přibližně 85 % radioaktivně značené látky vyloučeno do moči a 15 % je vylučováno ve stolici. Renální exkrecí je vyloučeno 23 % dávky vildagliptinu v nezměněné formě. Eliminační poločas po perorálním podání je 3 hodiny.
Podle farmakokinetických studií není zapotřebí úprava dávky ve vztahu k BMI ani k pohlaví. U zdravých starších jedinců (nad 70 roků) je celková expozice vildagliptinu (100 mg jednou denně) zvýšena o 32 %, s 18% zvýšením vrcholové koncentrace v plazmě, ve srovnání s mladými zdravými jedinci (18–40 roků). Tyto změny však nejsou považovány za klinicky významné. Inhibice DPP-4 vildagliptinem není ovlivněna věkem.
Klinické indikace sitagliptinu a vildagliptinu
Sitagliptin byl schválen ke klinickému užití v roce 2006 jako první inhibitor DPP-4. V Evropě byl zaregistrován jako lék druhé volby u pacientů nedostatečně kompenzovaných režimovými opatřeními a metforminem, jako lék druhé volby, který je možno přidat k sulfonylureovým preparátům nebo glitazonům při nesnášenlivosti metforminu. Jako třetí lék do kombinace s metforminem a sulfonylureou při nedostatečném efektu režimových opatření a dvojkombinace. Tato registrace je platná i pro Českou republiku. Nově byl v Evropě registrován pro monoterapii (při nesnášenlivosti či kontraindikaci metforminu) a do trojkombinace s metforminem a glitazony. Základní dávka sitagliptinu je 100 mg podávaných jednou denně per os.
Nejdůležitější klinická pozice sitagliptinu je v kombinaci s metforminem. Její výhodnost byla prokázána několika klinickými studiemi. Ve 24týdenní, prospektivní, randomizované a placebem kontrolované studii, v níž bylo 100 mg sitagliptinu přidáno ke stávající léčbě metforminem [13], byl zaznamenán statisticky významný pokles HbA1c o průměrných 0,65 % proti placebu. Riziko hypoglykemií, výskyt nežádoucích gastrointestinálních účinků a pokles hmotnosti byly shodné s placebovou větví. V Goldsteinově studii bylo dosaženo poklesu hladiny glykovaného hemoglobinu o 2,07 % (resp. o 3,5 % v otevřené části) proti placebu (vyjádřeno v absolutní hodnotě, podána dávka 100 mg sitagliptinu a 2 g metforminu, studie trvala 24 týdnů) [14]. Bylo prokázáno, že účinek kombinace sitagliptinu s metforminem vede k významnějšímu zlepšení glykemie, než by odpovídalo prostému součtu efektů obou látek. Tento tzv. synergický a komplementární efekt je způsoben tím, že metformin sám zvyšuje hladinu aktivního GLP-1, a tak zlepšuje efekt sitagliptinu. Tato klinická studie tedy definuje metformin jako ideální lék do kombinace se sitagliptinem. Při současné úrovni poznatků není důvod předpokládat, že stejné výsledky nebudou dosaženy při léčbě vildagliptinem.
Vildagliptin je registrován pro léčbu pacientů s diabetem 2. typu nedostatečně kompenzovaných režimovými opatřeními a maximálně tolerovanou dávkou monoterapie (metformin, sulfonylurea nabo glitazon). Je tedy určen pro léčbu v dvojkombinaci. Podle SPC je stanovena terapeutická dávka 50 mg vildagliptinu jednou denně pro kombinovanou léčbu se sulfonylureou, v ostatních kombinacích je to dávka 50 mg dvakrát denně. Ve 24týdenní klinické studii, která porovnávala účinek vildagliptinu s efektem akarbózy u 661 pacientů s diabetem 2. typu nedostatečně kompenzovaných režimovými opatřeními [15], bylo prokázáno, že účinek vildagliptinu je významně vyšší u pacientů s kratší dobou trvání diabetu. Tento poznatek odpovídá předpokladu vycházejícímu z patofyziologie progrese diabetu 2. typu a mechanismu účinku gliptinů.
Porovnání klinického efektu sitagliptinu a vildagliptinu
Úvodem této kapitoly je nezbytné zdůraznit, že výsledek léčby pacientů s diabetem 2. typu nezávisí pouze na potenciálu antidiabetika samotného, ale je definován také dalšími charakteristikami intervenovaného souboru. Pro seriózní analýzu lze použít pouze randomizované studie, současně je třeba 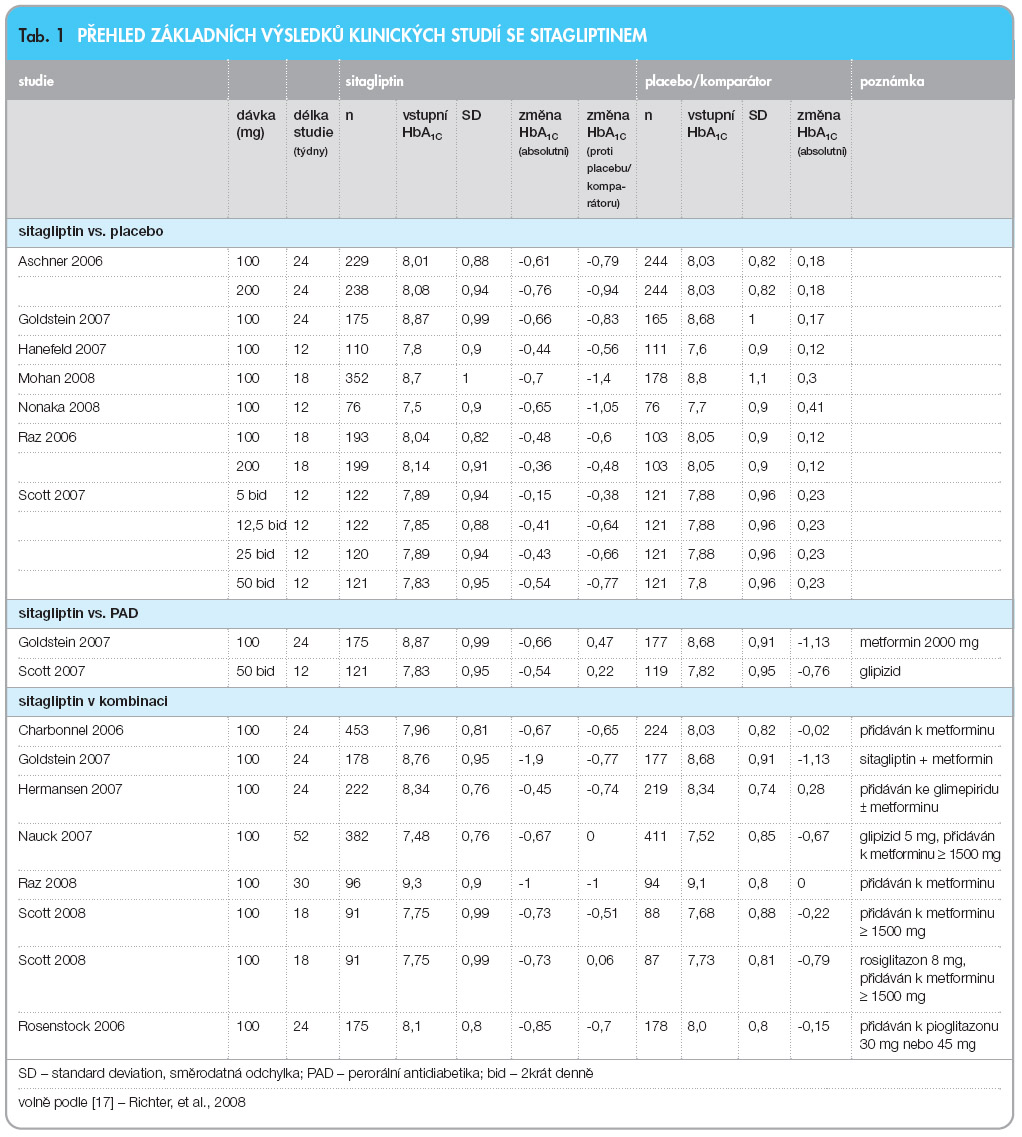 zohlednit vstupní kompenzaci souboru (viz dále), při léčbě gliptiny také délku trvání diabetu,
zohlednit vstupní kompenzaci souboru (viz dále), při léčbě gliptiny také délku trvání diabetu, 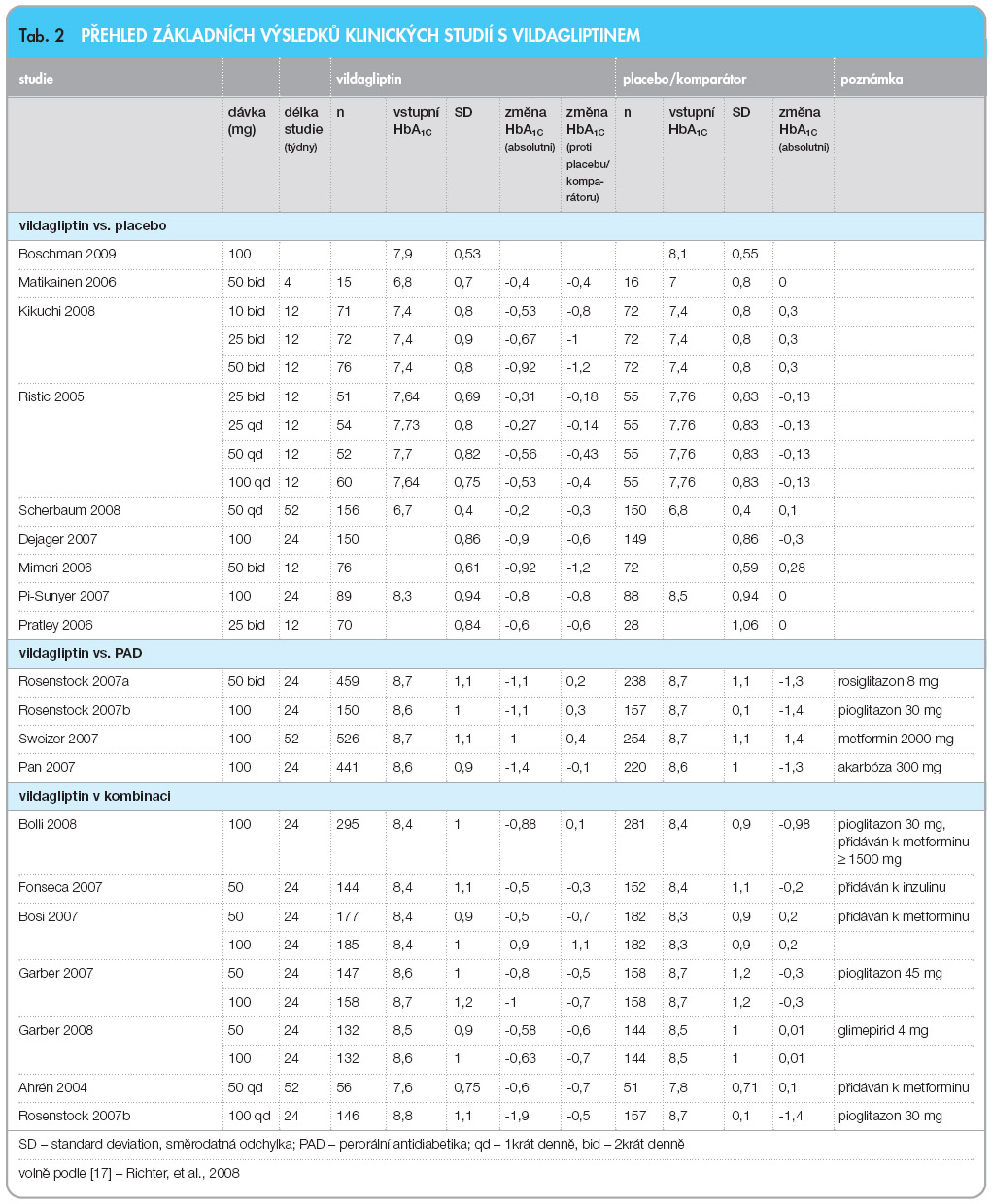 případně index tělesné hmotnosti. Všechna srovnání opírající se o komparaci výsledků např. dvou vybraných studií jsou obvykle účelová. Pokud není k dispozici přímé porovnání dvou látek (randomizovaný soubor, porovnání „head to head“), je jediným seriózním zdrojem kvalitně provedená metaanalýza. Přehled základních výsledků klinických studií se sitagliptinem je uveden v tab. 1, základní výsledky klinických studií s vildagliptinem uvádí tab. 2. První metaanalýza byla uveřejněna v roce 2007 a zahrnovala celou skupinu gliptinů dohromady. Průměrné zlepšení kompenzace glykovaného hemoglobinu činilo podle této práce 0,74 % a gliptiny byly noninferiorní (neměly nižší účinnost) ve srovnání s ostatními perorálními antidiabetiky (PAD) [16].
případně index tělesné hmotnosti. Všechna srovnání opírající se o komparaci výsledků např. dvou vybraných studií jsou obvykle účelová. Pokud není k dispozici přímé porovnání dvou látek (randomizovaný soubor, porovnání „head to head“), je jediným seriózním zdrojem kvalitně provedená metaanalýza. Přehled základních výsledků klinických studií se sitagliptinem je uveden v tab. 1, základní výsledky klinických studií s vildagliptinem uvádí tab. 2. První metaanalýza byla uveřejněna v roce 2007 a zahrnovala celou skupinu gliptinů dohromady. Průměrné zlepšení kompenzace glykovaného hemoglobinu činilo podle této práce 0,74 % a gliptiny byly noninferiorní (neměly nižší účinnost) ve srovnání s ostatními perorálními antidiabetiky (PAD) [16].
V roce 2008 byla uveřejněna metaanalýza randomizovaných, prospektivních, placebem kontrolovaných, dvojitě zaslepených klinických studií se sitagliptinem a vildagliptinem, jejímž cílem bylo srovnat klinický efekt a případné nežádoucí účinky obou gliptinů [17]. V této metaanalýze jsou hodnoceny pouze randomizované studie, výsledky jsou filtrovány i z hlediska homogenity. Je podrobně analyzován možný vliv bias na výsledek. Terapie sitagliptinem vede k významnému zlepšení kompenzace glykovaného hemoglobinu o 0,7 % (95% CI -0,9 až -0,6; p = 0,00001) proti placebu. Terapie vildagliptinem rovněž významně zlepšuje kompenzaci glykovaného hemoglobinu o 0,6 % (95% CI -0,8 až -0,4; p = 0,00001) proti placebu.
V této metaanalýze je také provedena analýza studií, v nichž byl gliptin přidán ke stávající léčbě antidiabetickým lékem. Aditivní efekt byl zaznamenán jako statisticky významný, pro vildagliptin je vyjádřen poklesem hladiny glykovaného hemoglobinu o 0,7 % (95% CI -0,9 až -0,4; p = 0,00001), čemuž odpovídá efekt sitagliptinu, pouze s větší heterogenitou výsledků. Absolutní pokles hodnot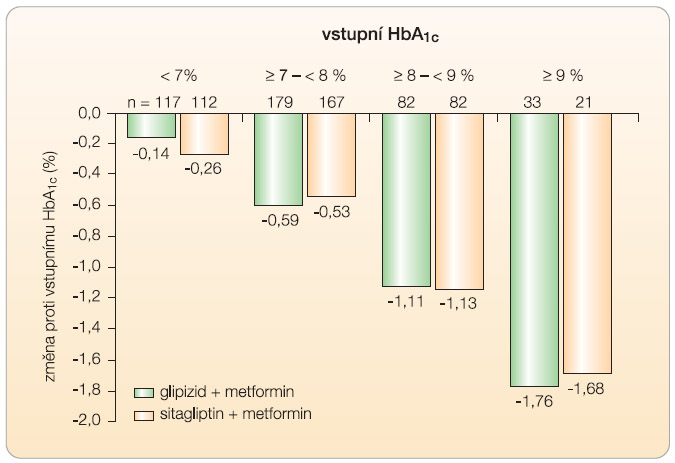 y glykovaného hemoglobinu v důsledku farmakologické intervence je velmi závislý na vstupní hodnotě, toto pravidlo platí pro jakoukoliv antidiabetickou léčbu, nejinak je tomu i u gliptinů. Závislost výsledného zlepšení kompenzace na výšce hladiny glykovaného hemoglobinu při vstupu do studie je velmi pěkně dokumentována v celé řadě prací s gliptiny [14, 18–21]. Velmi názorně je vliv vstupní kompenzace na výsledek zobrazen v grafu 1 podle publikace Naucka a kol. [19]. Tyto nálezy jsou opět velmi důležité pro nezávislé hodnocení účinnosti terapie založené na inkretinech.
y glykovaného hemoglobinu v důsledku farmakologické intervence je velmi závislý na vstupní hodnotě, toto pravidlo platí pro jakoukoliv antidiabetickou léčbu, nejinak je tomu i u gliptinů. Závislost výsledného zlepšení kompenzace na výšce hladiny glykovaného hemoglobinu při vstupu do studie je velmi pěkně dokumentována v celé řadě prací s gliptiny [14, 18–21]. Velmi názorně je vliv vstupní kompenzace na výsledek zobrazen v grafu 1 podle publikace Naucka a kol. [19]. Tyto nálezy jsou opět velmi důležité pro nezávislé hodnocení účinnosti terapie založené na inkretinech.
K optickému zkreslení může dojít, pokud se změny kompenzace zobrazí graficky jako absolutní změna glykovaného hemoglobinu bez zohlednění právě vstupní hodnoty, jak je to provedeno v recentně publikovaném přehledném článku [22]. V grafech jsou sice uvedeny vstupní hodnoty glykohemoglobinu, ale nikde není zmíněn jejich vliv na výsledek terapie. Vedle přesvědčivé matematické modelace, která vliv vstupní kompenzace kvantifikuje [23], můžeme k výše uvedenému konstatování dojít i prostou logickou úvahou. Z klinického hlediska je normální hodnota glykovaného hemoglobinu limitou (žádná léčba v eticky vedené klinické studii ani v praxi nemůže z důvodu nebezpečí, které vyplývá z hypoglykemie, snižovat hodnoty glykovaného hemoglobinu pod hodnoty u zdravého člověka). Je-li vstupní hemoglobin půl procenta nad normálními hodnotami, může být maximální zlepšení kompenzace právě půl procenta, je-li vstupní glykohemoglobin vyšší než norma např. o 5 % absolutní hodnoty, může být potenciální maximální zlepšení právě oněch 5 %. Toto vysvětlení je podporováno následujícím výsledkem: extrémní zlepšení kompenzace (snížení glykovaného hemoglobinu o 3,5 % absolutní hodnoty/sic!/) bylo dosaženo při léčbě sitagliptinem v kombinaci s metforminem při léčbě pacientů(n = 72) s průměrným vstupním glykohemoglobinem 11,2 % [14].
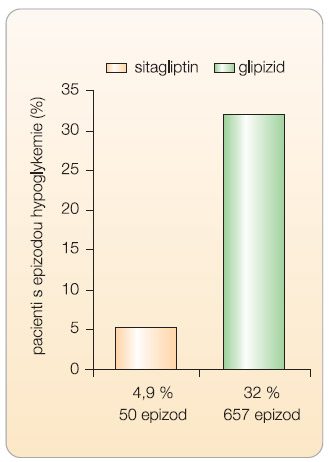
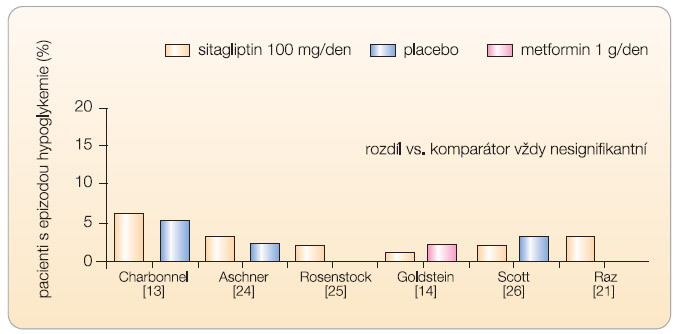 Z klinického hlediska je pro potenciál dosažení maximálního účinku podstatné snížení rizika hypoglykemie (glipitiny mají tzv. glukózo-dependentní účinek). Ve výše uvedené metaanalýze [17] bylo shledáno, že riziko hypoglykemie při léčbě gliptiny a při podávání placeba se neliší a není rozdílu mezi sitagliptinem a vildagliptinem. Velmi názorné je grafické vyjádření incidence hypoglykemických příhod, viz graf 2 a 3 [13, 14, 19, 21, 24–26].Podle výsledků klinických studií, které jsou v současnosti k dispozici, je tedy klinická účinnost obou gliptinů shodná. Situace odpovídá očekávání. Vlastním efektorem gliptinů je totiž inzulin; pokud je tedy inhibice DPP-4 přibližně stejná při dávce 100 mg sitagliptinu jednou denně a při dávce vildagliptinu 50 mg dvakrát denně [27–29], musí vést u stejných pacientů terapie ke stejnému výsledku.
Z klinického hlediska je pro potenciál dosažení maximálního účinku podstatné snížení rizika hypoglykemie (glipitiny mají tzv. glukózo-dependentní účinek). Ve výše uvedené metaanalýze [17] bylo shledáno, že riziko hypoglykemie při léčbě gliptiny a při podávání placeba se neliší a není rozdílu mezi sitagliptinem a vildagliptinem. Velmi názorné je grafické vyjádření incidence hypoglykemických příhod, viz graf 2 a 3 [13, 14, 19, 21, 24–26].Podle výsledků klinických studií, které jsou v současnosti k dispozici, je tedy klinická účinnost obou gliptinů shodná. Situace odpovídá očekávání. Vlastním efektorem gliptinů je totiž inzulin; pokud je tedy inhibice DPP-4 přibližně stejná při dávce 100 mg sitagliptinu jednou denně a při dávce vildagliptinu 50 mg dvakrát denně [27–29], musí vést u stejných pacientů terapie ke stejnému výsledku.
Vliv inhibitorů DPP-4 na lipidy
Velmi zajímavou otázkou je potenciální vliv gliptinů na hladinu plazmatických lipidů. Platí, že po zlepšení kompenzace diabetu dochází i ke zlepšení profilu plazmatických lipidů. Čistá intervence inzulinové rezistence sníží hladinu triacylglycerolů (která u neintervenovaných osob dosti těsně koreluje se stupněm inzulinové rezistence) a zvýší hladinu HDL cholesterolu, neboť jejich patologické odchylky jsou přímým důsledkem inzulinové rezistence. Vliv antidiabetických farmak jako celku na lipidy je dosti nekonzistentní, velmi špatně se totiž odděluje účinek přímý od účinku zprostředkovaného zlepšením kompenzace.
Efekt gliptinů na lipidy může být posouzen pouze ve studii, kdy jsou gliptiny podávány v monoterapii proti placebu, nebo v kombinaci proti placebu. Vildagliptin v monoterapii nemá žádný statisticky významný účinek na hladiny lipidů ve srovnání s placebem [30–32]. V práci Risticově [33] byl zaznamenán sice statisticky významný (p = 0,004), ale z klinického praktického hlediska irelevantní pokles hladiny HDL cholesterolu o 0,04 mmol/l proti placebu. V této publikaci nebyl zaznamenán vliv vildagliptinu na celkový cholesterol, LDL cholesterol ani na triacylglyceroly.
Monoterapie sitagliptinem hladiny lipidů v jedné práci neovlivnila [24], v některých publikacích není vliv léčby na lipidy popsán [30, 34 /v této práci zařazeni pacienti s dietou i PAD/, 20]. V práci Hanefelda [35] bylo po dávce 100 mg denně pozorováno zvýšení celkového cholesterolu (o 3,9 %), LDL cholesterolu (o 7,8 %) a HDL cholesterolu (o 4,3 %) po aktivní léčbě proti placebu, taktéž pokles hladiny triacylglycerolů (o 4,4 %). V práci Scotta, kde byly použity různé dávky sitagliptinu [26], nebyla proti placebu nalezena žádná změna v hodnotě celkového a LDL cholesterolu, mírné zvýšení hladiny HDL cholesterolu (o 2,1–3,9 %) a snížení hladiny triacylglycerolů (o 9,0–14,4 %).
V klinických studiích, které hodnotily efekt vildagliptinu jako aditivní terapie ke stávající léčbě antidiabetickými farmaky proti placebu [36–38], byly zaznamenány změny koncentrace lipidů do 3–9 %, ale nebyly nikdy statisticky významné ve srovnání s placebem. Pouze Fonseca a kol. ve své práci [39], která ovšem zahrnula pacienty s dlouhou dobou trvání diabetu léčené inzulinem, zaznamenali, že rozdíl mezi celkovým cholesterolem (podobně i LDL cholesterolem) v aktivní větvi a v placebové větvi na konci studie byl 4,0 6 1,8 % (resp. 5,8 6 2,9 %). Je však třeba zdůraznit, že změna v aktivně léčené větvi vyjádřená v procentech nepřekročila 4 % v žádném lipidovém parametru, tedy odpovídá změnám pozorovaným v ostatních studiích, kdy byl vildagliptin podáván v kombinaci. V práci Bosiho a kol. [40] nebyl zaznamenán rozdíl mezi vildagliptinem a placebem v ovlivnění celkového cholesterolu, LDL cholesterolu a HDL cholesterolu, pouze vzestup hladiny triacylglycerolů byl významnější po podání placeba (+ 19 6 6 %) proti vzestupu po léčbě 50 mg vildagliptinu (+ 1 6 5 %, p = 0,014), ale nebyl významnější proti vzestupu po léčbě 100 mg vildagliptinu (+ 5 6 5 %, p = 0,052). Tedy výsledky inkonzistentní, svědčící jednoznačně pro neutrální vliv vildagliptinu na lipidy. Dlužno zdůraznit, že pouze v jedné práci je při hodnocení vlivu aktivní léčby na lipidy zmínka o adjustaci podle hypolipidemické terapie [37], a to se závěrem, že po adjustaci není statisticky významný vliv léčby vildagliptinem prokazatelný. Nepřímo lze tedy vyvodit, že inkonzistentní nálezy v uvedených studiích mohou být důsledkem právě vlivu hypolipidemické terapie.
V přímém srovnání s akarbózou vildagliptin lipidy neovlivnil [15]. Práce Schweizera a kol. [41], ve které byl porovnáván účinek vildagliptinu a metforminu u osob s diabetem 2. typu nedostatečně kompenzovaných režimovými opatřeními a kde nebyla prokázána noninferiorita vildagliptinu (tedy účinek vildagliptinu byl nižší než efekt metforminu), také nebyl prokázán rozdíl ve vlivu na jakýkoliv standardně hodnocený lipidový parametr. V malé metaanalýze pěti studií s vildagliptinem, jejímž hlavním cílem bylo porovnat účinnost u osob vyššího a nižšího věku [42], jsou v souhrnné tabulce uvedeny procentuální změny lipidů jako statisticky významné. Nicméně i zde se jedná o vyhodnocení změny proti výchozímu stavu (při vstupu do studie, tzv. base line), hodnoty nejsou vztaženy k placebu. Naprostá většina hodnot se pohybuje v rozmezí 1–3 %, což odpovídá změnám v placebových větvích. Kombinovaná terapie sitagliptinem a metforminem podle práce Nauckovy neovlivnila lipidy proti kombinované terapii metforminem a glipizidem, pouze hladina LDL cholesterolu byla vyšší na konci sledovaného období o 2,5 % [19]. V jiné publikaci [43], v níž byla také užita kombinace sitaglitinu s metforminem, byl zaznamenán zřetelný pokles hladiny LDL cholesterolu a triglyceridů po podávání sitagliptinu a taktéž vzestup hladiny HDL cholesterolu. Při porovnání se změnami v placebové skupině však nedosahovaly změny statistické významnosti. Stejně tak nebyly nalezeny signifikantní rozdíly v koncentracích lipidů po léčbě sitagliptinem v kombinaci s metforminem v práci Raze [44]. V dalších publikacích, které se týkaly terapie sitagliptinem kombinované s ostatními perorálními antidiabetiky, nebyly změny lipidů popsány [14, 43].
Problematické je vyhodnocení vlivu gliptinů na lipidy proti komparátoru z řady glitazonů. Je všeobecně známo, že vliv glitazonu na lipidy je významný a rozdílný u pioglitazonu a rosiglitazonu [45], proto, porovnáme-li účinek gliptinů na lipidy s glitazony, můžeme dostat arteficiálně zkreslené výsledky. Tomu odpovídají výsledky studie Rosenstocka a kol. [46], která je někdy nekorektně citována jako důkaz vlivu gliptinů na lipidy. Absolutní změny hodnot celkového cholesterolu, LDL cholesterolu, HDL cholesterolu a triacylglycerolů po léčbě vildagliptinem v této práci odpovídají změnám v jiných studiích, kde nebyl zaznamenán žádný rozdíl proti placebu. V této studii tedy opět platí, že vliv vildagliptinu na lipidy je neutrální. Statistická významnost v této studii je artefaktem, který způsobil komparátor (rosiglitazon 8 mg). Podobný artefakt vznikl ve studii, která porovnávala efekt vildagliptinu s pioglitazonem u pacientů léčených metforminem [47]. Opět se ukázal sice statisticky významný rozdíl vůči komparátoru, ale absolutní změny po podávání vildagliptinu odpovídají změnám, které byly pozorovány ve studiích srovnávajících vildagliptin s placebem, ve kterých nebyl nalezen žádný rozdíl mezi vildagliptinem a placebem.
Podobně srovnávali účinnost sitagliptinu a rosiglitazonu ve své studii Scott a kol. [48]. Na rozdíl od studie Rosenstockovy [46] byly v této práci tři větve – sitagliptin, rosiglitazon (8 mg) a placebo, což právě dovoluje jasně ukázat rozdíly, které vzniknou, srovnává-li se účinek gliptinů s placebem či s glitazonem. Tak i v této studii bylo prokázáno arteficiální ovlivnění lipidů. Pokles hladiny LDL cholesterolu po sitagliptinu o 5,3 % s rozdílem proti aktivnímu komparátoru o 14,8 % (!), pokles hladiny triacylglycerolů po sitagliptinu o 16,7 % (tato hodnota je ale významná ve srovnání s placebem; p < 0,05) opět se statisticky významným rozdílem proti aktivnímu komparátoru o 17,9 %. V písemnictví lze nalézt pouze dvě experimentální práce, které se zabývají vlivem inhibice DPP-4 (vildagliptinem) na postprandiální stav [49, 50]. Podle nich je zesílena mobilizace lipidů postprandiálně a naopak snížena postprandiální triacylglycerolémie, ta patrně jako důsledek komplexního efektu inkretinů. Nicméně 4 týdny terapie vildagliptinem neměly opět žádný vliv na hodnoty lipidů nalačno ve srovnání s placebem. Výsledky klinických studií neprokazují vliv gliptinů na lipidy. Zaznamenané absolutní rozdíly po léčbě jsou inkonzistentní a neliší se od změn po podání placeba. Tento závěr platí pro sitagliptin i vildagliptin.
Vliv inhibitorů DPP-4 na kardiovaskulární riziko
Dlouhodobé klinické mortalitní studie s gliptiny nemohly být doposud provedeny s ohledem na délku doby, která je k realizaci těchto studií potřeba. O vlivu gliptinů na kardiovaskulární morbiditu nebo mortalitu tak můžeme pouze spekulovat. Gliptiny nezvyšují riziko hypoglykemie (výjimkou je kombinace se sekretagogy, kde však za zvýšení rizika hypoglykemie není zodpovědný gliptin, ale zlepšení kompenzace a vlastnosti sekretagog). Všechny analýzy velkých klinických studií provedené v poslední době ve vztahu k výsledku studie ACCORD [51] jednoznačně definují hypoglykemii jako rizikový faktor mortality. Na tomto závěru se shodli i diabetologové a kardiologové v USA [52]. V této souvislosti můžeme očekávat, že při léčbě gliptiny dojde ke snížení kardiovaskulární mortality jako přímého efektu zlepšení kompenzace [53].
Vedle přínosu zlepšení kompenzace by mohlo být ovlivněno kardiovaskulární riziko zlepšením rizikových faktorů ICHS. Vliv gliptinů na celkový a LDL cholesterol je nekonstatní, v průměru se neliší od placeba, o vlivu na krevní tlak existuje velmi málo informací. Jsou zaznamenány poklesy krevního tlaku při léčbě sitagliptinem [54] i vildagliptinem [41], nicméně ve většině klinických studií není změna hodnot krevního tlaku explicitně vyjádřena. Na teoretické a experimentální úrovni se diskutuje ovlivnění systému renin-angiotenzin [55] a možné zvýšení rizika vzniku angioneurotického edému při léčbě inhibitory angiotenzin konvertujícího enzymu [56]. Vliv na tělesnou hmotnost je popisován jako váhově neutrální [16]. Spekuluje se o přímém vlivu GLP-1 na kardiomyocyty.
Celkově tedy můžeme uzavřít, že na základě stávajících informací lze předpokládat, že terapie gliptiny může být z hlediska ovlivnění kardiovaskulárního rizika spíše pozitivní (ve srovnání s ostatními antidiabetiky, s výhodou jako součást terapie ovlivňující kardiovaskulární riziko) [57]. Nicméně pro vyjádření jakéhokoliv jednoznačného soudu není v současnosti k dispozici dostatek relevantních dat.
Závěr
Podle dosavadních klinických studií a zkušeností z běžné klinické praxe je zřejmé, že gliptiny jsou významným obohacením pro terapii diabetu 2. typu. Účinek na zlepšení kompenzace je v zásadě shodný s doposud užívanými perorálními antidiabetiky, přitom z hlediska rizika hypoglykemie se jeví jako velmi bezpečné. Jejich místo v léčbě je třeba odvodit od mechanismu účinku a výsledků klinických studií. Je prokázán synergický efekt s metforminem, proto je jejich primární místo v kombinaci právě s metforminem. Vlastním efektorem je zejména zlepšení sekrece inzulinu prostřednictvím zvýšení koncentrace GLP-1, proto budou účinnější u pacientů s krátkou dobou trvání diabetu, jelikož sekreční potenciál ubývá s délkou trvání diabetu 2. typu. Klinický účinek gliptinů je důsledkem inhibice DPP-4, jejich klinická efektivita proto musí být nutně stejná, pokud je inhibice DPP-4 srovnatelná. Odlišení jednotlivých gliptinů může být v případných nežádoucích účincích, dávkování, ale nemohou se lišit u stejných pacientů v klinickém efektu na zlepšení kompenzace. Výsledky klinických studií neprokazují relevantní a konstatní vliv na sérové lipidy ve srovnání s placebem.
Z klinického hlediska je důležité, že gliptiny nemá smysl podávat jako náhradu jiného perorálního antidiabetika, ale naopak jako další zintenzivnění stávající léčby. Výjimkou může být náhrada sulfonylurey k zamezení hypoglykemií. Další klinické studie a praktické zkušenosti zpřesní indikace pro dosažení maximálního efektu. I se současnými poznatky je však možné vybrat ty pacienty, kteří budou mít největší prospěch z léčby gliptiny – významné zlepšení kompenzace bez zvýšení rizika hypoglykemie.
Seznam použité literatury
- [1] D'Alessio DA, Vahl TP. Glucagon-like peptid 1: evolution of an incretin into a treatment for diabetes. Am J Physiol Endocrinol Metab 2004; 286: E882–E890.
- [2] Kvapil M. Perušičová J. Postprandiální glykémie. Triton, Praha; 2006.
- [3] Ahrén B. Gut peptides and Type 2 diabetes mellitus treatment. Curr Diab Rep 2003; 3: 365–372.
- [4] Nauck M, Stöckmann F, Ebert R, Creutzfeldt W, et al. Reduced incretin effect in Type 2 (non-insulin-dependent) diabetes. Diabetologia 1986; 29: 46–52.
- [5] Davis SN, Johns D, Maggs D, et al. Exploring the substitution of exenatide for insulin in patients with type 2 diabetes treated with insulin in combination with oral antidiabetes agents. Diabetes Care 2007; 30: 2767–2772.
- [6] Heine RJ, Van Gaal LF, Johns D, et al. Exenatid versus insulin glargine in patients with suboptimally controlled Type 2 diabetes: a randomized trial. Ann Intern Med 2005; 143: 559–569.
- [7] Nelson P, Poon T, Guan X, et al. The incretin mimetic exenatid as a monotherapy in patients with type 2 diabetes. Diabetes Technol Ther 2007; 9: 317–326.
- [8] De Meester I, Durinx C, Bal G, et al. Natural substrate of dipeptydyl peptidase IV. Adv Exp Med Biol 2000; 477: 67–87.
- [9] Demuth HU, McIntosh CH, Pederson RA. Type 2 diabetes–therapy with dipeptidyl peptidase IV inhibitors. Biochim Biophys Acta 2005; 1751: 33–44.
- [10] SPC sitagliptin 2009. http: //www.emea.europa.eu/humandocs/Humans/EPAR/januvia/januvia.htm
- [11] Karasik A, Aschner P, Katzeff H, et al. Sitagliptin, a DPP-4 inhibitor for the treatment of patients with type 2 diabetes: a review of recent clinical trials. Curr Med Res Opin 2008; 24: 489–496.
- [12] SPC vildagliptin 2009. http: //www.emea.europa.eu/humandocs/Humans/EPAR/galvus/galvus.htm
- [13] Charbonnel B, Karasik A, Liu J, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing metformin therapy in patients with Type 2 diabetes inadequately controlled with metformin alone. Diabetes Care 2006; 29: 2638–2643.
- [14] Goldstein BJ, Feinglos MN, Lunceford JK, et al. Effect of Initial Combination Therapy With Sitagliptin, a Dipeptidyl Peptidase-4 Inhibitor, and Metformin on Glycemic Control in Patiens With Type 2 Diabetes. Diabetes Care 2007; 30: 1979–1987.
- [15] Pan C, Yang W, Barona JP, et al. Comparison of vildagliptin and acarbose monotherapy in patients with Type 2 diabetes: a 24-week, double-blind, randomized trial. Diabet Med 2008; 25: 435–441.
- [16] Amori RE, Lau J, Pittas AG. Efficacy and Safety of Incretin Therapy in Type 2 Diabetes: Systematic Review and Meta-analysis. JAMA 2007; 298: 194–206.
- [17] Richter B, Bandeira-Echtler E, Bergerhoff K, Lerch C. Emerging role of dipeptidyl peptidase-4 inhibitors in the management of type 2 diabetes. Vasc Health Risk Manag 2008; 4: 753–768.
- [18] Dejager S, Razac S, Foley JE, Schweizer A. Vildagliptin in drug-naive patients with Type 2 diabetes: a 24-week, double-blind, randomized, placebo-controlled, multiple-dose study. Horm Metab Res 2007; 39: 218–223.
- [19] Nauck MA, Meininger G, Sheng D, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, compared with the sulfonylurea, glipizide, in patients with type 2 diabetes inadequately controlled on metformin alone. A randomized, double-blind, non-inferiority trial. Diabetes Obes Metab 2007; 9: 194–205.
- [20] Nonaka K, Kakikawa T, Sato A, et al. Efficacy and safety sitagliptin monotherapy in Japanese patients with type 2 diabetes. Diabetes Res Clin Pract 2008; 79: 291–298.
- [21] Raz I, Hanefeld M, Xu L, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy in patients with Type 2 diabetes mellitus. Diabetologia 2006; 49: 2564–2571.
- [22] Gilbert MP, Pratley RE. Efficacy and Safety of in-cretin-based therapies in patients with type 2 diabetes mellitus. Am J Med 2009; 122: S11–S24.
- [23] Topp GP, et al. Differences in Reported Efficacy between Oral Anti-Hyperglycemic Agents Largely Reflect Differences in Baseline A1C. Diabetes 2008; 1(suppl.1): A436–A437.
- [24] Aschner P, Kipnes MS, Lunceford JK, et al. Effect of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy on glycemic control in patients with Type 2 diabetes. Diabetes Care 2006; 29: 2632–2637.
- [25] Rosenstock J, Brazg R, Andryuk PJ, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing pioglitazone therapy in patients with type 2 diabetes; a 24-week, multicenter, randomized, double-blind, placebo-controlled, parallel-group study. Clin Ther 2006; 28: 1556–1568.
- [26] Scott R, Wu M, Sanchez M, Stein P. Efficacy and tolerability of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy over 12 weeks in patients with type 2 diabetes. Int J Clin Pract 2007; 61: 171–180.
- [27] He YL, Serra D, Wang Y, et al. Pharmacokinetics and Pharmacodynamics of Vildagliptin in Patiens with Type 2 Diabetes Mellitus. Clin Pharmacokinet 2007; 46: 577–588.
- [28] Herman GA, Bergman A, Liu F, et al. Pharmacokinetics and Pharmacodynamic Effects of the Oral DPP-4 Inhibitor Sitagliptin in Model-Aged Obese Objects. J Clin Pharmacol 2006; 46: 876–886.
- [29] Hu P, Yin Q, Deckert F, et al. Pharmacokinetics and Pharmacodynamics of Vildagliptin in Healthy Chinese Volunteers. J Clin Pharmacol 2009; 49: 39–49.
- [30] Kikuchi M, Abe N, Kato M, et al. Vildagliptin dose-dependently improves glycemic control in Japanese patients with type 2 diabetes mellitus. Diabetes Res Clin Pract 2009; 83: 233–240.
- [31] Pi-Sunyer FX, Schweizer A, Mills D, Dejager S. et al. Efficacy and tolerability of vildagliptin monotherapy in drug-naive patients with Type 2 diabetes. Diabetes Res Clin Pract 2007; 76: 132–138.
- [32] Scherbaum WA, Schweizer A, Mari A, et al. Efficacy and tolerability of vildagliptin in drug-naive patients with type 2 diabetes and mild hyperglycaemia. Diabetes Obes Metab 2008; 10: 675–682.
- [33] Ristic S, Byiers S, Foley J, Holmes D. Improved Glycaemic control with dipeptidyl peptidase-4 inhibitor in patients with type 2 diabetes: vildagliptin (LAF237). Diabetes Obes Metab 2005; 7: 692–698.
- [34] Mohan V, Yang W, Son HY, et al. Efficacy and safety of sitagliptin in the treatment of patients with type 2 diabetes in China, India, Korea. Diabetes Res Clin Pract 2009; 83: 106–116.
- [35] Hanefeld M, Herman GA, Wu M, et al. Once-daily sitagliptin a dipeptidyl peptidase-4 inhibitor, for the treatment of patiens with type 2 diabetes. Curr Med Res Opin 2007; 23: 1329–1339.
- [36] Garber AJ, Schweizer A, Baron MA, et al. Vildagliptin in combination with pioglitazone improves glycaemic control in patients with type 2 diabetes failing thiazolidinedione monotherapy: a randomized, placebo-controlled study. Diabetes Obes Metab 2007; 166–174.
- [37] Garber AJ, Foley JE, Banerji MA, et al. Effects of vildagliptin on glucose control in patients with type 2 diabetes inadequately controlled with a sulphonylurea. Diabetes Obes Metab 2008; 10: 1047–1056.
- [38] Rosenstock J, Kim SW, Baron MA, et al. Efficacy and tolerability of initial combination therapy with vildagliptin and pioglitazone compared with component monotherapy in patients with Type 2 diabetes. Diabetes Obes Metab 2007; 9: 175–185.
- [39] Fonseca V, Schweizer A, Albrecht D, et al. Addition of vildagliptin to insulin improves glycaemic control in type 2 diabetes. Diabetologia 2007; 50: 1148–1155.
- [40] Bosi E, Camisasca RP, Collober C, et al. Effects of vildagliptin on glucose control over 24 weeks in patients with Type 2 diabetes inadequately controlled with metformin. Diabetes Care 2007; 30: 890–895.
- [41] Schweizer A, Couturier A, Foley JE, Dejager S. Comparison between vildagliptin and metformin to sustain reductions in HbA1c over 1 year in drug-naive patients with Type 2 diabetes. Diabet Med 2007; 24: 955–961.
- [42] Pratley RE, Rosenstock J, Pi-Sunyer FX, et al. Management of Type 2 Diabetes in Treatment-Naive Elderly Patients: benefits and risks of vildagliptin monotherapy. Diabetes Care 2007; 30: 3017–3022.
- [43] Hermansen K, Kipnes M, Luo E, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, in patients with type 2 diabetes mellitus inadequately controlled on glimepiride alone or on glimepiride and metformin. Diabetes Obes Metab 2007; 9: 733–745.
- [44] Raz I, Chen Y, Wu M, et al. Efficacy and safety of sitagliptin added to ongoing metformin therapy with type 2 diabetes. Curr Med Res Opin 2008; 24: 537–550.
- [45] Yki-Järvinen H. Thiazolidinediones. N Engl J Med 2004; 351: 1106–1117.
- [46] Rosenstock J, Baron MA, Dejager S, et al. Comparison of vildagliptin and rosiglitazone monotherapy in patients with Type 2 diabetes. Diabetes Care 2007; 30: 217–223.
- [47] Bolli G, Dotta F, Rochotte E, et al. Efficacy and tolerability of vildagliptin vs. pioglitazone when added to metformin: a 24-week, randomized, double-blind study. Diabetes Obes Metab 2008; 10: 82–90.
- [48] Scott R, Loeys T, Davies MJ, et al. Efficacy and safety of sitagliptin when added to ongoing metformin therapy in patients with type 2 diabetes. Diabetes Obes Metab 2008; 10: 959–969.
- [49] Boschmann M, Engeli S, Dobberstein K, et al. Dipeptidyl-Peptidase-IV Inhibition Augments Postprandial Lipid Mobilization and Oxidation in Type 2 Diabetic Patients. J Clin Endocrinol Metab 2009; 94: 846–852.
- [50] Matikainen N, Mänttäri S, Schweizer A, et al. Vildagliptin therapy reduces postprandial intestinal triglyceriderich lipoprotein particles in patients with type 2 diabetes. Diabetologia 2006; 49: 2049–2057.
- [51] Gerstein HC, Riddle MC, Kendall DM, et al. Glycemia Treatment Strategies in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) Trial. Am J Cardiol 2007; 99: 34i–43i.
- [52] Skyler JS, Bergenstal R, Bonow RO, et al. Intensive Glycemic Control and the Prevention of Cardiovascular Events: Implications of the ACCORD, ADVANCE, and VA Diabetes Trials. Diabetes Care, 2009; 32: 187–192.
- [53] Ray KK, Seshasai SR, Wijesuriya S, et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomized controlled trials. Lancet 2009; 373: 1765–1772.
- [54] Mistry GC, Maes AL, Lasseter KC, et al. Effect of sitagliptin, a dipeptidyl peptidase-4 inhibitor, on blood pressure in nondiabetic patients with mild to moderate hypertension. J Clin Pharmacol 2008; 48: 592–598.
- [55] Jackson EK, Mi Z. Sitagliptin Augments Sympathetic Enhancement of the Renovascular Effects of Angiotensin II In Genetic Hypertension. Hypertension 2008; 51: 1637–1642.
- [56] Brown NJ, Byiers S, Carr D, et al. Dipeptidyl Peptidase-IV Inhibitor Use Associated With Increased Risk of ACE Inhibitor-Associated Angioedema. Hypertension 2009 [Epub ahead of print].
- [57] Gavin JR 3rd. Reducing global cardiovascular risk in patients with type 2 diabetes mellitus. J Am Osteopath Assoc 2008; 108(suppl. 3): S14–S19.