Poruchy tvorby růstového hormonu u dospělých a možnosti jejich léčby
Růstový hormon je polypeptid produkovaný somatotropními buňkami předního laloku hypofýzy. Zásadním způsobem ovlivňuje lineární růst u dětí a má řadu dalších, především metabolických účinků. Jeho nedostatek se v dospělosti projevuje abnormálním tělesným složením s nadbytkem tělesného tuku a snížením beztukové tělesné hmoty, redukovanou kostní hmotou a sníženou svalovou výkonností, dále některými kardiovaskulárními a psychickými změnami se zhoršenou kvalitou života. Součástí tohoto převážně metabolického syndromu jsou nepříznivé změny lipidového spektra, snížená inzulinová senzitivita a prokoagulační stav, jež jsou spojeny s předčasnou aterosklerózou. Syndrom nedostatku růstového hormonu u dospělých je dnes dobře definovaným syndromem, který představuje závažný endokrinní deficit a může se podílet na zvýšené morbiditě a mortalitě postižených osob. Substituční léčba růstovým hormonem se podává za jasně stanovených kritérií a vede ke zlepšení nebo k úpravě klinického stavu u těchto nemocných.
![Obr. 1 Hormony adenohypofýzy; volně podle [16] – Harris, 1996.](https://www.remedia.cz/photo-a-27996---.jpg) Růstový hormon (GH) je adenohypofyzární peptid o 191 aminokyselinách, který stimuluje jaterní i lokární produkci a uvolňování inzulinu podobných růstových faktorů (především IGF-I) do systémové cirkulace; v řadě procesů vyvíjí i vlastní přímé účinky, především proteoanabolické, lipolytické, antinatriuretické, moduluje sekreci inzulinu a sacharidový metabolismus, má protektivní vliv na kardiovaskulární systém a účinky neurotropní. Prostřednictvím IGF-I vede ke stimulaci angiogeneze, steroidogeneze a spermatogeneze, stimuluje růst a zrání ovariálních folikulů a vyznačuje se dalšími účinky. Ovlivňuje zásadně lineární růst u dětí a metabolismus a tělesné složení u dospělých (obr. 1). Je regulován komplexem zpětných vazeb
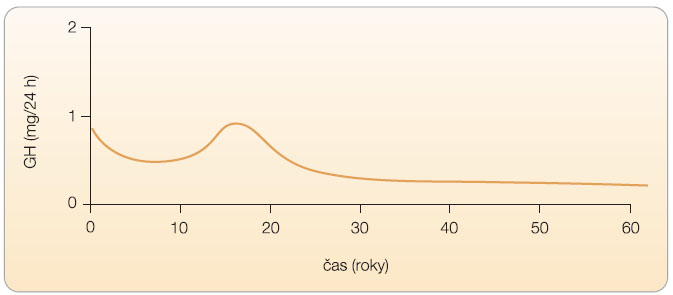
Růstový hormon (GH) je adenohypofyzární peptid o 191 aminokyselinách, který stimuluje jaterní i lokární produkci a uvolňování inzulinu podobných růstových faktorů (především IGF-I) do systémové cirkulace; v řadě procesů vyvíjí i vlastní přímé účinky, především proteoanabolické, lipolytické, antinatriuretické, moduluje sekreci inzulinu a sacharidový metabolismus, má protektivní vliv na kardiovaskulární systém a účinky neurotropní. Prostřednictvím IGF-I vede ke stimulaci angiogeneze, steroidogeneze a spermatogeneze, stimuluje růst a zrání ovariálních folikulů a vyznačuje se dalšími účinky. Ovlivňuje zásadně lineární růst u dětí a metabolismus a tělesné složení u dospělých (obr. 1). Je regulován komplexem zpětných vazeb ![Obr. 2 Biologické účinky růstového hormonu (GH) a inzulinu podobného růstového faktoru (IGF-I); volně podle [17] – Nordiscience, 2003.](https://www.remedia.cz/photo-a-27997---.jpg) zahrnujících GH, IGF a vazebné proteiny pro IGF (především IGFBP-3), z oblasti hypotalamu je jeho sekrece regulována GH releasing hormonem (GHRH, somatoliberin) a somatostatinem (SMS), viz obr. 2. GH je secernován v pulsech (6–10 za den), sekrece vykazuje diurnální rytmus s největší amplitudou pulsů v noci a je závislá na věku (graf 1 a 2). GH působí prostřednictvím transmembránových receptorů na plazmatické membráně hepatocytů, buněk myokardu, adipocytů, fibroblastů, v ledvinách aj. Naproti tomu hladiny IGF-I v séru jsou relativně konstantní. Jaterní produkce IGF je řízena především GH, ale ovlivňuje ji i nutriční stav, fyzická aktivita, inzulin, glukagon, pohlavní hormony, tyroxin aj. IGF-I bezprostředně ovlivňuje lidský růst v dětství a obecně stimuluje buněčné funkce spojené s výstavbou organismu, má účinky proteoanabolické, lipolytické.
zahrnujících GH, IGF a vazebné proteiny pro IGF (především IGFBP-3), z oblasti hypotalamu je jeho sekrece regulována GH releasing hormonem (GHRH, somatoliberin) a somatostatinem (SMS), viz obr. 2. GH je secernován v pulsech (6–10 za den), sekrece vykazuje diurnální rytmus s největší amplitudou pulsů v noci a je závislá na věku (graf 1 a 2). GH působí prostřednictvím transmembránových receptorů na plazmatické membráně hepatocytů, buněk myokardu, adipocytů, fibroblastů, v ledvinách aj. Naproti tomu hladiny IGF-I v séru jsou relativně konstantní. Jaterní produkce IGF je řízena především GH, ale ovlivňuje ji i nutriční stav, fyzická aktivita, inzulin, glukagon, pohlavní hormony, tyroxin aj. IGF-I bezprostředně ovlivňuje lidský růst v dětství a obecně stimuluje buněčné funkce spojené s výstavbou organismu, má účinky proteoanabolické, lipolytické.
 Již od začátku minulého století bylo známo, že růstový hormon má zásadní vliv na normální růst a vývoj dítěte do dospělosti. První zkušenosti se substitučním podáváním přípravku lidského GH se datují do doby asi před padesáti lety. Jednalo se o GH získávaný extrakcí z kadaverózních hypofýz, který byl v roce 1985 nahrazen syntetickým lidským GH, produkovaným rekombinantní DNA technologií. Později byl popsán syndrom deficitu růstového hormonu u dospělých (growth hormone deficiency in adults,
Již od začátku minulého století bylo známo, že růstový hormon má zásadní vliv na normální růst a vývoj dítěte do dospělosti. První zkušenosti se substitučním podáváním přípravku lidského GH se datují do doby asi před padesáti lety. Jednalo se o GH získávaný extrakcí z kadaverózních hypofýz, který byl v roce 1985 nahrazen syntetickým lidským GH, produkovaným rekombinantní DNA technologií. Později byl popsán syndrom deficitu růstového hormonu u dospělých (growth hormone deficiency in adults, 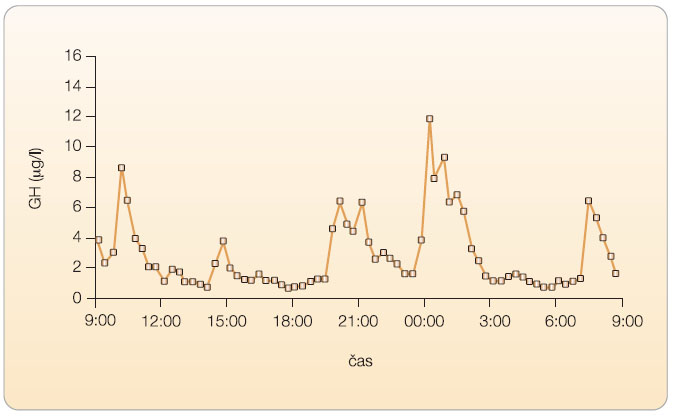 GHDA) a s ním spojená rizika [1, 2]. Byl definován začátkem devadesátých let 20. století jako klinický syndrom zahrnující abnormální tělesné složení s nadbytkem tělesného tuku (fat mass, FM) a snížením beztukové tělesné hmoty (lean body mass, LBM), redukovanou kostní hmotou a sníženou svalovou výkonností, dále některými kardiovaskulárními změnami, psychickými změnami a zhoršenou kvalitou života. Součástí tohoto převážně metabolického syndromu jsou nepříznivé změny lipidového spektra, snížená inzulinová senzitivita [2–4] a prokoagulační stav, které jsou spojeny s předčasnou aterosklerózou [1, 2]. GHDA tak představuje závažný endokrinní deficit, který se může podílet na zvýšené morbiditě a mortalitě postižených osob [2, 5].
GHDA) a s ním spojená rizika [1, 2]. Byl definován začátkem devadesátých let 20. století jako klinický syndrom zahrnující abnormální tělesné složení s nadbytkem tělesného tuku (fat mass, FM) a snížením beztukové tělesné hmoty (lean body mass, LBM), redukovanou kostní hmotou a sníženou svalovou výkonností, dále některými kardiovaskulárními změnami, psychickými změnami a zhoršenou kvalitou života. Součástí tohoto převážně metabolického syndromu jsou nepříznivé změny lipidového spektra, snížená inzulinová senzitivita [2–4] a prokoagulační stav, které jsou spojeny s předčasnou aterosklerózou [1, 2]. GHDA tak představuje závažný endokrinní deficit, který se může podílet na zvýšené morbiditě a mortalitě postižených osob [2, 5].
Příčinou vzniku deficitu GH u dospělých jsou nejčastěji adenomy hypofýzy, ale i jiné nádory selární a supraselární oblasti, jako je kraniofaryngeom, gliomy, metastázy, meningeomy aj., dále infiltrativní procesy – histiocytóza nebo sarkoidóza, stavy po radioterapii mozku, posttraumatické stavy, cévní příčiny (ischemická nekróza či krvácení, Sheehanův syndrom, vaskulitidy), infekce nebo autoimunitní záněty. Genetické defekty se projeví již v dětském věku. Nedostatek GH se může vyskytovat jako izolovaný deficit, u dospělých osob je častěji sdružený s deficitem dalších hormonů adenohypofýzy.
K substituční léčbě růstovým hormonem jsou indikováni nemocní s hypotalamo-hypofyzárním postižením vzniklým v dospělosti (AO, adult onset) nebo v dětství (CO, childhood onset) a podmínkou zavedení substituce GH u dospělých je biochemický průkaz těžkého deficitu GH a klinický obraz deficitu GH. K biochemické diagnostice se využívají většinou dynamické testy, nejspolehlivější je inzulinový toleranční test (ITT), kdy při dosažené hypoglykemii s hodnotami nižšími než 2,2 mmol/l nedojde k vzestupu koncentrace GH nad 3 mg/l. V případě kontraindikace ITT se užívá nejčastěji test s argininem a GHRH. Při diagnóze pomůže i stanovení hladiny IGF-I, podle možností též určení hladiny IGFBP-3.
První studie o účincích substituce GH u dospělých začaly koncem osmdesátých let. Růstový hormon a příbuzné látky včetně IGF-I a vazebných proteinů jsou v současné endokrinologii stále intenzivně zkoumány. V řadě prací byl prokázán pozitivní vliv léčby růstovým hormonem na tělesné složení [6, 7], změny kardiovaskulárního aparátu [5, 8, 9], kostní změny [1, 10], kvalitu života a na další parametry, hlavně metabolické [2]. Je známo, že růstový hormon je účinný anabolický a lipolytický hormon s řadou metabolických funkcí. Jeho nedostatek je spojen se zmnožením tukové tkáně, snížením celkové tělesné tekutiny a úbytkem svalové hmoty [1, 7, 11]. U neléčených osob s GHD bylo prokázáno o 7 % vyšší množství tuku než u zdravých osob a tomu odpovídalo i snížení netukové tělesné hmoty [12–14]. Zvýšený obsah tuku je především v abdominální oblasti a je doprovázen úbytkem svalové tkáně se snížením svalové síly, fyzického výkonu a tolerance zátěže. Redukce objemu extracelulární tekutiny se sníženým obsahem sodíku a sníženým prokrvením svalů se také může podílet na snížené fyzické výkonnosti. V některých studiích bylo prokázáno, že změny tělesného složení jsou výraznější u osob s deficitem GH vzniklým v dětství. Podle literatury dlouhodobá substituční léčba GH může normalizovat nebo alespoň zlepšit tělesné složení [2, 11].
Dobře prozkoumanou oblastí je snížení kostní denzity (BMD) u GHD. Bylo prokázáno, že dospělí s deficitem růstového hormonu mají sníženou kostní hmotu a vyšší riziko fraktur. Osoby s deficitem růstového hormonu vzniklým v dětství (CO) mají osteopenii způsobenou nedostatečnou mineralizací kostí v dětství, v dospívání a ve fázi dozrávání skeletu po ukončení růstu s nízkou dosaženou vrcholovou kostní hmotou (peak bone mass). Hodnoty BMD jsou u 20–30 % nemocných nižší než -2SD oproti zdravým vrstevníkům [1, 10]. U osob, kde vznikl deficit GH až v dospělosti (AO), bývá sice osteopenie častým nálezem, vyskytuje se asi u 19 % dospělých této skupiny, ale tento stav je komplikován jednak heterogenitou nemocných, častějšími vícečetnými endokrinními deficity a přidruženými nemocemi. Zdá se, že u této skupiny se jedná především o stav sníženého kostního obratu [10, 15]. Důležitá je adekvátní léčba ostatních hormonálních deficitů, pokud jsou prokázány – tedy substituce glukokortikoidy, pohlavními steroidy a hormony štítné žlázy. Tato terapie má vliv nejen na kostní obrat, ale i na další metabolické parametry. Podle některých studií se udává nárůst kostní denzity po zavedení substituční terapie průměrně o 2 % ročně. Významnější je tento efekt u pacientů s nedostakem GH vzniklým v dětství [1, 11]. V některých studiích je popisováno zvýšení kostního obratu v počátcích léčby růstovým hormonem s přechodným poklesem kostní denzity.
Nepříznivé změny hladin lipidů se vyskytují u více než 50 % osob s GHDA a mohou se podílet na jejich zvýšené kardiovaskulární morbiditě a mortalitě. Více jsou ohroženi pacienti s deficitem vzniklým v dospělosti (AO), a to zvláště ženy [5, 9]. Typické jsou změny hladin celkového a LDL cholesterolu se snížením hladiny HDL, vysoké hladiny triacylglycerolů (až u 68 % osob) a apolipoproteinu B [2, 3]. Jedním z faktorů, který může modifikovat metabolismus lipidů, je viscerální akumulace tuku, který je metabolicky aktivnější. Podle některých studií vykazují pozitivní korelaci s oxidací tuků právě ukazatele abdominální obezity (obvod pasu). Substituční terapie u osob s GHDA vede ke zlepšení hladin lipidů, hlavně celkového a LDL cholesterolu. Byla pozorována lepší odpověď hladiny IGF-I na léčbu GH u mužů než u žen. Některé práce prokazují poruchu inzulinové senzitivity, která může souviset i se změnami tělesného složení.
Nemocní s GHD mají až dvakrát vyšší mortalitu na kardiovaskulární nemoci oproti věkově srovnatelným kontrolním osobám především v důsledku předčasné aterosklerózy. Může se na ní podílet jednak rizikový metabolický syndrom, zvýšená prokoagulační aktivita (zvýšené hladiny PAI-1 a fibrinogenu), vyšší aktivita sympatiku, porucha endotelové funkce i úbytek hmoty myokardu se snížením funkce levé komory s tendencí k arytmiím.
Substituční léčbu růstovým hormonem zahajujeme obvykle malými dávkami hormonu podanými subkutánně na noc. Počáteční dávka je 0,15–0,30 mg/den, (tj. 0,45–0,90 IU/den) a dávku titrujeme podle klinického stavu a hladin IGF-I pro daný věk. Průměrná substituční dávka je u dospělých většinou do 1 mg/den (tj. do 3 IU/den). Vyšší dávky je obvykle nutno podávat u premenopauzálních žen, dávka klesá s věkem a bývá nižší u obézních. V České republice působí v současnosti 7 center pro terapii GH u dospělých. Tato léčba je od roku 1999 plně hrazena zdravotními pojišťovnami.
Z nežádoucích účinků jsou v literatuře nejčastěji uváděny: sklon k retenci tekutin s otoky, bolesti kloubů a svalů, vzácně benigní intrakraniální hypertenze. Kontraindikací terapie GH jsou aktivní malignity, i když v případě substitučních dávek růstového hormonu nebyl prokázán zvýšený výskyt nádorů. Léčba GH je kontraindikována u proliferativní diabetické retinopatie. Řada studií prokazuje, že některé nežádoucí účinky léčby GH jsou závislé na dávce a ustupují po jejím snížení. Často je nutná individuální úprava dávky podle věku, pohlaví nemocného a klinického stavu tak, aby bylo dosaženo co nejlepšího efektu léčby [5]. Růstový hormon je látka se širokým endokrinologicko-metabolickým vlivem. Jeho deficit závažně zvyšuje morbiditu a mortalitu postižených osob. Deficit růstového hormonu je dnes dobře definovaným syndromem a existuje mezinárodní konsenzus na jeho diagnostiku a léčbu.
Seznam použité literatury
- [1] Attanasio AF, Lamberts SWJ, Matranga AMC, et al. Adult growth hormone (GH)-deficient patients demonstrate heterogeneity between childhood onset and adult onset before and during human GH treatment. J Clin Endocrinol Metab 1997; 82: 82–88.
- [2] Amato G, Capella C, Fazio S, et al. Body composition, bone metabolism, and heart structure and function in growth hormone (GH)-deficient adults before and after GH replacement therapy at low doses. J. Clin Endocrinol Metab 1993; 77: 1671–1676.
- [3] Arwert LI, Ross JC, Lips P, et al. Effects of 10 years of growth hormone (GH) replacement therapy in adult GH-deficient men. Clin Endocrinol 2005; 63: 310–316.
- [4] Murray RD, Columb B, Adams JE, Shalet SM. Low bone mas sis an frequent feature of the adult GH deficiency syndrome in middle-age and the elderly. J Clin Endocrinol Metab 2004; 89: 1124–1130.
- [5] Patel MBR, Arden NK, Masterson LM, et al. Investigating the role of growth hormone-insulin-like growth factor (GH-IGF) axis as a determinant of male bone mineral density (BMD). Bone 2005, prelim. e-publ.
- [6] Fernholm R, Bramnert M, Haag E, et al. Growth hormone replacement therapy improves body composition and increases bone metabolism in elderly patients with pituitary disease. J Clin Endocrinol Metab 2000; 85: 4104–4112.
- [7] Nilsson AG. Effects of growth hormone replacement therapy on bone markers and bone mineral density in growth hormone-deficient adults. Horm Res 2000; 54: 52–57.
- [8] Drake WM, Howell SJ, Monson JP, et al. Optimising GH therapy in adults and children. Endocrin Rev 2001; 22: 425–450.
- [9] Shalet SM, Shavrikova E, Cromer M. Effects of GH treatment on bone in postpubertal GH-deficient patients: a 2-year randomized, controlled, dose-ranging study. J Clin Endocrinol Metab 2003; 88: 4124–4129.
- [10] Laron Z, Wang XL. Growth hormone, lipoprotein(a) and cardiovascular disease. Eur Heart J 1998; 19: 204–206.
- [11] Al-Shoumer KAS, Gray R, Anyaoku V, et al. Effects of four years treatment with biosynthetic human growth hormone (GH) on glucose homeostasis, insulin secretion and lipid metabolism in GH-deficient adults. Clin Endocrinol 1998; 48: 795–802.
- [12] Colao A, di Somma C, Pivinello R, et al. The cardiovascular risk of adult GH deficiency improved after GH replacement therapy and worsened in untreated GHD, a 12-month prospective study. J Clin Endocrinol Metab 2002; 87: 1088–1093.
- [13] Jenšovský J, Lebl J, Christiansen JS, et al. Růstový hormon. Praha, Galén 2000: 173–244.
- [14] Klibanski A. Growth hormone and cardiovascular risk markers. Growth Hormon and IGF research 2003; 13: 109–115.
- [15] Mason P, Griffin S, Nicoue-Benglah M, et al. Impact of growth hormone (GH) treatment on cardiovascular risk factors in GH-deficient adults, a metaanalysis of blinded, randomized, placebo-controlled trials. J Clin Endocrinol Metab 2004; 89: 2192–2199.
- [16] Harris AG. The hypothalamic-pituitary axis. In: Acromegaly and Its Management. Daly AF, ed. 1996, Lippincott-Raven: Philadelphia, PA. p. 9–16.
- [17] Nordiscience, GHDA, 2003.