Poruchy tyreoidální osy u dětí a dospívajících
Souhrn:
Al Taji E. Poruchy tyreoidální osy u dětí a dospívajících. Remedia 2019; 29: 262–270.
Poruchy tyreoidální osy a zejména poruchy funkce štítné žlázy jako takové jsou u dětí a dospívajících nejčastějšími endokrinopatiemi. Článek shrnuje současné poznatky o jejich etiopatogenezi, klinickém obrazu, diagnostice a léčbě. První část je zaměřena zejména na vrozenou hypotyreózu, méně častou vrozenou hypertyreózu a na některé další klinicky významné vrozené poruchy tyreoidální osy. Další část, věnovaná získaným tyreopatiím, se zabývá především autoimunitními tyreopatiemi a přináší aktuální pohled na léčebné postupy jak u chronické lymfocytární tyreoiditidy, tak u Gravesovy–Basedowovy tyreotoxikózy. Závěrem je shrnuta základní laboratorní diferenciální diagnostika tyreoidálních nálezů a krátce připomenuta také problematika jodového deficitu.
Summary:
Al Taji E. Disorders of thyroid axis in children and adolescents. Remedia 2019; 29: 262–270.
Disorders of thyroid axis and namely disorders of thyroid gland itself belong to the most frequent endocrinopathies in children and adolescents. The article summarizes current knowledge of their pathogenesis, clinical manifestation, diagnostics and treatment. The first part is focussed on congenital hypothyroidism and more rare, nevertheless serious congenital hyperthyroids. The part of the article discussing acquired thyreopaties is focused mostly on autoimmune thyroid diseases, including the latest global knowledge of therapy of chronic lymphocytic thyroiditis as well as Graves–Basedow thyreotoxicosis. Finally, basic differential diagnostics of thyroidological laboratory findings is shown and iodine deficiency briefly mentioned.
Key words: congenital hypothyroidism, chronic lymphocytic thyroiditis,substitution therapy, Graves–Basedow thyreotoxicosis, antithyroid drug therapy, iodine deficiency, goiter.
Klasifikace poruch tyreoidální osy
Hormony štítné žlázy jsou již od prenatálního období a pak po celý život jedince zcela nezbytné pro morfogenezi, diferenciaci, růst, metabolismus a funkci všech tkání celého lidského organismu. Naprosto klíčová je adekvátní tvorba hormonů štítné žlázy a následná schopnost cílových buněk je správně využít pro optimální vývoj a růst během prenatálního a dětského období.
K poruchám tyreoidální osy řadíme tyreopatie, tj. onemocnění štítné žlázy jako takové, a dále poruchy periferního metabolismu a využití tyreoidálních hormonů a také poruchy centrální regulace štítné žlázy. Poruchy tyreoidální osy vznikající na vrozeném podkladě jsou často diagnostikovány hned v novorozeneckém období – primární vrozená hypotyreóza, díky celoplošnému novorozeneckému screeningu v ještě presymptomatickém stadiu, a novorozenecká hypertyreóza na základě klinických příznaků a/nebo anamnézy. Některé vrozené poruchy se klinicky manifestují a následně diagnostikují až později – centrální hypotyreóza, poruchy transportu, metabolismu a periferního využití tyreoidálních hormonů, příp. mírnější formy subklinické hypotyreózy vznikající na vrozeném podkladě. Příčiny vrozených poruch tyreoidální osy mohou být v některých případech exogenní, např. vliv maternální tyreopatie, jodového zásobení matky a plodu, s často tranzientním průběhem. Obvykle se ale jedná o primární morfologické a/nebo funkční postižení tyreoidální osy, mnohdy na známém monogenním podkladě. Pak lze očekávat, že porucha bude permanentní – celoživotní.
Nejčastějšími získanými poruchami tyreoidální osy jsou autoimunitní onemocnění štítné žlázy. Přestože jsou tyto nemoci klasifikovány jako získané tyreopatie, na jejich etiologii se spolu s exogenními a endogenními faktory významně podílejí genetické predispozice. Na opačných pólech tyreoidálních autoimunit stojí chronická lymfocytární tyreoiditida, způsobující převážně hypofunkci štítné žlázy, a Gravesova–Basedowova choroba jako nejčastější příčina hypertyreózy, resp. tyreotoxikózy.
Vrozené poruchy tyreoidální osy
Vrozená hypotyreóza
Vrozená hypotyreóza je nejčastější
vrozené endokrinní onemocnění s celosvětovým výskytem
1 : 2 000–3 500 novorozenců [1], v České republice
1 : 2 766 [2]. Nejčastější příčinou kongenitální
hypotyreózy je porucha prenatálního vývoje štítné žlázy,
jejímž důsledkem je tyreoidální
dysgeneze – hypoplazie, ektopie nebo atyreóza.
Příčiny dysgeneze štítné žlázy nejsou plně objasněny.
V menším procentu případů se podařilo prokázat defekty
některých transkripčních faktorů a receptoru pro TSH
(tyreostimulační hormon, tyreotropin) [3]. Druhou nejčastější
příčinou je dyshormonogeneze,
tj. porucha
biosyntézy tyreoidálních hormonů. Tyreoidální dyshormonogeneze
je převážně monogenně podmíněné onemocnění s autozomálně
recesivní dědičností způsobené mutacemi v genech pro
jodidové přenašeče, enzymatické systémy nezbytné pro
organifikaci a recirkulaci jodu (nejčastěji tyreoidální
peroxidázu) nebo genu pro tyreoglobulin [4]. Pro dyshormonogenezi je
typická neonatální struma
(obr. 1A, B).
Dysgeneze a dyshormonogeneze obvykle vedou k permanentní
hypotyreóze vyžadující celoživotní léčbu. Tranzientní
vrozená hypotyreóza může být vyvolána těžším jodovým
deficitem matky, perinatálním nadbytkem jodu nebo transplacentárně
přenesenými protilátkami inhibujícími receptor pro TSH od matky
s atrofickou formou chronické lymfocytární tyreoiditidy.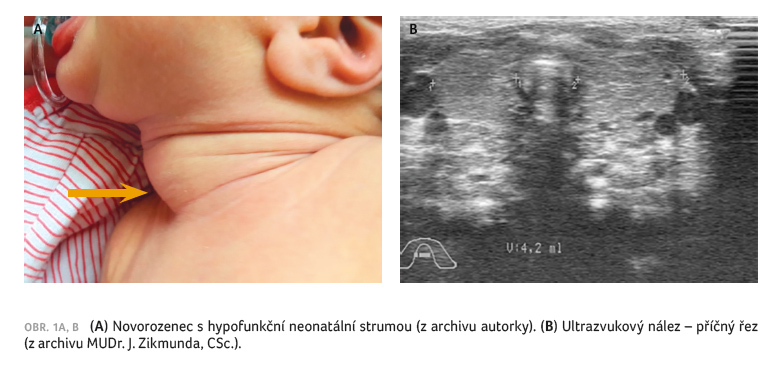
Novorozenecký screening a diagnostika
Léčba vrozené hypotyreózy
tyreoidálním extraktem byla dostupná již od konce
19. století. Zásadním negativním faktorem pro prognózu dětí
s vrozenou hypotyreózou však zůstávalo pozdní stanovení
diagnózy. In utero
je hypofunkce fetální štítné žlázy kompenzována
transplacentárním přenosem tyroxinu od matky, u novorozence
je proto klinický obraz nenápadný, obvykle bývá přítomna jen
protrahovaná novorozenecká žloutenka, příp. otevřená malá
fontanela [5]. Nápadnější
příznaky u neléčené vrozené hypotyreózy nastupují
v prvních měsících života (nezájem při krmení,
neprospívání, snížený svalový tonus, obstipace, pupeční
kýla, makroglosie, anémie, poruchy termoregulace), plně vyjádřený
klinický obraz bývá ve věku 3–6 měsíců. Před zavedením
screeningu byla diagnóza u některých dětí stanovena až
v batolecím nebo předškolním věku, kdy byl již vývoj
mozku nevratně poškozen. Důsledkem byla těžká mentální
retardace s řadou neurologických a somatických symptomů
a s poruchou sluchu – historicky tzv. sporadický
kretenismus (obr. 2) [6].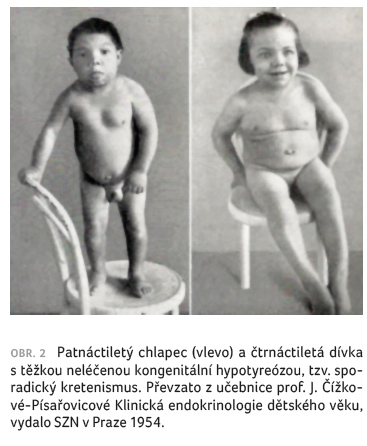
V 70. letech 20. století studie potvrdily, že na základě klinických symptomů lze v prvním měsíci života diagnózu stanovit jen u 10 % dětí a v prvních třech měsících života jen u jedné třetiny dětí. Současně ukázaly, že při zahájení substituční léčby do věku tří měsíců dosáhne až 80 % dětí IQ vyššího než 85, ale této hodnoty nebylo dosaženo při zahájení léčby po šestém měsíci života [7]. Tyto poznatky spolu s možností rutinního stanovení koncentrace TSH, stanovení hodnoty T4 (tyroxinu) ze suché krevní kapky a moderní léčby syntetickým levotyroxinem celosvětově vedly k postupnému zavedení novorozeneckého screeningu vrozené hypotyreózy.
V České republice zahájila pilotní studie profesorka Olga Hníková hned v polovině 70. let, celoplošný novorozenecký screening vrozené hypotyreózy se jí podařilo značným úsilím prosadit v roce 1985 [8]. Nejprve se prováděl stanovením koncentrace T4, od roku 1996 jsou v suché krevní kapce z vpichu do patičky hodnoceny koncentrace TSH. Překročení hranice cut off, tj. hodnoty TSH vyšší než 15 mIU/l ve 48.–72. hodině života, vyžaduje okamžité vyšetření koncentrací TSH a fT4 (volný tyroxin) z venózního vzorku krve.
Od roku 2002 funguje rescreening novorozenců ohrožených falešně negativními výsledky primárního screeningu (např. novorozenci s velmi nízkou porodní hmotností vyžadující intenzivní péči) mezi 8.–14. dnem po narození [9]. I když je v našich podmínkách naprostá většina dětí s vrozenou hypotyreózou diagnostikována v rámci novorozeneckého screeningu, na klinický obraz hypotyreózy je třeba nezapomínat. Novorozeneckým screeningem založeným na hodnocení sérové koncentrace TSH není diagnostikovatelná centrální vrozená hypotyreóza, možné jsou také případy úniku ze screeningu (děti migrantů, porod doma).
Po záchytu ve screeningu a potvrzení diagnózy na základě koncentrace žilního fT4 a TSH následují další kroky s cílem určit příčinu vrozené hypotyreózy, stanovit její závažnost (indikátorem stupně hypotyreózy in utero je zejména opoždění kostního zrání), časně diagnostikovat případné sdružené vrozené vývojové vady a odlišit permanentní a tranzientní formu (např. u přenesených maternálních autoprotilátek). Podrobnější laboratorní vyšetření zahrnuje kromě stanovení hodnot fT4 a TSH také zjištění koncentrace fT3 (volný trijodtyronin), TG (tyreoglobulin), antityreoidálních protilátek (aTSHR – proti receptoru pro TSH, aTPO – proti tyreoidální peroxidáze, ahTG – proti tyreoglobulinu) a jodurie. Ultrazvukové vyšetření štítné žlázy spolehlivě rozliší, zda je in situ přítomná štítná žláza normální velikosti, struma, nebo zda je štítná žláza hypoplastická. Pokud se ultrazvukem nepodaří štítnou žlázu in situ zobrazit, může se jednat o atyreózu, častěji je ale příčinou ektopie štítné žlázy, nejlépe diagnostikovatelná scintigrafickým vyšetřením.
Děti s vrozenou hypotyreózou mají ve srovnání s ostatní populací 2–5krát vyšší riziko sdružených vrozených vývojových vad [10]. Častější jsou srdeční vady, vady uropoetického systému, rozštěpy rtu a patra. Je proto vhodné doplnit ultrazvukové vyšetření uropoetického traktu, srdce a případně centrálního nervového systému (CNS). Žádoucí je také co nejčasnější identifikace vrozené hypotyreózy jako součásti syndromů, např. u pseudohypoparatyreózy, Downova syndromu nebo syndromické vrozené hypotyreózy při defektu transkripčních faktorů. Nejčastějším asociovaným postižením je senzorineurální porucha sluchu. Vzniká v důsledku prenatální a perinatální hypotyreózy nebo i jiných mechanismů (např. defekt pendrinu – iontového přenašeče ve štítné žláze a vnitřním uchu). Vyšetření sluchu metodou otoakustických emisí je povinné u všech dětí s vrozenou hypotyreózou ve věku do tří měsíců.
Terapie
Lékem volby k substituční léčbě
vrozené hypotyreózy jsou syntetické přípravky s levotyroxinem.
Doporučená dávka při zahájení léčby u novorozence je
10–15 μg/kg/den [11]. Tableta požadované síly nebo její část
se podává čerstvě rozdrcená v malém množství vody nebo
mateřského mléka na lžičce nebo stříkačkou v jedné
denní dávce a vždy za stejných podmínek. Striktní
požadavek podávání ráno nalačno již není v aktuálních
doporučených postupech zahrnut, nicméně u dětí je návyk
podávání levotyroxinu hned ráno nalačno 30 minut před prvním
ranním krmením, posléze před snídaní, vhodné vytvořit. Je
doporučeno preferovat originální přípravky. Je třeba se
vyvarovat tekutých forem připravovaných magistraliter a současně
nepodávat z důvodů zhoršené absorpce přípravky obsahující
železo nebo vápník. U manifestní hypotyreózy má být léčba
zahájena do 14 dnů věku dítěte [11]. Cílem léčby je co
nejrychlejší normalizace hodnot fT4 (v horní polovině normy
dle věku) a posléze TSH, jejichž koncentrace se pravidelně
sledují. Dávka se upravuje s růstem a věkem dítěte
(tab. 1).
U subklinické hypotyreózy jsou dávky individuálně
redukovány. V některých případech (např. u vrozené
hypotyreózy s normální štítnou žlázou in
situ) se po třetím roce života diagnóza
permanentní hypotyreózy potvrzuje přerušením nebo snížením
dávky substituční léčby na 3–4 týdny s následným
posouzením dynamiky TSH.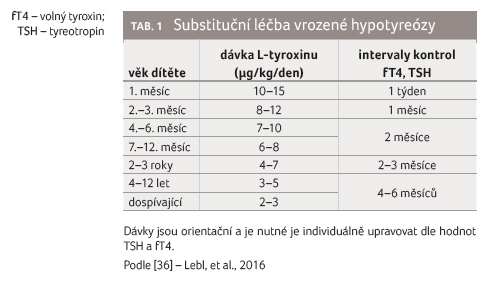
Zvýšení koncentrace TSH při zavedené substituční léčbě je nežádoucí, ukazuje na nedostatečnou kompenzaci hypotyreózy při příliš nízké substituční dávce nebo nepravidelném užívání levotyroxinu. V léčbě je nutné se vyvarovat i předávkování a déletrvající suprese TSH s rizikem urychlení kostního zrání, negativního vlivu na kostní denzitu a nejspíše i na neurokognitivní vývoj. Kromě monitorace hormonálních koncentrací jsou součástí dispenzarizace pravidelné ultrazvukové kontroly štítné žlázy (zejména u dyshormonogeneze), sledování somatického (růstová a hmotnostní křivka, růstová rychlost, prořezávání a výměna chrupu, pubertální vývoj, případně kostní věk) a psychomotorického vývoje dítěte [11].
Časná a adekvátní substituční terapie spolu s dobrou spoluprací rodiny je hlavním limitujícím faktorem psychomotorického, mentálního a somatického vývoje většiny dětí s vrozenou hypotyreózou. Více než 90 % těchto dětí se dnes vyvíjí a roste srovnatelně se zdravým sourozencem [12,13].
Z globálního hlediska zůstává v péči o děti s vrozenou hypotyreózou nadále hlavním cílem zavedení celoplošného novorozeneckého screeningu ve všech zemích. Screening vrozené hypotyreózy je totiž celosvětově realizován jen u 29,3 % novorozenců: 84,2 % narozených v Evropě, 82,3 % narozených v Americe, 37,8 % narozených v Africe a Oceánii a 24,4 % narozených v Asii. Každoročně tak má šanci na případnou časnou diagnózu a léčbu jen asi 37 ze 127 milionů narozených dětí. Mezi 90 miliony dětí, které tuto šanci nemají, je bohužel i ve 21. století (při incidenci vrozené hypotyreózy 1 : 3 000) kolem 30 000 dětí s pozdně léčenou nebo vůbec neléčenou vrozenou hypotyreózou [1].
Vrozená hypertyreóza
Mnohem vzácnějším, ale velmi závažným akutním stavem je vrozená hypertyreóza. Nejčastější příčinou je transplacentární přenos protilátek stimulujících TSH receptor (aTSHR neboli TRAK) od matky s floridní Gravesovou–Basedowovou tyreotoxikózou – nediagnostikovanou a neléčenou, nebo i léčenou. Zvýšené riziko hrozí ale také u matek, které pro tuto diagnózu v minulosti podstoupily tyreoidektomii či léčbu radiojodem, protože tvorba protilátek může přetrvávat. U rizikových těhotných žen je nezbytné hodnoty protilátek proti TSH receptoru monitorovat a následně vyhodnotit riziko pro plod a novorozence [14–16].
In utero se hyperfunkce fetální štítné žlázy v důsledku její stimulace maternálními protilátkami proti TSH receptoru nejčastěji projevuje tachykardií, arytmiemi, strumou a intrauterinní růstovou retardací. Hrozí předčasný porod. Pokud má matka pozitivní protilátky proti TSH receptoru, plod musí být zejména v druhé polovině těhotenství pečlivě ultrazvukově sledován. U novorozence se hypertyreóza manifestuje kromě strumy nápadnou dráždivostí, neprospíváním i přes zvýšenou chuť k jídlu, řídkými stolicemi, hypertermií, exoftalmem a menší velkou fontanelou. V závažných případech může dojít k hepatomegalii, splenomegalii, srdečnímu selhání nebo k metabolickému rozvratu. U každého novorozence rizikové matky (ať už má protilátky pozitivní, nebo nebyly v těhotenství vyšetřeny) je doporučeno vyšetření funkce štítné žlázy a hodnot protilátek z pupečníkové krve a poté jeho opakování během prvního a druhého týdne života. Neonatální tyreotoxikóza má sice tranzientní charakter odpovídající postupnému vymizení transplacentárně přenesených protilátek z cirkulace novorozence, ale vzhledem k její závažnosti a mortalitě představující 12–25 % je zcela nezbytné co nejčasnější stanovení diagnózy a zahájení okamžité a adekvátní léčby na specializovaném pracovišti [17].
Terapie
Lékem první volby jsou tyreostatika – thiamazol (methimazol), obvykle 0,4–0,8 mg/kg/den podávaných per os nebo nazogastrickou sondou ve 2–3 dávkách. Tyreostatika podávaná matce lze využít i k ovlivnění fetální tyreotoxikózy. Ke zvládnutí tachykardie a adrenergní stimulace bývají potřebné betablokátory (propranolol), v závažných případech se přidávají kortikoidy. Délka léčby se řídí normalizací hodnot tyreoidálních hormonů a vymizením protilátek z cirkulace, obvykle je nezbytná několik týdnů až 3–4 měsíce. Dítě je nutné dlouhodobě komplexně sledovat i po skončení léčby.
Vrozené poruchy periferního využití tyreoidálních hormonů
Kromě adekvátní tvorby hormonů štítné žlázy jsou nezbytným předpokladem jejich optimálního a efektivního využití v cílových buňkách správně fungující mechanismy v periferii. K závažnému klinickému obrazu vedou vrozené poruchy transportních proteinů pro tyreoidální hormony lokalizované na plazmatické membráně cílových buněk.
Geneticky podmíněné defekty transportéru MCT8 jsou zodpovědné za AHD (Allanův–Herndonův–Dudleyové) syndrom s X vázanou dědičností. MCT8 funguje jako transportér T3 (trijodtyroninu) do neuronů. V důsledku jeho defektu dochází k hyposaturaci CNS tyreoidálními hormony, a naopak k hypersaturaci tkání, které nejsou závislé na MCT8. U postižených chlapců dominuje těžká psychomotorická retardace, centrální hypotonie progredující do spasticity, poruchy řeči, hubnutí, tachykardie. Laboratorně jsou charakteristické normální až mírně zvýšené hodnoty TSH, snížené hodnoty fT4 a zvýšené hodnoty fT3. V léčbě se nově zkoušejí analoga tyreoidálních hormonů, diagnóza je však bohužel většinou stanovena až ve fázi ireverzibilního poškození mozku [18].
Geneticky podmíněný defekt β jaderného receptoru pro hormony štítné žlázy (obvykle s autozomálně dominantní dědičností) je příčinou generalizované rezistence periferních tkání na tyreoidální hormony. Důsledkem je významné zvýšení hodnot tyreoidálních hormonů, koncentrace TSH přitom ale není snížená – je mírně zvýšená nebo normální. Diagnóza je obvykle stanovena při vyšetření pro strumu nebo tachykardii, typickým projevem u dětí je také hyperaktivita. Řada jedinců je asymptomatických a léčba u nich není nutná. V ostatních případech je postup individuální podle převažujících klinických projevů, v případě známek hypertyreózy se preferuje symptomatická léčba (např. betablokátory). Podávání tyreostatik, nebo dokonce indikace tyreoidektomie je u této diagnózy postupem non lege artis.
Získané poruchy štítné žlázy
V této skupině u dětí a dospívajících dominují autoimunitní onemocnění štítné žlázy (AITD) – chronická lymfocytární tyreoiditida (CLT) a Gravesova–Basedowova tyreotoxikóza (GB). V našich podmínkách jsou autoimunitní tyreopatie nejčastější příčinou strumy a poruch funkce štítné žlázy. Na jejich rozvoj mají vliv faktory genetické (rizikové typy HLA genetické výbavy, non HLA imunoregulační geny), endogenní (např. hormonální změny v období puberty) a exogenní (např. endokrinní disruptory, infekce, zevní ozáření). Důsledkem je jejich negativní působení na imunologickou toleranci. AITD se vyskytuje častěji u dívek, výskyt stoupá v období dospívání. Rizikovou skupinou pro vznik AITD jsou děti s již existujícím autoimunitním onemocněním (diabetes mellitus 1. typu, celiakie), s genetickými syndromy (Downův, Turnerův, Klinefelterův, Noonanové), po radioterapii v oblasti hlavy, krku a hrudníku a při léčbě některými farmaky (např. lithium, amiodaron, biologická léčba). U rizikových skupin má být prováděn pravidelný laboratorní, případně i ultrazvukový screening AITD. Vyšší výskyt AITD mají také děti s pozitivní rodinnou anamnézou [19].
Chronická lymfocytární tyreoiditida
Chronická lymfocytární tyreoiditida
(CLT) je nejčastější formou AITD a nejčastější příčinou
získané hypofunkce štítné žlázy. U dětí a dospívajících
typicky probíhá pod obrazem Hashimotovy tyreoiditidy se strumou,
vzácně jako atrofická tyreoiditida. V patogenezi hrají
hlavní roli destruktivní vlivy buněčné imunity zprostředkované
Th1 lymfocyty, typická je lymfocytární infiltrace štítné žlázy.
Až u 90 % pacientů jsou detekovatelné protilátky proti
tyreoidální peroxidáze (aTPO), případně proti tyreoglobulinu
(ahTG). Význam těchto protilátek je zejména diagnostický.
Primárně nemají přímý podíl na destrukci štítné žlázy,
až později hrají roli v sekundárním poškození
(na protilátkách závislá cytotoxicita, aktivace
komplementu). Jejich titr nemá zásadnější prognostický význam,
po stanovení diagnózy ho není nutné opakovaně vyšetřovat.
Pro atrofickou formu CLT jsou typické protilátky proti TSH
receptoru s inhibičním účinkem. Negativita autoprotilátek
CLT zcela nevylučuje, protože mohou být namířeny i proti
jiným antigenům, které se běžně nevyšetřují. Průběh CLT je
u dětí a dospívajících individuální a obtížně
predikovatelný. Spontánní remise iniciální fáze CLT je u dětí
častější než u dospělých – až u třetiny
případů. U další třetiny je stav stacionární, u třetiny
po fázi eutyreózy (normální hodnoty fT4 a TSH,
pozitivita protilátek aTPO, ahTG) přechází do subklinické
(zvýšené hodnoty TSH, normální fT4) až manifestní hypotyreózy
(zvýšené hodnoty TSH, snížené u fT4), tabulka 2 [20].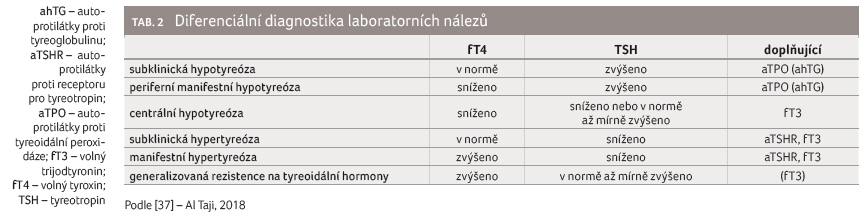
Diagnóza je v dnešní době mnohdy stanovena ještě presymptomaticky, v rámci laboratorního nebo ultrazvukového vyšetření primárně indikovaného z jiných příčin nebo indikovaného bez jednoznačného klinického korelátu (např. nález pozitivity tyreoidálních autoprotilátek při komplexním imunologickém vyšetření). V některých případech bývá CLT diagnostikována až ve fázi, kdy je spojena se sníženou produkcí tyreoidálních hormonů a manifestuje se klinickými symptomy, např. zvýšenou únavností, obstipací, suchou kůží, lámavými vlasy, nevýkonností ve škole, zhoršením prospěchu a snížením fyzické zdatnosti. Postupně se snižuje růstová rychlost a stoupá tělesná hmotnost. Puberta se může opožďovat, nebo naopak nastává předčasná pseudopuberta (zkřížená afinita vysoké hodnoty TSH s LH receptorem), u dívek se objevují poruchy menstruačního cyklu. Typická je struma, ale nemusí být vždy přítomna. U závažné hypotyreózy bývá patrný myxedém s prosáknutím v obličeji a s otokem víček, bradykardie, hypotenze, perikardiální výpotek. Subjektivní tolerance příznaků hypotyreózy je individuální, u dětí bývá vyšší než u dospělých. Laboratorně jsou časté poruchy lipidogramu, elevace aktivity aminotransferáz, anémie, hyperprolaktinemie.
Terapie
Podle aktuálních doporučení je jednoznačnou indikací k zahájení léčby CLT manifestní hypotyreóza (zvýšení hodnot TSH a jejich snížení u fT4) [20]. Léčbu se doporučuje zahájit také v případě CLT a jasného ultrazvukového nálezu strumy (i eufunkční). Léčba incipientních fází CLT u pacientů s pouhou elevací hodnot autoprotilátek (eufunkční štítná žláza, bez strumy) již není doporučována. V případě mírné subklinické hypotyreózy u CLT bez strumy (TSH 5–10 mIU/l, tzv. hypertyreotropinemie) je u dětí starších tří let upřednostňováno sledování bez léčby. U dětí ve věku do tří let je s ohledem na vývoj a dozrávání CNS léčba většinou indikovaná. U CLT a potvrzené významné subklinické hypotyreózy (TSH > 10 mIU/l) je doporučeno zahájení léčby ve všech věkových skupinách [21,22].
Lékem volby je levotyroxin podávaný v jedné denní dávce ráno nalačno (optimálně 30 minut před snídaní). Požadavek podávání levotyroxinu ráno nalačno nemusí být nejspíše tak striktní, protože např. u dětí s vrozenou hypotyreózou je doporučeno „podávání za stále stejných podmínek“, u dospělých byl popsán adekvátní léčebný efekt při podávání levotyroxinu večer před spaním [11,23]. Vstřebání levotyroxinu se zhoršuje při současném požití sójového mléka, vlákniny, přípravků s kalciem, železem a při malabsorpci. Dávkování levotyroxinu je individuální, obvyklá substituční dávka je kolem 80–100 μg/m2/den; orientačně 4–6 μg/kg/den u dětí ve věku 1–5 let, 3–4 μg/kg/den u dětí ve věku 6–10 let, 2–3 μg/kg/den u starších 11 let. U subklinické nebo mírné hypotyreózy postačují dávky 1–2 μg/kg/den i nižší. V případě dlouhodobé adaptace na těžkou hypotyreózu zahajujeme léčbu pouze třetinou až polovinou plánované dávky a dávku navyšujeme postupně, abychom zabránili rozvoji psychických obtíží (neklid, nespavost), případně vzniku pseudotumoru cerebri (cave: na rozdíl od substituce vrozené hypotyreózy, kdy léčbu zahajujeme ihned plnou substituční dávkou i u nejtěžších forem).
Po zahájení léčby nebo po změně dávky levotyroxinu je vhodné zkontrolovat koncentraci fT4 a TSH za 6–8 týdnů, jinak je doporučeno provádět kontroly ve tří až šestiměsíčních intervalech podle věku dítěte. Nutné jsou pravidelné ultrazvukové kontroly (alespoň v ročních intervalech), vzhledem ke zvýšenému riziku neoplazie v uzlu štítné žlázy a vzniku lymfomu štítné žlázy. Doporučený je screening celiakie, protože u CLT je vyšší riziko rozvoje asociovaných autoimunitních chorob. CLT může být také součástí polyglandulárních autoimunitních syndromů. U mírných forem CLT je po určité době vhodné ověřit nutnost substituční léčby, u těžších forem lze očekávat nutnost celoživotní léčby.
Gravesova–Basedowova choroba
Hlavním patofyziologickým mechanismem u Gravesovy–Basedowovy choroby je produkce autoprotilátek stimulujících TSH receptor (aTSHR neboli TRAK). Stimulace TSH receptoru způsobuje růst strumy a nadměrnou tvorbu hormonů štítné žlázy (obr. 3). Gravesova–Basedowova choroba je u dětí a dospívajících nejčastější příčinou hypertyreózy. Na klinickém obraze se podílí exces tyreoidálních hormonů a zkřížený autoimunitní proces na extratyreoidálních tkáních. Nadbytek hormonů štítné žlázy způsobuje hypermetabolický stav a zvyšuje tonus sympatiku. Typickým projevem je hyperkinetická cirkulace – tachykardie (subjektivně palpitace), systolická hypertenze, dále pokles tělesné hmotnosti i při zvýšené chuti k jídlu, návaly horka, průjmy, třes rukou. U dětí se často zhoršuje školní prospěch, jsou dráždivé, neklidné, trpí nespavostí. U dívek nastupují poruchy menstruačního cyklu. Při dlouhodobé nadprodukci tyreoidálních hormonů se urychluje růstová křivka a kostní zrání, zhoršuje se mineralizace skeletu.
Laboratorní nález u manifestní
GB tyreotoxikózy je jednoznačný – vysoké koncentrace fT4
a fT3, snížené (suprimované) hodnoty TSH a zvýšené
aTSHR. Ve fázi subklinické hypertyreózy jsou hodnoty TSH
suprimované a hodnoty fT4 v normě (tab. 2). Důležité je odlišení GB tyreotoxikózy
od ostatních vzácnějších stavů, kdy je zvýšena
koncentrace fT4 (tab. 3).
Nejčastější chybou je záměna generalizované rezistence
na tyreoidální hormony za GB tyreotoxikózu, a v důsledku
toho zbytečná a potenciálně riziková léčba tyreostatiky
u dětí s rezistencí na tyreoidální hormony.
Terapie
Stanovení diagnózy manifestní GB
tyreotoxikózy vyžaduje okamžité zahájení tyreostatické léčby,
při závažné tyreotoxikóze je nutná hospitalizace. Lékem první
volby je methimazol (thiamazol) [15,16]. Obvyklá dávka methimazolu
je 0,2–0,5 mg/kg/den (dávka by neměla překročit 30 mg/den),
postačuje podávání v jedné denní dávce (u vyššího
dávkování ev. rozděleně do dvou dávek s ohledem
na nauzeu), tabulka 4.
Některé nežádoucí účinky závisejí na výši dávky,
proto je doporučeno používat co nejnižší dávku, která je
schopna normalizovat koncentrace tyreoidálních hormonů.
K nejčastějším nežádoucím účinkům patří kopřivka,
svědění, bolesti kloubů a svalů, mírné reverzibilní
poškození jaterních funkcí (není zvýšené riziko jaterního
selhání). Agranulocytóza je vzácná, v případě možných
symptomů (nejasná teplota, obraz angíny, afty) je nutné ihned
vyšetřit krevní obraz. Rodina musí být poučena o možných
nežádoucích účincích tyreostatik a o nutnosti
přerušení léčby v případě jejich projevů. Z důvodu
zvýšeného rizika těžkého ireverzibilního postižení jater
nemá být u dětí a dospívajících až na zcela
výjimečné situace používán propylthiouracil [15,16]. Zejména
na začátku tyreostatické léčby se s výhodou
přidávají betablokátory (atenolol, propranolol, metoprolol),
které snižují tonus sympatiku a také periferní konverzi T4
na T3. Léčba typu „block and replace“ (vyšší dávka
tyreostatika a současné podávání levotyroxinu) není
v současné době pro vyšší riziko nežádoucích účinků
bez zvýšeného přínosu oproti „titrační“ léčbě
doporučována.
Během léčby je třeba v kratších časových intervalech sledovat hodnoty fT4 a TSH a případně fT3 (T3 toxikóza při normální koncentraci fT4 a při supresi TSH). Suprese TSH je často dlouhodobá a trvá až měsíce. Vhodné jsou občasné kontroly titru aTSHR jako ukazatele aktivity nemoci. Jakmile se projevy hypertyreózy zmírní, dávku tyreostatik lze snížit – cílem je udržení eutyreoidního stavu, který má příznivý vliv také na samotný autoimunitní proces. Dlouhodobé remise lze během dvouleté léčby tyreostatiky dosáhnout asi v 15–30 % případů. U dětí je pravděpodobnost dosažení remise nižší a riziko relapsu vyšší než u dospělých. K nepříznivým prognostickým faktorům patří nižší věk dítěte, objemná struma a vyšší hodnoty tyreoidálních hormonů a aTSHR v době manifestace. Při nedosažení remise konzervativní léčbou, při relapsech tyreotoxikózy, při toxicitě tyreostatik, nespolupráci v medikamentózní léčbě nebo při trvající závažné endokrinní orbitopatii je indikováno chirurgické řešení – totální tyreoidektomie s následnou celoživotní substitucí levotyroxinu [15,16]. Není jednoznačné, zda tyreostatická léčba trvající déle než dva roky zvyšuje procento remisí, při dobrém efektu a bezproblémové toleranci je v individuálních případech akceptovatelná [15,24]. U dívek po totální tyreoidektomii pro GB chorobu je vhodné před předáním do péče pro dospělé zkontrolovat protilátky aTSHR, které mohou perzistovat a znamenat případné riziko pro budoucí graviditu.
Projevy endokrinní orbitopatie nejsou u dětí vzácné, ale jsou ve většině případů mírné (symetrická retrakce a otok víček, lagoftalmus), méně častý je exoftalmus. Ke zklidnění obvykle dochází po dosažení eutyreoidního stavu při tyreostatické léčbě. Je vhodné využít lokální oční terapii (lubrikancia, masti na noc). Systémové podání kortikoidů je indikováno pouze v závažných případech.
Problematika jodového deficitu
Jod je základním mikronutrientem
nezbytným pro syntézu hormonů štítné žlázy. Jodový deficit
je příčinou tzv. chorob z nedostatku jodu (IDD) [25].
Nejrizikovější je období prenatálního vývoje a raného
dětství do věku tří let, kdy těžký nedostatek jodu může
způsobit až tzv. endemický kretenismus. Nejzávažnější formy
deficitu jodu se u nás podařilo vymýtit zahájením programu
jodace kuchyňské soli na počátku 50. let 20. století.
V oblastech s přetrvávajícím mírnějším deficitem
jodu se ještě donedávna vyskytovala tzv. kognitivní endemická
dysfunkce a jodopenická difuzní struma. Jodopenická struma
byla nejčastější dětskou tyreopatií, dnes je u nás
nejčastější příčinou strumy autoimunitní onemocnění štítné
žlázy. Mírný nedostatek jodu u těhotné ženy způsobuje
tranzientní hypertyreotropinemii, příp. hypotyreózu novorozence.
Hodnoty TSH zjištěné při novorozeneckém screeningu jsou dle
WHO/UNICEF/ICDD citlivým ukazatelem zásobení populace jodem
a monitorují úspěšnost profylaktických programů. Díky
komplexnímu programu jodové suplementace byla Česká republika
v roce 2004 v oficiální klasifikaci WHO/ICCIDD zařazena
mezi státy s dostatečnou jodovou saturací u všech
věkových skupin (tab. 5). I nadále je ale třeba zajistit zvýšené
dodávky jodu těhotným a kojícím ženám nad rámec běžného
příjmu v potravě. Dle České endokrinologické společnosti
a České pediatrické společnosti ČLS
JEP bylo doporučeno celoplošně
saturovat těhotné a kojící ženy dávkou 100 µg/den
(ve formě tablet jodidu nebo vitaminovými přípravky pro
gravidní a kojící) [26]. Novější doporučení uvádí
dávky 150–200 µg elementárního jodu/den podávané nad rámec
běžného příjmu v potravě formou přípravku s přesně
definovaným množstvím jodu [14,27,28]. Z celosvětového
hlediska zůstává i po několika dekádách značné
snahy o zvládnutí jodového deficitu ohrožena rizikem jeho
vzniku až třetina dětské populace.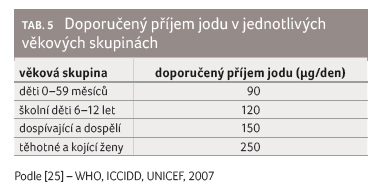
Indikace a interpretace vyšetření
tyreoidální osy
Zlatým standardem tyreologické diagnostiky a spolehlivým diagnostickým nástrojem i nástrojem pro dlouhodobé sledování a monitoraci např. substituční léčby je současné stanovení hodnot TSH a fT4. Stanovení hodnoty fT3 není běžně nutné, je vymezeno zejména pro monitorování léčby GB tyreotoxikózy a pro diagnostiku, případně monitorování léčby méně častých poruch tyreoidální osy (např. centrální hypotyreózy, některých vrozených defektů tyreoidální osy). K posouzení funkce štítné žlázy není vhodné stanovení celkové koncentrace T3 a T4. Je významně ovlivněna koncentrací vazebných bílkovin, která se mění vlivem netyreoidálních chorob a stavů a při léčbě některými farmaky. Výsledky je třeba posuzovat podle referenčních mezí pro danou laboratorní metodiku a nejlépe i dle věku dítěte. Pokud laboratoř není schopna poskytnout věkovou stratifikaci norem dle laboratorní metodiky a výrobce, lze použít obecné normy získané vyšetřením větších populačních skupin zdravých dětí [29,30]. Ke sledování dynamiky je vhodné stanovení ve stejné laboratoři.
Interpretace základních tyreologických nálezů je uvedena v tabulce 2. Samotná hodnota TSH může sloužit jako základní ukazatel funkce tyreoidální osy, hodnotu fT4 bez znalosti koncentrace TSH ale nikdy neposuzujeme. Nejvhodnější je současné posouzení hodnot TSH a fT4. Nález snížené koncentrace fT4 při zvýšené koncentraci TSH nebo zvýšené koncentrace fT4 se suprimovaným TSH, tedy laboratorní obraz manifestní hypotyreózy nebo hypertyreózy, obvykle nečiní obtíže v diagnostické ani terapeutické rozvaze. Častým, většinou náhodným nálezem je mírně zvýšená koncentrace TSH (TSH 5–10 mIU/l) při normální hodnotě fT4 – tzv. hypertyreotropinemie (mírná subklinická hypotyreóza). Tento nález není nutné řešit urgentně, zkontrolujeme dynamiku TSH a fT4 s časovým odstupem za plného zdraví. U většiny dětí se nález normalizuje nebo neprogreduje [31]. Při trvajícím nálezu doplníme koncentrace protilátek aTPO a provedeme ultrazvukové vyšetření štítné žlázy. Pozitivní autoprotilátky a/nebo suspektní ultrazvukový nález svědčí pro počínající CLT. Pokud není současně přítomna struma, u dětí starších tří let stav sledujeme. Při negativitě protilátek a normálním ultrazvukovém nálezu na štítné žláze se obvykle jedná o neautoimunitní subklinickou hypotyreózu. Etiologie neautoimunitní subklinické hypotyreózy je heterogenní, zahrnuje příčiny vrozené i získané [21,22]. Mírné zvýšení hodnoty TSH je častým nálezem u obézních dětí. Je důsledkem, nikoliv příčinou obezity a pokles tělesné hmotnosti po změně životního stylu vede k poklesu a normalizaci hodnot TSH [32]. Terapeutický přístup k mírné neautoimunitní subklinické hypotyreóze (koncentrace TSH do dvojnásobku horní hranice normy s normální koncentrací fT4) je u dětí starších tří let, bez strumy a bez anamnézy ozařování v současné době zdrženlivý, stav je ale třeba sledovat [21,22,33].
Diagnosticky složitější bývá situace, kdy snížené hodnoty fT4 nedoprovází elevace hodnot TSH, nebo naopak jsou hodnoty fT4 zvýšené při nesuprimovaném TSH. Při nálezu snížené koncentrace fT4 bez adekvátní elevace hodnoty TSH (která je snížená, normální, ev. hraničně zvýšená) zvažujeme centrální etiologii – sekundární (hypofyzární) nebo terciární (hypotalamickou) hypotyreózu [34]. S obdobným nálezem se můžeme setkat i u závažných celkových onemocnění, případně i u chronického stresu. Snížení hodnot fT4 a TSH může provázet také mentální anorexii. Typický pro tuto diagnózu je syndrom nízkého T3 (nízké koncentrace fT3, normální až mírně snížené koncentrace fT4 a TSH). Reaktivita hypotalamo hypofyzární osy bývá narušena u psychiatrických pacientů (např. u bipolární afektivní poruchy, při léčbě některými psychofarmaky), TSH u nich pak často nereaguje ani na pokles hodnoty fT4 při rozvoji periferní hypotyreózy. Pokud zvýšené hodnoty fT4 (a fT3) nejsou provázeny sníženým – suprimovaným – TSH, nejčastěji se jedná o generalizovanou rezistenci na tyreoidální hormony (tab. 3).
Závěr
Široká dostupnost laboratorního vyšetření tyreoidální osy přináší kromě nesporných výhod určitá rizika – správnost jeho indikace ve smyslu nadužívání a jeho následné interpretace. Zhodnocení výsledků laboratorního vyšetření a z toho plynoucí diagnostické, případně terapeutické kroky by měly být v souladu s aktuálními poznatky a doporučeními [11,14–16,22,26,27,34]. V praxi ale preskripce levotyroxinu narůstá a jeho indikace se v rozporu s doporučenými postupy mnohdy naopak posouvá k nižším hodnotám TSH [35]. Je třeba odlišit stavy, které nevyžadují další podrobné vyšetřování, nebo dokonce léčbu (hraniční nálezy bez klinického korelátu, varianty normy), od skutečných tyreopatií, u nichž je naopak frekventní sledování a případně léčba nezbytností. Neopomenutelným nástrojem k racionálnímu posouzení výstupů laboratorního vyšetření by měla nadále zůstat rodinná, osobní a farmakologická anamnéza s důrazem na rizikové faktory, klinický stav, fyzikální nález včetně palpačního vyšetření štítné žlázy, hodnocení funkce kardiovaskulárního aparátu, kvality kůže a kožních adnex a u dětí a dospívajících vždy také posouzení růstové, hmotnostní křivky a pubertálního vývoje
Seznam použité literatury
- [1] Ford G, LaFranchi SH. Screening for congenital hypothyroidism: a worldwide view of strategies. Best Pract Res Clin Endocrinol Metab 2014; 28: 175–178.
- [2] www.novorozeneckyscreening.cz (webové stránky Koordinačního centra novorozeneckého screeningu pro Českou republiku)
- [3] Abu‑Khudir R, Larrivée‑Vanier S, Wasserman JD, et al. Disorders of thyroid morphogenesis. Best Pract Res Clin Endocrinol Metab 2017; 31: 143–159.
- [4] Targovnik HM, Citterio CE, Rivolta CM. Iodide handling disorders (NIS, TPO, TG, IYD). Best Pract Res Clin Endocrinol Metab 2017; 31: 195–212.
- [5] Vulsma T, Gons MH, de Vijlder JJ. Maternal‑fetal transfer of thyroxine in congenital hypothyroidism due to a total organification defect or thyroid agenesis. N Engl J Med 1989; 321: 13–16.
- [6] Čížková‑Písařovicová J. Štítná žláza – thyreoidea. In: Čížková‑Písařovicová J. Klinická endokrinologie dětského věku. Praha: Státní zdravotnické nakladatelství, 1954; 37–40.
- [7] Klein AH, Meltzer S, Kenny FM. Improved prognosis in congenital hypothyroidism treated before age three months. J Pediatr 1972; 81: 912–915.
- [8] Hníková O, Kračmar P. Kongenitální hypotyreóza. 1. vyd. Praha: Avicenum, 1989; 1–100.
- [9] Metodický návod k zajištění novorozeneckého laboratorního screeningu a následné péče. In: Věstník Ministerstva zdravotnictví České republiky 2016; částka 6, 2–12.
- [10] Olivieri A, Stazi MA, Mastroiacovo P, et al. A population‑based study of the frequency of additional congenital malformations in infants with congenital hypothyroidism: data from the Italian registry for congenital hypothyroidism (1991‑1998). J Clin Endocrinol Metab 2002; 87: 557–562.
- [11] Léger J, Olivieri A, Donaldson M, et al. on behalf of ESPE‑PES‑SLEP‑JSPE‑APEG‑APPES‑ISPAE, and the Congenital Hypothyroidism Consensus Conference Group. European Society for Paediatric Endocrinology Consensus Guidelines on Screening, Diagnosis, and Management of Congenital Hypothyroidism. J Clin Endocrinol Metab 2014; 99: 363–384.
- [12] Grüters A, Jenner A, Krude H. Long‑term consequences of congenital hypothyroidism in the era of screening programmes. Best Pract Res Clin Endocrinol Metab 2002; 16: 369–382.
- [13] Albert BB, Heather N, Derraik JSB, et al. Neurodevelopmental and body composition outcomes in children with congenital hypothyroidism treated with high‑dose initial replacement and close monitoring. J Clin Endocrinol Metab 2013; 98: 3663–3670.
- [14] Alexander EK, Pearce EN, Brent GA, et al. 2017 Guidelines of the American thyroid association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2017; 27: 315–389.
- [15] Ross DS, Burch HB, Cooper DS, et al. 2016 American thyroid association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid 2016; 26: 1343–1421.
- [16] Kahaly GJ, Bartalena L, Hegedüs L, et al. 2018 European thyroid association guideline for the management of Graveʼs hyperthyroidism. Eur Thyroid J 2018; 7: 167–186.
- [17] Léger J. Management of fetal and neonatal Graves´disease. Horm Res Pediatr 2017; 87: 1–6.
- [18] Krude H, Kühnen P, Biebermann H. Treatment of congenital thyroid dysfunction: achievements and challanges. Best Pract Clin Endocrinol Metab 2015; 25: 399–413.
- [19] Brown RS. Autoimmune thyroiditis in childhood. J Clin Res Pediatr Endocrinol 2013; 5: 45–49.
- [20] Radetti G. Clinical aspects of Hashimotoʼs thyroiditis. In: Szinnai G, editor. Paediatric Thyroidology. 1. vydání. Basilej: Karger, 2014; 158–170.
- [21] Monzani A, Prodam F, Rapa A, et al. Natural history of subclinical hypothyroidism in children and adolescents and potential effects of replacement therapy: a review. Eur J Endocrinol 2013; 168: R1–11.
- [22] Lazarus J, Brown RS, Daumerie C, et al. 2014 European Thyroid Association guidelines for the management of subclinical hypothyroidism in pregnancy and children. Eur Thyroid J 2014; 3: 76–94.
- [23] Bolk N, Visser TJ, Nijman J, et al. Effects of evening vs morning levothyroxine intake: a randomized double‑blind crossover trial. Arch Intern Med 2010; 170: 1996–2003.
- [24] Léger J, Gelwane G, Kaguelidou F, et al., and the French childhood Gravesʼdisease study group. Positive impact of long‑term antithyroid drug treatment on the outcome of children with Gravesʼdisease: national long‑term cohort study. J Clin Endocrinol Metab 2012; 97: 110–119.
- [25] Assessment of iodine deficiency disorders and monitoring their elimination. Third edition. Geneva: WHO, ICCIDD, UNICEF, 2007: 1–97.
- [26] Horáček J, Jiskra J, Límanová Z, et al. Doporučení pro diagnostiku a léčbu onemocnĕní štítné žlázy v tĕhotenství a pro ženy s poruchou fertility. Vnitr Lek 2013; 59: 909–931.
- [27] DeGroot L, Abalovich M, Alexander EK, et al. Management of thyroid dysfunction during pregnancy and postpartum: An Endocrine Society practice guidelines. J Clin Endocrinol Metab 2012; 97: 2543–2565.
- [28] Límanová Z, Jiskra J. Doporučení pro prevenci, časný záchyt a léčbu tyreopatií v těhotenství 2018 (Česká endokrinologická společnost ČLS JEP). www.cskb.cz/res/file/zapisy‑vyboru‑cskb/2018/Z1/Z1‑P1.pdf
- [29] Lem AJ, de Rijke YB, van Toor H, et al. Serum thyroid hormone levels in healthy children from birth to adulthood and in short children born small for gestational age. J Clin Endocrinol Metab 2012; 97: 3170–3178.
- [30] http://www.rki.de/DE/Content/Gesundheitsmonitoring/Studien/Kiggs/Basiserhebung/Basiserhebung_node.html)
- [31] Lazar L, Frumkin, Battat E, et al. Natural history of thyroid function tests over 5 years in a large pediatric cohort. J Clin Endocrinol Metab 2009; 94: 1678–1682.
- [32] Longhi S, Radetti G. Thyroid function and obesity. J Clin Res Pediatr Endocrinol 2013; 5: 40–44.
- [33] Cerbone M, Bravaccio C, Capalbo D, et al. Linear growth and intellectual outcome in children with long‑term idiopathic subclinical hypothyroidism. Eur J Endocrinol 2011; 164: 591–597.
- [34] Persani L, Brabant G, Dattani M, et al. 2018 European thyroid association guidelines on the diagnosis and management of central hypothyroidism. Eur Thyroid J 2018; 5: 225–237.
- [35] Taylor PN, Iqbal A, Minassian C, et al. Falling threshold for treatment of bordeline elevated thyrotropin levels – balancing benefits and risks. Evidence from a large community‑based study. JAMA Intern Med 2014; 174: 32–39.
- [36] Lebl J, Al Taji E, Koloušková S, et al. Tyreopatie. In: Lebl J, Al Taji E, Koloušková S, et al. Dětská endokrinologie a diabetologie. Praha: Galén, 2016; 189–235.
- [37] Al Taji E. Autoimunitní onemocnění štítné žlázy v ordinaci PLDD. Pediatr praxi 2018; 19: 13–17.