Postavení cetuximabu v léčbě kolorektálního karcinomu
Souhrn:
Cetuximab patří mezi významné představitele cílené léčby u pacientů s metastatickým kolorektálním karcinomem – onemocněním, jež je vzhledem k počtu nemocných závažným problémem nejen medicínským. V České republice je cetuximab podáván v klinické praxi u pacientů s touto diagnózou již déle než deset let. Za tuto dobu byly dokončeny výstupy množství klinických studií a byly provedeny různé subanalýzy, které nám dále přinesly mnoho nových dat, jak cílenou léčbu cetuximabem více individualizovat a dosáhnout lepších terapeutických výsledků. Přehledový článek se zabývá postavením cetuximabu v léčbě metastatického onemocnění na podkladě aktuálních poznatků a zmiňuje rovněž možnosti použití přípravku v neoadjuvantní terapii karcinomu rekta.
Key words: colorectal carcinoma – targeted therapy – metastases – chemotherapy.
Summary:
Cetuximab is a very important representative of the targeted treatment in patients with metastatic colorectal cancer, which is not only a medical problem due to the number of patients. In the Czech Republic, cetuximab has been administered in clinical practice for this diagnosis for over 10 years. During this time, data from a number of clinical trials matured and follow‑up analyses were performed. The new data enable us to individualize more any targeted treatment with cetuximab and to achieve better therapeutic outcomes. This review article evaluates the position of cetuximab in the treatment of metastatic disease and on also in the neoadjuvant treatment of rectal carcinoma.
Mechanismus účinku, dávkování a přehled klinických studií
Receptor pro epidermální růstový
faktor (epidermal growth factor receptor, EGFR; receptor 1 pro lidský
epidermální růstový faktor, HER1; ErbB1) je transmembránový
glykoprotein o molekulové hmotnosti 170 kDa složený
z 1 186 aminokyselin. Jeho produkce je kódována genem EGFR1,
který je uložen na krátkém raménku sedmého chromozomu
(7p12). Receptor pro epidermální růstový faktor patří do rodiny
ErbB tyrozinkinázových receptorů, kam dále řadíme také HER2
(ErbB2), HER3 (ErbB3) a HER4 (ErbB4). Skládá se
z extracelulární domény sloužící pro vazbu ligandu,
z transmembránové lipofilní domény a z intracytoplazmatické
domény, jež vykazuje tyrozinkinázovou aktivitu [1]. Mezi ligandy
EGFR patří epidermální růstový faktor (EGF), amfiregulin,
epiregulin, neuregulin, transformující růstový faktor alfa
(transforming growth factor alpha, TGFα), betacellulin, heparin
vázající EGF (heparin binding EGF, HB EGF) [2]. Receptor
pro EGF může být aktivován i ionizujícím zářením.
Po navázání ligandů nebo po ozáření dochází
k homodimerizaci dvou extracelulárních domén EGFR nebo
k heterodimerizaci EGFR domény s jiným z členů
rodiny ErbB. Po internalizaci dimerů nastává autofosforylace
intracelulární tyrozinkinázové domény aktivující
cytoplazmatické transdukční proteinové kaskády. Tato doména
rovněž indukuje buněčnou proliferaci i akceleraci buněčné
repo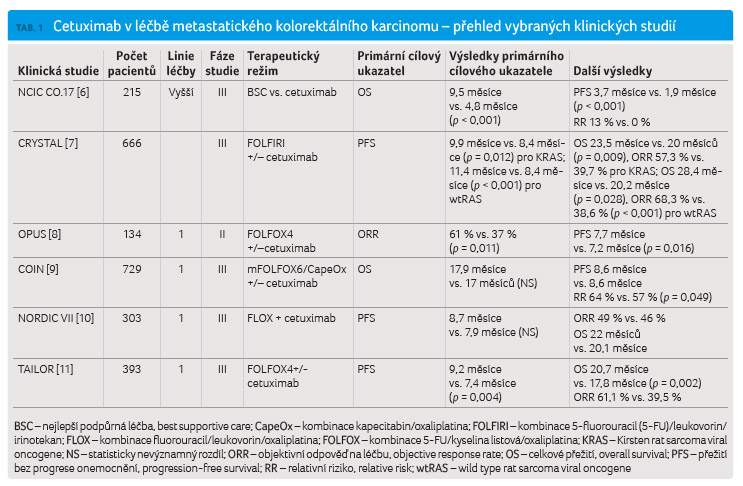 pulace a inhibuje apoptózu [3]. Mezi nejdůležitější
signální dráhy řadíme Ras/Raf/MAPK, PI3K/AKT, JAK/STAT nebo
PLC/PKC. Cílem onkologické terapie je inhibice dráhy EGFR, v níž
se v případě metastatického kolorektálního karcinomu
(metastatic colorectal cancer, mCRC) nejvíce uplatňují dvě
monoklonální protilátky ‒ cetuximab a panitumumab.
Cetuximab (Erbitux) je chimérická IgG1 monoklonální protilátka
a její oblast vázající antigen (Fab) je myšího původu.
Cetuximab se podává v nasycovací dávce 400 mg/m2
a dále v týdenní aplikaci v dávce 250 mg/m2.
Alternativou je praktičtější podání ve dvoutýdenních
intervalech v dávce 500 mg/m2, bez zhoršení
tolerance či léčebných výsledků [4]. Nežádoucí účinky
cetuximabu jsou odlišné od chemoterapie, dominují kožní
projevy (akneiformní exantém, suchost kůže, paronychia apod.),
dále se mohou vyskytovat mukozitida, průjem, nevolnost, únava, ale
objevují se i projevy hematologické toxicity. Asi u 2–3 %
případů dochází po podání cetuximabu k rozvoji
anafylaktické reakce, vhodná je proto premedikace kortikoidy
a antihistaminiky. Pilotní studie BOND prokázala, že přidání
cetuximabu k irinotekanu u nemocných s mCRC
po předchozí terapii irinotekanem prodlužuje mediány přežití
bez známek progrese (progression free survival, PFS)
a celkového přežití (overall survival, OS) [5]. Tento
výsledek naznačuje, že cetuximab může způsobovat „obnovení“
senzitivity k irinotekanu. Proběhlo dále několik klinických
studií fáze II a III, které hodnotily cetuximab v léčbě
mCRC. Přehled nejvýznamnějších uvádíme v tabulce 1.
pulace a inhibuje apoptózu [3]. Mezi nejdůležitější
signální dráhy řadíme Ras/Raf/MAPK, PI3K/AKT, JAK/STAT nebo
PLC/PKC. Cílem onkologické terapie je inhibice dráhy EGFR, v níž
se v případě metastatického kolorektálního karcinomu
(metastatic colorectal cancer, mCRC) nejvíce uplatňují dvě
monoklonální protilátky ‒ cetuximab a panitumumab.
Cetuximab (Erbitux) je chimérická IgG1 monoklonální protilátka
a její oblast vázající antigen (Fab) je myšího původu.
Cetuximab se podává v nasycovací dávce 400 mg/m2
a dále v týdenní aplikaci v dávce 250 mg/m2.
Alternativou je praktičtější podání ve dvoutýdenních
intervalech v dávce 500 mg/m2, bez zhoršení
tolerance či léčebných výsledků [4]. Nežádoucí účinky
cetuximabu jsou odlišné od chemoterapie, dominují kožní
projevy (akneiformní exantém, suchost kůže, paronychia apod.),
dále se mohou vyskytovat mukozitida, průjem, nevolnost, únava, ale
objevují se i projevy hematologické toxicity. Asi u 2–3 %
případů dochází po podání cetuximabu k rozvoji
anafylaktické reakce, vhodná je proto premedikace kortikoidy
a antihistaminiky. Pilotní studie BOND prokázala, že přidání
cetuximabu k irinotekanu u nemocných s mCRC
po předchozí terapii irinotekanem prodlužuje mediány přežití
bez známek progrese (progression free survival, PFS)
a celkového přežití (overall survival, OS) [5]. Tento
výsledek naznačuje, že cetuximab může způsobovat „obnovení“
senzitivity k irinotekanu. Proběhlo dále několik klinických
studií fáze II a III, které hodnotily cetuximab v léčbě
mCRC. Přehled nejvýznamnějších uvádíme v tabulce 1.
Dříve bylo podání cetuximabu doporučováno spíše s režimy obsahujícími irinotekan, rovněž vzhledem k výsledkům klinických studií uvedených v tabulce. V posledních letech však proběhlo několik sledování, jež prokázala, že cetuximab lze s účinností podat i s režimem FOLFOX. V minulém roce byly prezentovány výsledky čínských autorů dosažené v prospektivní randomizované studii fáze III TAILOR, která porovnávala účinnost a bezpečnost režimu FOLFOX4/cetuximab versus samotný FOLFOX4 v první linii léčby nemocných s mCRC s nemutovaným genem RAS. Primárním cílovým ukazatelem bylo prodloužení PFS v případě kombinačního režimu, což tato studie potvrdila (9,2 měsíce vs. 7,4 měsíce, HR [poměr rizik] 0,69; p = 0,004), podobně významné bylo také prodloužení OS (20,7 měsíce vs. 17,8 měsíce; p = 0,002) a objektivní odpovědi na léčbu (objective response rate, ORR) (61,1 % vs. 39,5 %). Toto hodnocení je specifické, neboť pouze méně než polovina pacientů byla následně léčena dalšími liniemi terapie, i vzhledem k omezené úhradě této léčby v Číně [11]. Podobně také další studie – CALGB/SWOG 80405 – prokázala efekt režimu FOLFOX s cetuximabem. Výsledky tohoto sledování budou diskutovány níže. Cetuximab není vhodné podávat s kapecitabinem.
Predikce účinku anti EGFR terapie
S rozvojem poznání molekulární biologie dochází k hledání prediktivních faktorů anti EGFR terapie s cílem lépe individualizovat tuto finančně náročnou léčbu. Vzhledem k mechanismu účinku cetuximabu, který spočívá v blokádě EGFR, byla právě exprese EGFR kritériem zahájení anti EGFR terapie. Klinické studie v subanalýzách však neprokázaly prediktivní význam exprese EGFR v léčbě cetuximabem [12]. Tuto skutečnost nakonec opožděně přijal i plátce zdravotní péče, který již stanovení exprese EGFR k proplacení anti EGFR terapie nevyžaduje. V roce 2006 byla publikována práce, která prokázala vliv stavu mutace v exonu 2 genu KRAS na léčebnou odpověď cetuximabu [13]. Geny KRAS patří do skupiny RAS, jejíž členové se vyskytují buď v nemutované formě (wild type – wt), nebo ve formě mutované, kdy je signální dráha EGFR/Ras/Raf/MAPK trvale aktivovaná bez ohledu na inhibici EGFR. Negativní efekt na anti EGFR terapii, jako je tomu v případě mutace v exonu 2 genu KRAS, prokázaly i další mutace KRAS (v exonech 3 a 4), následně se pak projevil také u pacientů s mutovaným genem NRAS. Celkem se mutace RAS vyskytuje přibližně u poloviny pacientů s mCRC. Testování uvedené mutace je aktuálně rutinním vyšetřením u pacientů s mCRC a je jednoznačně definovaným kritériem podání anti EGFR terapie. Součástí by mělo být i vyšetření mutace BRAFV600E, která je spíše negativním prognostickým faktorem. Prediktivní vliv mutace BRAF není jednoznačný, její přítomnost indikuje podání režimu FOLFOXIRI [13‒15]. Jako zajímavý klinický prediktivní faktor u cetuximabu byl pozorován stupeň kožní toxicity. U pacientů s vyjádřenou kožní toxicitou stupně 3‒4 jsou pozorovány ve většině klinických studií lepší léčebné výsledky. Při absenci akneiformního exantému je naopak nízká šance na dosažení léčebné odpovědi.
V současnosti je široce diskutován prognostický i prediktivní význam lokalizace primárního tumoru. Pravostranná a levostranná část tlustého střeva pocházejí z vývojově odlišných zárodečných listů (midgut versus hindgut). Obě části se liší cévním zásobením, inervací, lymfatickou drenáží [16]. Hranici mezi oběma částmi lze definovat na rozhraní proximálních dvou třetin a distální třetiny příčného tračníku. Často je tato hranice nesprávně určena do oblasti hepatálního ohbí. Vliv lokalizace na prognózu onemocnění a predikci efektu cílené terapie hodnotily většinou retrospektivní analýzy dříve publikovaných klinických studií. Zmíníme analýzu studie CALGB/SWOG 80405 [17]. Analýza prokázala delší OS u pacientů s levostranným postižením (33,3 měsíce versus 19,4 měsíce; p < 0,001). Z hlediska predikce účinku cetuximabu byl prokázán jeho významný vliv na OS v porovnání s bevacizumabem u levostranných karcinomů (39,3 měsíce versus 32,6 měsíce), naopak v léčbě pravostranných karcinomů dosáhl lepších výsledků bevacizumab (13,6 měsíce vs. 29,2 měsíce). Podobné výsledky prokázaly i další analýzy.
Horší prognóza pravostranných karcinomů ve srovnání s levostrannými může být způsobena vyšším výskytem mutace RAS, BRAF, hypermetylačním stavem, molekulárními subtypy CMS1 a CMS3, což je asociováno s horšími výsledky terapie cetuximabem. Do popředí se proto dostává otázka, zda u pacientů s wtRAS lze anti EGFR terapii indikovat i ve vztahu k lokalizaci primárního karcinomu. Dosud uskutečněné subanalýzy dokazují, že anti EGFR terapii je nutno upřednostnit v případě levostranných tumorů, v případě pravostranných je její indikace sporná. Situaci komplikuje skutečnost, že zatím nemáme k dispozici výsledky prospektivních studií, jež by pomohly vyřešit tuto problematiku.
Na druhé straně proběhla subanalýza klinické studie CRYSTAL, která prokázala vyšší procento celkové ORR u pacientů s pravostranným tumorem léčených kombinací FOLFIRI/cetuximab než u pacientů léčených samotnou chemoterapií. Není tedy chybou podat anti EGFR terapii u pacientů s wtRAS a pravostranným karcinomem v případě konverzní léčby jaterních metastáz, kde přidání cetuximabu může zvýšit procento ORR. V poslední době se diskutuje i prediktivní význam sekvence anti EGFR a anti VEGF (vaskulární endoteliální růstový faktor, vascular endothelial growth factor) léčby. Zdá se, že anti EGFR terapie je méně účinná při zahájení po předchozí anti VEGF léčbě, která může vyvolat v tumoru biologické změny vedoucí ke vzniku rezistence na cetuximab či na panitumumab. Naopak cetuximab může v první linii léčby zvýšit citlivost k následné terapii bevacizumabem [18].
Terapie anti EGFR versus anti VEGF
Jedním z diskutovaných problémů je nalezení optimální sekvence cílené terapie u pacientů s nemutovaným genem RAS, hlavně lépe v první linii léčby, kde lze předpokládat největší terapeutický přínos. Aktuálně máme k dispozici kromě inhibitorů EGFR i možnost inhibice VEGF pomocí bevacizumabu. Anti EGFR terapie je cílena primárně na nádorové buňky, kdežto anti VEGF terapie je zaměřena na mikroprostředí nádorové tkáně inhibicí angiogeneze. Kombinace obou typů terapie se nedoporučuje pro horší léčebné výsledky, než přináší její samostatné použití v kombinaci s chemoterapií [19].
Na podkladě nepřímých srovnání různých klinických studií se zdá, že u pacientů s genem wtRAS má větší vliv na prodloužení OS použití anti EGFR terapie v první linii. Přímé srovnání obou možností cílené léčby bylo hodnoceno ve dvou sledováních fáze III. Studie AIO/FIRE 3 hodnotila u nepředléčených pacientů s mCRC s genem wtKRAS kombinaci FOLFIRI/cetuximab versus FOLFIRI/bevacizumab. Primárním cílovým ukazatelem bylo stanovení ORR, která neprokázala statisticky významný rozdíl (62 % vs. 58 %; HR 1,18; p = 0,18). Medián OS byl významně delší u pacientů léčených cetuximabem než u nemocných léčených bevacizumabem (28,7 měsíce vs. 25,0 měsíce; HR 0,77; p = 0,017) [20]. V další analýze této studie byli hodnoceni pacienti nejen s nemutovaným genem KRAS, ale i pacient s nemutovaným genem NRAS. Tato skupina prokázala ještě významnější prodloužení mediánu OS (33,1 měsíce versus 25,0 měsíce; HR 0,7; p = 0,0059) [21].
Výsledky další studie CALGB/SWOG 80405 byly prezentovány na konferenci ASCO v roce 2014. Práce hodnotila celkem 2 344 dosud neléčených nemocných s mCRC s genem wtKRAS. Podobně jako v předchozí práci byly přímo srovnávány cetuximab s bevacizumabem v první linii, oba s podáním chemoterapie (FOLFOX nebo FOLFIRI). Studie neprokázala statisticky významný rozdíl v OS (primární cílový ukazatel) mezi rameny s cetuximabem a s bevacizumabem (30 měsíců vs. 29 měsíců; HR 0,88; 95% CI [interval spolehlivosti] 0,77–1,01; p = 0,8) [22].
V roce 2016 publikoval Heinemann metaanalýzu výše uvedených studií, navíc do ní byla zahrnuta ještě data z klinické studie fáze II PEAK, která srovnávala s bevacizumabem jiný inhibitor EGFR ‒ panitumumab. Metaanalýza prokázala, že u pacientů s genem wtRAS bylo při podávání anti EGFR terapie OS významně delší než při podávání bevacizumabu (HR 0,79; p = 0,0061), hodnota PFS byla bez signifikantního rozdílu (HR 0,93; p = 0,5733). Procento ORR bylo vyšší při použití anti EGFR terapie, ale u této léčby bylo významně častější dosažení tzv. časného zmenšení tumoru v 6.‒8. týdnu od jejího zahájení. Tato skutečnost je důležitá hlavně při výběru režimu v rámci konverzní léčby jaterních metastáz u RAS nemutovaných karcinomů, kde by anti EGFR terapie měla být jednoznačně upřednostněna [23].
Cetuximab versus panitumumab
V současnosti lze v léčbě mCRC podat dva odlišné inhibitory EGFR ‒ cetuximab nebo panitumumab. Zatím nemáme jednoznačně zdokumentováno, která protilátka je výhodnější. V roce 2007 byly publikovány dvě klinické studie, které srovnávaly cetuximab s placebem a panitumumab s placebem u předléčených pacientů s mCRC refrakterním na chemoterapii. Cetuximab i panitumumab prokázaly významné prodloužení PFS, nicméně prodloužení OS nastalo jen u pacientů léčených cetuximabem [24,25]. Jedná se však o nepřímé srovnání.
Obě protilátky byly vzájemně hodnoceny v randomizované studii fáze III u nemocných s refrakterním mCRC s genem wtKRAS. Studie neprokázala statisticky významný rozdíl v mediánu OS mezi cetuximabem a panitumumabem (10,4 měsíce vs. 10,0 měsíce; HR 0,97; 95% CI 0,84–1,11) [26]. Cetuximab i panitumumab se liší v nežádoucích účincích. Při podávání cetuximabu je častější vznik anafylaktické reakce, je pozorován nepatrně vyšší výskyt únavy, nevolnosti či zvracení. Léčba panitumumabem je spojena s výraznějšími kožními reakcemi a s hypomagnezemií. K dispozici máme více klinických studií hodnotících cetuximab než panitumumab. Souvisí to s dřívějším vývojem cetuximabu, který dostal povolení Úřadu pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) k léčbě mCRC v roce 2004, panitumumab až o dva roky později. V českém registru CORECT bylo k datu 15. 9. 2015 evidováno celkem 1 784 pacientů léčených cetuximabem ve srovnání s 1 106 pacienty léčenými panitumumabem.
Odlišnosti mezi oběma přípravky lze vysvětlit různou strukturou. Obě monoklonální protilátky se skládají ze dvou stejných částí Fab, jež slouží k vazbě na nádorový antigen (EGFR), a z jednoho fragmentu Fc. Cetuximab je chimérická IgG1 protilátka, zatímco panitumumab je plně humánní IgG2 protilátka. Tento rozdíl je důležitý ve vztahu k vyvolání imunitní reakce. Panitumumab se sice váže na EGFR s větší afinitou než cetuximab, má ale výrazně nižší imunogenicitu v důsledku nižší afinity na receptor Fc gama (FcγR) [27]. Po navázání protilátky na cílovou strukturu nádorové buňky dochází k vazbě na složky komplementu s jeho aktivací a s následnou penetrací cytoplazmatické membrány nádorové buňky. Druhým způsobem destrukce nádorových buněk je buněčná cytotoxicita závislá na protilátkách, kdy po navázání protilátky na antigen nádorové buňky dochází k aktivaci makrofágů, NK buněk a cytotoxických T lymfocytů. Právě tato stimulace imunitní odpovědi je významně více vyjádřena u cetuximabu. Tuto skutečnost lze využít při kombinaci cetuximabu s protilátkami proti CTLA 4 (cytotoxický T lymfocytární antigen 4) nebo PD 1 (receptor programované buněčné smrti 1), kde probíhá řada klinických studií, zatím však převážně na modelech kolorektálního karcinomu in vitro.
Další důležitou indikací cetuximabu v kombinaci s chemoterapií je recidivující/metastatický skvamózní karcinom hlavy a krku. Toto tzv. EXTREME schéma je v současné době celosvětovým standardem v první linii léčby u uvedené indikace.
Cetuximmab v kombinaci s předoperační radioterapií
Základem léčby lokálně pokročilého karcinomu rekta je konkomitantní chemoradioterapie [28]. Výsledky této terapie však stále nejsou uspokojivé. Problémem je hlavně vznik vzdálené diseminace, která se objevuje přibližně u jedné třetiny pacientů [29,30]. Příčinou je zřejmě časné šíření nádorových buněk do vzdálených oblastí již v době stanovení diagnózy. Konkomitantní chemoterapie pravděpodobně nemá dostatečný účinek k eliminaci této subklinické diseminace. Diskutuje se proto možnost zařazení anti EGFR terapie do léčebného algoritmu lokálně pokročilého karcinomu rekta.
Uskutečnilo se několik studií převážně fáze I a II, které hodnotily cetuximab v této indikaci v kombinaci s chemoradioterapií. Používanými cytostatiky byly 5 fluorouracil, kapecitabin, oxaliplatina nebo irinotekan. Dávka radioterapie se pohybovala v rozmezí 45–50,4 Gy. Hlavním cílem bylo hodnocení patologické kompletní remise (pathological complete response, pCR), která je prediktorem delšího přežití bez známek recidivy (disease free survival, DFS) i OS [31]. V rámci hodnocení klinických studií dosahovala celková průměrná pCR pouze 10,7 % (0–25 %) [32]. Tento výsledek není lepší než procento výskytu pCR (13,5 %) u pacientů léčených neoadjuvantní chemoradioterapií bez podání cetuximabu, jak prokázala rozsáhlá metaanalýza [33]. K ozřejmení problematiky kombinace chemoradioterapie a anti EGFR léčby bude nutné další studium vzájemné interakce jednotlivých terapeutických modalit. Například Nyati a spolupracovníci diskutují o tom, zda by příčinou nemohla být suboptimální sekvence podávané léčby, která může vyústit spíše v antagonistický efekt než v efekt potenciační [34]. Další příčinou nižšího procenta pCR po předoperační chemoradioterapii v kombinaci s cetuximabem může být snížení tumorové proliferace po aplikaci inhibitoru EGFR s následnou nižší odpovědí méně proliferujících buněk na ionizující záření [35].
V neoadjuvantní léčbě karcinomu rekta je navíc méně zdokumentován prediktivní význam stavu mutace genu RAS než v paliativním podání. Podle asi nejrozsáhlejší klinické studie fáze II EXPERT C bylo zjištěno významné prodloužení OS u pacientů s genem wtKRAS léčených cetuximabem. Nemocní byli v této studii léčeni indukční chemoterapií v režimu XELOX, následně byla indikována radioterapie v kombinaci s kapecitabinem [36]. Problémem kombinované neoadjuvantní léčby může být i zhoršení toxicity po přidání cetuximabu.
Možností, jak léčbu více individualizovat, je studium dynamiky EGFR během neoadjuvantní chemoradioterapie. Dvě české práce potvrdily významně kratší DFS i OS u pacientů se zvýšením exprese EGFR po podání neoadjuvantní chemoradioterapie. Byla srovnávána exprese EGFR v diagnostické endobiopsii a exprese EGFR v resekátu po chemoradioterapii. Jednalo se přibližně o 25 % pacientů, u nichž došlo ke zvýšení exprese EGFR [37‒39]. Indukované zvýšení EGFR souvisí zřejmě s akcelerovanou repopulací nádorových kmenových buněk, která je zodpovědná za selhání léčby. Je vhodné identifikovat skupinu pacientů se zvýšením exprese EGFR během předoperační radiochemoterapie, jež by mohla mít přínos z další léčby inhibitory EGFR po chirurgickém výkonu, eventuálně na podkladě in vivo vyšetření pomocí PET EGFR již s časným zařazením cetuximabu do neoadjuvance. Další klinické studie budou nutné k pochopení této perspektivní možnosti léčby. Aktuálně nepatří podání cetuximabu v neoadjuvantní léčbě v kombinaci s radioterapií mezi terapeutické standardy.
Seznam použité literatury
- [1] Willett CG, Duda DG, Czito BG, et al. Targeted therapy in rectal cancer. Oncology (Williston Park) 2007; 21: 1055–1065.
- [2] Yarden Y. The EGFR family and its ligands in human cancer: signalling mechanism and therapeutic opportunities. Eur J Cancer 2001; 37: S3–S8.
- [3] Uberall I, Kolar Z, Trojec R, et al. The status and role of ErbB receptors in human cancer. Exp Mol Pathol 2008; 84: 79–89.
- [4] Pfeiffer P, Nielsen D, Bjerregaard J, et al. Biweekly cetuximab and irinotecan as third‑line therapy in patients with advanced colorectal cancer after failure to irinotecan, oxaliplatin and 5‑fluorouracil. Ann Oncol 2008; 19: 1141–1145.
- [5] Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotekan in irinotekan‑refractory metastatic colorectal cancer. N Engl J Med 2004; 351: 337–345.
- [6] Karapetis CS, Khambata‑Ford S, Jonker D, et al. K‑ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008; 359: 1757–1765.
- [7] Van Cutsem E, Köhne CH, Láng I, et al. Cetuximab plus irinotecan, fluorouracil, and leucovorin as first‑line treatment for metastatic colorectal cancer: updated analysis of overall survival according to tumor KRAS and BRAF mutation status. J Clin Oncol 2011; 29: 2011–2019.
- [8] Bokemeyer C, Bondarenko I, Makhson A, et al. Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first‑line treatment of metastatic colorectal cancer. J Clin Oncol 2009; 27: 663–671.
- [9] Maughan TS, Adams RA, Smith CG, et al. Addition of cetuximab to oxaliplatin‑based first‑line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet 2011; 377: 2103–2114.
- [10] Tveit KM, Guren T, Glimelius B, et al. Phase III trial of cetuximab with continuous or intermittent fluorouracil, leucovorin, and oxaliplatin (Nordic FLOX) versus FLOX alone in first‑line treatment of metastatic colorectal cancer: the NORDIC‑VII study. J Clin Oncol 2012; 30: 1755–1762.
- [11] Qin S, Xu J, Wang L, et al. LBA‑05 First‑line FOLFOX‑4 ± cetuximab in patients with RAS wild‑type (wt) metastatic colorectal cancer (mCRC): the open‑label, randomized phase 3 TAILOR trial. Ann Oncol 2016; 27 (Suppl 4): 0–25.
- [12] Hebbar M, Lacko F. Usefulness of epidermal growth factor receptor expression determination for cetuximab therapy in patients with colorectal cancer. Anticancer Drug 2006; 17: 855–857.
- [13] Liévre A, Bachet JB, Le Corre D, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66: 3992–3995.
- [14] Pietrantonio F, Petrelli F, Coinu A, et al. Predictive role of BRAF mutations in patients with advanced colorectal cancer receiving cetuximab and panitumumab: a meta‑analysis. Eur J Cancer 2015; 51: 587–594.
- [15] Moa C, Liao RY, Qiu LX, et al. BRAF V600E mutation and resistance to anti‑EGFR monoclonal antibodies in patients with metastatic colorectal cancer: a meta‑analysis. Mol Biol Rep 2011; 38: 2219–2223.
- [16] Shen H, Yang J, Huang Q, et al. Different treatment strategies and molecular features between right‑sided and left‑sided colon cancers. World J Gastroenterol 2015; 21: 6470–6478.
- [17] Venook AP, Niedzwiecki D, Innocenti F, et al. Impact of primary (1°) tumor location on overall survival (OS) and progression‑free survival (PFS) in patients (pts) with metastatic colorectal cancer (mCRC): Analysis of CALGB/SWOG 80405. J Clin Oncol 2016; 34 (Suppl): 3504 (Abstr).
- [18] Zaniboni A, Formica V. The Best. First. Anti‑EGFR before anti‑VEGF, in the first‑line treatment of RAS wild‑type metastatic colorectal cancer: from bench to bedside. Cancer Chemother Pharmacol 2016; 78: 233–244.
- [19] Tol J, Koopman M, Cats A, et al. Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N Engl J Med 2009; 360: 563–572.
- [20] Heinemann V, Fischer von Weikersthal L, Decker T, et al. Randomised comparison of FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first‑line treatment of KRAS wild‑type metastatic colorectal cancer: German AIO study KRK‑0306 (FIRE‑3). J Clin Oncol 2013; 31 (Suppl): LBA3506 (Abstr).
- [21] Stintzig S, Jung A, Rossius L, et al. Analysis of KRAS/NRAS and BRAF mutations in FIRE‑3: a randomized phase III study of FOLFIRI plus cetuximab or bevacizumab as first‑line treatment for wild‑type (WT) KRAS (exon 2) metastatic colorectal cancer (mCRC) patients. Eur J Cancer 2013; 49 (Suppl 3): LBA17 (Abstr).
- [22] Venook A, Niedzwiecki H, Lenz HJ, et al. CALGB/SWOG 8040. Ann Oncol 2014; 25: ii105–ii117.
- [23] Heinemann V, Rivera F, O’Neil BH, et al. A study‑level meta‑analysis of efficacy data from heed‑to‑head first line trial of epidermal growth factor receptor inhibitors versus bevacizumab in patients with RAS wild‑type metastatic colorectal cancer. Eur J Cancer 2016; 67: 11–20.
- [24] Jonker DJ, O’Callaghan CJ, Karapetis CS, et al. Cetuximab for the treatment of colorectal cancer. N Engl J Med 2007; 357: 2040–2048.
- [25] Van CE, Peeters M, Siena S, et al. Open‑label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy‑refractory metastatic colorectal cancer. J Clin Oncol 2007; 25: 1658–1664.
- [26] Price JT, Peeters M, Kim TW, et al. Panitumumab versus cetuximab in patients with chemotherapy‑refractory wild‑type KRAS exon 2 metastatic colorectal cancer (ASPECT): a randomised, multicentre, open‑label, non‑inferiority phase 3 study. Lancet Oncol 2014; 15: 569–579.
- [27] Mellor JD, Brown MP, Irving HR, et al. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. J Hemat Oncol 2013; 6: 1–10.
- [28] Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351: 1731–1740.
- [29] Bosset JF, Collette L, Calais G, et al. Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med 2006; 355: 1114–1123.
- [30] Gerard JP, Conroy T, Bonnetain F, et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorine in T3‑4 rectal cancers: results of FFCD 9203. J Clin Oncol 2006; 24: 4620–4625.
- [31] Rodel C, Martus P, Papadoupolos T, et al. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J Clin Oncol 2005; 23: 8688–8696.
- [32] Richter I, Dvořák J, Bartoš J. Neoadjuvatní chemoradioterapie karcinomu rekta v kombinaci s inhibitory receptoru pro růstový epidermální faktor. Klin Onkol 2014; 27: 166–172.
- [33] Hartley A, Ho KF, McConkey C, et al. Pathological complete response following preoperative chemoradiotherapy in rectal cancer: analysis of phase II/III trials. Br J Radiol 2005; 78: 934–938.
- [34] Nyati MK, Morgan MA, Feng FY, et al. Integration of EGFR inhibitors with radiochemotherapy. Nat Rev Cancer 2006; 6: 876–885.
- [35] Rau B, Sturm I, Lage H, et al. Dynamic expression profile of p21WAF1/CIP1 and Ki‑67 predicts survival in rectal carcinoma treated with preoperative radiochemotherapy. J Clin Oncol 2003; 21: 3391–3401.
- [36] Dewdney A, Cunningham D, Tabernero J, et al. Multicenter randomized phase II clinical trial comparing neoadjuvant oxaliplatin, capecitabine, and preoperative radiotherapy with or without cetuximab followed by total mesorectal excision in patients with high‑risk rectal cancer (EXPERT‑C). J Clin Oncol 2012; 30: 1620–1627.
- [37] Dvořák J, Sitorová V, Ryška A, et al. The prognostic significance of changes of tumour epidermal growth factor receptor expression after neoadjuvant chemoradiation in patiens with rectal adenocarcinoma. Strahlenter Onkol 2012; 10: 145–147.
- [38] Richter I, Dvořák J, Blüml A, et al. Vliv předoperační chemoradioterapie na změnu exprese receptoru pro epidermální růstový faktor u pacientů léčených předoperační chemoradioterapií pro lokálně pokročilý karcinom rekta. Klin Onkol 2014; 27: 361–366.
- [39] Richter I, Dvořák J, Blüml A, et al. The prognostic significance of tumor epidermal growth factor receptor (EGFR) expression change after neoadjuvant chemoradiation in patients with rectal adenocarcinoma. Contemp Oncol 2015; 19: 48–53.