Úvod
Kolorektální karcinom (CRC) je jedním z nejfrekventovanějších nádorových onemocnění vůbec. Pomineme-li nádory kůže, představuje v České republice 3. nejčastější malignitu u mužů (hned za nádory plic a prostaty) a 2. nejčastější malignitu u žen (po karcinomu prsu).
Incidence tohoto onemocnění neustále narůstá (8000 osob v roce 2005), zatímco mortalita v poslední době stagnuje (ročně zemře na následky CRC v ČR přibližně 4400 pacientů). V celosvětovém žebříčku incidence Česká republika dlouhodobě balancuje mezi prvním a druhým místem [1].
Přibližně čtvrtina pacientů je již primárně diagnostikována ve IV. klinickém stadiu, u dalších 50 % pacientů nastává generalizace onemocnění v pozdější době. Nejčastěji dochází k metastatickému postižení jater.
Jedině radikální chirurgické odstranění metastáz přináší možnost dlouhodobého přežití. Tato metoda je však technicky možná jen zhruba u 20 % pacientů. Většina pacientů je tak odkázána na systémovou paliativní chemoterapii (CHT), jejímž hlavním cílem je prodloužení života pacientů a zlepšení jeho kvality. Z cytostatik se v terapii CRC již několik desetiletí používá antimetabolit 5-fluorouracil (5-FU) modulovaný leukovorinem (folinic acid, FA) – režim FU/FA v bolusovém nebo kontinuálním podání. Přidání irinotekanu (režim FOLFIRI) nebo oxaliplatiny (režim FOLFOX) zvyšuje procento léčebných odpovědí a zlepšuje přežití nemocných. V případě, že je pacient léčen sekvenčně kombinovanou chemoterapií s 5-fluorouracilem, irinotekanem a oxaliplatinou, jsou léčebné výsledky nejlepší a medián přežití přesahuje 20 měsíců. Tato léková kombinace představuje v současnosti zlatý standard cytostatické léčby metastatického CRC (mCRC) [2–5].
Překážkou déletrvajícího úspěchu léčby chemoterapií je však neselektivita cytotoxických látek a postupný rozvoj rezis
tence nádorových buněk. Důsledkem
neselektivity cytostatik je poškození rychle se množících buněk kostní dřeně a sliznice zažívacího traktu, které vyúsťuje v nutnost redukce dávky, a tím i dosažení horší léčebné odpovědi. Suboptimální dávkování cytostatik (mimo jiné) pak vede k postupnému rozvoji rezistence nádorových buněk a k vymizení efektu původně účinné léčby.
V posledních letech se pozornost celé onkologické veřejnosti obrací k molekulárním mechanismům vzniku a rozvoje nádorového onemocnění a k možnostem jejich terapeutického ovlivnění. Byla identifikována řada klíčových molekul uvnitř signálních drah regulujících růst, diferenciaci a apoptózu nádorových buněk, které je možné cíleně terapeuticky ovlivnit.
U mCRC je pozornost v současnosti zaměřena především na receptor pro epidermální růstový faktor (EGFR) a na ligand receptoru pro vaskulární endotelový růstový faktor (VEGF). Proti oběma uvedeným molekulám byly vyvinuty monoklonální protilátky a byla ověřena jejich účinnost v praxi.
Receptor pro epidermální růstový faktor (EGFR)
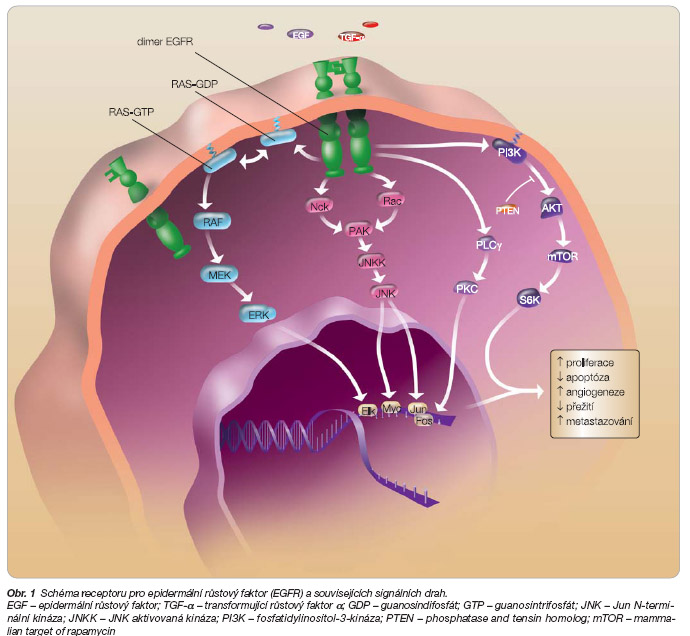
Zvýšená exprese tohoto tyrozinkinázového receptoru označovaného též HER-1 (erbB-1) byla prokázána u většiny pacientů s mCRC [6, 7]. EGFR se skládá z extracelulární domény vázající ligand, transmembránového segmentu a intracelulární domény, se kterou je spojena tyrozinkinázová aktivita zodpovědná za přenos signálu. Vazbou ligandu – EGF, transformující růstový faktor-
a
(TGF-
a
), amphiregulin, epiregulin, betacellulin a heparin vázající EGF (HB-EGF) – na receptor dochází k tvorbě heterodimerických receptorových komplexů s následnou autofosforylací tyrozinkinázové domény [8, 9]; cestou především dostředivé dráhy RAS-RAF-MEK-MAPK a dráhy PI3K-AKT-mTOR-S6K pak dochází k ovlivnění transkripce v jádře, a tím i k ovlivnění proliferace, apoptózy, angiogeneze a metastatického potenciálu nádorové buňky, viz
obr. 1
. Aktivace EGFR tedy vede ke zvýšenému přežívání a proliferaci nádorové buňky, k novotvorbě cév a dále podporuje migraci, invazi, a v důsledku toho i metastazování.
Cetuximab je chimérická (skládá se z části lidské a myší) IgG1 monoklonální protilátka proti EGFR, která má přibližně 10násobnou afinitu k receptoru ve srovnání s fyziologickými ligandy. Je produkován pomocí rekombinantní DNA technologie s využitím buněčné linie savčích buněk. Blokádou receptoru inhibuje výše uvedené děje a vede k apoptóze nádorových buněk [10, 11]. V preklinických studiích byl u této látky prokázán synergický protinádorový účinek při kombinaci s cytostatiky (především s irinotekanem)
in vitro
a
in vivo
, a dokonce i možnost překonání rezistence k chemoterapii, na kterou již nebyla při předchozí léčbě zaznamenána žádná léčebná odpověď. Tento mechanismus je vysvětlován např. obnovením apoptózy, poškozením reparační aktivity DNA či zabráněním úniku cytostatika z buňky [12–15].
Zásadní studií v historii této účinné látky byla randomizovaná klinická studie
fáze II EMR 62202-007 BOND , která ve
2 ramenech srovnávala léčbu samotným cetuximabem s léčbou kombinací cetuximabu a irinotekanu u pacientů s mCRC [13]. Podmínkou zařazení pacientů do studie byla pozitivní nádorová exprese EGFR a selhání předchozí léčby irinotekanem. V kombinovaném rameni bylo dosaženo celkové odpovědi (response rate, RR, tj. kompletní remise, CR, + parciální remise, PR) u 23 % pacientů a klinického benefitu (CR + PR + stabilizace onemocnění, SD)
u 56 % pacientů; medián času do pro
grese (time to progression, TTP) byl 4,1 měsíce a medián přežití od zahájení léčby cetuximabem (overall survival, OS) 8,6 měsíce. V rameni s monoterapií cetuximabem byly výsledky signifikantně horší – RR 11 %, TTP 1,5 měsíce a medián OS 6,9 měsíce.
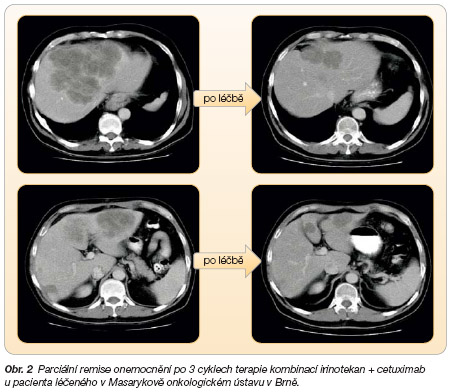
Na základě těchto výsledků byl cetuximab kategorizován a zařazen do léčby pacientů s mCRC exprimujícím EGFR po selhání předchozí léčby irinotekanem nejprve ve Spojených státech amerických a od července 2005 se používá také v České republice (viz
obr. 2
).
Podmínky pro zahájení léčby
– �pozitivní exprese EGFR stanovená imunohistochemicky (pomocí PharmDX kitu DAKO, event. ZYMED). Nutno podotknout, že prediktivní hodnota tohoto parametru je dle aktuálních výsledků studií velmi slabá, vyšetření je však stále vyžadováno pojišťovnou pro úhradu léčiva z prostředků zdravotního pojištění;
– �absence mutace onkogenu KRAS (tedy přítomnost tzv. divokého typu KRAS) stanovená metodou sekvenování genu nebo pomocí PCR (kit TheraScreen KRAS) – viz dále;
– �přiměřené hematologické, renální a jaterní parametry;
– �dobrý celkový stav pacienta (ECOG PS 0 a 1, absence metastáz v CNS hodnocená klinicky).
Léčebné schéma
Cetuximab se podává v úvodní nasycovací dávce 400 mg/m2
tělesného povrchu intravenóz
ně
po dobu 120 minut po před
chozí premedikaci antihistaminikem a kortikoidy. Tato premedikace je doporučena i při všech následných týdenních aplikacích, kdy je dávka cetuximabu snížena na 250 mg/m2 a doba aplikace zkrácena na 60 minut. V průběhu podávání infuze a minimálně 1 hodinu po jejím ukončení je nutné pečlivé monitorování vitálních funkcí. Pokud se podává současně irinotekan, aplikujeme jej s časovým odstupem minimálně 1 hodiny od ukončení aplikace cetuximabu v dávce 350 mg/m2 tělesného povrchu jedenkrát za tři týdny (event. v redukované dávce 300 mg/m2, pokud předcházela v minulosti radioterapie na oblast pánve). V případě kombinace s režimem FOLFIRI, event. FOLFOX, následuje po aplikaci irinotekanu (resp. oxaliplatiny) klasická kontinuální infuze s 5-fluorouracilem a leukovorinem.
Léčba probíhá do progrese onemocnění nebo do stavu neakceptovatelné toxicity. Důvodem pro ukončení léčby je i závažná reakce z přecitlivělosti (stupeň 3 nebo 4 podle stupnice National Cancer Institute – Common Toxicity Criteria, NCI-CTC). Pokud se u pacienta vyskytne kožní reakce stupně 3 (exantém postihující více než 50 % tělesného povrchu), musí být léčba cetuximabem přerušena a může být znovu zahájena bez jakékoli změny dávky v případě, že dojde ke zmírnění reakce na stupeň 2. Při dalším výskytu závažných
kožních reakcí je nutné léčbu opět přeru
šit a po zlepšení na stupeň 2 lze pokračovat v nižším dávkování cetuximabu (200 mg/m2
po druhém výskytu a 150 mg/m2 po tře
tím výskytu závažné kožní reakce).
Farmakokinetika
Týdenní aplikace cetuximabu vychází z dlouhého biologického poločasu, který se pohybuje v rozmezí od 79 do 129 hodin při cílové dávce. Sérová koncentrace cetuximabu dosahuje stabilních hodnot po 3 týdnech podávání v monoterapii.
Nežádoucí účinky léčby (NUL)
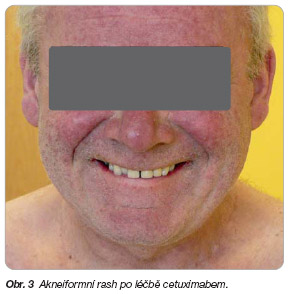
K velmi častým nežádoucím účinkům léčby cetuximabem (> 10 %) patří především akneiformní exantém (u 80 % nemocných, nástup v prvních 3 týdnech léčby, vyšší stupeň predikuje klinický efekt, viz
obr. 3
), dále suchá kůže a pruritus, dušnost, mírnější reakce spojené s infuzí (horečka, třesavka, nauzea, vomitus, cefalea, vertigo – objeví se většinou krátce po první aplikaci cetuximabu) a lehké zvýšení hladin jaterních enzymů. K častým nežádoucím účinkům (1–10 %) patří především závažné alergické reakce, které vznikají do 1 hodiny po první infuzi léčiva a projevují se rychlou obstrukcí dýchacích cest (bronchospasmus, stridor, chrapot), kopřivkou, hypotenzí až ztrátou vědomí. Pokud se objeví, vyžadují okamžité a trvalé přerušení léčby cetuximabem. Z dalších nežádoucích reakcí lze zmínit ještě iontové dysbalance (především hypomagnezémii), event. mukozitidu a konjunktivitidu.
Klinické studie
Primární ověření účinnosti a bezpečnosti cetuximabu u předléčených pacientů s mCRC
1. �BOND – viz výše [13].
2. �MABEL (Monoclonal Antibody erBitux in a European pre-Licence study) – evropská studie, která potvrdila účinnost cetuximabu u mCRC a ukázala, že přidání antihistaminik k běžným kortikosteroidům může snížit četnost alergických reakcí na 1 % při zachování účinnosti [16].
3. �LABEL (Latin American erBitux prE-Licence study) – 1ramenná studie (jen cetuximab + irinotekan), ve které bylo dosaže
no RR 27 % při mediánu TTP > 4
měsíce a mediánu OS 9,7 měsíce [17].
4. �Studie 045 – ověřila bezpečnost a účinnost i při podávání cetuximabu v dávce 500 mg/m2 1krát za 2 týdny [18].
5. �EVEREST (Evaluation of Various Erbitux REgimens by means of Skin and Tumour biopsies) – ukázala, že při absenci kožní toxicity lze zvyšováním dávky cetuximabu o 50 mg/m2 týdně až do dávky 500 mg/m2 docílit navýšení RR (ze 16 % až na 30 %) [19].
Studie se zaměřením na kvalitu života
1. �EPIC (The Erbitux Plus Irinotecan in Colorectal Cancer) – studie fáze II, ve
které bylo 1298 pacientů (po selhání léčby oxaliplatinou) randomizováno do 2
ramen: 1/ cetuximab + irinotekan vs. 2/ irinotekan v monoterapii. Primárním
cílem byla doba do progrese (progression-free sur
vi
val, PFS), sekundárním
cílem pak kva
li
ta
života pacientů (hod
nocená pomocí
dotazníků EORTC QLQ
-C30). Bylo dosaženo zlepšení RR (16,4 %
vs. 4,2 %) i zlepšení PFS (HR 0,69; p < 0,0001), celkové přežití (OS)
bylo srovnatelné. I přes očekávané
výraznější nežádoucí účinky léčby v kombinovaném rameni (navíc byl oproti monoterapii zaznamenán exantém, únava a průjem) však bylo při léčbě kombinací irinotekanu s cetuximabem potvrzeno signifikantní zlepšení kvality života, a to především v parametrech zlepšení celkového zdravotního stavu, zmírnění bolestí a zmírnění nauzey [20].
2. �NCIC CO.17 – randomizovaná studie fáze III, ve které bylo 572 pacientů rozděleno do dvou ramen: 1/ cetuximab + BSC („best supportive care" – nejlepší podpůrná léčba) vs. 2/ BSC. V rameni s cetuximabem bylo opět dosaženo signifikantního zlepšení kvality života pa
cientů a zlepšení OS (6,1 vs. 4,6 měsí
ce,
HR 0,77; p = 0,0046), PFS zůstal
nezměněn (1,9 vs. 1,8 měsíce) [21].
Studie s kombinací protilátek anti-EGFR a anti-VEGF
1. �BOND 2 – studie fáze II, jejíž nevýhodou byl relativně nízký počet zařazených
pacientů (n = 83). Obsahovala 2 rame
na: 1/ cetuximab + bevacizumab + irinotekan vs. 2/ cetuximab + bevacizumab. Bylo sice dosaženo zlepšení RR (37 % vs. 20 %) a TTP (7,3 vs. 4,9 měsíce), ovšem za cenu zvýšení toxicity (přede
vším průjmy stupně 3/4 u 28 % vs. 0
%). Výsledky byly pro nízký počet hodnocených pacientů statisticky nesignifikantní, pro pomalý nábor pacientů byla studie nakonec předčasně zastavena [22].
2. �CAIRO 2 – randomizovaná studie fáze III, ve které bylo 755 pacientů s nepředléčeným mCRC rozděleno do 2 ramen: 1/ kapecitabin + oxaliplatina + bevacizumab + cetuximab vs. 2/ kapecitabin + oxaliplatina + bevacizumab. Primárním cílem byl PFS. V kombinovaném rameni došlo při očekávané vyšší toxicitě (především výskyt průjmu u 26 % vs.
19 %; p
= 0,026) k překvapivému zhor
šení
mediánu PFS (9,6 vs. 10,7 měsíce; p = 0,0018), OS byl srovnatelný (20,3 vs. 20,4 měsíce). Při subanalýze dle KRAS (viz dále) u „wild type" KRAS v kombinovaném rameni nebylo zaznamenáno zlepšení výsledků, naopak v přítomnosti mutace KRAS při kombinaci obou protilátek byl výrazně zhoršen PFS (8,6 vs. 12,5 měsíce; p = 0,043) a nesignifikantně i OS (19,1 vs. 24,9 měsíce; p = 0,35) [23].
3. �PACCE – studie s konkurenční anti-EGFR protilátkou panitumumabem, ve které bylo 800 pacientů rozděleno do ramen: 1/ FOLFOX + bevacizumab + panitumumab vs. 2/ FOLFOX + bevacizumab. Při kombinaci obou protilátek byla zaznamenána opět výrazně vyšší toxicita (stupeň 3/4 u 81 % vs. 69 %), navíc došlo i ke zhoršení PFS (9 vs. 10,5 měsíce) a ke zhoršení celkového přežití [24].
4. �CALGB/SWOG 80405 – studie fáze III, ve které byli dosud nepředléčení pacienti s mCRC randomizováni do jednoho ze 3 ramen: chemoterapie dle rozhodnutí lékaře (FOLFOX nebo FOLFIRI) + 1/ bevacizumab, 2/ cetuximab, 3/ kombinace cetuximabu a bevacizumabu. Vzhledem k referované vyšší toxicitě při kombinaci obou typů protilátek však byla studie pozastavena.
Celkově lze tedy shrnout, že
kombinace anti-EGFR a anti-VEGF terapie je výrazně toxičtější než podání protilátek samostatně, především však nezlepšuje léčebné výsledky, ba naopak zhoršuje PFS a pravděpodobně i celkové přežití s akcentací u pacientů s mutací KRAS.
Cetuximab v I. linii léčby pacientů s mCRC – 2 zásadní studie
1. �CRYSTAL (Cetuximab combined with iRinotecan in first line therapY for metaSTatic colorectAL cancer) – randomizovaná studie fáze III, ve které bylo 1198 pacientů s mCRC s prokázanou expresí EGFR rozděleno do 2 ramen: 1/ FOLFIRI + cetuximab vs. 2/ FOLFIRI. Podařilo se dosáhnout primárního cíle, kterým byl PFS – v kombinovaném rameni došlo ke zlepšení mediánu PFS (8,9 vs. 8 měsíců; p = 0,0048), 1letého PFS (34 % vs. 20 %) i objektivní odpovědi (RR 47 % vs. 39 %; p = 0,004), dále pak ke zvýšení procenta resekability jaterních metastáz (6 % vs. 2,5 %). NUL byly v obou ramenech srovnatelné kromě vyšší četnosti průjmů (15 % vs. 10 %) a kožních reakcí v rameni s cetuximabem [25].
2. �OPUS – randomizovaná studie fáze II, ve které bylo analogicky jako v předchozí studii randomizováno 337 pacientů (s mCRC exprimujícím EGFR) do 2 ramen: 1/ FOLFOX 4 + cetuximab vs. 2/ FOLFOX 4. Primárním cílem byl v tomto případě RR, který se podařilo při kombinaci biochemoterapie zvýšit z 36 % na 46 % (p = 0,064), dále byl v kombinovaném rameni zaznamenán vyšší počet kurativních chirurgických výkonů. Medián PFS byl v obou ramenech stejný, tedy 7,2 měsíce (HR 0,931; p = 0,62). Z NUL převládaly opět kožní reakce (stupeň 3/4 u 14 % pacientů s cetuximabem) a reakce z přecitlivělosti (u 4 % pacientů), ostatní NUL byly v obou ramenech srovnatelné [26].
Studie a subanalýzy studií se zaměřením na status onkogenu KRAS
Jak již bylo uvedeno výše, většina studií zařazovala pacienty do léčby cetuximabem dle imunohistochemicky stanovené exprese EGFR na povrchu nádorové buňky. Při probíhajícím výzkumu však bylo opakovaně prokázáno, že i nemalá část pacientů (více než 25 %) s negativní expresí receptoru na povrchu buňky zareaguje na léčbu cetuximabem a naopak – jen část pacientů s pozitivní expresí EGFR na tuto léčbu skutečně odpoví (RR se u samostatné protilátky pohybuje mezi 9–13 %, při kombinaci s irinotekanem kolem 25 % a při použití s kombinovanou chemotera
pií FOLFOX, resp. FOLFIRI v rozmezí 46
% a 47 %) [27, 28].
Není tedy divu, že se výzkum zaměřil na hledání dalších potenciálních prediktivních parametrů, které by dokázaly lépe předpovídat odpověď na tuto ekonomicky poměrně nákladnou léčbu.
Ze všech zkoumaných faktorů (EGFR exprese stanovená pomocí metody FISH, mutace genu pro EGFR, počet kopií genu pro EGFR, hladina PTEN, koncentrace ligandů pro EGFR – epiregulinu a amphiregulinu, mutace KRAS…) vykázalo nejlepší výsledky právě vyšetření mutace onkogenu KRAS [29–35].
Jak již bylo zmíněno v úvodu, po navázání ligandu na EGFR dojde k dimerizaci receptoru, autofosforylaci tyrozinkinázové domény a k aktivaci signálních drah RAS-RAF-MEK-MAPK a PI3K-AKT-mTOR-S6K (
obr. 1
). Klíčovou součástí této signalizační kaskády je GTP vázající onkoprotein KRAS (resp. RAS), lokalizovaný na vnitřní straně buněčné membrány; tento onkoprotein se vyskytuje ve dvou vzájemně v sebe přecházejících konfiguracích – aktivní GTP-RAS a inaktivní GDP-RAS. Navázáním ligandu na EGFR dojde k přeměně inaktivní GDP-formy na aktivní GTP-RAS a k následnému přenosu signálu směrem k jádru buňky, což vyúsťuje v aktivaci transkripce genů regulujících negativně apoptózu a pozitivně proliferaci, angio
genezi a buněčnou migraci
(metastazování). Pokud dojde k zablokování EGFR cetuximabem, zůstává RAS v inaktivní GDP-formě a transdukce signálu směrem k jádru je přerušena.
Přibližně u 40 % pacientů
s CRC je však v genu KRAS, kódujícím tento GTPázový RAS-pro
tein, přítomna mutace. Bylo
identifikováno 7 hlavních mutací v kodonech 12 a 13, nejčastější je záměna glycinu v kodonu 12 za asparagin (Gly12Asp). Produktem mutovaného genu KRAS je funkčně alterovaný
onkoprotein RAS, který se
vyskytuje pouze v GTP-formě, je tedy trvale aktivní a vysílá stimulační signál k jádru buňky nezávisle na stavu EGFR. Blokáda EGFR monoklonální protilátkou je v tomto případě zce
la nadbytečná a neúčinná.
Status onkogenu KRAS se ukázal jako zřetelný prediktivní parametr odpovědi na anti-EGFR terapii. Onkogen bez přítomnosti mutace označujeme jako „wild type" KRAS (wtKRAS), s mutací mKRAS. Studuje se i jeho potenciálně prognostický význam – přítomnost mutace KRAS totiž ve většině případů znamená horší prognózu pro
pacienta s nádorovým one
mocněním.
K vyšetření lze kromě zmrazené nádorové tkáně použít i archivované parafinové bločky se vzorky nádorů. Status onkogenu KRAS může být vyšetřen buď klasickým sekvenováním genu, které je časově náročnější, nebo alternativně pomocí specializovaných kitů, pracujících na principu kombinace alelově specifické PCR (polymerázová řetězová reakce) a PCR v reálném čase (např. kit TheraScreen KRAS). Touto metodou lze detekovat i méně než 1 % mutací na pozadí wtKRAS. V České republice existuje v současné době 9 specializovaných laboratoří, které toto vyšetření provádějí (Praha – 3 pracoviště tohoto typu, Plzeň, Hradec Králové, Brno, Olomouc, Ostrava a Nový Jičín).
Uvedené závislosti byly ověřeny ve 3 randomizovaných klinických studiích fáze III, resp. v jejich subanalýzách, jejichž výsledky byly zveřejněny na 44. výroční konferenci ASCO v červnu 2008:
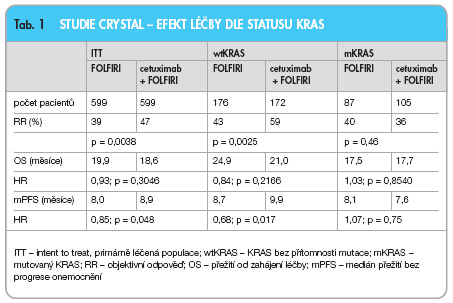
1. �CRYSTAL (FOLFIRI
6
cetuximab) – KRAS-status byl analyzován u 540 pacientů (45 % ze všech zařazených), z nichž byl u 348 pacientů identifikován wtKRAS (64,4 %) a u 192 pacientů mKRAS (35,6 %). Hodnocená populace byla srovnatelná s primární léčenou (intent to treat, ITT) populací. U pacientů s wtKRAS bylo v kombinovaném rameni oproti chemoterapii samotné dosaženo signifikantního zlepšení mediánu PFS (9,9 vs. 8,7 měsíce, HR 0,68; p = 0,017), zlepšení jednoletého přežití bez progrese (1-y PFS: 43 % vs. 25 %)
i objektivní odpovědi (RR 59 % vs. 43
%; p = 0,0025), nesignifikantně pak i zlepšení celkového přežití (OS 24,9 vs. 21
měsíců, HR 0,84; p = 0,2166), viz
tab.
1
a
graf 1
. Zatímco v rameni s FOLFIRI nebyl patrný rozdíl v PFS mezi pacienty s wtKRAS a pacienty s mutací, v kombinovaném rameni FOLFIRI + cetuximab
již byl tento rozdíl evidentní – medián
PFS 9,9 vs. 7,6 měsíce ve prospěch pacientů s wtKRAS (HR 0,63; p = 0,007). Z NUL byla v kombinovaném rameni
zaznamenána vyšší četnost neutrope
nií,
průjmů, vomitu a akneiformního rashe
(podobně jako u ITT-populace), signi
fi
kantní rozdíly v NUL mezi wtKRAS a mKRAS nebyly prokázány [36].
2. �OPUS (FOLFOX
6
cetuximab) – KRAS-status byl analyzován u 233 pacientů (69 % z ITT), z nich u 134 pacientů identifikován wtKRAS (58 %) a u 99 pa
cientů mKRAS (42 %). Hodnocená
populace byla opět plně srovnatelná s ITT populací. U pacientů s wtKRAS bylo v kombinovaném rameni oproti chemoterapii samotné dosaženo signifikantního zlepšení mediánu PFS (7,7 vs. 7,2 měsíce, HR 0,57; p = 0,016) i objektivní odpovědi (RR 61 % vs. 37 %; p = 0,011), viz
tab. 2
a
graf 1
. V kombinovaném rameni FOLFOX + cetuximab byl potvrzen evidentní rozdíl v PFS mezi pacienty s wtKRAS a pacienty s mutací – medián PFS 7,7 vs. 5,5 měsíce (HR 0,45; p = 0,0009) ve prospěch pacientů s wtKRAS. Z NUL byly v kombinovaném rameni opět častější neutropenie, průjmy a akneiformní rash [37].
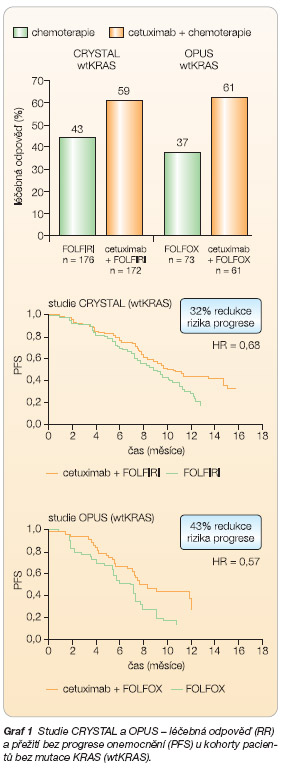
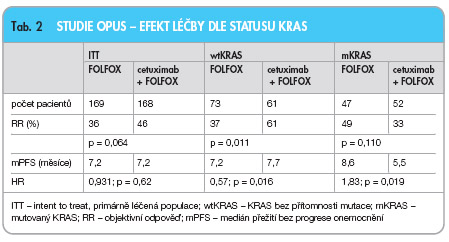
Celkově lze shrnout, že při srovnání wtKRAS-populace s ITT-populací došlo k evidentnímu zvýraznění léčebného prospěchu z přidání cetuximabu k chemoterapii u populace s wtKRAS. U populace s mKRAS nepředstavovalo přidání cetuximabu k chemoterapii žádný přínos, naopak při srovnání s pacienty léčenými pouze chemoterapií došlo k mírnému zhoršení v parametrech RR i mediánu PFS, které však nebylo statisticky signifikantní. Při mKRAS může tedy přidání cetuximabu pacientům event. i škodit! Pokud postavíme proti sobě v rameni se samostatnou chemoterapií populaci s wtKRAS a mKRAS, nenajdeme žádné výraznější rozdíly.
3. �Studie NCIC – CO.17 (cetuximab vs. BSC) – KRAS-status byl vyšetřen u 394
pacientů (69 % z ITT) – u 164 z nich (42
%) identifikován wtKRAS a u 230 (58 %) mKRAS. Obě populace byly srovnatelné s ITT populací. U pacientů s mKRAS nebyl prokázán rozdíl v PFS ani v OS mezi pacienty léčenými cetuximabem a pacienty s BSC. Naopak u pacientů
s wtKRAS došlo v rameni s cetuxima
bem k signifikantnímu zlepšení mediánu PFS
(3,8 vs. 1,9 měsíce, HR 0,40;
p < 0,0001)
i OS (9,5 vs. 4,8 měsíce,
HR
0,55; p < 0,0001). Léčebná odpověď při terapii cetuximabem byla evidentně vyšší u pa
cientů s wtKRAS (12,8 %) oproti paci
entům s mKRAS (1,2 %). Při srovnání OS v rameni pouze s BSC nebyl nalezen rozdíl mezi pacienty bez mutace a s mutací KRAS, což zpochybňuje roli KRAS jako nezávislého prognostického faktoru [38].
Závěr
Cetuximab prokázal v randomizovaných studiích a následně i v běžné klinické praxi evidentní protinádorovou aktivitu v léčbě mCRC především při kombinaci s chemoterapií, a to při relativně příznivém profilu toxicity. Je účinný v terapii pokročilého chemorezistentního mCRC, má výborné výsledky v I. linii léčby metastatického onemocnění a v současné době probíhají i studie s adjuvantním podáním. Nejenže dokáže prodloužit celkové přežití pacientů a přežití bez progrese onemocnění, ale zlepšuje i kvalitu života nemocných a při podání v I. linii též výrazně zvyšuje procento radikálních chirurgických resekcí (především jaterních metastáz), čímž se stává jedním ze zásadních terapeutických prostředků vedoucích v některých případech k „vyléčení" pacienta s mCRC.
Účinnost cetuximabu lze velmi spolehlivě predikovat stanovením mutace onkogenu KRAS a tím z terapie předem vyloučit pacienty, kteří by z ní neměli žádný prospěch. Znalost statusu KRAS usnadňuje lékaři rozhodnutí o správné terapeutické strategii a umožňuje mu „ušít léčbu na míru" s ohledem na konkrétního pacienta. Každý pacient s mCRC, který je v dobrém klinickém stavu, by měl mít vyšetřen status onkogenu KRAS, a je-li u něj identifikován „wild type", neměl by v léčebném algoritmu jeho metastatického onemocnění cetuximab chybět.
V současnosti probíhá výzkum dalších potenciálních prediktivních parametrů
odpovědi na terapii anti-EGFR (např.
PTEN – vysoká exprese koreluje se zlepšením PFS), které v kombinaci s KRAS předpokládanou léčebnou odpověď ještě více upřesní.