Postavení metforminu v léčbě diabetu mellitu 2. typu
Metformin, který je jako perorální antidiabetikum rutinně používán v léčbě diabetu mellitu 2. typu, je nejúčinnějším a přitom nejbezpečnějším lékem ze skupiny biguanidů. Hlavním mechanismem je pravděpodobně inhibice výdeje glukózy z jater, která se odehrává primárně v mitochondriích hepatocytů. Metformin snižuje glykemii u diabetiků 2. typu v monoterapii bez rizika hypoglykemie. Metformin je lékem první volby u všech pacientů s DM2 bez ohledu na body mass index a léčba má být zahájena v okamžiku stanovení diagnózy DM2. Výjimkou jsou pacienti s kontraindikací, případně nesnášenlivostí metforminu. Metformin je naprosto nezbytným prvkem terapie DM2, při dodržení kontraindikací je bezpečný a je první volbou v léčbě DM2 a v prevenci kardiovaskulárních komplikací diabetu.
Úvod
Metformin je nejsilnějším a přitom nejbezpečnějším perorálním antidiabetikem (PAD) ze skupiny biguanidů. V léčbě diabetu mellitu 2. typu (DM2) se v Evropě rutinně používá již zhruba od poloviny osmdesátých let, v USA později. Fenformin a buformin, léky ze skupiny biguanidů, které byly jeho předchůdci, byly staženy z trhu v 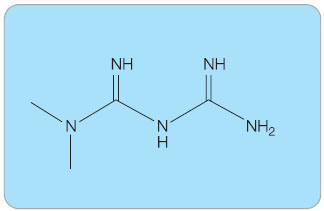 sedmdesátých letech (v ČR později) pro záchyt stovek případů laktátové acidózy s téměř 50% letalitou. Teprve klinické studie s metforminem z devadesátých let minulého století plně obnovily jeho významné postavení v léčbě DM2. Metformin (v přípravcích jako hydrochlorid) – dimethylbiguanid (obr. 1) – je v současné době jediným používaným představitelem této skupiny PAD, který je doporučován v léčbě DM2 [1]. Obecně jsou biguanidy deriváty guanidinu, látky z rostliny Galea officinalis, která se k léčbě diabetu používala už ve středověku.
sedmdesátých letech (v ČR později) pro záchyt stovek případů laktátové acidózy s téměř 50% letalitou. Teprve klinické studie s metforminem z devadesátých let minulého století plně obnovily jeho významné postavení v léčbě DM2. Metformin (v přípravcích jako hydrochlorid) – dimethylbiguanid (obr. 1) – je v současné době jediným používaným představitelem této skupiny PAD, který je doporučován v léčbě DM2 [1]. Obecně jsou biguanidy deriváty guanidinu, látky z rostliny Galea officinalis, která se k léčbě diabetu používala už ve středověku.
Mechanismus účinku
Mechanismus působení metforminu není zcela vyjasněn. Hlavním mechanismem je pravděpodobně inhibice výdeje glukózy z jater, která se odehrává primárně v mitochondriích hepatocytů a zahrnuje aktivaci signálního enzymu AMP-aktivované proteinkinázy [2]. Tento enzym má pozitivní vliv na glukózový a lipidový metabolismus. Suprimuje glukoneogenezi (resp. podporuje supresi navozenou inzulinem) a inhibuje glykogenolýzu, přičemž hlavním účinkem je potlačení glukoneogeneze. Zvyšuje transport glukózy ve svalu, čímž dále zvyšuje její utilizaci (zvyšuje aktivitu glukózových transportérů GLUT-4 a GLUT-1), což je spojeno se zvýšením aktivity glykogensyntázy a se zvýšeným ukládáním glykogenu. Snižuje oxidaci volných mastných kyselin asi o 30 %, což snižuje lipotoxické poškození b-buněk pankreatu (obecně tedy snižuje oxidační stres) a inzulinovou rezistenci [3]. Snížené vstřebávání glukózy při léčbě metforminem se vysvětluje vyšší koncentrací metforminu ve stěně tenkého střeva. Metformin nezvyšuje hladinu laktátu v krvi, snižuje významně koncentraci inzulinu. Metformin je někdy řazen k PAD zvyšujícím inzulinovou senzitivitu, ale tento efekt nebyl v některých studiích prokázán. Mechanismus účinku metforminu v dávkách vyšších než 1 g je blízký nové skupině antidiabetik s inkretinovým efektem [4]. Názory na mechanismus tohoto působení však nejsou jednotné, týkají se ovlivnění enzymu dipeptidyl peptidázy 4 (DPP-4) či inkretinu glukagon-like peptid 1 (GLP-1). Existují důkazy o preventivním působení metforminu na smrt endoteliálních buněk vystavených vysokým koncentracím glukózy. Metformin chrání endoteliální buňky před poškozením oxidačním stresem vyvolaným hyperglykemií tím, že ovlivňuje mitochondriální PTP (permeability transitor pore) – kanálky citlivé na oxidační stres, jejichž otevření znamená buněčnou smrt [5]. Na lidských endotelových buňkách bylo prokázáno, že metformin má „duální efekt“. Jednak inhibuje otevření kanálků, jednak snížením hyperglykemie snižuje oxidativní stres. Bylo potvrzeno signifikantní snížení hyperglykemie vyvolané tvorbou volných kyslíkových radikálů v lidských umbilikálních venózních endoteliálních buňkách po přidání metforminu do růstového prostředí. Vliv metforminu na endoteliální funkce sledovala také dvojitě zaslepená a randomizovaná studie HOME (Hyperinsulinemia the Outcome of its Metabolic Effect), která trvala 16 týdnů s následným sledováním nemocných po dobu 4 let. Soubor tvořili diabetici 2. typu převádění pro neuspokojivou kompenzaci diabetu na léčbu inzulinem, k němuž byl přidán buď metformin, nebo placebo.
Farmakokinetika a farmakodynamika
Metformin je primárně absorbován v tenkém střevě, biologická dostupnost po požití nalačno je asi 50 %, doba nástupu maximální koncentrace v krvi je různá podle lékové formy (asi 1–2 hod. u rychle se uvolňující formy a 6–7 hod. u retardované – XR – formy). Poločas eliminace je při normální funkci ledvin asi 6 hodin. Průměrná plazmatická koncentrace metforminu je 10-5 mol/l. Maximální koncentrace je asi o 20 % nižší při podávání stejných dávek metforminu XR, při stejných hodnotách plochy pod křivkou. Vazba na bílkoviny je minimální. Ustáleného stavu plazmatické koncentrace je dosaženo asi za 24–48 hodin. Asi 90 % absorbované látky je vyloučeno glomerulární filtrací a tubulární sekrecí. Distribuce metforminu je ve většině tkání podobná jako v periferní krvi. Vyšší koncentrace je v játrech a ledvinách, nejvyšší ve střevní stěně. Jídlo zpomaluje absorpci metforminu, u XR formy zvyšuje absorpci o 50 %.
Lékové interakce
Plazmatickou koncentraci metforminu zvyšuje cimetidin (kompetice o stejné transportéry v tubulech ledvin), méně zvyšují účinek metforminu furosemid a nifedipin. Nejasná je otázka metabolizování metforminu, které je obecně realizováno působením tkáňových transportérů.
Léčebné využití
Metformin snižuje glykemii u diabetiků 2. typu v monoterapii bez rizika hypoglykemie. Řada analýz, např. ADOPT (A Diabetes Outcome Progression Trial) potvrdila tento fakt [6]. Ve studii byl porovnáván účinek glibenklamidu, metforminu a rosiglitazonu. Ze současných PAD je metformin nejrozšířenějším lékem jak v monoterapii, tak i v kombinační léčbě s dalšími PAD (glitazony, gliptiny, meglitinidy, deriváty sulfonyl-urey – DSU, akarbóza) a s inzulinem. Metformin snižuje zejména glykemii nalačno (FPG – fasting plasma glucose), méně glykemii po jídle (PPG – postprandial glucose). Příčinou je snížení tvorby jaterní glukózy, především potlačením glykogenolýzy. Metaanalýza prvních placebem kontrolovaných studií s monoterapií metforminem ukázala snížení glykemie o 2,6 mmol/l, hladiny glykovaného hemoglobinu (HbA1c) o 1,3 % (ve srovnání s deriváty sulfonylurey se neliší v účinku na glykemii). Ve studiích s diabetiky s horší kompenzací činil pokles HbA1c 1,5–2 % (ve studii UKPDS – United Kingdom Prospective Diabetes Study – klesl o 0,6 %) [7]. Snížení glykemie závisí na dávce, jejíž výše se pohybuje v rozmezí 500–2000 mg, při dávce vyšší než 2000 mg je tento efekt již nevýrazný.
U osob s diabetem mellitem 2. typu může dojít při léčbě ke snížení hmotnosti (v průměru o 1,2 kg oproti zvýšení hmotnosti o 1,7 kg při terapii DSU), přinejmenším je efekt hmotnostně neutrální [8]. Obecně lze říci, že léčba metforminem pozitivně ovlivňuje kromě hyperglykemie i další rizikové vaskulární faktory (např. prokoagulační stav provázející DM2) [9]. Toto konstatování dokládají výsledky studií, např. UKPDS, kde metformin snížil mortalitu na kardiovaskulární onemocnění u skupiny pacientů s DM2. V podskupině obézních diabetiků sledovaných ve studii UKPDS, kteří byli léčeni metforminem, bylo zaznamenáno snížení rizika infarktu myokardu o 39 %, snížení všech makrovaskulárních komplikací o 30 % a snížení celkové mortality o 36 %. Ve studii PRESTO (Prevention of Restenosis with Tranilast and Its Outcomes) měli z léčby metforminem prospěch diabetici, kteří podstoupili koronární angioplastiku. Riziko infarktu myokardu a úmrtí se snížilo.
Účinnost metforminu v prevenci DM2 dokládá studie DPP (Diabetes Prevention Program), kdy se během tří let snížilo riziko progrese do DM2 o 31 % při podávání metforminu 2krát denně v dávce 850 mg [10]. Proto ADA (American Diabetes Association) doporučuje zahájit léčbu i u pacientů s prediabetem*. Metformin snižuje koncentrace triglyceridů (spolu s poklesem jaterních VLDL) a LDL cholesterolu u osob, které mají hodnoty těchto látek zvýšené, zatímco koncentraci HDL cholesterolu mírně zvyšuje; výsledky pozorování jsou ovšem nekonzistentní.
Použití metforminu u diabetiků 1. typu není podle SPC (Summary of Product Characteristics) doporučeno, i když u některých výrazně inzulinorezistentních diabetiků 1. typu s vysokými dávkami inzulinu může být přidání metforminu k intenzifikované léčbě inzulinem vhodné, jak dokládají výsledky několika studií [11]. Využití lze nalézt i v terapii syndromu polycystických ovarií, kdy může obnovit menstruaci a fertilitu (vyvolání ovulace bylo častější než při terapii klomifenem), ovšem nesnižuje většinou výskyt akné a hirsutismu (při snížení koncentrace testosteronu a dehydroepiandrosteronu) [12].
Metformin podávaný diabetikům 2. typu snižuje zvýšené hladiny C-reaktivního proteinu (CRP), který ukazuje na přítomnost chronického zánětlivého stavu. Otázkou, která ještě není zcela vyřešena, je, jakým mechanismem vede tato léčba ke snížení CRP: zda jde o přímé ovlivnění sekrece CRP, nebo o důsledek zlepšení inzulinové senzitivity (a tím snížení zánětlivých stimulů). Ve dvojitě zaslepené kontrolované studii Cartera, do níž byli zařazeni špatně kompenzovaní obézní diabetici 2. typu, bylo podávání metforminu provázeno statisticky významným snížením hladin CRP, které nekorelovalo se zlepšením kompenzace diabetu.
NAFLD (Non Alcoholic Fatty Liver Disease – nealkoholická steatóza jater), která zahrnuje jaterní steatózu a závažnější steatohepatitidu s tendencí k progresi do jaterní cirhózy a je považována za jaterní manifestaci metabolického syndromu, může být příznivě ovlivněna použitím metforminu; i když výsledky pozorování nejsou jednotné (v experimentu u zvířat), podobný účinek je ověřován i v humánních studiích [13].
Indikace
Metformin je lékem první volby u všech pacientů s DM2 bez ohledu na body ![Obr. 2 Algoritmus léčby hyperglykemie u nemocných s diabetem 2. typu. Hodnoty glykovaného hemoglobinu (HbA1c) vycházejí ze studie DCCT; podle ADA/EASD [20] – Nathan, et al., 2008.](https://www.remedia.cz/photo-a-27919---.jpg) mass index (dříve preferenčně u obézních diabetiků) a léčba má být zahájena v okamžiku stanovení diagnózy DM2. Výjimkou jsou pacienti s kontraindikací, případně s nesnášenlivostí metforminu.
mass index (dříve preferenčně u obézních diabetiků) a léčba má být zahájena v okamžiku stanovení diagnózy DM2. Výjimkou jsou pacienti s kontraindikací, případně s nesnášenlivostí metforminu.
Dnes se v léčbě diabetu 2. typu řídíme doporučeními České diabetologické společnosti (ČDS) vycházejícími z konsenzuálních doporučení evropské a americké diabetologické společnosti (ADA/EASD). První algoritmus byl publikován v srpnu 2006 [14], na základě metaanalýzy některých studií s léčbou rosiglitazonem pak byla tato doporučení v lednu 2008 upravena (obr. 2).
Doporučení z ledna 2009 reflektují diskusi o studiích ACCORD, ADVANCE a VADT [15]. Součástí těchto doporučení je i tabulka s přehledem možností snižování glykemií s jejich výhodami a nevýhodami včetně rozdělení použití antidiabetik a inzulinu do dvou skupin. První skupinu tvoří taková léčebná opatření, která jsou autory doporučení označována za léčbu legalizovanou. Ve druhé skupině jsou uvedeny možnosti léčení DM2 přístupem, u něhož je „méně potvrzena“ bezpečnost léčby [15].
Terapie musí být vedena podle individuálně stanovených cílů. Podle výsledků prospektivních studií (STENO II, DCCT/EDIC, Kumamoto) je zřejmé, že prospěch z normalizace glykemie se objeví až s odstupem více let. Snaha o těsnou kompenzaci diabetu má smysl tam, kde očekávaná délka života pacienta odpovídá době, která je potřebná, aby se projevil přínos intenzivní léčby (což platí stejně i pro intervenci dyslipidemie a krevního tlaku). Naopak pokud je pacient obecně zatížen vysokým rizikem jakýchkoliv komplikací, které omezují délku života, je vhodné stanovit individuální cíle léčby. Hlavním ukazatelem kompenzace diabetu a důležitým parametrem ve vztahu k úpravě antidiabetické léčby je hodnota glykovaného hemoglobinu (HbA1c) a postprandiální glykemie. Při dosažení hladiny HbA1c < 5 % je dostačující kontrolovat jeho hodnotu pravidelně po 3 měsících. V ostatních případech je nutné zintenzivnit terapii kombinací s jinými PAD nebo s inzulinem.
Výhodou metforminu z klinického terapeutického hlediska je možnost kombinovat jeho podávání se všemi dalšími PAD i s inzulinem. V tomto případě lékař zvažuje další hlediska. Před aplikací metforminu je nutné pečlivě vyšetřit renální funkce, zejména u starších pacientů. Při zahájení monoterapie metforminem (současně se zavedením režimových opatření) je podle standardů České diabetologické společnosti doporučeno podávat metformin u pacientů s DM2 v nejnižší dávce, tj. 500 mg jednou až dvakrát denně, s postupnou titrací do udržovací dávky představované obvykle 2 g denně, s maximální doporučovanou dávkou 3 g denně (v tomto případě je metformin podáván třikrát denně 1 g). Metformin ve formě XR má výhodu jednoho podání denně, léčba je lépe snášena, lék je obvykle podáván večer.
Riziko kardiovaskulárních onemocnění
Metformin je jediné PAD, o kterém byly publikovány přesvědčivé důkazy potvrzující snížení kardiovaskulárního rizika u pacientů s DM2. Pravděpodobné mechanismy protektivního vlivu na kardiovaskulární systém jsou uvedeny v tab. 1. Na rozdíl od DSU a inzulinu je vazoprotektivní efekt metforminu nezávislý na 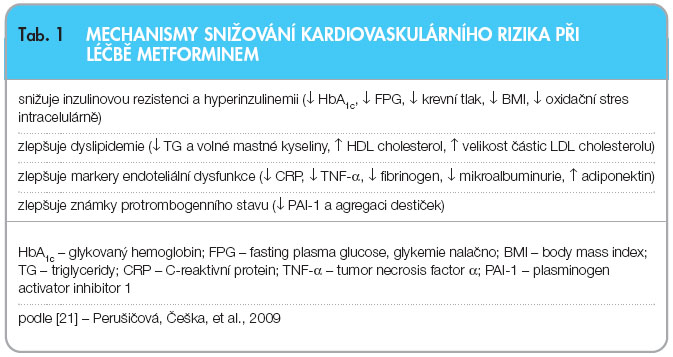 jeho hypoglykemizujícím účinku [16]. Většinu publikovaných dat o přednosti metforminu v porovnání s ostatními PAD komplexně shrnula publikovaná práce autorů z univerzitního výzkumného centra v americkém Memphisu. Nejnižší celková mortalita mezi diabetiky 2. typu byla zaznamenána u těch nemocných, v jejichž léčebné kombinaci byl zastoupen metformin, oproti těm, kteří dostávali režim bez metforminu (byla hodnocena kombinace se statiny, ACEI, sartany a výsledky byly adjustovány k věku, pohlaví, rase, glykovanému hemoglobinu nebo k souběžnému užívání inzulinu) [17].
jeho hypoglykemizujícím účinku [16]. Většinu publikovaných dat o přednosti metforminu v porovnání s ostatními PAD komplexně shrnula publikovaná práce autorů z univerzitního výzkumného centra v americkém Memphisu. Nejnižší celková mortalita mezi diabetiky 2. typu byla zaznamenána u těch nemocných, v jejichž léčebné kombinaci byl zastoupen metformin, oproti těm, kteří dostávali režim bez metforminu (byla hodnocena kombinace se statiny, ACEI, sartany a výsledky byly adjustovány k věku, pohlaví, rase, glykovanému hemoglobinu nebo k souběžnému užívání inzulinu) [17].
Nežádoucí účinky a kontraindikace
Nejčastějšími nežádoucími účinky provázejícími léčbu metforminem jsou gastrointestinální obtíže. U třetiny pacientů se vyskytnou přechodně na počátku léčby v různé intenzitě. Pacienty obtěžuje nejčastěji průjem, říhání, horní dyspeptický syndrom, kovová pachuť v ústech. Obtíže jsou závislé na velikosti dávky. Prevencí může být postupná titrace dávky a užívání léku společně s jídlem. Při manifestaci projevy většinou odezní po snížení dávky. Někdy je ale nutná náhrada lékem z jiné skupiny PAD. Osvědčuje se nízká dávka metforminu, 500 mg, podaná s jídlem večer (forma XR). Asi 5–10 % pacientů netoleruje plnou terapeutickou dávku, která představuje přibližně 2 g metforminu denně. I když je popsán vliv metforminu na snížení absorpce vitaminu B12 a kyseliny listové, je výskyt megaloblastové makrocytární anémie raritní (v případech poruch nutrice). Těžká hypoglykemie může být důsledkem kombinované terapie, především s DSU a inzulinem (metformin zvyšuje hypoglykemizující efekt). Nejzávažnějším, ale vzácným nežádoucím účinkem je laktátová acidóza. Nejsou-li přítomny kontraindikace pro  podání metforminu (tab. 2), vyskytuje se laktátová acidóza při léčbě metforminem ojediněle. Prospektivní komparativní studie nebo observační kohortové studie nepřinesly důkaz, že je terapie metforminem spojena se zvýšeným rizikem laktátové acidózy ve srovnání s jinými PAD, je-li léčba vedena správně a se zřetelem ke kontraindikacím podání. V případech, kde byl metformin shledán příčinou laktátové acidózy u pacientů s DM2, šlo o nemocné s hypoxemií, hypoperfuzí a renální insuficiencí, často hospitalizované, kdy nebyly respektovány kontraindikace (srdeční selhání, respirační selhání, akutní infekce, chirurgické výkony). Současné doporučení amerického úřadu FDA (Food and Drug Administration) zní nepodávat metformin mužům s hladinou kreatininu > 133 mmol/l a ženám s hladinou kreatininu > 120 mmol/l (hodnocení stavu renálních funkcí pouze podle hladiny kreatininu je ale nepřesné, mj. závislé na množství svalové hmoty a věku). U diabetiků se i při minimálním snížení renálních funkcí vyskytuje častěji než u nediabetické populace kontrastní nefropatie i při použití malého množství kontrastní látky. Proto je nutné i při normálních renálních funkcích léčbu metforminem přerušit den před diagnostickým výkonem, po vyšetření zkontrolovat funkce ledvin a metformin podat až po 48 hodinách. Při zhoršení kompenzace diabetu se přechodně použije inzulin. U pacientů s chronickým srdečním selháním se obecně doporučuje metformin nepodávat ve stadiu NYHA III a NYHA IV pro riziko laktátové acidózy. Riziková skupina pro vznik laktátové acidózy zahrnuje i pacienty s akutní či chronickou acidózou jiné etiologie, s onemocněním jater, pacienty s AIDS léčené antivirotiky, a dále nemocné vystavené těžké fyzické zátěži a nemocné s abúzem alkoholu [18].
podání metforminu (tab. 2), vyskytuje se laktátová acidóza při léčbě metforminem ojediněle. Prospektivní komparativní studie nebo observační kohortové studie nepřinesly důkaz, že je terapie metforminem spojena se zvýšeným rizikem laktátové acidózy ve srovnání s jinými PAD, je-li léčba vedena správně a se zřetelem ke kontraindikacím podání. V případech, kde byl metformin shledán příčinou laktátové acidózy u pacientů s DM2, šlo o nemocné s hypoxemií, hypoperfuzí a renální insuficiencí, často hospitalizované, kdy nebyly respektovány kontraindikace (srdeční selhání, respirační selhání, akutní infekce, chirurgické výkony). Současné doporučení amerického úřadu FDA (Food and Drug Administration) zní nepodávat metformin mužům s hladinou kreatininu > 133 mmol/l a ženám s hladinou kreatininu > 120 mmol/l (hodnocení stavu renálních funkcí pouze podle hladiny kreatininu je ale nepřesné, mj. závislé na množství svalové hmoty a věku). U diabetiků se i při minimálním snížení renálních funkcí vyskytuje častěji než u nediabetické populace kontrastní nefropatie i při použití malého množství kontrastní látky. Proto je nutné i při normálních renálních funkcích léčbu metforminem přerušit den před diagnostickým výkonem, po vyšetření zkontrolovat funkce ledvin a metformin podat až po 48 hodinách. Při zhoršení kompenzace diabetu se přechodně použije inzulin. U pacientů s chronickým srdečním selháním se obecně doporučuje metformin nepodávat ve stadiu NYHA III a NYHA IV pro riziko laktátové acidózy. Riziková skupina pro vznik laktátové acidózy zahrnuje i pacienty s akutní či chronickou acidózou jiné etiologie, s onemocněním jater, pacienty s AIDS léčené antivirotiky, a dále nemocné vystavené těžké fyzické zátěži a nemocné s abúzem alkoholu [18].
Kombinace s vybranými PAD
![Graf 1 Srovnání vlivu jednotlivých perorálních antidiabetik nebo jejich kombinací na klinické a laboratorní parametry sledované u pacientů s DM2; podle [22] – Bolen, et al., 2007.](https://www.remedia.cz/photo-a-27922---.jpg) Jak již bylo uvedeno výše, pokud není dosaženo v monoterapii metforminem ani po titraci dávky cílové hodnoty glykovaného hemoglobinu, je dalším krokem kombinovaná léčba. Vzájemná srovnání vlivu na klinické a laboratorní parametry mezi skupinami PAD (jejich kombinacemi) znázorňuje graf 1. Některé kombinace metforminu existují jako fixní v jedné tabletě (s rosiglitazonem, pioglitazonem, sitagliptinem, vildagliptinem, glibenklamidem). Výhoda kombinace s DSU spočívá v komplexním účinku – metformin snižuje zejména glykemie nalačno, zatímco glibenklamid snižuje zejména postprandiální glykemie. DM2 je charakterizován přítomností obou základních poruch – inzulinové rezistence a sekrece inzulinu, kombinace metforminu s DSU tedy upravuje obě poruchy. V kombinaci s metforminem se doporučuje zejména gliklazid nebo glimepirid v nejnižší dávce a při nedostatečné kompenzaci po několika týdnech je možno jeho podávání zvýšit na průměrnou dávku. Při chronické monoterapii se nedoporučuje překračovat střední dávky perorálního antidiabetika skupiny DSU. Při glykemiích s hodnotami vyššími než 15 mmol/l nelze očekávat významnější efekt skupiny DSU. Meglitinidy lze alternativně použít místo DSU v kombinaci s metforminem u pacientů se zachovalou sekrecí inzulinu a s výrazným vzestupem PPG. Využívá se u nich krátké prandiální stimulace sekrece inzulinu místo delšího efektu DSU. Při kombinaci metforminu s glitazonem je účinek obou látek aditivní, zlepšující inzulinovou senzitivitu, ale odlišným mechanismem – metformin je inzulin šetřící lék a glitazon je inzulinový senzitizér. Farmakokinetické charakteristiky jsou stejné jako při použití obou látek samostatně. Metformin snižuje glykemii především prostřednictvím snížení tvorby jaterní glukózy, zatímco glitazony stimulují receptory PPAR-g a zlepšují periferní vychytávání a utilizaci glukózy. Při samostatném užití se hypoglykemie nevyskytuje, při současném užití se ojediněle může vyskytnout. U pacientů s touto kombinovanou léčbou musejí být současně respektovány kontraindikace léčby glitazony (srdeční selhání, edémové stavy, těhotenství) a v průběhu léčby je třeba kontrolovat klinický stav pacienta se zřetelem na retenci tekutin včetně známek oběhového selhávání. Léky s inkretinovým působením zahrnující jednak analoga GLP-1, jednak gliptiny (inhibitory dipeptidyl peptidázy 4) se používají v kombinační terapii s metforminem, pokud není dosaženo cílové hodnoty dlouhodobé kompenzace [19]. Podmínkou jejich účinného působení je zachovalá sekrece inzulinu, kterou stimulují v přítomnosti glukózy. V případě, že léčba kombinací PAD nevede k dosažení alespoň uspokojivé dlouhodobé kompenzace nebo je kontraindikována, je třeba zahájit léčbu inzulinem.
Jak již bylo uvedeno výše, pokud není dosaženo v monoterapii metforminem ani po titraci dávky cílové hodnoty glykovaného hemoglobinu, je dalším krokem kombinovaná léčba. Vzájemná srovnání vlivu na klinické a laboratorní parametry mezi skupinami PAD (jejich kombinacemi) znázorňuje graf 1. Některé kombinace metforminu existují jako fixní v jedné tabletě (s rosiglitazonem, pioglitazonem, sitagliptinem, vildagliptinem, glibenklamidem). Výhoda kombinace s DSU spočívá v komplexním účinku – metformin snižuje zejména glykemie nalačno, zatímco glibenklamid snižuje zejména postprandiální glykemie. DM2 je charakterizován přítomností obou základních poruch – inzulinové rezistence a sekrece inzulinu, kombinace metforminu s DSU tedy upravuje obě poruchy. V kombinaci s metforminem se doporučuje zejména gliklazid nebo glimepirid v nejnižší dávce a při nedostatečné kompenzaci po několika týdnech je možno jeho podávání zvýšit na průměrnou dávku. Při chronické monoterapii se nedoporučuje překračovat střední dávky perorálního antidiabetika skupiny DSU. Při glykemiích s hodnotami vyššími než 15 mmol/l nelze očekávat významnější efekt skupiny DSU. Meglitinidy lze alternativně použít místo DSU v kombinaci s metforminem u pacientů se zachovalou sekrecí inzulinu a s výrazným vzestupem PPG. Využívá se u nich krátké prandiální stimulace sekrece inzulinu místo delšího efektu DSU. Při kombinaci metforminu s glitazonem je účinek obou látek aditivní, zlepšující inzulinovou senzitivitu, ale odlišným mechanismem – metformin je inzulin šetřící lék a glitazon je inzulinový senzitizér. Farmakokinetické charakteristiky jsou stejné jako při použití obou látek samostatně. Metformin snižuje glykemii především prostřednictvím snížení tvorby jaterní glukózy, zatímco glitazony stimulují receptory PPAR-g a zlepšují periferní vychytávání a utilizaci glukózy. Při samostatném užití se hypoglykemie nevyskytuje, při současném užití se ojediněle může vyskytnout. U pacientů s touto kombinovanou léčbou musejí být současně respektovány kontraindikace léčby glitazony (srdeční selhání, edémové stavy, těhotenství) a v průběhu léčby je třeba kontrolovat klinický stav pacienta se zřetelem na retenci tekutin včetně známek oběhového selhávání. Léky s inkretinovým působením zahrnující jednak analoga GLP-1, jednak gliptiny (inhibitory dipeptidyl peptidázy 4) se používají v kombinační terapii s metforminem, pokud není dosaženo cílové hodnoty dlouhodobé kompenzace [19]. Podmínkou jejich účinného působení je zachovalá sekrece inzulinu, kterou stimulují v přítomnosti glukózy. V případě, že léčba kombinací PAD nevede k dosažení alespoň uspokojivé dlouhodobé kompenzace nebo je kontraindikována, je třeba zahájit léčbu inzulinem.
Závěr
Metformin je naprosto nezbytným prvkem terapie DM2. Při respektování všech kontraindikací je bezpečným lékem, první volbou v léčbě DM2 a v prevenci kardiovaskulárních komplikací diabetu. Existuje dostatečný počet důkazů, že vazoprotektivní působení metforminu je nezávislé na hypoglykemizujícím účinku (na rozdíl od DSU a inzulinu). Metformin působí komplexně, ovlivňuje řadu rizikových faktorů a celkově vykazuje antiaterogenní účinky. Nejen v léčbě hyperglykemie je doporučována včasná kombinace farmak s různými mechanismy účinku, které výsledný efekt zesilují.
* Prediabetes zahrnuje hraniční glykemie nalačno (IFG – impaired fasting glucose) a poruchu glukózové tolerance (IGT – impaired glucose tolerance).
Seznam použité literatury
- [1] Bosi E. Metformin–the gold standard in type 2 diabetes: what does the evidence tell us? Diabetes Obes Metab 2009; 11 (Suppl. 2): 3–8.
- [2] Wong AK, Howie J, Petrie JR, Lang CC. AMP-activated protein kinase pathway: a potential therapeutic target in cardiometabolic disease. Clin Sci (Lond) 2009; 116: 607–620.
- [3] Shah S, Iqbal M, Karam J, et al. Oxidative stress, glucose metabolism, and the prevention of type 2 diabetes: pathophysiological insights. Antioxid Redox Signal 2007; 9: 911–929.
- [4] Cuthbertson J, Patterson S, O'Harte FP, Bell PM. Investigation of the effect of oral metformin on dipeptidylpeptidase-4 (DPP-4) activity in type 2 diabetes. Diabet Med 2009; 26: 649–654.
- [5] Detaille D, Guigas B, Chauvin C, et al. Metformin prevents high-glucose-induced endothelial cell death through a mitochondrial permeability transition-dependent process. Diabetes 2005; 54: 2179–2187.
- [6] Viberti G, Kahn SE, Greene DA, et al. A diabetes outcome progression trial (ADOPT): an international multicenter study of the comparative efficacy of rosiglitazone, glyburide, and metformin in recently diagnosed type 2 diabetes. Diabetes Care 2002; 25: 1737–1743.
- [7] Genuth S. The UKPDS and its global impact. Diabet Med 2008; 25 (Suppl. 2): 57–62.
- [8] Saenz A, Fernandez-Esteban I, Mataix A, et al. Metformin monotherapy for type 2 diabetes mellitus. Cochrane Database Syst Rev 2005; (3): CD002966.
- [9] Grant PJ. Beneficial effects of metformin on haemostasis and vascular function in man. Diabetes Metab 2003; 29 (4 Pt 2): 6S44–6S52.
- [10] Slama G. The potential of metformin for diabetes prevention. Diabetes Metab 2003; 29: 6S104–6S111.
- [11] Abdelghaffar S, Attia AM. Metformin added to insulin therapy for type 1 diabetes mellitus in adolescents. Cochrane Database Syst Rev 2009; (1): CD006691.
- [12] Palomba S, Falbo A, Russo T, et al. Role of metformin in patients with polycystic ovary syndrome: the state of the art. Minerva Ginecol 2008; 60: 77–82.
- [13] Vuppalanchi R, Chalasani N. Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: Selected practical issues in their evaluation and management. Hepatology 2009; 49: 306–317.
- [14] Nathan DM, Buse JB, Davidson MB, et al. Management of hyperglycaemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2006; 49: 1711–1721.
- [15] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycaemia in type 2 diabetes mellitus: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2009; 52: 17–30.
- [16] Bailey CJ. Metformin: effects on micro- and macrovascular complications in type 2 diabetes. Cardiovasc Drugs Ther 2008; 22: 215–224.
- [17] Gosmanova EO, Canada RB, Mangold TA, et al. Effect of metformin-containing antidiabetic regimens on all-cause mortality in veterans with type 2 diabetes mellitus. Am J Med Sci 2008; 336: 241–247.
- [18] Salpeter S, Greyber E, Pasternak G, Salpeter E. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database Syst Rev 2006; (1): CD002967.
- [19] Salvatore T, Carbonara O, Cozzolino D, et al. Progress in the oral treatment of type 2 diabetes: update on DPP-IV inhibitors. Curr Diabetes Rev 2009; 5: 92–101.
- [20] Nathan DM, Buse JB, Davidson MB, et al. Management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: update regarding thiazolidinediones: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2008; 31: 173–175.
- [21] Perušičová J, Češka R, et al. Kardiabetes. Kardiovaskulární choroby a diabetes mellitus. Facta Medica, 2009.
- [22] Bolen S, Feldman L, Vassy J, et al. Systematic review: comparative effectiveness and safety of oral medications for type 2 diabetes mellitus. Ann Intern Med 2007; 147: 386–399.