Postavení mometason furoátu v léčbě respiračních onemocnění
Mometason furoát je moderní glukokortikosteroid, který nalézá široké uplatnění v léčbě řady respiračních onemocnění. V příspěvku jsou diskutovány farmakologické vlastnosti molekuly mometason furoátu a její klinické uplatnění v léčbě alergické rinokonjunktivitidy, nosní polypózy, rinosinusitidy, průduškového astmatu a chronické obstrukční plicní nemoci u dospělé i dětské populace.
Úvod
Rok 2010 byl vyhlášen Rokem plic. Průduškové astma patří celosvětově k nejčastějším chronickým chorobám. Celosvětově je astmatem postiženo přes 300 milionů osob. Alergická rýma je dalším velmi častým onemocněním, které je stále ještě mnohdy lékaři i pacienty považováno za banální problém. Celosvětově je přitom alergickou rýmou postiženo 5–50 % populace [1] a těžká alergická rýma může významně zhoršovat kvalitu života. Iniciativa ARIA (Allergic Rhinitis and its Impact on Asthma) [1] přišla jako první s koncepcí spojených dýchacích cest. Bylo prokázáno, že u osob trpících alergickou rýmou se významně častěji než u osob bez alergické rýmy projevuje také průduškové astma. Obráceně platí, že u převážné většiny pacientů s astmatem se současně objevuje také alergická rýma. Mělo by proto být pravidlem vyšetřit u všech pacientů s astmatem horní cesty dýchací k vyloučení alergické rýmy a u všech osob trpících alergickou rýmou vyloučit astma. Inhalační kortikosteroidy (KS) jsou uznávaným základním kamenem léčby jak u pacientů s perzistující alergickou rýmou, tak u osob s perzistujícím astmatem, a to pro všechny stupně tíže těchto onemocnění. Dobře léčená alergická rýma u pacientů, kteří trpí současně průduškovým astmatem, je jedním ze základních předpokladů úspěšné terapie astmatu a zklidnění alergické rýmy často umožňuje snížit farmakoterapii astmatu.
Mometason furoát (MF) je syntetický glukokortikoid, který je ve světě dostupný jak ve formě topického nosního spreje, tak ve formě určené pro inhalační aplikaci. V České republice (ČR) je inhalační léková forma registrována, ale není bohužel v současné době na trhu. Vedle těchto indikací je MF k dispozici také jako dermatologikum ve formě pro lokální aplikaci na kůži.
Ve formě nosního spreje je MF v ČR schválen pro intranazální aplikaci v indikaci alergická rýma a její profylaxe u dospělých pacientů a u dětí od šesti let (v USA již od dvou let věku dítěte), u pacientů od osmnácti let také pro léčbu nosních polypů. Nově se objevují práce, které potvrzují účinnost MF v prevenci nosních polypů u pacientů, kteří podstoupili endoskopickou operaci nosních dutin (FESS – Functional Endoscopic Sinus Surgery) [2]. Specialisté v ORL na základě klinických zkušeností s oblibou užívají nosní KS při léčbě akutní rinosinusitidy, i když v ČR pro tuto indikaci nebyl MF oficiálně schválen. V inhalační formě je MF v ČR schválen pro léčbu astmatu u dospělých a dětí od 12 let věku, v USA i pro léčbu dětí od 4 let věku. Ve světě je inhalační forma MF využívána také při léčbě chronické obstrukční plicní nemoci (CHOPN).
Farmakologické vlastnosti
Chemická struktura molekuly
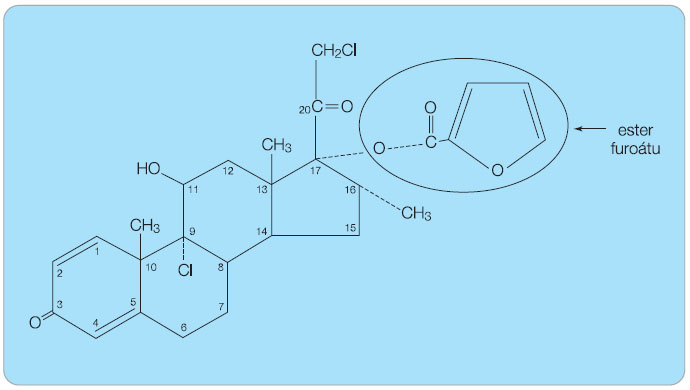 V chemické struktuře molekuly o relativní molární hmotnosti 521,4 byly provedeny modifikace, z nichž nejvýznamnější je přítomnost 2-furoátové skupiny na pozici C17 namísto skupiny propionátové (obr. 1). Tato změna molekuly je zodpovědná za zlepšení vazebných schopností při vazbě na glukokortikoidní receptor a rovněž za vyšší lipofilitu [3]. MF se odlišuje také orientací methylové skupiny na C16 (a) oproti ostatním vysoce účinným glukokortikoidům s orientací β.
V chemické struktuře molekuly o relativní molární hmotnosti 521,4 byly provedeny modifikace, z nichž nejvýznamnější je přítomnost 2-furoátové skupiny na pozici C17 namísto skupiny propionátové (obr. 1). Tato změna molekuly je zodpovědná za zlepšení vazebných schopností při vazbě na glukokortikoidní receptor a rovněž za vyšší lipofilitu [3]. MF se odlišuje také orientací methylové skupiny na C16 (a) oproti ostatním vysoce účinným glukokortikoidům s orientací β.
Mechanismus účinku
Glukokortikoidy modulují humorální a buněčné mechanismy během zánětlivých procesů regulací syntézy proteinů na úrovni genů, mají silnou protizánětlivou aktivitu. V časné fázi zánětlivé odpovědi inhibují uvolňování mediátorů, jako jsou histamin, prostaglandiny, leukotrieny a některé cytokiny, z žírných buněk, v pozdní fázi potom uvolňování interleukinů, leukotrienů a dalších cytokinů. Glukokortikoidy blokují influx prozánětlivých buněk do tkáně, redukují počet eozinofilů a snižují vaskulární permeabilitu a adhezi leukocytů k cévní stěně [4–6]. Protizánětlivá aktivita MF byla zkoumána in vitro a in vivo ve studiích kontrolovaných placebem. Hodnocení protizánětlivé aktivity ukazují, že MF je velmi účinný v inhibici časné i pozdní fáze zánětlivé odpovědi [7–10]. V experimentu na myších buňkách dosáhl MF 50% inhibice syntézy cytokinů v koncentraci IC50 nižší než 0,25 nM, došlo k inhibici syntézy IL-1, IL-5, IL-6 a TNF-a, které hrají důležitou úlohu v průběhu zánětlivé odpovědi organismu. Mometason furoát byl nejméně 10krát účinnější než beklometason [11].
Afinita ke glukokortikoidnímu receptoru
Vazebná afinita ke glukokortikoidnímu receptoru je předpokladem účinnosti glukokortikoidu. Afinita molekuly MF byla hodnocena in vitro ve srovnávací studii s glukokortikoidy flutikason propionátem, budesonidem, triamcinolonem a dexamethasonem (ne však s flutikason furoátem, který byl hodnocen v samostatném experimentu v roce 2007). Mometason furoát se váže ke glukokortikoidnímu receptoru s nejvyšší afinitou [12], současně je účinek této molekuly vysoce selektivní. Účinnost glukokortikoidů může být hodnocena také podle koncentrace potřebné k iniciaci syntézy protizánětlivých mediátorů. Koncentrace MF, která již iniciuje protizánětlivý účinek, je ve srovnání s beklometasonem či budesonidem nejnižší [8].
Farmakokinetika a biologická dostupnost
Farmakokinetické vlastnosti molekuly MF po intranazální nebo inhalační aplikaci vysvětlují klinicky vysokou bezpečnost této molekuly ověřenou v dlouholeté klinické praxi. Po intranazálním či inhalačním podání MF se polknutím dostává část aplikované dávky do zažívacího traktu. Ze zažívacího traktu se jen velmi špatně absorbuje, a do krevního oběhu se proto dostává pouze minimální množství látky, které dále prochází intenzivním metabolismem při prvním průchodu játry [13]. Stanovení biologické dostupnosti KS je důležitým parametrem pro posouzení systémové bezpečnosti, a to zejména rizika vlivu na osu hypothalamus-hypofýza-nadledviny (osa HPA) a ovlivnění růstu u dětí. Biologická dostupnost látky je ovlivněna absorpcí sliznicí dýchacích cest a stupněm metabolizace při prvním průchodu játry. Vysoká lipofilita a intenzivní metabolismus při prvním průchodu játry jsou základním předpokladem velmi nízké biologické dostupnosti této molekuly [14, 15].
Plazmatické hladiny MF byly hodnoceny pomocí senzitivní analýzy s velmi nízkým kvantitativním limitem 50 pg/ml. Biologická dostupnost byla hodnocena u zdravých dobrovolníků. Plazmatické hladiny MF po intranazálním podání byly u přibližně 99 % těchto dobrovolníků pod hranicí kvantifikace, po perorální inhalaci doporučených dávek v blízkosti nebo pod kvantifikačním limitem [16]. Pro možnost porovnání s ostatními KS byla na základě hodnot AUC (plocha pod křivkou plazmatických koncentrací) u těch jedinců, u kterých bylo vůbec možné detekovat hladinu MF, stanovena biologická dostupnost < 0,1 %. Po inhalačním podání je biologická dostupnost MF nižší než 1 % [13]. Obecně lze říci, že MF dosahuje v organismu nejnižších plazmatických hladin z dostupných KS, čímž dochází k minimalizaci rizika systémových nežádoucích účinků.
Lékové interakce
Klinicky relevantní lékové interakce molekuly MF nebyly prokázány.
Bezpečnost
Lokální nežádoucí účinky
Klinické studie u dospělé populace i u dětí ukazují, že lokální nežádoucí účinky MF ve formě nosního spreje (MFNS) se při aplikaci dávek 50–800 mg denně objevují přibližně se stejnou frekvencí jako při podávání placeba. Lokální nežádoucí účinky jsou většinou jen mírné a spontánně vymizí bez nutnosti přerušení aplikace léku. Ve 12měsíční studii zaměřené na zjištění možných histopatologických změn nosní sliznice nevedla dlouhodobá aplikace MFNS ke změnám v tloušťce epitelu ani k fokální metaplazii. To naznačuje, že dlouhodobá léčba MFNS není spojena s atrofií nosní sliznice [17]. Lokální nežádoucí účinky inhalační formy MF se neliší od nežádoucích účinků jiných inhalačních KS. Nejčastěji se objevuje epistaxe [18, 19], dále je to vznik sooru, dysfonie a faryngitida. Všechny tyto lokální nežádoucí účinky se objevují častěji při dávkování dvakrát denně než při aplikaci jednou denně. Rozvoji sooru v dutině ústní lze většinou předejít pečlivým vyplachováním úst po aplikaci léku a používáním inhalačního nástavce u přípravků ve formě dávkovaného spreje. Pravděpodobnost vzniku všech lokálních nežádoucích účinků lze snížit, pokud stav pacienta umožňuje aplikaci MF jednou denně [20].
Systémová bezpečnost
Systémová expozice MF při intranazální i inhalační aplikaci je možná dvěma způsoby. Jednak absorpcí přes sliznici dýchacích cest, jednak absorpcí ze zažívacího traktu po spolknutí části aplikované dávky. Díky vlastnostem uvedeným výše (výrazná lipofilita, téměř kompletní metabolizace na neaktivní metabolity při prvním průchodu játry a z toho vyplývající minimální biologická dostupnost) vykazuje MF velmi vysoký stupeň systémové bezpečnosti. Pro hodnocení systémové bezpečnosti glukokortikoidů se používá hodnocení vlivu léku na osu HPA, ovlivnění kostní minerální denzity, u dětí ovlivnění růstu. Dalšími možnými systémovými účinky glukokortikoidů jsou katarakta a glaukom, snadná zranitelnost a atrofie kůže.
Systémová bezpečnost MFNS byla rozsáhle hodnocena ve více než dvaceti studiích u dětí a dospělých. Při intranazální aplikaci MF nebyl u dětí ani dospělých zaznamenán žádný vliv na osu HPA a hladinu plazmatického kortizolu [21]. V randomizované studii kontrolované placebem, jíž se zúčastnilo 96 dětí ve věku 3–12 let s alergickou rýmou, byl aplikován po dobu 14 dní MF v dávce až 200 mg denně. MF byl dobře tolerován a nebyly zaznamenány žádné významné rozdíly mezi hladinou plazmatického kortizolu a 24hodinových koncentrací volného kortizolu v moči mezi dětmi, které dostávaly MF, a dětmi, jimž bylo aplikováno placebo [22]. Schenkel publikoval studii, ve které bylo 98 dětí ve věku 3–9 let randomizováno k aplikaci 100 mg MF denně nebo k aplikaci placeba po dobu 52 týdnů. Skupina dětí léčených MF nevykazovala žádnou supresi růstu ve srovnání s dětmi léčenými placebem [23]. Klinické studie s MF v inhalační formě ukazují, že terapeutické dávky nemají klinicky významný vliv na osu HPA [21]. V závislosti na dávce bylo – podobně jako u jiných inhalačních KS – v některých studiích zjištěno zpomalení růstu u dětí [24, 25]. Je ovšem známo, že zpomalení růstu je přechodného charakteru a že většina dětí léčených inhalačními KS dosáhne normální predikované výšky [26].
Terapeutické využití v léčbě respiračních chorob
Alergická rýma
Nosní KS jsou lékem volby u pacientů s perzistující sezonní i celoroční alergickou rýmou. Díky svým výrazným protizánětlivým účinkům a inhibici časné i pozdní alergické reakce významně snižují nosní kongesci, rinoreu, svědění nosu i kýchání. V posledních letech se ukazuje, že nosní KS zmírňují také oční příznaky, které se často pojí s alergickou rýmou – svědění, zarudnutí a slzení očí. Zdá se, že vliv nosních KS na oční příznaky alergické rinokonjunktivitidy je „class effect“, tedy že se projevuje u celé této lékové skupiny [27]. Mechanismus ovlivnění očních příznaků se v současné době vysvětluje nejčastěji nazookulárním reflexem. Oční potíže podle této teorie vznikají alespoň zčásti v důsledku reflexního mechanismu, kdy dochází k přenosu vzruchu parasympatickými nervy z alergicky reagující nosní sliznice do oční spojivky. Terapeutické zklidnění nosní sliznice tedy ztlumí i tento reflex a vede ke zmírnění nebo ústupu očních potíží [28].
Vliv MFNS na oční příznaky alergické rinokonjunktivitidy u pacientů ve věku od 12 let trpících sezonní alergickou rýmou studovali Anolik a kol., Hébert a kol., Bielory a kol. či Schenkel a kol. [29–33]. Všichni uvedení autoři zjistili, že vedle známého účinku na nosní příznaky je MF účinný i v redukci očních příznaků sezonní alergické rýmy (TOSS – Total Ocular Symptom Score). Studií zkoumajících účinnost a bezpečnost MFNS v léčbě alergické rýmy byla publikována celá řada. Penagos a kol. [34] provedli metaanalýzu randomizovaných dvojitě slepých studií hodnotících účinnost a bezpečnost MF oproti placebu, které byly publikovány od roku 1996 do konce října 2007. Z potenciálně relevantních 113 studií bylo do metaanalýzy zařazeno 16 publikací, které splňovaly všechna vstupní kritéria a zahrnovaly celkem 2998 pacientů s alergickou rýmou ve věku 5–65 let. Pacienti byli v aktivní větvi studií léčeni MF 200 mg (dospělé osoby) nebo 100 mg (děti) denně. Tato analýza přinesla důkaz kategorie Ia o účinnosti MF v léčbě alergické rýmy ve srovnání s placebem. Četnost nežádoucích reakcí byla přitom obdobná v aktivní i placebové větvi studií.
Akutní rinosinusitida
Etiologie rinusitidy může být virová, bakteriální nebo alergická. Akutní rinosinusitida je většinou vyvolána virovou infekcí a někdy může být komplikována sekundární bakteriální infekcí. U značné části pacientů s akutní sinusitidou tak není vůbec nutná antibiotická terapie. Důvodem pro užití nosních KS v léčbě akutní rinosinusitidy jsou výrazné protizánětlivé účinky této lékové skupiny. Ačkoliv MF (stejně jako ostatní dostupné nosní KS) není v ČR indikován k léčbě akutní rinosinusitidy, praktické klinické zkušenosti řady lékařů a informace z odborné literatury naznačují velmi dobrý terapeutický efekt nosních KS přidaných k běžné léčbě tohoto onemocnění.
Meltzer a kol. [35] srovnávali ve dvojitě slepé randomizované studii účinnost a bezpečnost MFNS, amoxicilinu a placeba u 981 pacientů starších 12 let s akutní rinosinusitidou. Pacienti byli po dobu 15 dní randomizováni do 4 skupin. V prvních dvou skupinách pacienti dostávali MFNS 200 µg jednou nebo dvakrát denně, třetí skupina byla léčena amoxicilinem 500 µg 3krát denně a čtvrtá skupina byla léčena placebem. U skupiny pacientů léčené MFNS 200 µg dvakrát denně došlo ke statisticky významnému zlepšení klinických příznaků ve srovnání s ostatními skupinami. Pacienti léčení MF 200 µg jednou denně vykázali signifikantní zlepšení oproti placebové skupině, ale nikoliv oproti skupině léčené amoxicilinem. Všechny typy léčby byly dobře snášeny a měly obdobnou incidenci nežádoucích reakcí. V jiné studii Meltzer a kol. [36] sledovali u pacientů s akutní sinusitidou efekt přidání MF (2krát denně 400 µg) k amoxicilin klavulanátu ve srovnání s léčbou samotným amoxicilin klavulanátem. Přidání MF k antibiotické léčbě vedlo k signifikantní redukci příznaků akutní sinusitidy ve srovnání s léčbou samotným antibiotikem. Ve studii in vitro prokázal Neher a kol. [37] navíc baktericidní aktivitu MF proti Streptococcus pyogenes a S. milleri, což by mohlo podporovat užití tohoto KS v léčbě akutní bakteriální rinosinusitidy. Klinické studie v této indikaci ale zatím chybí.
Nosní polypy
Nosní polypóza postihuje přibližně 4 % populace [38]. Pro toto onemocnění je charakteristická dominance eozinofilního zánětu nejasné etiologie a onemocnění bývá často spojeno s průduškovým astmatem, aspirinsenzitivitou a s cystickou fibrózou. Nosní KS jsou schopny účinně potlačovat eozinofilní zánět, což racionálně zdůvodňuje jejich indikaci pro léčbu nosní polypózy.
Účinnost a bezpečnost MF v léčbě nosní polypózy řeší dvojitě slepá randomizovaná studie, jejímiž autory jsou Butkus-Small a kol. [39], kteří srovnávali 4měsíční léčbu 200 mg MF jednou nebo dvakrát denně oproti placebu u 354 dospělých pacientů s oboustrannou polypózou a tím vyvolanou významnou nosní obstrukcí. U obou skupin pacientů, kteří dostávali aktivní léčbu došlo ve srovnání s placebem k signifikantní redukci velikosti a rozsahu polypů, zmírnění nosní obstrukce a k navrácení čichu. K výraznějšímu zmírnění nosní obstrukce došlo u pacientů, kterým byl MF aplikován dvakrát denně. Frekvence nežádoucích účinků se ve skupinách s aktivní terapií nelišila od placebové skupiny. Ke stejným výsledkům dospěli ve studii s podobným designem Stjärne a kol. [40]. Rychlostí nástupu účinku se zabývali Butkus-Small a kol. [41], kteří za tímto účelem analyzovali 447 pacientů ze dvou klinických studií. Zjistili, že přetrvávající zlepšení většiny hlavních symptomů nosní polypózy se objevuje už za 24 hodin až 5 dní od zahájení léčby 200 mg MF dvakrát denně.
Účinnost MF byla hodnocena také v postchirurgické léčbě a v prevenci nosní polypózy. Ve studii u 162 pacientů po FESS, jimž byl dva týdny po výkonu aplikován MFNS v dávce 200 mg a kteří byli poté sledováni po dobu až 175 dní, se na základě endoskopického vyšetření hodnotil čas do relapsu nosních polypů. MF statisticky signifikantně prodloužil čas do relapsu (výskyt nežádoucích účinků byl srovnatelný s placebem) a jeho podávání u pacientů po FESS tak umožňuje prodloužit období do případné indikace opakované chirurgické léčby [2].
Asthma bronchiale
Inhalační KS jsou základním kamenem léčby lehkého, středně těžkého a těžkého perzistujícího astmatu u dětí i dospělých. Jsou indikovány v závislosti na tíži onemocnění jako monoterapie nebo jako součást kombinované léčby všude tam, kde projevy astmatu nejsou dostatečně kontrolovány občasnou aplikací SABA (short acting a2-agonists) dle potřeby při potížích [42].
MF je pro léčbu astmatu v současné době schválen ve více než 40 zemích světa pro pacienty ve věku od 12 let, v USA je od roku 2008 schválen i pro léčbu dětských astmatiků od 4 let věku. Účinnost a bezpečnost MF byla hodnocena v řadě studií s kvalitním designem jak u dospělých, tak u dětských astmatiků. Zhodnocení mnoha těchto studií publikovali v přehledných článcích Karpel a Nelson, Bousquet, či Tan a Corren [20, 43, 44]. Uvedení autoři potvrzují velmi dobrou účinnost a vysokou bezpečnost MF v léčbě průduškového astmatu.
Chronická obstrukční plicní nemoc
Na rozdíl od astmatu mají inhalační KS u CHOPN jen malý vliv na patologii dýchacích cest a omezený efekt na rychlost zhoršování plicních funkcí. Inhalační KS ale mohou ovlivnit frekvenci exacerbací, symptomy a zpomalovat celkové zhoršování zdravotního stavu [45]. Inhalační KS jsou indikovány pro III. a IV. stadium CHOPN (těžké a velmi těžké) a největší prospěch z léčby inhalačními KS mají pacienti s poklesem FEV1 (usilovně vydechnutý objem za 1 sekundu) pod 50 % náležité hodnoty a s častými exacerbacemi [46].
Calverley a kol. [45] ve dvojitě slepé studii kontrolované placebem srovnávali podávání MF 800 mg jednou denně večer, 400 mg 2krát denně a podávání placeba u 911 pacientů se středně těžkou až těžkou CHOPN po dobu 52 týdnů. Hodnotili postbronchodilatační změny FEV1, počet exacerbací a celkové skóre příznaků chronické obstrukční plicní nemoci. Obě aktivní větve vykázaly signifikantně lepší výsledky ve srovnání s placebem a dávkování jednou nebo dvakrát denně vedlo k rovnocenným výsledkům. Calverley uzavírá, že dávkování MF jednou denně je vhodnou alternativou dávkování dvakrát denně a pacienti s dávkováním jednou denně mají lepší adherenci k léčbě.
Závěr
Mometason furoát je moderní glukokortikoid s výborným poměrem účinnosti a bezpečnosti, který nalézá široké uplatnění v léčbě celé řady alergických i nealergických onemocnění dýchacích cest. Snad se můžeme těšit, že plánovaná fixní kombinace mometason furoátu s formoterolem, která by se měla objevit po roce 2011, se dostane do rukou lékařů i v České republice a důstojně tak rozšíří skupinu fixních kombinací inhalačních kortikosteroidů a dlouhodobě působících b-sympatomimetik (LABA) určených pro léčbu astmatu a CHOPN.
Seznam použité literatury
- [1] Bousquet J, Khaltaev N, Cruz A, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 Update (in collaboration with the World Health Organization, GA2LEN and AllerGen). Allergy 2008; 63 (Suppl. 86): 8–160.
- [2] Stjärne P, Olsson P, Alenius M. Use of Mometasone Furoate to Prevent Polyp Relapse After Endoscopic Sinus Surgery. Arch Otolaryngol Head Neck Surg 2009; 135 (No. 3): 296–302.
- [3] Valotis A, Högger P. Significant receptor affinities of metabolites and a degradation product of mometasone furoate. Respir Res 2004; 5: 7.
- [4] Barnes PJ, Adcock IM. Anti-inflammatory actions of steroids: molecular mechanisms. Trends Pharm Sci 1993; 14: 436–441.
- [5] Mygind N. Glucocorticosteroids and rhinitis. Allergy 1993; 48: 476–490.
- [6] Crocker IC, Church MK, Newton S, Townley RG. Glucocorticoids inhibit proliferation and interleukin-4 and interleukin-5 secretion by aeroallergen-specific T-helper type 2 cell lines. Ann Allergy Asthma Immunol 1998; 80: 509–516.
- [7] Umland SP, Nahrebne DK, Razac S, et al. The inhibitory effects of topically active glucocorticoids on IL-4, IL-5, and interferon-gamma production by cultured primary CD4+ T cells. J Allergy Clin Immunol 1997; 100: 511–519.
- [8] Crocker IC, Zhou CY, Bewtra AK, et al. Glucocorticosteroids inhibit leukotriene production. Ann Allergy Asthma Immunol 1997; 78: 497–505.
- [9] Frieri M, Therattil J, Chavarria V, et al. Effect of mometasone furoate on early and late phase inflammation in patients with seasonal allergic rhinitis. Ann Allergy Asthma Immunol 81: 431–437.
- [10] Ciprandi G, Tosca MA, Passalacqua G, Canonica GW. Intranasal mometasone furoate reduces late phase inflammation after allergen challenge. Ann Allergy Asthma Immunol 2001; 86: 433–438.
- [11] Barton BE, Jakway JP, Smith, SR, Siegel IM. Cytokine inhibition by a novel steroid, mometasone furoate. Immunopharmacol Immunotoxicol 1991; 13: 251–261.
- [12] Valotis A, Neukam K, Elert O, Hogger P. Human Receptor Kinetics, Tissue Binding Affinity and Stability of Mometasone Furoate. J Pharm Sci 2004; 93: 1337–1350.
- [13] Affrime MB, Cuss F, Padhi D, et al. Bioavailability and Metabolism of Mometasone Furoate following Administration by Metered-Dose and Dry-Powder Inhalers in Healthy Human Volun-teers. J Clin Pharmacol 2000; 40: 1227–1236.
- [14] Corren J. Intranasal corticosteroids for allergic rhinitis: How do different agents compare? J Allergy Clin Immunol 1999; 104: S144–S149.
- [15] Hochhaus G. Pharmacokinetic/Pharmacodynamic Profile of Mometasone Furoate Nasal Spray: Potential Effects on Clinical Safety and Efficacy. Clin Ther 2008; 30: 1–13.
- [16] Onrust SV, Lamb HM. Mometasone furoate. A review of its intranasal use in allergic rhinitis. Drugs 1998; 56: 725–745.
- [17] Minshall E, Ghaffar O, Cameron L, et al. Assessment by nasal biopsy of long-term use of mometasone furoate aqueous nasal spray (Nasonex) in the treatment of perennial rhinitis. Otolaryngol Head Neck Surg 1998; 118: 648–654.
- [18] Small BC, Teper A. Efficacy and safety of mometasone furoate nasal spray in allergic rhinitis, acute rhinosinusistis and nasal polyps. Therapy 2009; 6(3).
- [19] Ratner PH, Meltzer EO, Teper A. Mometasone furoate nasal spray is safe and effective for 1-year treatment of children with perennial allergic rhinitis. Int J Pediatr Otorhinolaryngol 2009; 73: 651–657.
- [20] Karpel JP, Nelson H. Mometasone furoate dry powder inhaler: a once-daily inhaled corticosteroid for the treatment of persistent asthma. Curr Med Res Opin 2007; 23: 2897–2911.
- [21] Bruni FM, DeLuca G, Venturoli V, Boner AL. Intranasal Corticosteroids and Adrenal Suppression. Neuroimmunomodulation 2009; 16: 353–362.
- [22] Brannan MD, Herron JM, Affrime MB. Safety and Tolerability of Once-Daily Mometasone Furoate Aqueous Nasal Spray in Children. Clin Ther 1997; 196: 1330–1339.
- [23] Schenkel EJ, Skoner DP, Bronsky EA, et al. Absence of growth retardation in children with perennial allergic rhinitis after one year of treatment with mometasone furoate aqueous nasal spray. Pediatrics 2000; 105: E22.
- [24] Skoner D, Dunn M, Lee T. Effects of mometasone furoate dry powder inhaler on growth velocity and hypothalamic-pituitary-adrenal axis function in children with asthma. Am J Respir Crit Care Med 2003; 167: A272.
- [25] Pedersen S, Agertoft L, Lee T, Staudinger H. Lower-leg growth in children with asthma during treatment with inhaled corticosteroids. J Allergy Clin Immunol 2003;111: S269.
- [26] Childhood Asthma Management Program Research Group. Long-term effects of budesonide or nedocromil in children with asthma. New Engl J Med 2000; 343: 1054–1063.
- [27] Blaiss MS. Evolving paradigm in the management of allergic rhinitis associated ocular symptoms: role of intranasal corticosteroids. Curr Med Res Opin 2008; 24: 821–836.
- [28] Baroody FM, Foster KA, Markaryan A, Tineo M. Nasal ocular reflexes and eye symptoms in patients with allergic rhinitis. Ann Allergy Asthma Immunol 2008; 100: 194–199.
- [29] Anolik R, Nathan RA, Schenkel A, et al. Intranasal Mometasone Furoate Alleviates the Ocular Symptoms Associated with Seasonal Allergic Rhinitis: Results of a Post Hoc Analysis. Int Arch Allergy Immunol 2008; 147: 323–330.
- [30] Hébert J, Danzig M, Gates D. Mometasone Furoate Improves Total Ocular Symptom Score in Patients With Allergic Rhinitis. J Allergy Clin Immunol 2007; 119, abstracts S 61.
- [31] Schenkel E, LaForce C, Gates D. Mometasone Furoate nasal Spray in Seasonal Allergic Rhinitis. Effective in Relieving of Ocular Symptoms. Allergy Clin Immunol Int – J World Allergy Org 2007; 19: 50–53.
- [32] Bielory L. Ocular symptom reduction in patients with seasonal allergic rhinitis treated with the intranasal corticosteroid mometasone furoate. Ann Allergy Asthma Immunol 2008; 100: 272–279.
- [33] Bielory L. A Meta-Analysis of the Impact of Mometasone Furoate Nasal Spray on Individual Ocular Symptoms of Allergic Rhinitis. J Allergy Clin Immunol 2009; 123: S134.
- [34] Penagos M, Compalati E, Tarantini F, et al. Efficacy of mometasone furoate nasal spray in the treatment of allergic rhinitis. Meta-analysis of randomized, double-blind, placebo-controlled, clinical trials. Allergy 2008; 63: 1280–1291.
- [35] Meltzer EO, Bachert C, Staudinger H. Treating acute rhinosinusitis: Comparing efficacy and safety of mometasone furoate nasal spray, amoxicillin, and placebo. J Allergy Clin Immunol 2005; 116: 1289–1295.
- [36] Meltzer EO, Charous BL, Busse WW, et al. Added relief in the treatment of acute recurrent sinusitis with adjunctive mometasone furoate nasal spray. J Allergy Clin Immunol 2000; 106; 630–637.
- [37] Neher A, Gstöttner M, Scholtz A, Nagl M. Antibacterial Activity of Mometasone Furoate. Arch Otolaryngol Head Neck Surg 2008; 134: 519–521.
- [38] Hedman J, Kaprio J, Poussa T, Nieminen MM. Prevalence of asthma, aspirin intolerance, nasal polyposis and chronic obstructive pulmonary disease in a population-based study. Int J Epidemiol 1999; 28: 717–722.
- [39] Small CB, Hernandez J, Reyes A, et al. Efficacy and safety of mometasone furoate nasal spray in nasal polyposis. J Allergy Clin Immunol 2005; 116: 1275–1281.
- [40] Stjärne P, Mösges R, Jorissen M, et al. A randomized controlled trial of mometasone furoate nasal spray for the treatment of nasal polyposis. Arch Otolaryngol Head Neck Surg 2006; 132: 179–185.
- [41] Small CB, Stryszak P, Danzig M, Damiano A. Onset of symptomatic effect of mometasone furoate nasal spray in the treatment of nasal polyposis. J Allergy Clin Immunol 2008; 121: 928–932.
- [42] Bateman ED, Hurd SS, Barnes PJ, et al. Global strategy for asthma management and prevention: GINA executive summary. Eur Respir J 2008; 31: 143–178.
- [43] Bousquet J. Mometasone furoate: an effective anti-inflammatory with a well-defined safety and tolerability profile in the treatment of asthma. Int J Clin Pract 2009; 63: 806–819.
- [44] Tan RA, Corren J. Mometasone furoate in the management of asthma: a review. Ther Clin Risk Manag 2008; 4: 1201–1208.
- [45] Calverley PMA, Rennard S, Nelson HS, et al. One-year treatment with mometasone furoate in chronic obstructive pulmonary disease. Respir Res 2008; 9: 73.
- [46] Kašák V. Tiotropium a jeho místo v léčbě stabilizované chronické obstrukční plicní nemoci. Farmakoterapie 2005; 1: 7–10.