Postavení specifické alergenové imunoterapie v léčbě alergií
Specifická alergenová imunoterapie je léčebný postup, při kterém jsou do organismu alergika postupně vpravovány vzestupné dávky alergizující látky s cílem snížit aktivitu symptomů navozených expozicí příčinného alergenu. Specifická alergenová imunoterapie navozuje vznik klinické i imunologické tolerance, má dlouhodobý léčebný účinek a může působit prevenci progrese alergického onemocnění. Zlepšuje kvalitu života alergických pacientů.
Úvod
Specifická alergenová imunoterapie (dříve hyposenzibilizace, desenzibilizace) je léčebná metoda známá již téměř 100 let. V roce 1911 Noon [1] a Freeman [2] patřili mezi první, kteří publikovali její léčebné užití. Tehdy se jednalo pouze o empirii, dnes však víme, že tato terapie představuje celosvětově uznávaný postup, který spolu s alergenovou eliminací a farmakoterapií tvoří komplex účinných léčebných opatření. Během léčby se do organismu alergika v pravidelných časových intervalech vpravují definované dávky terapeutického alergenu, na který je tento pacient přecitlivělý. Cílem je snížit reaktivitu jedince na konkrétní alergen zásahem do regulačního působení T lymfocytů. Jedná se o kauzální léčebný postup, který není jenom léčbou konkrétního alergického onemocnění, ale i léčbou podstaty imunopatologického procesu, alergie zprostředkované protilátkami typu IgE, alergie I. typu [3]. Její léčebný přínos je individuální v závislosti na diagnóze a tíži onemocnění, na době jejího trvání, na celkovém stavu pacienta, na druhu kauzálního alergenu, na mono- nebo polyvalentnosti alergie a také na volbě terapeutického alergenu i na kvalitě provedení léčebné kúry. Účinnost specifické alergenové imunoterapie byla prokázána při léčbě alergie pylové, roztočové, plísňové, hmyzí a zvířecí. Předpokladem dobrého efektu je včasné zahájení, které tlumí aktivitu nemoci, brání její progresi, vzniku komplikací i dalších projevů alergie. V lehčím stadiu onemocnění je také nižší riziko nežádoucích účinků léčby [3].
Mechanismy působení
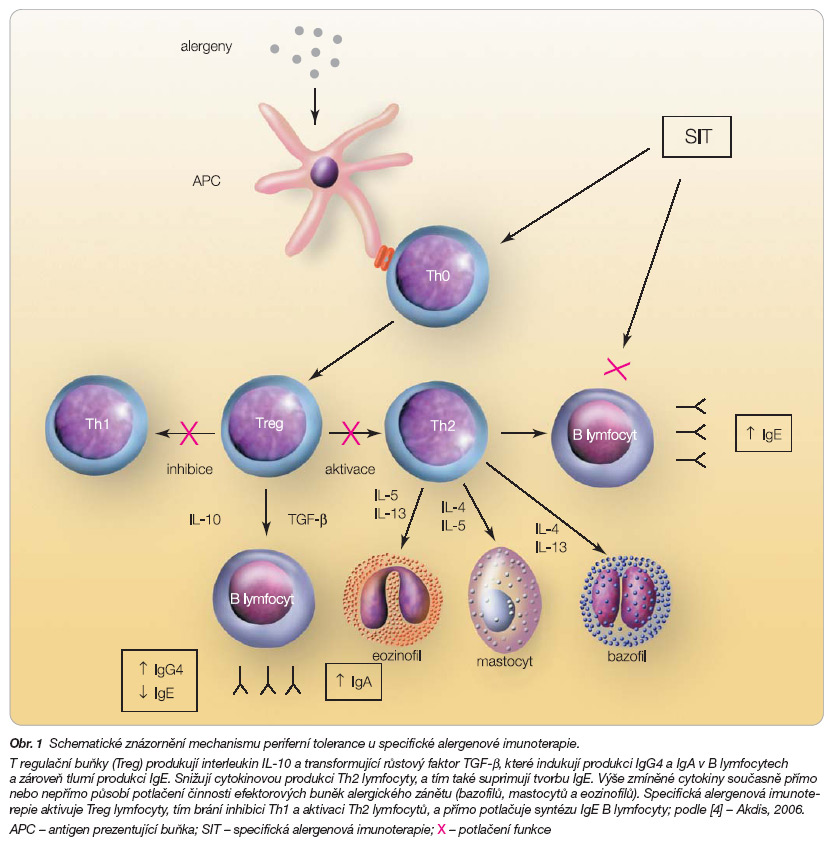
Alergické onemocnění vzniká v důsledku nevyvážené imunitní odpovědi na alergen, při níž jsou vytvářeny alergen-specifické protilátky IgE. Jsou tvořeny v B lymfocytech a jejich tvorba je závislá na vzniku pomocných Th2 lymfocytů produkujících ve zvýšené míře interleukin IL-4, IL-5 a IL-13. Samotná existence alergen-specifických Th2 lymfocytů však ke vzniku alergie nestačí, je známo, že jsou přítomny i u nealergiků. Cílem imunologického ovlivnění těchto dějů je normalizovat patologickou převahu cytokinové produkce Th2 lymfocytů směrem ke zvýšení tvorby cytokinů produkovaných Th1 lymfocyty, tj. především interferonu INF-g a IL-12. Nedávno bylo prokázáno, že v tomto směru sehrávají významnou roli tzv. regulační T lymfocyty (Treg). U zdravých lidí jsou nacházeny ve vyšší míře než u alergiků. Potlačují proliferaci a expresi cytokinů tvořených Th1 a Th2 lymfocyty a ovlivňují i činnost antigen-prezentujících buněk. Regulační T lymfocyty definujeme na základě jejich funkce. Řadíme sem např. CD4+CD25+ lymfocyty, které exprimují transkripční faktor FOXP3, považovaný za velmi důležitý pro indukci jejich tvorby. Existují ale také regulační T lymfocyty (Treg1) exprimující interleukin IL-10 a transformující růstový faktor TGF-b. Předpokládá se, že tyto dva typy regulačních T lymfocytů hrají největší roli v potlačení alergických symptomů. Další typ regulačních T lymfocytů (Th3) produkuje IL-4, IL-10 i TGF-b a vzniká v důsledku orální aplikace antigenu např. při sublinguální alergenové imunoterapii [4]. Léčba vakcínami mění rovnováhu mezi populacemi efektorových a regulačních lymfocytů, které regulují periferní toleranci. Aplikací vysoké dávky alergenu se v imunitním systému tato porušená periferní tolerance vůči alergenům znovu „naprogramuje" [5]. Dle posledních prací zabývajících se touto problematikou se zdá, že specifická imunoterapie vede ke vzniku regulačních T lymfocytů secernujících interleukin IL-10 nebo TGF-b a schopných potlačovat imunitní odpověď mediovanou IgE protilátkami a vyvolávat produkci protilátek IgG4 a IgA v B lymfocytech [6]. Imunomodulační vliv alergenové imunoterapie zasahuje komplexně do celého řetězce alergické reakce, od prezentace antigenu přes zásah do dysbalance cytokinové produkce Threg, Th0, Th1 a Th2 lymfocytů až po snížení počtu a aktivity efektorových buněk zánětu v cílových orgánech [3], viz obr. 1.
I když mechanismy působení alergenové imunoterapie nejsou doposud detailně prozkoumány, je pravděpodobné, že se také odlišují v závislosti na způsobu aplikace vakcín. Na rozdíl od klasické léčby, kdy je alergen podáván subkutánně, působí sublinguální podání cestou slizničního lymfatického systému. Pomocí přenosu radioaktivně značených autologních leukocytů se zjistilo, že po injekční aplikaci alergenu se zánětlivá aktivita objevuje v místě vpichu už během první hodiny po podání a poté narůstá v závislosti na čase. Naopak při sublinguální imunoterapii se znaky radioaktivity označující místa zánětu v příslušné regionální oblasti podpaží nebo střev neobjevily, i když pacienti alergenový extrakt spolkli. Význam sublinguální aplikace tedy nespočívá v přímém přestupu z ústní sliznice do krve, ale poskytuje výhodu již evolučně existujícího fyziologického mechanismu orální tolerance vůči různým antigenům zevního prostředí. Alergen je zachycen dendritickými buňkami sliznice s následnou fagocytózou, makropinocytózou nebo endocytózou. Dendritické buňky potom dozrávají a migrují do proximálních mízních uzlin, které představují speciální mikroprostředí, podporující indukci slizniční tolerance prostřednictvím produkce IgG4 blokujících protilátek a indukci T lymfocytů se supresivními funkcemi [7, 8].
Injekční a sublinguální imunoterapie působí na odlišných lymfatických drahách. V časné fázi, kdy je alergen kontaktován a pohlcen a zároveň je usnadněna modulace specifické imunitní odpovědi, se do celého procesu zapojuje systém vrozené imunity spolu se specifickými protilátkami. Expozice alergenu v průběhu specifické imunoterapie nespouští regulaci pozitivní zpětnou vazbou zprostředkovanou protilátkami IgE, která by vedla k větší sekreci IL-4 a k syntéze IgE. Naproti tomu vysoké dávky alergenu podporují zapojení nízkoafinitního receptoru FceRII (CD23), jenž je znám jako regulátor negativní zpětné vazby u odpovědí závislých na IgE [5–8].
Indikace a kontraindikace léčby
Alergenová imunoterapie je indikována tehdy, pokud je alergologickým vyšetřením prokázána přítomnost alergie I. typu na pyly, roztoče domácího prachu, vzdušné plísně, zvířecí srst a hmyzí jed. Jedná se většinou o takové alergeny, kde není možné provést důslednou eliminaci nebo v případě zvířecí alergie jsou přítomny obtíže, aniž by dotyčný byl chovatelem zvířete. Klinickými projevy tohoto typu alergie je alergická rinokonjunktivitida, alergické asthma bronchiale, reakce na bodnutí hmyzem a někdy i atopický ekzém.
Indikaci a vlastní vedení léčby provádí lékař-specialista v oboru alergologie a klinická imunologie. Aplikace injekčních vakcín musí být prováděna vždy ve zdravotnickém zařízení, které je dostatečně personálně i přístrojově vybaveno pro případ nutnosti řešení eventuálně vzniklé akutní anafylaktické reakce. Zahájení léčby a její úvodní vzestupná (a také rizikovější) fáze mají být vždy ponechány odborníkovi. Udržovací injekční aplikace může být ve výjimečných případech delegována jinému lékaři, ale za podmínek dodržení všech výše uvedených požadavků na bezpečné zvládnutí nežádoucích reakcí. Před zahájením terapie se doporučuje, aby pacient (nebo jeho rodič či odpovědný zástupce) byl podrobně seznámen s celou problematikou léčby a podepsal informovaný souhlas s léčbou. Čím dříve ve vztahu k prvním symptomům choroby je léčba zahájena, tím je její efekt vyšší. Přehled indikací a kontraindikací alergenové imunoterapie je uveden v tab. 1, 2 [9].
Gravidita představuje pouze relativní kontraindikaci. Nikdy nebyl prokázán teratogenní účinek léčby. Pro existující riziko anafylaktické reakce v iniciální fázi by se nemělo v tomto období s terapií začínat, ale s udržovací léčbou je možno v těhotenství pokračovat. Relativní kontraindikací je také těžký průběh atopického ekzému [9].
Pokud je alergenová imunoterapie hmyzím jedem indikována u pacientů s kardiovaskulárním onemocněním vyžadujícím podávání b-blokátorů, je zapotřebí pečlivě zvážit rizika i přínos kombinace obou terapeutických postupů. Léčbu b-blokátory většinou není možno ukončit. Přitom imunoterapie hmyzím jedem je prokazatelně účinným postupem, významně snižujícím riziko fatální reakce po včelím nebo vosím bodnutí. U těchto jedinců je možné tuto vakcinaci provádět, ale pacient musí být pečlivě kardiologicky sledován, včetně pravidelného monitorování krevního tlaku a EKG záznamu [9].
Účinnost léčby
Účinnost alergenové imunoterapie závisí na několika činitelích:
1. ‑kvalita alergenové vakcíny,
2. ‑vhodná aplikační cesta,
3. ‑včasný start a dostatečná délka terapie,
4. ‑dodržování dalších léčebných i režimových opatření.
Specifická alergenová imunoterapie je účinná pouze tehdy, jsou-li k ní použity kvalitní, tzv. standardizované vakcíny. V ideálním případě se jedná o vakcínu známého složení a s prokázanou účinností, prověřenou adekvátně prováděnými a placebem kontrolovanými studiemi. V současnosti je pro výrobce vakcín doporučována standardizace na celkovou alergenní potenci, tj. na biologickou aktivitu a na množství hlavního alergenu, vyjádřené ve hmotnostních jednotkách (mg/ml). Stanovení potence vakcíny v biologických jednotkách se provádí měřením kožní reakce u skupiny obdobně alergicky reagujících jedinců a v laboratorních podmínkách podle schopnosti vakcíny inhibovat vazebnou kapacitu specifických protilátek IgE (např. RAST inhibice). Složení alergenové vakcíny je navíc určováno a standardizováno pomocí dalších metod (izoelektrická fokusace, SDS-PAGE elektroforéza, IgE imunoblotting, CRIE-křížová radioimunoelektroforéza). Přesnost a spolehlivost těchto metod je závislá na charakteristice použitých sér alergiků a na alergenové vakcíně použité jako referenční vnitropodnikový standard [3].
Na našem trhu rozlišujeme alergenové vakcíny I. a II. generace. Alergeny I. generace jsou vyráběny podle starých technologických postupů, nejsou standardizované, jejich koncentrace je vyjádřena v jednotkách proteinového dusíku (PNU). Tyto preparáty by se dnes už vůbec neměly používat. Alergeny II. generace jsou standardizované plně nebo v míře, která je pro konkrétní alergen u daného výrobce proveditelná. U nás se prakticky jedná o vakcíny firmy ALK-Abelló, Stallergenes a Allergy Therapeutics. Jsou vyráběny moderními postupy a mají prokázanou léčebnou účinnost řadou klinických studií publikovaných v renomovaných impaktovaných časopisech. Náš domácí výrobce vakcín (Seva-pharma) má v současnosti na trhu pouze pylové standardizované vakcíny injekční a perorální (jednotky JSK), jejich účinnost byla doložena vždy jednou studií pro každý typ aplikace a na poměrně malém počtu pacientů.
Další podmínkou účinnosti je způsob aplikace. Teoreticky je možné vakcíny aplikovat několika aplikačními cestami: injekčně (subkutánně), nazálně, perorálně, sublinguálně a inhalačně. Prokazatelně účinná je pouze léčba injekční (subkutánní) a sublinguální. Sliny mají omezenou proteolytickou aktivitu vůči alergenům, takže aplikace pod jazyk alergen nelikviduje. Při perorálním podání (a spolknutí) ale dochází ke kompletní degradaci alergenu v gastrointestinálním traktu [8]. Zatímco terapie injekční je vhodná jak pro léčbu alergie na inhalované alergeny i hmyzí jedy, sublinguální léčebné schéma se pro léčbu hmyzí přecitlivělosti neužívá. Sublinguální aplikace je stejně účinná jako injekční, má však ve srovnání s ní některé významné výhody: je méně riziková, téměř se při ní nevyskytují celkové anafylaktické reakce, je šetrnější, a proto vhodná zvl. u hypersenzitivních nemocných, umožňuje domácí léčbu, a tudíž odpadá nutnost cestování pacienta na injekci do zdravotnického zařízení. Podmínkou účinnosti je ale použití podstatně vyšších terapeutických dávek (50–100krát vyšších) ve srovnání s terapií subkutánní [10]. Dle některých farmako-ekonomických studií je ve svém důsledku tato léčba nakonec i levnější [11, 12]. S výhodou je používána u dětí školního i předškolního věku [13]. U nás zcela nedávno přednesla Krčmová a kol. výsledky vlastní studie srovnávající účinnost i cenu subkutánní a sublinguální alergenové imunoterapie při léčbě alergické rýmy preparáty Phostal a Staloral u souboru 57 dospělých alergiků. Injekční léčba vykazovala klinicky časnější nástup účinků, ale po třech letech podávání se obě skupiny od sebe nelišily. Průměrné náklady na léčbu klesly ve skupině léčené injekcemi na 34 % původní částky a ve skupině léčené sublinguálním podáním na 30 %. Ve skupině kontrolní, bez alergenové imunoterapie, náklady klesly pouze na 82 % původní částky [14].
Další podmínkou účinnosti alergenové imunoterapie je její včasné zahájení a dostatečně dlouhé trvání. Čím je s terapií započato dříve, tj. v časných fázích alergického onemocnění, kdy ještě nejsou přítomny chronické změny a komplikace, tím je efekt lepší. Proto se doporučuje léčbu zahajovat již v dětském věku (možno už od 3 let) či v adolescenci nebo v časné dospělosti. U lidí starších 60 let již není vhodné alergenové vakcíny podávat. Alergenová imunoterapie má probíhat po dobu 3 až 5 let, někdy i déle, kontinuálně, nezávisle na ročním období. To platí i pro nemocné s polinózou léčené pylovými alergeny. Pouze u velmi senzitivních jedinců v případě silnějších symptomů se doporučuje dávku alergenu v pylové sezoně snížit nebo výjimečně i terapii krátkodobě přerušit [10, 15]. Aplikace pylových vakcín před začátkem sezony (např. preparátem Pollinex) se provádí u některých blíže specifikovaných nemocných. Má také prokázanou účinnost, ale není považována za léčbu I. volby.
I v průběhu alergenové imunoterapie je nutné dodržovat léčebná i režimová opatření. V některých případech je vhodné i během terapie užívat některá farmaka, např. antihistaminika, antileukotrieny či lokální kortikoidy. Alergenová eliminace nebo snaha o omezení kontaktu s alergeny musí být neustále brána na zřetel a je další nezbytnou podmínkou úspěšnosti léčby alergenovými vakcínami. Je iluzorní si myslet, že např. absolvování terapie zvířecími alergeny umožní chov domácích zvířat. Také ten, kdo podstoupil terapii hmyzím jedem, musí být neustále obezřetný při pohybu v přírodě a musí být i nadále vybaven balíčkem první pomoci pro možnost léčebného zásahu při eventuální reakci na hmyzí bodnutí.
Rizika léčby
Vzhledem k tomu, že při alergenové imunoterapii je do organismu vpravována látka, která je příčinou alergie, nelze vyloučit ani při správné aplikaci možnost vzniku nežádoucí reakce.
Ta se může objevit během léčby kdykoliv. Častější je v průběhu iniciální fáze se vzestupným dávkováním, při použití injekčních forem (zvl. vodných nedepotních) a při užití zrychlených aplikačních schémat [3]. U alergenů depotních je navázán alergen na minerální nosič (např. kalcium fosfát, hydroxid hlinitý) nebo tyrozin. Tím je umožněno pomalé a postupné uvolňování účinné látky z místa vpichu při subkutánní aplikaci, je prodloužen interval mezi jednotlivými vpichy, snížen počet injekcí i riziko reakcí.
Při provádění alergenové imunoterapie se mohou vyskytnout dva typy nežádoucích reakcí, místní a celkové. Místní reakce v případě užití injekční subkutánní formy vznikají v místě vpichu a objeví se většinou během 20–30 minut jako svědivý erytém, edém, kopřivkový pupen. Někdy se může objevit za delší dobu (po několika hodinách) po vpichu bolestivý podkožní infiltrát o průměru několika centimetrů. Místní reakce u léčby sublinguální vznikají záhy po aplikaci a projeví se pálením v ústech, eventuálně mírným edémem sliznice. Místní reakce jsou pro pacienta nepříjemné, ale nikoli ohrožující. Při opakovaných intenzivnějších místních reakcích se doporučuje provádět léčbu pod clonou antihistaminik nebo snížit dávku. Při použití vakcín, kde je alergen navázán na hydroxid hlinitý (Alutard SQ, HLA-depot), se mohou v místě vpichu po několika dnech vytvořit a přetrvávat po delší dobu podkožní uzlíčky, které se dokonce mohou i aktivovat při větší expozici alergenu. Většinou spontánně vymizí a nevyžadují úpravu dávkování [3, 15].
Systémové reakce jsou charakterizovány celkovými příznaky a projevy mimo oblast vpichu vakcíny. Vznikají především u injekčních forem aplikace a rozvíjejí se během několika minut po aplikaci. Čím časněji, tím je horší prognóza ve smyslu komplikovaného průběhu a obtížné léčby. Projeví se většinou jakou generalizovaný pruritus a erytém, urtikarie, rýma, kašel a astmatická dušnost, eventuálně celková anafylaktická reakce s hypotenzí s příznaky kardiopulmonálního selhání. Obecně ale platí, že alergenová imunoterapie, včetně její injekční formy, pokud je prováděna lege artis, je léčbou bezpečnou, s minimálním rizikem vzniku systémových reakcí a anafylaxe. Klasifikace systémových reakcí dle Evropské akademie alergologie a klinické imunologie [9, 15] viz tab. 3.
Vybavení ordinace provádějící injekční alergenovou imunoterapii pro případ nutnosti léčby systémové reakce viz tab. 4.
Budoucnost alergenové imunoterapie
V současné době jsme svědky neustálého zdokonalování výroby alergenových vakcín, především zkvalitnění standardizace. Je snaha o to, aby modifikačními postupy byly vytvářeny takové alergoidy, které mají nižší alergenicitu a vyšší imunogenicitu, tj. aby byly účinnější a bezpečnější. Velký výzkumný potenciál je směrován do vývoje neinjekčních tabletových forem vakcín. Dnes, kdy je známa aminokyselinová sekvence řady hlavních a vedlejších alergenů, se otevírá především možnost výroby rekombinantních alergenových preparátů s důraznějším účinkem na T regulační buňky bez rizika vzniku potenciálně nebezpečné alergické odpovědi podněcované Th2 lymfocyty [3, 16, 17].
Závěr
Specifická alergenová imunoterapie je velmi účinná léčebná metoda alergie zprostředkovaná protilátkami typu IgE. Je to doposud jediná kauzální léčba, která vede k dlouhodobě přetrvávající toleranci vůči alergenům vzniklé na základě normalizace imunitní odpovědi organismu. Nejedná se o alternativu, ale o důležitou a nezastupitelnou součást komplexní terapie alergických chorob, na jejichž vzniku se podílejí alergeny inhalované a hmyzí. Brání nové senzibilizaci a snižuje symptomy bronchiální hyperreaktivity u pacientů s astmatem a pylovou alergickou rýmou. Mechanismus jejího působení není ještě do všech detailů známý, studium teoretických poznatků i vývoj nových typů alergenových vakcín intenzivně pokračuje.
Seznam použité literatury
- [1] Noon L. Prophylactic inoculation against hay fever. Lancet 1911; 1: 1572–1573.
- [2] Freeman J. Vaccination against hay fever: Report of results during first three years. Lancet 1914; 1: 1178.
- [3] Rybníček O, Seberová E. Průvodce specifickou alergenovou imunoterapií. Praha, ČIPA 2004.
- [4] Akdis CA, Barlan IB, Bahceciler N, Akdis M. Immunological mechanisms of sublingual immunotherapy. Allergy 2006; 61 (Suppl. 81): 11–14.
- [5] Schmidt-Weber CB, Blaser K. New insights into the mechanisms of allergen-specific immunotheray. Curr Opin Allergy Clin Immunol 2005; 5: 525–530.
- [6] Durham SR, Till SJ. Immunologic changes associated with allergen immunotherapy. J Allergy Clin Immunol 1998; 102: 157–164.
- [7] Payet-Jamroz M, Helm SL, Wu J, et al. Suppression of IgE responses in CD23-transgenic animals is due to expression of CD23 on non-lymphoid cells. J Immunol 2001; 166: 4863–4869.
- [8] Petrisková J. SLIT-imunologické mechanizmy. Ako ich (ne)poznáme. Klin Imunol Alergol 2006; 15: 5–17.
- [9] Alvares-Cuesta E, Bousquet J, Canonica GW, et al. Standards for practical allergen-specific immunotherapy. Allergy 2006; 61 (Suppl. 82): 1–20.
- [10] Bousquet J, Van Cauwenberge P, Khaltaev N; Aria Workshop Group; World Health Organization. Allergic rhinitis and its impact on asthma. J Allergy Clin Immunol 2001; 108 (Suppl. 5): S147–334.
- [11] Berto P, Passalacqua G, Crimi N, et al.; Italian SPAI Study Group. Economic evaluation of sublingual immunotherapy vs symptomatic treatment in adults with pollen-induced respiratory allergy: the Sublingual Immunotherapy Pollen Allergy Italy (SPAI) study. Ann Allergy Asthma Immunol 2006; 97: 615–621.
- [12] Bousquet J. Sublingual immunotherapy: Validated. Allergy 2006; 61 (Suppl. 81): 5–6.
- [13] Pham-Thi N, de Blic J, Scheinmann P. Sublingual immunotherapy in the treatment of children. Allergy 2006; 61 (Suppl. 81): 7–10.
- [14] Krčmová I, Hanzálková Y, et al. Subkutánní či sublinguální alergenová imunoterapie v léčbě alergické rýmy? Přednáška na pracovní schůzi ČSAKI , Praha 14. 12. 2006.
- [15] Bousquet J, Lockey R, Malling HJ. WHO position paper. Allergen immunotherapy: therapeutic vaccines for allergic diseases. Allergy 1998; 53 (Suppl. 44): 4–30.
- [16] Didier A. Future developments in sublingual immunotherapy. Allergy 2006; 61 (Suppl. 81): 29–31.
- [17] Pereira C, Botelho F, Tavarez B, et al. Kinetics and dynamic evaluation of specific immunotherapy. Allerg Immunol 2004; 36: 375–386.