Potřeba a perspektivy nových antibiotik
Choroby vyvolané mikroby jsou v celosvětovém měřítku v popředí příčin morbidity a mortality. Přes nesporný globální přínos antibiotik se stále častěji setkáváme s informacemi o výskytu infekcí způsobených bakteriemi rezistentními k antibiotikům. Vedle celkového snížení spotřeb antibiotik jako základní podmínky omezení vzniku a šíření rezistence je jednou z dalších možností hledání a rychlé klinické uplatnění nových látek se spolehlivým antibakteriálním účinkem i na rezistentní mikroorganismy. Vývoj zcela nových originálních antibakteriálních léčiv však v posledních desetiletích výrazně stagnuje a po více než 30 letech byly až na přelomu tisíciletí registrovány tři nové originální přípravky (linezolid, daptomycin a tigecyklin).
Začátek cíleného používání antibiotik představoval jeden ze základních mezníků v pokroku moderní medicíny 20. století. Objev a masová produkce sulfonamidů, penicilinu a streptomycinu přinesly zásadní snížení morbidity a mortality v souvislosti s infekcemi všude, kde byly tyto léky dostupné. Postupně se v klinické praxi objevovaly další skupiny látek s antibakteriální účinností jako makrolidy, tetracykliny, glykopeptidy, cefalosporiny, chinolony a jiné, které kromě vysoké úspěšnosti v léčbě bakteriálních infekcí současně umožnily rozvoj medicínských oborů mnohdy spojených s vysokým rizikem infekčních komplikací. Jako příklad mohou sloužit některé chirurgické disciplíny, transplantační medicína a hematoonkologie. Není divu, že zhruba od počátku 50. let až do konce 70. let minulého století se mluví o „zlaté éře" antibiotik, kdy podle některých tehdejších prognóz dokonce nebyla daleko doba, ve které se infekce nebudou vyskytovat vůbec [1].
Současnost tomu ale zdaleka nenasvědčuje. Přes nesporný globální přínos antibiotik jsou choroby vyvolané mikroby stále v celosvětovém měřítku v popředí příčin morbidity a mortality. Navíc se v různé míře projevují negativní důsledky dlouhodobého, ale především nadměrného a nesprávného používání antibiotik.
Globálně narůstající rezistence k antibiotikům znamená ztrátu klinické účinnosti nejen starších, ale mnohdy i těch nejnovějších přípravků. Nejen v odborné literatuře, ale i ve sdělovacích prostředcích se stále častěji setkáváme s informacemi o reálné hrozbě výskytu infekcí způsobených bakteriemi rezistentními k antibiotikům, v anglické terminologii také příhodně označovanými jako „superbugs". Podle některých se v tomto kontextu jedná o prokazatelnou krizi antibiotické terapie, či dokonce o počátek postantibiotické éry [2, 3].
Z biologického a evolučního hlediska lze chápat lavinovité šíření odolnosti k lékům jako přirozený projev nesmírné adaptability bakteriálních společenstev na měnící se podmínky prostředí. Právě tato vlastnost je zjevně hlavním nositelem evoluční úspěšnosti bakteriální říše [4]. Je pak zákonité, že čím více a čím častěji jsou bakteriální populace vystavovány působení antibiotik, tím intenzivněji se aktivují a geneticky přenášejí různé mechanismy, které eliminují účinek léků a tím zaručují přežívání mikrobů.
Právě proto je chápáno celkové snížení spotřeby antibiotik jako základní podmínka omezení vzniku a šíření rezistence. Neméně důležité je omezení aplikace širokospektrých přípravků, důraz na správné podávání (dávka, aplikační interval, trvání léčby) a v neposlední řadě zlepšení kontroly nemocničních infekcí. Na význam a nutnost implementace těchto principů se opakovaně upozorňuje v programech a materiálech WHO, Evropské komise, ECDC (Evropské centrum pro kontrolu a prevenci nemocí). V České republice se této problematice v návaznosti na mezinárodní aktivity a projekty věnuje například Subkomise pro antibiotickou politiku (SKAP) ČLS JEP a Chemoterapeutická sekce České internistické společnosti ČLS JEP.
Jednou z dalších možností alespoň dočasného snížení negativních důsledků ve vývoji rezistence je hledání a rychlé klinické uplatnění nových látek se spolehlivým antibakteriálním účinkem i na rezistentní mikroorganismy.
Naléhavá potřeba rozšíření terapeutického arzenálu se týká zejména některých mikroorganismů vysoce adaptovaných na nemocniční prostředí i na působení antibiotik. Efektivní léčba oportunních infekcí vyvolaných odolnými mikroby je díky rezistenci často velmi limitována, pokud je vůbec reálná. Současné statistiky uvádějí, že minimálně polovina všech nemocničních infekcí v průmyslových zemích má přímou souvislost s rezistentními mikroby [5].
Mezi grampozitivními bakteriemi je ve středu zájmu Staphylococcus aureus s rezistencí k b-laktamovým antibiotikům (MRSA) často ve spojení s rezistencí k dalším skupinám antibiotik, zatím omezeně také glykopeptid rezistentní stafylokoky (VRSA) Zejména na hematoonkologických odděleních jsou obávané enterokoky rezistentní k vankomycinu (VRE) [6].
Ze skupiny gramnegativních bakterií se například jedná o multirezistentní enterobakterie s produkcí širokospektrých b-laktamáz (ESBL), nejčastěji je to Klebsiella spp., E. coli a další. Neméně obávané jsou multirezistentní a zatím spíše výjimečně i panrezistentní kmeny Pseudomonas aeruginosa, Acinetobacter baumannii, Burkholderia cepacia [6].
Výjimkou nejsou ani anaerobní bakterie. Epidemický výskyt Clostridium difficile (ribotyp 027) s hyperprodukcí toxinů způsobujících pseudomembranózní enterokolitidy s velmi těžkým, někdy smrtícím průběhem a s vysokým stupněm přirozené i získané rezistence k mnoha antibiotikům je vysoce aktuální jak v severní Americe, tak i v řadě evropských zemí [7]. Další velmi aktuální hrozbou je celosvětové šíření multirezistentních kmenů Mycobacterium tuberculosis. Postižena je i skupina vyvolavatelů invazivních oportunních mykóz (kandidy non-albicans, Aspergillus spp., Mucor spp.) ohrožujících těžce imunosuprimované pacienty. Základní systémová antimykotika se stávají v řadě případů neúčinná a stále častěji je třeba volit rezervní, vysoce finančně nákladné přípravky.
U původců komunitních infekcí není situace, alespoň v našich podmínkách, tak závažná, což znamená, že základní přípravky volby (například peniciliny u bakteriálních respiračních infekcí, nitrofurantoin u nekomplikovaných uroinfekcí) si zachovávají stále vysokou účinnost [8, 9]. Dokladem toho jsou pravidelné přehledy citlivosti nejvýznamnějších invazivních bakteriálních izolátů poskytované Národní referenční laboratoří (NRL) pro antibiotika. Jako jejich zdroj slouží síť úzce spolupracujících mikrobiologických laboratoří. Celý systém je začleněn do mezinárodního projektu EARSS (European Antimicrobial Resistance Surveillance System). Tato data ale také potvrzují, že v České republice došlo v posledních několika letech k strmému, i v rámci Evropy ojedinělému nárůstu rezistence k fluorochinolonům, který postihuje nejen nozokomiální patogeny, ale i komunitní kmeny E. coli a může velmi brzy znamenat zásadní omezení terapeutické použitelnosti celé skupiny [10].
Pokud mluvíme o nových antibiotikách, je třeba rozlišovat deriváty již známých molekul a nové originální molekuly s mechanismem účinku doposud nevyužitým v klinické praxi. Deriváty mohou přinést určitá vylepšení v antibakteriální aktivitě, spektru účinku, farmakologických vlastnostech, případně při překonání některých mechanismů rezistence, ale málokdy znamenají zásadní změnu oproti starším přípravkům. Pokud se týká zcela nových originálních látek, jejich počet v posledních desetiletích výrazně stagnuje. Po více než 30 letech byly až na přelomu tisíciletí registrovány originální přípravky linezolid, daptomycin a tigecyklin [1, 5].
Podcenění závažnosti fenoménu rezistence, jeho globálních důsledků, stejně jako nepředpokládaná rychlost šíření genů rezistence je zřejmě jednou z hlavních příčin zpomalení výzkumu a vývoje nových sloučenin v období zlaté éry antibiotik.
Nová antibiotika cílená především k léčbě grampozitivních infekcí
Z významných derivátů posledních let lze uvést perorální telithromycin, odvozený ze skupiny makrolidových antibiotik a určený hlavně pro léčbu respiračních infekcí. Jeho přínosem je účinek na bakteriální kmeny, jako je například Streptococcus pyogenes, které se staly k původním makrolidům rezistentní. Výskyt nežádoucích účinků zahrnujících závažné poškození jater, prodloužení QT intervalu a další rizika plynoucí z inhibice izoenzymu CYP 3A4 (interakce s některými statiny) vedl v poslední době v USA k zúžení indikací telithromycinu pouze na léčbu komunitních pneumonií. V ČR je sice registrován, ale zatím na trh uveden nebyl a vzhledem k obecně nízké hladině rezistence komunitních respiračních patogenů v našich podmínkách není ani jeho zavedení do klinické praxe potřebné.
Alternativním lékem pro léčbu nemocničních infekcí (pneumonie, sepse, infekce kůže a měkkých tkání) vyvolaných rezistentními grampozitivními koky se stal od roku 2000 kombinovaný injekční přípravek složený ze dvou streptograminových antibiotik, quinupristin/dalfopristin [12]. Historie streptograminů zdaleka není nová. Streptograminy působí obdobným mechanismem účinku jako makrolidy a linkosamidy (inhibice syntézy proteinů ireverzibilní vazbou na 50S podjednotku bakteriálního ribozomu), na významu nabývají právě z důvodu nárůstu invazivních infekcí MRSA a Enterococcus faecium. V některých evropských zemích je registrována i perorální forma streptograminů, pristinamycin.
Parenterální cefalosporin, ceftobiprol, byl cíleně vyvinut pro léčbu MRSA infekcí kůže a měkkých tkání, stejně jako pneumonií. Je vysoce aktivní i vůči koaguláza negativním stafylokokům, penicilin rezistentním pneumokokům a k některým gramnegativním bakteriím. V současnosti prochází III. fází klinického zkoušení [13].
Zcela novou skupinou antibiotik uvedenou do klinického používání v nedávné době jsou oxazolidinony. Originální mechanismus účinku oxazolidinonů spočívá ve vazbě na ribozomální podjednotku 50S, čímž je blokována tvorba tzv. iniciačního komplexu s mRNA a N-formylmethionyl-tRNA navázanými na počátku. Jediným představitelem skupiny zatím schváleným pro klinické použití je linezolid účinný proti grampozitivním bakteriím včetně rezistentních kmenů MRSA, VRE, VRSA, rezistentním koaguláza negativním stafylokokům a pneumokokům rezistentním k penicilinu. Ostatní antibiotika inhibující proteosyntézu (tetracykliny, aminoglykosidy, makrolidy, linkosamidy a streptograminy) zasahují až v její další fázi, v tzv. elongačním cyklu. Vznik zkřížené rezistence mezi těmito antibiotiky a linezolidem je proto nepravděpodobný. Výskyt rezistence je zatím sporadický, ale varující v tom, že se jedná o rezervní antibiotikum. Určen je především k léčbě komunitních i nozokomiálních pneumonií a infekcí kůže a měkkých tkání. Jeho léčebný potenciál je bezesporu širší. Linezolid se dobře vstřebává ze zažívacího traktu, důkazem toho je skutečnost, že perorální formy dosahují stejně vysokých sérových hladin jako po aplikaci stejného množství nitrožilně. Doporučená dávka pro perorální i intravenózní použití se proto neliší. Perorální forma podávání je výhodná pro sekvenční léčbu a umožňuje ambulantní péči. Linezolid může působit myelosupresivně a navozovat anémii, leukopenii, trombocytopenii nebo pancytopenii. Doba podávání by z těchto důvodů neměla přesáhnout 28 dní [14].
Cyklický lipopeptid daptomycin je dalším antibiotikem s unikátním mechanismem účinku založeným na vazbě na bakteriální cytoplazmatickou membránu s následnou depolarizací membránového potenciálu, který vede k narušení základních procesů v bakteriální buňce a k jejímu rychlému zániku. Antibakteriální spektrum zahrnuje většinu aerobních grampozitivních mikroorganismů. Je registrován v USA i v Evropě, v České republice zatím není daptomycin dostupný. V roce 2006 FDA rozšířila jeho indikace z infekcí kůže a měkkých tkání i na sepse a endokarditidy stafylokokového původu bez ohledu na to, zda se jedná o etiologii MSSA (k meticilinu citlivý Staphylococcus aureus) nebo MRSA. Nicméně ani tento přípravek nezůstal ušetřen výskytu rezistence, k jejímuž vzniku může dojít i intra therapiam [15].
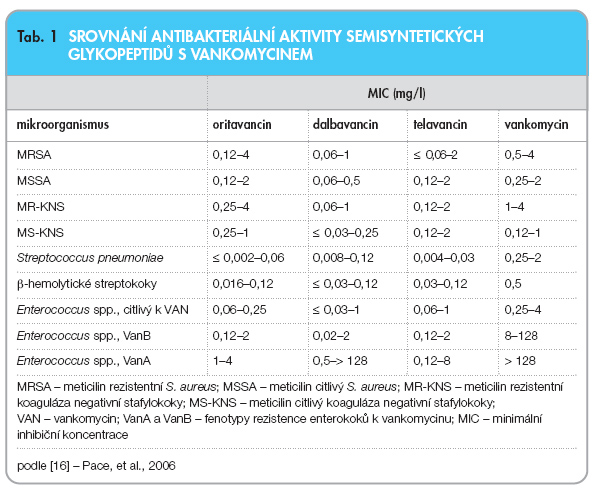
V různém stadiu klinického zkoušení se nacházejí zástupci druhé generace glykopeptidů, oritavancin, dalbavancin a telavancin, antibiotika slibná mimo jiné z důvodu zachování účinnosti i na kmeny enterokoků a stafylokoků rezistentní k první generaci (vankomycin, teikoplanin). Přehled antibakteriální aktivity semisyntetických glykopeptidů je uveden v tab. 1 [16].
Oritavancin jako prvně syntetizovaný přípravek z celé skupiny vykazuje intenzivní baktericidní efekt a výhodnější farmakokinetické vlastnosti ve srovnání s vankomycinem. Jeho účinek na enterokoky s fenotypem rezistence VanA je však pouze hraniční.
Dalbavancin je semisyntetický derivát teikoplaninu s vysokou aktivitou vůči VanA i VanB enterokokům. Podobně jako teikoplanin má značnou vazbu na sérové bílkoviny (98 %) a extrémně dlouhý biologický poločas, který je zárukou stabilních sérových hladin při parenterální aplikaci jednou týdně.
Telavancin vykazuje vysokou baktericidní aktivitu nejen vůči enterokokům rezistentním k první generaci glykopeptidů, ale i na VRSA a VISA. Za zmínku stojí, že působí dvojím mechanismem, kromě inhibice bakteriální buněčné stěny narušuje funkci cytoplazmatické membrány. Z hlediska intenzity účinku a prevence vzniku rezistence mohou být tyto vlastnosti přínosné pro terapii, stejně jako fakt, že přípravek in vitro významně inhibuje bakteriální populace vázané na biofilm. Tomu odpovídají i experimentální výsledky potvrzující vysokou úspěšnost v léčbě endokarditid pokusných zvířat. Zanedbatelná není ani prokázaná výborná tkáňová distribuce a pro glykopeptidy nezvykle vysoká intracelulární dostupnost.
K výše uvedené skupině lze přiřadit i cyklický lipoglykopeptid ramoplanin, zkoušený pouze v perorální formě z důvodů značné systémové toxicity při parenterální aplikaci. Jeho perspektiva spočívá ve využití pro dekolonizaci gastrointestinálního traktu rizikových nosičů VRE, případně jako alternativa pro léčbu těžkých infekcí vyvolaných toxickými kmeny Clostridium difficile [16].
Pro úplnost je třeba zmínit poslední generace fluorochinolonů charakteristické zesílenou aktivitou na řadu grampozitivních druhů a určené zejména pro terapii komunitních pneumokokových infekcí, především pneumonií. Mají svůj význam v oblastech s vysokými hladinami rezistence k penicilinům a dalším b-laktamům. Jedná se o 4. generaci, z níž je u nás registrován moxifloxacin, k dalším patří gemifloxacin, trovafloxacin a sitafloxacin [10]. Hlavním limitem fluorochinolonů je rychlé šíření rezistence podmíněné několika mechanismy a velmi často zkřížené v rámci celé skupiny. Registrován zatím nebyl chinolon garenoxacin, prezentující generaci tzv. des-F6 fluorochinolonů, sloučenin, u kterých je atom fluoru v molekule nahrazen jinou skupinou za účelem omezení nežádoucích účinků (fototoxicita) při dalším potencování aktivity na pneumokoky a anaeroby a relativně nízkým potenciálem pro vznik rezistence [17].
Nová antibiotika cíleně určená pro léčbu infekcí gramnegativní etiologie
Nemocniční kmeny enterobakterií a nefermentujících gramnegativních tyček jsou vybaveny různými mechanismy rezistence, případně jejich kombinacemi vůbec nejčastěji. Nepochybně s tím úzce souvisí nárůst mortality a morbidity hospitalizovaných pacientů, stejně jako ohromné ekonomické ztráty vázané na prodlužování hospitalizace a nákladnou péči o pacienty postižené nozokomiálními infekcemi způsobenými multirezistentními bakteriemi [18].
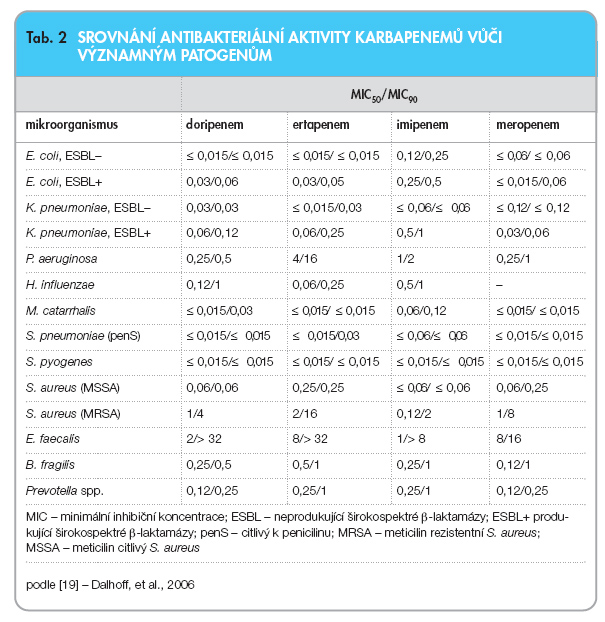
Karbapenemová antibiotika jsou rezervními léky právě pro léčbu závažných, mnohdy polymikrobiálních infekcí vyvolaných multirezistentními mikroorganismy (sepse, ventilátorová pneumonie, komplikované uroinfekce). I když také jejich účinnost zejména u pseudomonád a acinetobakterů v závislosti na lokalitě mnohdy významně klesá, výzkum těchto látek probíhá nadále ve snaze zachovat, či dokonce upevnit jejich pozici jako jedné z nejvýznamnějších skupin nemocničních antibiotik vůbec. Základní spektrum účinku karbapenemů je uvedeno v tab. 2 [19].
Ertapenem je zatím posledním v řadě zemí registrovaným a i u nás dostupným zástupcem karbapenemů. Vyznačuje se vysokou vazbou na sérové bílkoviny a dlouhým poločasem, což umožňuje jeho podávání jednou denně zhruba v třetinových dávkách ve srovnání s imipenemem nebo meropenemem. Na rozdíl od nich ale postrádá dostatečnou aktivitu na Pseudomonas aeruginosa, Acinetobacter baumannii a některé další nefermentujcí tyčky. Účinek na Enterobactericeae a anaeroby je srovnatelný s výše jmenovanými zástupci. Kromě léčby nozokomiálních infekcí je indikován i k léčbě komunitních pneumonií v zemích s výskytem vysokého procenta penicilin rezistentních pneumokoků [19].
Zatím pouze v Japonsku je registrován t.č. nejnovější zástupce karbapenemů, doripenem. Podle dosavadních studií lze jeho přínos vidět v tom, že rezistence k pseudomonádám, acinetobakterům a Burkholderia cepacia není, v závislosti na mechanismu, vždy zkřížená s imipenemem a meropenemem, jinak ale zřejmě nepřináší žádnou zásadní změnu ve spektru účinku ani v dalších ukazatelích podstatných pro terapii [19, 20].
Tigecyklin je nové širokospektré intravenózní antibiotikum ze skupiny glycylcyklinů, semisyntetických derivátů tetracyklinů. Přípravek je v ČR již registrován, ale zatím nebyl uveden na trh. Překonání některých mechanismů rezistence, jako je eflux či mutací podmíněná protekce cílového místa na rRNA, rozšiřuje jeho účinnost na problémové vysoce rezistentní gramnegativní i grampozitivní mikroorganismy. Do spektra jeho účinku mimo jiné patří i multirezistentní acinetobaktery, bakterie produkující ESBL, dále MRSA, VRE a většina anaerobů. V rámci klinického zkoušení vykazoval srovnatelnou účinnost s léčbou karbapenemy nebo kombinovaným podáním aztreonamu a vankomycinu [21]. Výskyt nežádoucích účinků obecně odpovídá tetracyklinové třídě antibiotik. Je prozatím registrován pro léčbu komplikovaných nitrobřišních infekcí a komplikovaných infekcí kůže a podkoží [21].
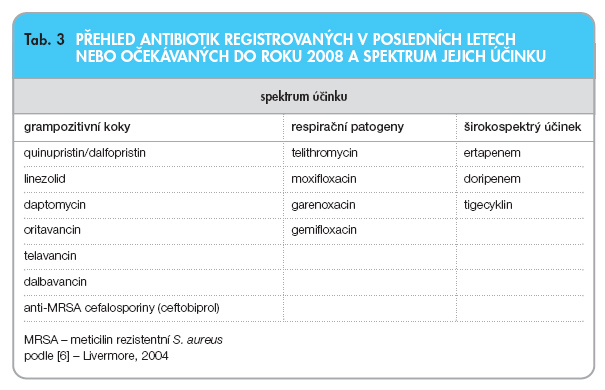
Sumární přehled nově registrovaných a k registraci chystaných antibiotik je uveden v tab. 3 (upraveno podle [6]).
Nové směry ve vývoji antibiotik
Vývoj nových látek s antibakteriálním působením a minimem výskytu nežádoucích účinků probíhá především na úrovni hledání dalších cílů esenciálních pro funkci mikroorganismu, jejichž ovlivnění by přineslo spolehlivý inhibiční účinek a současně neinterferovalo s buňkami makroorganismu.
Jako velmi perspektivní se v tomto ohledu jeví genomika, prudce se rozvíjející vědní obor, jehož snahou je určit úplnou primární strukturu (pořadí bazí) DNA studovaného druhu a vytěžit z této znalosti maximum biologicky relevantních informací, zejména identifikovat jednotlivé geny a určit jejich funkční vztahy (tzv. funkční genomika) [22].
Inhibice proteosyntézy je hlavní oblastí, na kterou se upínají současné výzkumné aktivity. Kromě mRNA jsou například intenzivně zkoumány ncRNA geny (nekódující RNA), které mají podíl na mnoha biologicky významných procesech, aniž jim byla v minulosti věnována patřičná pozornost. Nalezení jejich klíčové úlohy a určení optimálních přístupů, které regulují jejich funkce, vyžaduje hluboké porozumění metabolismu mikroorganismů na molekulární úrovni. Výsledkem mohou být nové generace látek účinně a selektivně zasahujících patogenní mikroby bez devastujícího vlivu na přirozenou, pro makroorganismus nesmírně důležitou mikroflóru. Zmiňované neselektivní působení na citlivé mikroorganismy bez rozdílu také významně přispívá ke vzniku rezistence, která se může pod tlakem antibiotika primárně aktivovat právě u nepatogenních bakterií a sekundárně se přenášet na mikroby schopné vyvolávat infekční chorobu [22].
Jestliže principem účinku dosavadních antibiotik je inhibice proliferace bakteriálních populací, experimentálně byly identifikovány látky se schopností eliminovat faktory virulence, které hrají při vzniku a průběhu infekčního procesu klíčovou roli. Příkladem může být molekula virastatinu, jenž blokuje u Vibrio cholerae dva faktory virulence, produkci toxinu a společně s toxinem regulované pilli na podkladě inhibice transkripce faktoru ToxT. Jiným perspektivním „antivirulentním" cílem je sekreční systém typu III, jenž zajišťuje vstup efektorových proteinů do hostitelské buňky, což je nutná podmínka uplatnění invazivity gramnegativních patogenů, jako jsou salmonely, shigely, yersinie, pseudomonády a také chlamydie [22, 23].
Další směry se například zaměřují na interferenci s bakteriální fyziologií, konkrétně na blokádu molekul „quorum senzing" zprostředkovávajících mezibakteriální komunikaci, na jejímž podkladě je stimulována bakteriální kolonizace a tvorba biofilmu [24].
K dalším perspektivním sloučeninám v obraně vůči hrozbě rezistence lze přiřadit novou generaci inhibitorů b-laktamáz. Zavedení prvních sloučenin tohoto typu (kyselina klavulanová, sulbaktam, tazobaktam) se ukázalo jako velmi přínosné pro obnovení účinnosti základních b-laktamových antibiotik. Rozšíření nových typů b-laktamáz, vůči nimž stávající sloučeniny postrádají inhibiční efekt, například ESBL nebo karbapenemázy, vyvolalo zájem o sloučeniny s afinitou i k těmto enzymům, jejich ověřování zatím probíhá na laboratorní úrovni. Výzkum inhibitorů se nezaměřuje pouze na b-laktamázy, ale také na enzymy podmiňující rezistenci k aminoglykosidům (acetyltransferázy, adenylázy) [23].
Efluxní transportní systémy, které rychle transportují antibiotikum mimo bakteriální buňku, jsou, zejména v kombinaci s dalšími mechanismy, častou příčinou rezistence grampozitivních i gramnegativních bakterií. Selektivně působícími inhibitory příslušných systémů skýtají perspektivu uplatnění v klinické praxi. Prvními popsanými látkami s tímto účinkem jsou reserpin, berberin, a dále v současnosti intenzivně zkoumaný rostlinný produkt, 5"-methoxyhydnokarpin. Jedná se o látku chemicky příbuznou antibiotikům s možností syntézy hybridních sloučenin s aktivitou na rezistentní mikroorganismy [23].
Závěr
I za předpokladu postupného omezení preskripce antibiotik v globálním měřítku se jeví jako pravděpodobné, že rezistence k antibiotikům bude do jisté míry progredovat ve smyslu akumulace genů rezistence zejména u nemocničních bakterií [6]. Zatímco u přípravků cílených na grampozitivní mikroby lze vysledovat nadějnou perspektivu dávající jistou záruku minimálně na několik příštích let, kritická situace nastává u gramnegativních bakterií. Zmiňované multirezistentní a panrezistentní izoláty pseudomonád a acinetobakterů naznačují vyčerpání rezerv současné antibiotické léčby. Kontrola infekcí vyvolaných multirezistentními enterobakteriemi je možná jen díky karbapenemům. Pokud dojde k rozšíření karbapenemáz, rovněž nozokomiální infekce této etiologie se stanou prakticky neléčitelné [6].
Potřeba nových antibiotik je na základě těchto skutečností jednoznačná. Sporné zůstává, jak zajistit zintenzivnění výzkumu a vývoje především v rámci velkých farmaceutických společností, mnoho z nich zaměřilo úsilí na vývoj komerčně zajímavějších farmak určených pro léčbu chronických, například kardiovaskulárních chorob. Nepříliš ideální z hlediska aktuální potřeby konkrétních přípravků je také dlouhá cesta mezi nalezením účinné látky a jejím uplatněním v klinické praxi. Je pochopitelné, že délka a složitost celého procesu je vedena snahou o maximální bezpečnost přípravků uváděných na trh. Na druhé straně může současně uplatňovaný postup znamenat, že během několikaletého laboratorního a klinického zkoušení se změní epidemiologie nemocničních, případně komunitních původců infekcí nebo se objeví nové mechanismy rezistence zahrnující i příslušnou látku a její následná využitelnost bude omezena nebo značně zkrácena [5, 6].
Je více než pravděpodobné, že v nejbližší budoucnosti nelze až na výjimky příliš spoléhat na nová, či dokonce zázračná antibiotika a je třeba vystačit s tím, co je k dispozici. To předpokládá maximální obezřetnost a rozvahu při indikování, výběru a způsobu používání antibiotik obecně. Pokud nebudou v širokém měřítku akceptovány základní principy pro racionální používání antibakteriálních přípravků, pravděpodobně můžeme v dohledné době směle vykročit vstříc postantibiotické éře.
Seznam použité literatury
- [1] Overbye MK, Barrett JF. Antibiotics: where did we wrong? Drug Dissovery Today 2005; 10: 45–52.
- [2] Abott A. Medics Braced for Fresh Superbug. Nature 2005; 436: 758.
- [3] Alanis AJ. Resistance to Antibiotics: Are We in the Post-Antibiotic Era? Arch Med Res 2005; 36: 697–705.
- [4] Capra F. Vývoj života. In: Tkáň života. Praha, Academia 2004: 202–237.
- [5] Barrett JF. Can Biotech Deliver New Antibiotics. Current Opinion in Microbiology 2005; 8: 498–503.
- [6] Livermore DM. The Need for New Antibiotics. Clinical Microbiology and Infection 2004; 10 (Suppl. 4): 1–9.
- [7] Barlett JG. The New Epidemic of Clostridium difficile – Associated Enteric Disease. Ann Int Med 2006; 145: 758–764.
- [8] Bartoníčková K, Bébrová E, Beneš J, et al. Doporučený postup pro antibiotickou léčbu komunitních infekcí ledvin a močových cest v primární péči. Praktický lékař 2006; 86: 429–438.
- [9] Bébrová E, Jindrák V, Kolář M, et al. Doporučený postup pro léčbu respiračních infekcí v primární péči. Praktický lékař 2005; 83: 502–515.
- [10] Nyč O, Urbášková P, Marešová V. Konsensus používání antibiotik III. Chinolony. Praktický lékař 2006; 86: 570–574.
- [11] Prokeš M. Zúžení indikací pro telithromycin. Pace News. http://www.pace.cz/article.php?id=151.
- [12] Allington DR, Rivey MP. Quinupristin/dalfopristin: a therapeutic review. Clinical Therapeutics 2001; 23: 24–44.
- [13] Bogdanovich T, Ednie LM, et al. Antistaphylococcal activity of ceftobiprole, a new broad-spectrum cephalosporin. Antimicrobial Agents and Chemotherapy 2005; 49: 4210–4219.
- [14] Dlouhý P, Harold I, et al. Postavení linezolidu v léčbě rezistentních grampozitivních infekcí. Klinická mikrobiologie a Infekční lékařství 2006; 12: 4–9.
- [15] Hayden MK, Rezai K, et al. Development of Daptomycin Resistance In Vivo in Methicillin-Resistant Staphylococcus aureus. J Clin Microb 2005; 43: 5285–5287.
- [16] Pace JL, Yang G. Glykopeptides: Update on an old successful antibiotic class. Biochemical pharmacology 2006; 71: 968–980.
- [17] Scott VW, Phillips L, Ludwig E, et al. Population Pharmacoknetics and Pharmacodynamics of Garenoxacin patients with Community-Acquired Respiratory Tract Infections. Antimicrobial Agents and Chemotherapy 2004; 48: 4766–4777.
- [18] Paterson LD. Resistance in Gram Negative Bacteria: Enterobactericeae. The American Journal of Medicine 2006; 119: S20–S28.
- [19] Dalhoff A, Nebojsa J, Echols R. Redefining Penems. Biochemical Pharmacology 2006; 71: 1085–1095.
- [20] Ge Y, Wikler MA, Sahm DF, et al. In Vitro Antimicrobial Activity of Doripenem, a New Carbapenem. Antimicrobial Agents and Chemotherapy 2004; 48: 1384–1396.
- [21] Greer ND. Tigecycline: The First in the Glycylcycline Class of Antibiotics. Baylor University Medical Center Proceedings 2006; 19: 155–161.
- [22] Vincente M, Hodgson J, Massidda O, et al. The Fallacies of Hope: Will we Discover New Antibiotics to Combat Pathogenic Bacteria in Time? FEMS Microbiological Reviews 2006; 30: 841–852.
- [23] Wright GD, Sutherland AD. New strategies for combating multidrug-resistant bacteria. Trends Mol Med. 2007; 13: 260–267.
- [24] Hentzer M, Wu H, Andersen JB, et al. Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors. The EMBO Journal 2003; 22: 3803–3815.