Premixované inzuliny v léčbě diabetu
Premixované inzuliny jsou přípravky obsahující krátkodobě a dlouhodobě účinný inzulin v definovaném poměru. Jsou určeny zejména pro terapii pacientů s diabetem 2. typu. Charakteristická farmakodynamika nabízí dobré ovlivnění zejména postprandiální glykemie. Premixovaná analoga vykazují ve srovnání s humánními premixovanými inzuliny větší potenciál snížení postprandiální glykemie a nižší riziko hypoglykemie. K dispozici je výběr přípravků s 25 %, 30 % a 50 % krátkodobě účinné složky, což umožňuje individuální nastavení terapie. Po selhání terapie kombinací perorálních antidiabetik jsou premixované inzuliny jedním z možných inzulinových režimů volby.
Úvod
Cílem terapie diabetu je snížení mortality a prevence pozdních komplikací při minimalizaci nežádoucích účinků terapie. Primární podmínkou dosažení cíle je snížení hyperglykemie, která je základním příznakem diabetu, k hodnotám zdravých osob. Pacient s diabetem 1. typu nemá vlastní sekreci inzulinu, proto je plně závislý na terapii exogenním inzulinem. U nemocných s diabetem 2. typu je v první fázi vývoje nemoci inzulin jednou z možných alternativ léčby (obvykle v kombinaci s perorálními antidiabetiky). Po delším průběhu choroby je však nezbytnou součástí terapie, protože sekrece inzulinu postupně klesá, i když je vždy zachována v míře zabraňující vzniku ketoacidózy.
Současná koncepce léčby diabetu vychází z patofyziologických poznatků, přičemž jsou v podstatě přípustné různé individuální variace terapie (nepřekračující kontraindikace), pokud je dosaženo cíle – bezpečného zlepšení kompenzace. Tímto prizmatem je třeba posuzovat využití jednotlivých režimů terapie inzulinem.
Průběh sekrece inzulinu
P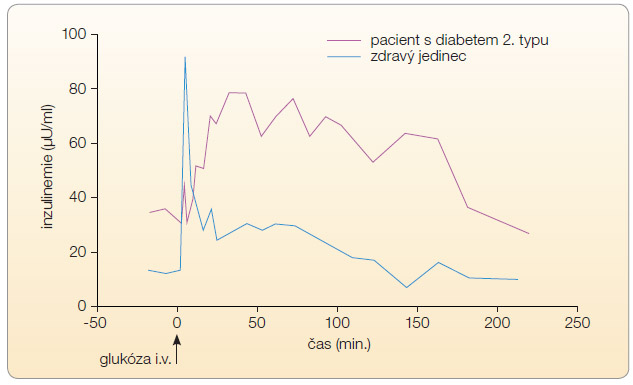 o sekrečním podnětu (glukóza, některé aminokyseliny, některé hormony) se zvyšuje uvolňování inzulinu z β-buněk s typickou dynamikou (graf 1). První fáze sekrece odpovídá zjednodušeně uvolnění inzulinu z předpřipravené zásoby, druhá fáze sekreční odpovědi odpovídá zejména zvýšení syntézy inzulinu [1]. První fáze sekrece představuje významný signál, který převádí metabolismus hepatocytů a periferních tkání ze stavu přizpůsobeného lačnění do stavu postprandiálního, kdy organismus může zabezpečit své potřeby energie z živin vstřebávaných z gastrointestinálního traktu. Její chybění je typickým prvním příznakem rozvíjejícího se diabetu 2. typu [1].
o sekrečním podnětu (glukóza, některé aminokyseliny, některé hormony) se zvyšuje uvolňování inzulinu z β-buněk s typickou dynamikou (graf 1). První fáze sekrece odpovídá zjednodušeně uvolnění inzulinu z předpřipravené zásoby, druhá fáze sekreční odpovědi odpovídá zejména zvýšení syntézy inzulinu [1]. První fáze sekrece představuje významný signál, který převádí metabolismus hepatocytů a periferních tkání ze stavu přizpůsobeného lačnění do stavu postprandiálního, kdy organismus může zabezpečit své potřeby energie z živin vstřebávaných z gastrointestinálního traktu. Její chybění je typickým prvním příznakem rozvíjejícího se diabetu 2. typu [1].
Při standardním příjmu tří velkých jídel denně je sekrece inzulinu zvýšena vždy po jídle (graf 2). Nalačno je pak snížena na úroveň, která zabezpečuje správný průběh intermediárního metabolismu. Glukóza je za běžné situace p![Graf 2 Schematický průběh sekrece endogenního inzulinu u zdravé osoby během celého dne; podle [1] – Pelikánová, et al., 2011. Inzulinemie se postprandiálně zvyšuje násobně oproti stavu nalačno. Cílem je udržení normoglykemie v postprandiálním stavu.](https://www.remedia.cz/photo-a-29495---.jpg) referenčně utilizována jako zdroj energie pouze v mozku, erytrocytech a některých dalších tkáních, energie nutná k přežívání ostatních tkání je získávána oxidací mastných kyselin. Ty jsou uvolňovány z tukové tkáně v důsledku odbrzděné lipolýzy (lipolýza je indukována zejména snížením inzulinemie s následnou zvýšenou aktivitou hormon-
referenčně utilizována jako zdroj energie pouze v mozku, erytrocytech a některých dalších tkáních, energie nutná k přežívání ostatních tkání je získávána oxidací mastných kyselin. Ty jsou uvolňovány z tukové tkáně v důsledku odbrzděné lipolýzy (lipolýza je indukována zejména snížením inzulinemie s následnou zvýšenou aktivitou hormon-
-senzitivní lipázy).
Inzulinové přípravky
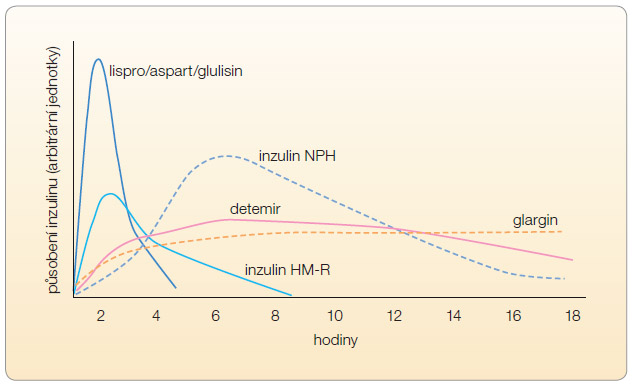 Velmi zjednodušeně lze dělit přípravky inzulinu na krátkodobě účinné (zejména tzv. krystalický – regular – inzulin a krátkodobě účinná analoga inzulinu) a dlouhodobě účinné (inzulin NPH, dlouhodobě účinná analoga inzulinu – bazální analoga). Jejich kombinací vznikají tzv. premixované inzuliny, jejichž farmakokinetika (a také farmakodynamika) se liší podle typu inzulinu a vzájemného poměru jednotlivých složek. Rozdíly schematicky znázorňuje graf 3.
Velmi zjednodušeně lze dělit přípravky inzulinu na krátkodobě účinné (zejména tzv. krystalický – regular – inzulin a krátkodobě účinná analoga inzulinu) a dlouhodobě účinné (inzulin NPH, dlouhodobě účinná analoga inzulinu – bazální analoga). Jejich kombinací vznikají tzv. premixované inzuliny, jejichž farmakokinetika (a také farmakodynamika) se liší podle typu inzulinu a vzájemného poměru jednotlivých složek. Rozdíly schematicky znázorňuje graf 3.
Premixované inzuliny
Obvyklým režimem aplikace inzulinu u všech pacientů s diabetem byla směs depotního a krátkodobě účinného inzulinu, kterou si pacient připravil sám postupným natažením do inzulinové stříkačky v poměru předepsaném lékařem. Rozdíly v aplikované dávce byly vysoké (dávkování po 0,1 ml, což byly 4 jednotky), a vedly k vyššímu riziku vzniku hypoglykemie. Zavedení továrně vyráběných premixovaných inzulinových směsí v definovaném poměru bylo ve své době velkým pokrokem [2, 3].
Inzulinová analoga a humánní inzulin
Hlavním důvodem vývoje inzulinových analog byl požadavek na zlepšení farmakokinetiky. Cílem bylo dosažení rychlejšího nástupu účinku u krátkodobě účinných analog, u dlouhodobě účinných analog pak prodloužení účinku na celých 24 hodin společně s bezvrcholovým průběhem a sníženou intraindividuální variabilitou [4]. Po zavedení analog inzulinu do praxe byla záhy připravena premixovaná analoga [5–8]. V současnosti jsou v České republice dostupné premixovaná inzuliny s obsahem 25 %, 30 % a 50 % krátkodobě účinného analoga. Protože jsou premixovaná analoga k dispozici v různém poměru krátkodobě a dlouhodobě účinné složky, je možné zvolit přípravek individuálně pro daného pacienta „na míru“ jeho metabolického profilu. Nic nebrání ani kombinaci dvou různých poměrů v jeden den, pokud to režim pacienta vyžaduje.
Léčba inzulinem u diabetu 1. typu
Pacient s diabetem 1. typu nemůže přežívat bez aplikace exogenního inzulinu [1]. Původně, po objevu depotních inzulinů, byli pacienti léčeni těmito přípravky aplikovanými jednou či dvakrát denně. Zásadní nevýhodou byla nutnost častého příjmu stravy, což v praxi znamenalo, že pacient podřizoval svůj život terapii. Riziko hypoglykemie bylo vysoké, proto i kompenzace diabetu nemohla být uspokojivá. Důsledkem bylo vysoké riziko rozvoje pozdních orgánových komplikací. Ke zlepšení situace napomohla aplikace pacientem vytvořené směsi krátkodobého a depotního inzulinu, nicméně tento způsob byl zatížen velkou nepřesností, a tím i vyšším rizikem hypoglykemie. Premixované inzuliny pouze mírně zlepšily situaci.
Zlom přinesla koncepce intenzifikované (intenzivní) terapie inzulinem, jejíž nedílnou součástí je režim aplikace inzulinu bazálního v kombinaci s krátkodobě účinným inzulinem před jídlem (tzv. režim bazál/bolus), selfmonitoring a edukace pacienta [9]. Režim aplikace inzulinu lépe napodobil fyziologickou sekreci inzulinu, edukovaný pacient mohl díky selfmonitoringu upravovat dávku prandiálního krátkodobě účinného inzulinu. Výsledkem bylo zlepšení kompenzace, které prokazatelně snížilo riziko komplikací. Přínos tohoto způsobu terapie prokázala jednoznačně studie DCCT (Diabetes Control and Complications Trial) [10] a následně její prodloužené sledování (EDIC) [11]. Intenzivní terapie inzulinem snížila nejen riziko mikrovaskulárních komplikací, ale jednoznačně také riziko manifestace ischemické choroby srdeční a přinesla i snížení mortality.
Od publikace studie DCCT se tak bazál/bolus stal základním režimem pro léčbu pacientů s diabetem 1. typu. Premixované inzuliny se mohou uplatnit pouze výjimečně, a to u osob se sníženou adherencí k terapii, u nichž není cílem terapie těsná kompenzace diabetu, ale pouze udržení asymptomatického stavu (bez příznaků dekompenzace diabetu). Lze si také představit situaci, kdy pacient dodržuje striktní režim životosprávy (definovaný příjem sacharidů vždy ve stejnou dobu, minimální fyzická aktivita), aplikuje pak dvakrát denně premixovaný analog s vyšším zastoupením krátkodobě účinné složky a příjem sacharidů v poledním jídle kryje jednou dávkou krátkodobě účinného analoga.
Patofyziologie diabetu mellitu 2. typu
Diabetes mellitus 2. typu je geneticky podmíněné onemocnění, na jehož manifestaci se významně podílí životospráva. U pacientů se rozvíjí několik vzájemně souvisejících poruch, jejichž výsledkem je postupně narůstající hyperglykemie [1]. Inzulinová rezistence je lokalizována zejména ve tkáni tukové a v příčně pruhovaném svalstvu, klinický význam má také rezistence k účinku inzulinu lokalizovaná v jaterních buňkách. Inzulinová sekrece je fyziologicky dvoufázová, přičemž se již na začátku vývoje diabetu 2. typu ztrácí první fáze sekrece inzulinu. V úvodu nemoci je celková sekrece zvýšena kompenzačně k inzulinové rezistenci, časem klesá [1, 12, 13].
Poměr vyjádření jednotlivých poruch se mění intraindividuálně v průběhu času, interindividuálně se pak liší významnost jednotlivých změn. U nemocných se zachovalou postprandiální sekrecí inzulinu a výrazně vyjádřenou inzulinovou rezistencí je typickým nálezem vysoká glykemie nalačno, s minimálními vzestupy postprandiálně, naopak u osob s relativně zachovalou citlivostí k inzulinu a se selháváním jeho sekrece jsou charakteristické zejména vysoké exkurze postprandiální glykemie [12, 13].Tyto skutečnosti jsou hlavním důvodem pro nutnost individuálního přístupu ve volbě farmakologické terapie diabetu mellitu 2. typu.
Indikace léčby inzulinem u diabetu 2. typu
Po dlouhou dobu byla vedena diskuse o vhodnosti či nevhodnosti terapie inzulinem u pacientů s diabetem 2. typu. Se znalo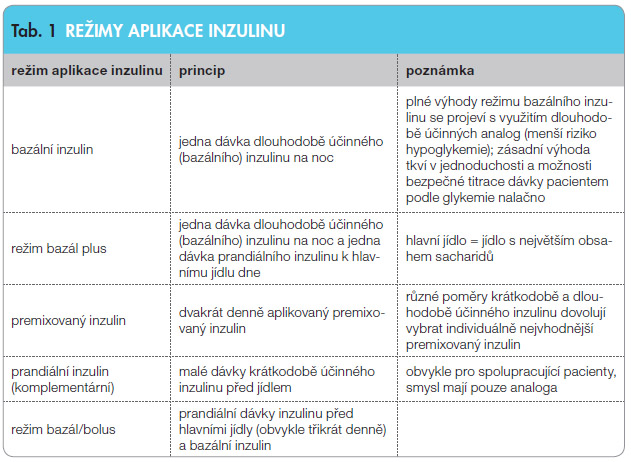 stí výsledků studie ORIGIN [14], ve které inzulin glargin aplikovaný u pacientů s prediabetem či v časných stadiích diabetu 2. typu nezvýšil riziko kardiovaskulárních komplikací, můžeme v současnosti pozici inzulinu v léčbě diabetu 2. typu definovat následovně: v prvních fázích nemoci je jednou z možností terapie, pokud možno vždy v kombinaci s metforminem, případně s jinými antidiabetiky. V pozdních fázích nemoci, kdy je sekrece endogenního inzulinu snížená (vyčerpání β-buněk), je léčba inzulinem nezbytná k dosažení požadované kompenzace.
stí výsledků studie ORIGIN [14], ve které inzulin glargin aplikovaný u pacientů s prediabetem či v časných stadiích diabetu 2. typu nezvýšil riziko kardiovaskulárních komplikací, můžeme v současnosti pozici inzulinu v léčbě diabetu 2. typu definovat následovně: v prvních fázích nemoci je jednou z možností terapie, pokud možno vždy v kombinaci s metforminem, případně s jinými antidiabetiky. V pozdních fázích nemoci, kdy je sekrece endogenního inzulinu snížená (vyčerpání β-buněk), je léčba inzulinem nezbytná k dosažení požadované kompenzace.
Přehled režimů aplikace inzulinu pro léčbu diabetu 2. typu je uveden v tab. 1. Mimo tyto základní režimy je možno v souladu se současným názorem na individuální přístup v terapii diabetu 2. typu volit i další kombinace, a to podle životního režimu pacienta (kombinace premixovaného inzulinu a prandiálního analoga, kombinace bazálního inzulinu a jedné dávky premixovaného inzulinu apod.).
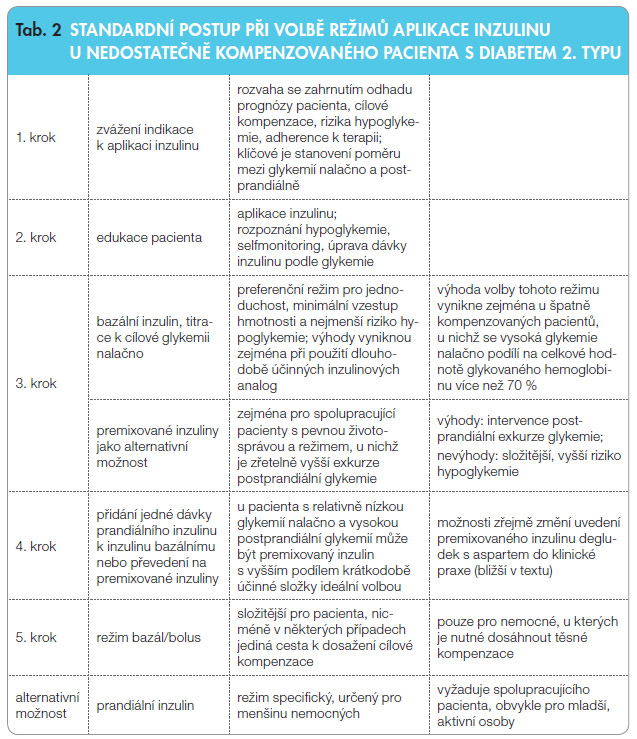
Podobně byla diskutována výhodnost a bezpečnost jednotlivých terapeutických inzulinových režimů u pacientů s diabetem 2. typu. K dispozici je pouze jediná dostatečně velká randomizovaná prospektivní studie, která porovnávala účinnost a bezpečnost tří základních režimů – jedné dávky bazálního inzulinu, dvou dávek premixovaného inzulinu a tří dávek prandiálního inzulinu. Byla uveřejněna analýza po jednom roce [15] a po třech letech léčby [16]. Hodnocení výsledků po jednom roce léčby je obtížné, podobné kompenzace bylo dosaženo režimem premixovaného inzulinu (medián glykovaného hemoglobinu dle DCCT, HbA 1C 7,3 %) a prandiálního inzulinu (medián HbA 1C 7,2 %), mírně horšího výsledku bylo dosaženo léčbou bazálním inzulinem (medián HbA 1C 7,6 %). Obtížně lze tento výsledek hodnotit proto, že lepší kompenzace bylo dosaženo také významně vyšší dávkou prandiálního inzulinu, přitom přírůstek hmotnosti byl 4,7 kg, 5,7 a 1,9 kg (medián) a incidence hypoglykemie podle počtu příhod na pacienta a rok byla 5,7, 12,0 a 2,3 příhody/pacient/rok (vždy premixovaný, prandiální a bazální inzulin; medián). Výsledky byly jednoznačnější až po třech letech – dosažená kompenzace byla shodná (medián HbA 1C 7,1 %, 6,8 % a 6,9 %), u pacientů léčených bazálním inzulinem však byla zjištěna nižší incidence hypoglykemie (3,0, 5,7 a 1,7 příhody/pacient/rok; medián) a nejnižší přírůstek hmotnosti. U většiny pacientů s diabetem 2. typu by tedy měl vyhovovat postup volby inzulinových režimů, který je uveden v tab. 2.
Pro posouzení výhodnosti, případně rizik jednotlivých režimů aplikace je třeba krom výsledků klinických studií zvážit požadovanou úroveň kompenzace pacienta. Prakticky všechny klinické studie jsou prováděny s cílem dosáhnout co nejnižších hodnot HbA 1C, případně glykemie nejbližší normálním hodnotám. V oblasti kompenzace, kdy se hodnoty glykemie blíží normální hodnotě zdravého člověka, se jeví z hlediska hypoglykemie nejbezpečnější režim bazálního inzulinu. Můžeme si ale představit následující situaci: cílem terapie pacienta nemusí být normoglykemie, přitom má pacient výrazný vzestup glykemie postprandiálně, premixované inzuliny pak mohou být ideální volbou.
Účinnost a bezpečnost terapie premixovanými inzuliny
K dispozici je celá řada klinických studií, které porovnávají účinnost a bezpečnost léčby premixovanými inzuliny (v současnosti v podstatě pouze premixovaná analoga) u pacientů s diabetem 2. typu s ostatními režimy léčby inzulinem, které byly zahrnuty do několika metaanalýz a přehledných prací [17–20]. Většina těchto studií je podporována farmaceutickými společnostmi a jejich uspořádání obvykle odpovídá cíli – prokázat lepší účinnost vlastního přípravku. Vstupním kritériem pro zařazení do studie je obvykle diabetes mellitus 2. typu nedostatečně kompenzovaný perorálními antidiabetiky, což představuje s ohledem na různé ovlivnění glykemie nalačno a vzhledem k postprandiálním exkurzím relativně nedostatečné vymezení. Pokud porovnáme režim bazálního inzulinu v kombinaci s metforminem (a s pioglitazonem) s režimem premixovaného analoga v kombinaci s metforminem (a s pioglitazonem) [21], můžeme předpokládat, že bude dosaženo lepší kompenzace premixovaným analogem za cenu vyššího rizika hypoglykemie (obvykle během dne) a vyššího přírůstku hmotnosti. Premixovaný inzulin totiž sníží exkurze postprandiální glykemie, což se projeví lepší kompenzací, daní za tento efekt je větší přírůstek hmotnosti a výše zmíněné hypoglykemie. Kombinace metforminu s pioglitazonem dobře sníží glykemii nalačno a v kombinaci s premixovaným inzulinem na hodnotu typicky bezpečně dosažitelnou terapií inzulinem bazálním.
Naopak – pokud porovnáme režim bazálního analoga s dvojkombinací metforminu a sekretagoga s premixovaným inzulinem samotným, bude výsledná kompenzace v nejhorším případě stejná [22]. Jestliže porovnáme účinek premixovaného analoga, které v sobě zahrnuje vyšší podíl krátkodobě účinné složky a aplikuje se 3krát denně v kombinaci s metforminem, s kombinací bazálního analoga a metforminu, ale bez sekretagoga, jistě bude premixovaný analog účinnější [23].
Léčba bazálním analogem sice vede k významně nižší konečné průměrné glykemii nalačno 6,5 mmol/l (odpovídá studii Treat To Target [24]), nicméně chybějící snížení postprandiální exkurze glykemie zatížilo tuto terapii handicapem 0,5 % HbA 1C. Ve studii Treat To Target bylo titrací bazálního inzulinu dosaženo průměrné hodnoty HbA 1C těsně pod hranicí 7 % (DCCT) při průměrné glykemii nalačno 6,5–6,7 mmol/l [24].
Dl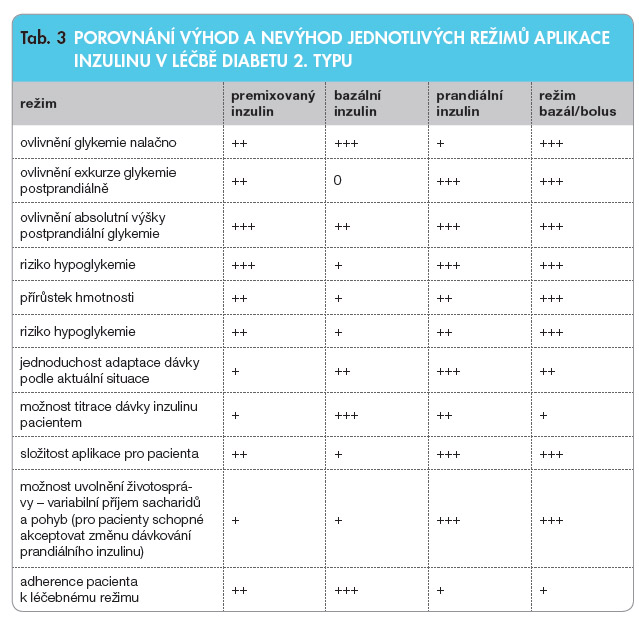 e mého osobního názoru je pro výběr vhodného režimu nutné uvědomit si u jednotlivých aplikačních schémat jejich výhody a nevýhody (tab. 3), které vyplývají zejména z farmakokinetiky, a pak zvolit individuální režim pro daného pacienta. Soudím, že každému zkušenému klinikovi jsou tyto rozdíly zřejmé, metaanalýzy nepomohou v rozhodování u jednotlivého pacienta, jsou pouze obecným vodítkem pro pochopení rozdílů mezi jednotlivými režimy.
e mého osobního názoru je pro výběr vhodného režimu nutné uvědomit si u jednotlivých aplikačních schémat jejich výhody a nevýhody (tab. 3), které vyplývají zejména z farmakokinetiky, a pak zvolit individuální režim pro daného pacienta. Soudím, že každému zkušenému klinikovi jsou tyto rozdíly zřejmé, metaanalýzy nepomohou v rozhodování u jednotlivého pacienta, jsou pouze obecným vodítkem pro pochopení rozdílů mezi jednotlivými režimy.
První kritické objasnění vztahu kombinace terapie a dosažení cílových hodnot se objevilo v publikaci profesorky Yki-Järvinen (obr. 1 a 2) [25]. Zde je taktéž zdůrazněno, že výsledné dávky inzulinů ve studiích jsou rozdílné při použití bazálních analog a premixovaných inzulinů, což by mělo být při hodnocení účinnosti jednotlivých režimů správně zohledněno. Práce taktéž upozorňuje, že v řadě studií nebylo využito plného potenciálu titrace bazálního inzulinu.
Se znalostí farmakokinetiky a s přijetím skutečnosti, že každý pacient s diabetem 2. typu má individuální průběh g![Obr. 1 Výsledky studií porovnávajících kombinaci perorálních antidiabetik a bazálního inzulinu (větev A) oproti kombinaci s premixovanými inzuliny (větev B); volně podle [25] – Yki-Järvinen, Kotronen, 2013. Šipky znázorňují vstupní glykovaný hemoglobin HbA1c (dle DCCT) a jeho výslednou hodnotu na konci studie. Plná šipka odpovídá statisticky významnému rozdílu, prázdná šipka rozdílu nesignifikantnímu. D – celková dávka inzulinu (jednotky/den, v režimu 6 jednotky/kg/den); * statisticky významný rozdíl v dávce inzulinu; n – celkový počet účastníků studie 1) A: inzulin NPH 1krát denně večer s metforminem; B: premixovaný protamin aspart/aspart 70/30 2krát denně s metforminem (podle [31] – Kilo, et al., 2003) 2) A: inzulin NPH 1krát denně večer s metforminem; B: NPH/humánní krátkodobě účinný inzulin 70/30 2krát denně s metforminem (podle [31] – Kilo, et al., 2003) 3) A: bazální inzulin glargin jednou denně s metforminem; B: protamin lispro/lispro 75/25 2krát denně s metforminem (podle [32] – Malone, et al., 2004) 4) A: bazální inzulin glargin 1krát denně s metforminem a pioglitazonem; B: protamin aspart/aspart 2krát denně s metforminem a pioglitazonem (podle [21] – Raskin, et al., 2005) 5) A: detemir 1–2krát denně s metforminem a sulfonylureou; B: protamin aspart/aspart 70/30 2krát denně s metforminem a sulfonylureou (podle [15] – Holman, et al., 2007). 6) A: bazální inzulin glargin 1krát denně a perorální antidiabetika B: protamin lispro/lispro 75/25 a perorální antidiabetika (podle [33] – Buse, et al., 2009)](https://www.remedia.cz/photo-a-29500---.jpg) l
l![Obr. 2 Výsledky studií porovnávajících bazální inzulin v kombinaci s perorálními antidiabetiky (větev A) s premixovanými inzuliny samotnými (větev B); volně podle [25] –Yki-Järvinen, Kotronen, 2013. Šipky znázorňují vstupní glykovaný hemoglobin HbA1c (dle DCCT) a jeho výslednou hodnotu na konci studie. Plná šipka odpovídá statisticky významnému rozdílu, prázdná šipka rozdílu nesignifikantnímu. D – celková dávka inzulinu (jednotky/den); * statisticky významný rozdíl v dávce inzulinu; n – celkový počet účastníků studie 1) A: inzulin NPH 1krát denně večer s metforminem a sulfonylureou; B: premixovaný inzulin humánní NPH/humánní krátkodobě účinný 70/30 2krát denně (podle [34] – Yki-Järvinen, et al., 1992) 2) A: inzulin NPH aplikovaný ráno s metforminem a sulfonylureou; B: premixovaný inzulin humánní NPH/humánní krátkodobě účinný 70/30 2krát denně (podle [34] – Yki-Järvinen, et al., 1992) 3) A: inzulin NPH 1krát denně večer se sulfonylureou; B: premixovaný inzulin humánní NPH/humánní krátkodobě účinný 70/30 2krát denně (podle [35] – Wolffenbuttel, et al., 1996) 4) A: inzulin NPH aplikovaný ráno se sulfonylureou; B: premixovaný inzulin humánní NPH/ humánní krátkodobě účinný 70/30 2krát denně (podle [35] – Wolffenbuttel, et al., 1996) 5) A: inzulin glargin aplikovaný ráno 1krát denně se sulfonylureou a metforminem; B: premixovaný inzulin humánní NPH/humánní krátkodobě účinný 70/30 2krát denně (podle [22] – Janka, et al., 2005)](https://www.remedia.cz/photo-a-29501---.jpg) ykemií podle stadia vývoje diabetu, relativního poměru poruchy inzulinové sekrece a inzulinové rezistence a vlastní životosprávy, lze uzavřít, že pro většinu nemocných je vhodným iniciálním inzulinovým režimem bazální analog. Premixované inzuliny mají své výhody zejména u spolupracujících pacientů se stabilním denním režimem, s vyšším vzestupem postprandiální glykemie, alternativně jako velmi účinný a přitom relativně bezpečný režim v situaci, kdy není striktní požadavek na těsnou kompenzaci v pokročilejší fázi vývoje diabetu 2. typu s chybějící postprandiální sekrecí inzulinu.
ykemií podle stadia vývoje diabetu, relativního poměru poruchy inzulinové sekrece a inzulinové rezistence a vlastní životosprávy, lze uzavřít, že pro většinu nemocných je vhodným iniciálním inzulinovým režimem bazální analog. Premixované inzuliny mají své výhody zejména u spolupracujících pacientů se stabilním denním režimem, s vyšším vzestupem postprandiální glykemie, alternativně jako velmi účinný a přitom relativně bezpečný režim v situaci, kdy není striktní požadavek na těsnou kompenzaci v pokročilejší fázi vývoje diabetu 2. typu s chybějící postprandiální sekrecí inzulinu.
Premixované inzuliny a riziko pozdních komplikací diabetu
Terapie premixovaným inzulinem snižuje koncentraci prekurzorů pozdních produktů glykace [26] a premixovaná analoga pozitivně ovlivňují tuhost arteriální stěny v porovnání s bazálním inzulinem [27]. Nicméně problematika rozdílného vlivu terapie premixovaným a bazálním inzulinem nebyla podrobněji studována z hlediska klinického. Vyjdeme-li z obecně přijímané premisy, že postprandiální glykemie je nezávislý rizikový faktor kardiovaskulárních komplikací, měla by terapie premixovanými inzuliny být ve smyslu snížení kardiovaskulárního rizika účinnější v porovnání s terapií bazálním inzulinem. Takový důkaz však nebyl přinesen a lze oprávněně pochybovat, že se jej podaří získat, protože případný přínos ovlivnění postprandiální glykemie bude vyvážen vyšším rizikem hypoglykemie. Z analýzy vztahu variability glykemie a kardiovaskulárního rizika u pacientů s diabetem 2. typu po akutním infarktu myokardu léčených prandiálním inzulinem a bazálním inzulinem vyplývá, že ani případné omezení exkurzí glykemie při použití premixovaného inzulinu nebude zásadním přínosem [28].
Pro koho je určen premixovaný inzulin?
Z porovnání výhod a nevýhod jednotlivých režimů aplikace inzulinu lze odvodit profil pacienta, pro něhož je léčba premixovaným inzulinem vhodná. Je to nemocný se stabilním životním režimem, bez intermitentních fyzických aktivit, spolupracující (ve smyslu dodržení konstantního režimu životosprávy). Nemocný, u nějž není striktním požadavkem těsná kompenzace diabetu a současně u něj již dochází k vyššímu vzestupu glykemie postprandiálně. Standardně je tato léčba určena pro pacienty s diabetem 2. typu, nicméně za jistých okolností ji lze použít i pro pacienty s diabetem 1. typu, obvykle je vhodné doplnit terapii krátkodobě účinným analogem podávaným v poledne.
Premixované inzuliny s vyšším podílem rychle účinkujícího analoga (50 %) je možné použít v režimu aplikace 3krát denně a takto nahradit režim bazál/bolus.
Lze pouze odhadnout, jak se změní indikace pro premixované inzuliny po registraci premixovaného inzulinu kombinujícího krátkodobě účinný analog aspart s dlouhodobě účinným bazálním inzulinem degludek [29]. Účinná koncentrace degludeku výrazně překračuje 24 hodin, proto je v podstatě lhostejné, kdy během dne si jej pacient aplikuje. Je možné si představit aplikaci fixní kombinace tohoto typu jednou denně před největším jídlem dne a současně titrovat dávku podle ranní glykemie. Nebo sjednotit akci pacienta do jednoho časového bodu dne – selfmonitoring glykemie nalačno, zvolení dávky a aplikace, vše ráno. Podmínkou je volba vhodného poměru složek tak, aby nedošlo při výraznějším navýšení dávky premixovaného inzulinu ke zvýšení rizika hypoglykemie po jídle.
Závěr
Premixované inzuliny byly v době zavedení velkým pokrokem v léčbě diabetu, zavedení premixovaných analog pak zlepšilo možnost ovlivnění postprandiální glykemie. Po zavedení dlouhodobě účinných analog do praxe (zejména inzulinu glargin) se na místo režimu první volby u většiny nemocných dostala terapie bazálním analogem jednou denně v kombinaci s perorálními antidiabetiky [30]. Tento režim je zatížen v porovnání s premixovanými inzuliny obvykle menším rizikem hypoglykemie a nižším přírůstkem hmotnosti [16]. Preferován je také pro svou jednoduchost a možnost snadné úpravy dávky inzulinu pacientem (titrace).
Avšak i v současnosti je možné s výhodou užít premixovaných inzulinů (zejména premixovaných analog) u pacientů se stabilní životosprávou a s relativně vyšším vzestupem postprandiální glykemie. Premixované inzuliny jsou stále dobrou možností volby s velmi dobrou účinností, možností individuálního výběru poměru rychle účinného analoga a depotní složky. Premixované inzuliny nabízejí oproti režimu bazál/bolus jednodušší léčbu s nižším rizikem hypoglykemie, a tudíž jsou předpokladem lepší compliance pacienta.
Seznam použité literatury
- [1] Pelikánová T, Bartoš V, et al. Praktická diabetologie. 5. vydání, Praha: Maxdorf, 2011, 744 s.
- [2] Jawadi MH, Ho LS. Stability and reproducibility of the biologic activity of premixed short-acting and intermediate-acting insulins. Am J Med 1986; 81: 467–471.
- [3] Davis SN, Thompson CJ, Brown MD, et al. A comparison of the pharmacokinetics and metabolic effects of human regular and NPH insulin mixtures. Diabetes Res Clin Pract 1991; 13: 107–117.
- [4] Taylor JR, Campbell KM. Insulin analogs for the management of type 2 diabetes. Am J Health Syst Pharm 2013; 70: 320–334.
- [5] Garber AJ. Premixed insulin analogues for the treatment of diabetes mellitus. Drugs 2006; 66: 31–49.
- [6] Heise T, Eckers U, Kanc K, et al. The pharmacokinetic and pharmacodynamic properties of different formulations of biphasic insulin aspart: a randomized, glucose clamp, crossover study. Diabetes Technol Ther 2008; 10: 479–485.
- [7] Malone JK, Woodworth JR, Arora V, et al. Improved postprandial glycemic control with Humalog Mix75/25 after a standard test meal in patients with type 2 diabetes mellitus. Clin Ther 2000; 22: 222–230.
- [8] Robbins DC, Beisswenger PJ, Ceriello A, et al. Mealtime 50/50 basal + prandial insulin analogue mixture with a basal insulin analogue, both plus metformin, in the achievement of target HbA1c and pre- and postprandial blood glucose levels in patients with type 2 diabetes: a multinational, 24-week, randomized, open-label, parallel-group comparison. Clin Ther 2007; 29: 2349–2364.
- [9] The Diabetes Control and Complications Trial (DCCT). Design and methodologic considerations for the feasibility phase. The DCCT Research Group. Diabetes 1986; 35: 530–545.
- [10] The DCCT Research Group. The effect of intensive treatment of diabetes on the development of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977–986.
- [11] Nathan DM, Cleary PA, Backlund JY, et al. Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study Research Group. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353: 2643–2653.
- [12] DeFronzo RA, Ferrannini E. Insulin resistance. A multifaceted syndrome responsible for NIDDM, obesity, hypertension, dyslipidemia, and atherosclerotic cardiovascular disease. Diabetes Care 1991; 14: 173–194.
- [13] Kahn SE. The pathophysiologic defects of type 2 diabetes. Abnormal insulin action and impaired insulin secretion. Postgrad Med 2000; 107 (6 Suppl Key): 11–15.
- [14] ORIGIN Trial Investigators, Gerstein HC, Bosch J, Dagenais GR, et al. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012; 367: 319–328.
- [15] Holman RR, Thorne KI, Farmer AJ, et al.; 4-T Study Group. Addition of biphasic, prandial, or basal insulin to oral therapy in type 2 diabetes. N Engl J Med 2007; 357: 1716–1730.
- [16] Holman RR, Farmer AJ, Davies MJ, et al.; 4-T Study Group. Three-year efficacy of complex insulin regimens in type 2 diabetes. N Engl J Med 2009; 361: 1736–1747.
- [17] Lasserson DS, Glasziou P, Perera R, et al. Optimal insulin regimens in type 2 diabetes mellitus: systematic review and meta-analyses. Diabetologia 2009; 52: 1990–2000.
- [18] Giugliano D, Maiorino MI, Bellastella G, et al. Efficacy of insulin analogs in achieving the hemoglobin A1c target of <7% in type 2 diabetes: meta-analysis of randomized controlled trials. Diabetes Care 2011; 34: 510–517.
- [19] Vaag A, Lund SS. Insulin initiation in patients with type 2 diabetes mellitus: treatment guidelines, clinical evidence and patterns of use of basal vs premixed insulin analogues. Eur J Endocrinol 2012; 166: 159–170.
- [20] Tambascia MA, Nery M, Gross JL, et al. Evidence-based clinical use of insulin premixtures. Diabetol Metab Syndr 2013; 5: 50.
- [21] Raskin P, Allen E, Hollander P, et al.; INITIATE Study Group. Initiating insulin therapy in type 2 Diabetes: a comparison of biphasic and basal insulin analogs. Diabetes Care 2005; 28: 260–265.
- [22] Janka HU, Plewe G, Riddle MC, et al. Comparison of basal insulin added to oral agents versus twice-daily premixed insulin as initial insulin therapy for type 2 diabetes. Diabetes Care 2005; 28: 254–259.
- [23] Robbins DC, Beisswenger PJ, Ceriello A, et al. Mealtime 50/50 basal + prandial insulin analogue mixture with a basal insulin analogue, both plus metformin, in the achievement of target HbA1c and pre- and postprandial blood glucose levels in patients with type 2 diabetes: a multinational, 24-week, randomized, open-label, parallel-group comparison. Clin Ther 2007; 29: 2349–2364.
- [24] Riddle MC, Rosenstock J, Gerich J; Insulin Glargine 4002 Study Investigators. The treat-to-target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care 2003; 26: 3080–3086.
- [25] Yki-Järvinen H, Kotronen A. Is there evidence to support use of premixed or prandial insulin regimens in insulin-naive or previously insulin-treated type 2 diabetic patients? Diabetes Care 2013; 36 (Suppl. 2): S205–S211.
- [26] Sakharova OV, Lleva RR, Dziura JD, et al. Effects on post-prandial glucose and AGE precursors from two initial insulin strategies in patients with type 2 diabetes uncontrolled by oral agents. J Diabetes Complications 2012; 26: 333–338.
- [27] Ohira M, Endo K, Oyama T, et al. Improvement of postprandial hyperglycemia and arterial stiffness upon switching from premixed human insulin 30/70 to biphasic insulin aspart 30/70. Metabolism 2011; 60: 78–85.
- [28] Siegelaar SE, Kerr L, Jacober SJ, Devries JH. A decrease in glucose variability does not reduce cardiovascular event rates in type 2 diabetic patients after acute myocardial infarction: a reanalysis of the HEART2D study. Diabetes Care 2011; 34: 855–857.
- [29] Ma Z, Parkner T, Christiansen JS, Laursen T. IDegAsp: a novel soluble insulin analogs combination. Expert Opin Biol Ther 2012; 12: 1533–1540.
- [30] Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in Type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012; 35: 1364–1379.
- [31] Kilo Ch, Mezitis N, Jain R, et al. Starting patients with type 2 diabetes on insulin therapy using once-daily injections of biphasic insulin aspart 70/30, biphasic human insulin 70/30, or NPH insulin in combination with metformin. J Diabetes Complications 2003; 17: 307–313.
- [32] Malone JK, Kerr LF, Campaigne, BN, et al. Combined therapy with insulin lispro mix 75/25 plus metformin or insulin glargine plus metformin: A 16-week, randomized, open-label, crossover study in patients with type 2 diabetes beginning insulin therapy. Clin Ther 2004; 26: 2034–2044.
- [33] Buse JB, Wolffenbuttel BH, Herman WH, et al. DURAbility of Basal Versus Lispro Mix 75/25 Insulin Efficacy (DURABLE) Trial 24-Week Results: Safety and efficacy of insulin lispro mix 75/25 versus insulin margine added to oral antihyperglycemic drugs in patients with type 2 diabetes. Diabetes Care 2009; 32: 1007–1013.
- [34] Yki-Järvinen H, Kaupilla M, Kujansuu E, et al. Comparison of Insulin Regimens in Patients with Non-Insulin-Dependent Diabetes Mellitus. N Engl J Med 1992; 327: 1426–1433.
- [35] Wolffenbuttel BHR, Sels JP, Rondas-Colbers G, et al. Comparison of Different Insulin Regimens in Elderly Patients With NIDDM. Diabetes Care 1996; 19: 1326–1332.