Prevence a léčba nevolnosti a zvracení vyvolaných chemoterapií
Key words: nausea, vomiting, chemotherapy, prevention, therapy.
Úvod
Nevolnost a zvracení vyvolané chemoterapií (chemotherapy induced nausea and vomiting, CINV) patří mezi významné faktory distresu a zhoršení kvality života pacientů, kterým je podávána protinádorová léčba. Mohou vést k anorexii, dehydrataci, nutriční depleci, minerálovému rozvratu, poklesu celkového funkčního stavu a k odstoupení od potenciálně kurativní léčby.
Incidence a závažnost CINV je ovlivněna více faktory – protinádorovým lékem, jeho dávkováním, aplikační cestou a režimem, pohlavím, věkem, anamnézou užívání alkoholu a předchozí zkušeností s chemoterapií [1].
I přes vývoj v prevenci a terapii CINV část pacientů dále trpí těmito obtěžujícími symptomy, obzvláště nevolnost představuje léčebný a subjektivní problém [2]. Mezi hlavní pokroky patří objev významu serotoninu a neurokininu v patofyziologii CINV, antagonisté serotoninového receptoru typu 3 (5 HT3 RA) a neurokininového receptoru 1 (NK1 RA) představují hlavní léky v prevenci a terapii CINV. Vedle těchto neurotransmiterů hrají důležitou roli dopamin, acetylcholin, kortikosteroidy, histamin, kannabinoidy a opioidy [3].
Přehledový článek vychází z doporučení ESMO (European Society for Medical Oncology)/MASCC (Multinational Association for Supportive Care in Cancer) a NCCN (National Comprehensive Cancer Network), které zachovávají stejné principy a jsou pravidelně aktualizovány [4–8].
Dělení nevolnosti a zvracení indukovaných chemoterapií
Pro potřeby definice preventivních a léčebných protokolů dělíme CINV na čtyři podjednotky – časnou, oddálenou, průlomovou a anticipační. Časná se rozvíjí minuty až hodiny po aplikaci, vrchol nastává přibližně za 5–6 hodin a upraví se do 24 hodin. Rizikové jsou mladé ženy bez anamnézy užívání alkoholu, s kinetózou a s ranními nevolnostmi. Oddálená se rozvíjí za více než 24 hodin od aplikace a je častější při užití cisplatiny, karboplatiny, cyklofosfamidu, doxorubicinu a může trvat až týden po poslední dávce. Anticipační představuje psychogenně indukovanou nevolnost a zvracení, přičemž bývá častěji ve formě nevolnosti. Jedná se o určitý naučený reflex, který souvisí s předchozí a současnou zkušeností s chemoterapií. Jeho incidence dosahuje 18–57 % a zpravidla roste s počtem absolvovaných chemoterapií. Průlomová je definována jako výskyt nevolnosti a zvracení, k nimž dochází navzdory preventivním postupům.
Dělení emetogenity chemoterapie
Pro definici preventivních a léčebných doporučení jsou protinádorové léky děleny podle potenciálu vyvolávat CINV [9,10]. V současnosti je shoda na čtyřech základních úrovních emetogenity – vysoká (highly emetogenic chemotherapy, HEC), střední (moderately emetogenic chemotherapy, MEC), nízká a minimální. Nevolnost a zvracení indukované chemoterapií se rozvíjejí při podávání vysoce rizikové chemoterapie u více než 90 % pacientů, střední u 30–90 %, nízké u 10–30 % a minimální u méně než 10 %, pokud nejsou užity preventivní postupy. Pro kompletní seznam rozdělení protinádorových léčiv do jednotlivých skupin lze čerpat z výše uvedených zdrojů. Pro praktické potřeby je nutné vnímat režimy v celé souvislosti, jednotlivá cytostatika, jejich kombinace a dávky, režimy a pokrývat riziko časné i oddálené CINV. Z hlediska klinických studií byla částečně odlišena skupina cisplatinových a neplatinových režimů ve skupině vysoké emetogenity a dále se vyděluje do samostatnosti režim AC (antracyklin + cyklofosfamid), který má poněkud odlišná specifika časné a oddálené CINV a je řazen do vysoce emetogenní skupiny [11]. Jako poslední byla provedena revize emetogenity karboplatiny a dávky převyšující 4 AUC (area under the curve) jsou hodnoceny jako vysoce emetogenní [6].
Klinická farmakologie antiemetik
Antagonisté serotoninových receptorů 5 HT3
Antagonisty serotoninových receptorů 5 HT3 dělíme na první generaci (ondansetron, granisetron) a druhou generaci (palonosetron). Metaanalýzy klinických studií neprokázaly nadřazenost jednotlivých přípravků první generace při srovnatelné toleranci a nežádoucích účincích, účinnost je dobrá proti časné CINV a poněkud nižší proti oddálené CINV [12]. Palonosetron má nejdelší biologický poločas eliminace, navíc ovlivňuje zkříženou komunikaci mezi signálními dráhami 5 HT3 a NK1 a nepřímo tak inhibuje substanci P. Poslední metaanalýza prokázala vyšší efektivitu palonosetronu oproti první generaci 5 HT3 RA v prevenci časné a oddálené CINV u HEC a MEC [13]. Klinická studie fáze III prokázala vyšší efektivitu subkutánního retardovaného granisetronu oproti ondansetronu, pokud jsou užity v kombinaci s dexametazonem a NK1 RA v prevenci CINV u HEC [14].
Palonosetron a subkutánní retardovaný granisetron jsou srovnatelně účinné a preferované v prevenci CINV u středně a vysoce emetogenních režimů, pokud není užit současně NK1 RA [8,15]. Po aplikaci palonosetronu, granisetronu s prodlouženým uvolňováním nebo v transdermálním dávkovacím systému (TDS) je efektivita 5 HT3 RA v terapii průlomové CINV výrazně omezená a je lépe volit léky z jiné farmakologické skupiny. Antagonisté receptoru 5 HT3 mohou, v závislosti na cestě podání a dávce, způsobovat prodloužení QT intervalu [16]. Palonosetron se jeví jako lék s nejmenším potenciálem prodloužení QT intervalu. Pacienti s rizikovými faktory prodloužení QT intervalu by měli být monitorováni pravidelně pomocí EKG a užívat pouze nejnižší efektivní dávky 5 HT3 RA. Nejčastějšími nežádoucími účinky léčby 5 HT3 RA jsou bolesti hlavy a zácpa a optimálního efektu je dosaženo při pravidelném podávání, nikoliv dle potřeby.
Antagonisté NK1 receptorů
Antagonisté NK1 receptorů představují další základní skupinu léčiv pro prevenci CINV, jejich místo a největší přínos je u oddálené CINV. V současnosti jsou na trhu aprepitant, fosaprepitant, rolapitant a netupitant, všechny přípravky prokázaly v klinických studiích efektivitu v prevenci CINV u HEC i MEC a jsou rovnocennou součástí doporučení [17,18]. Aprepitant, fosaprepitant a netupitant ovlivňují metabolismus léčiv cestou enzymu CYP3A4, doporučuje se mírná redukce dávek dexametazonu. Rolapitant neovlivňuje CYP3A4 a vykazuje minimum lékových interakcí [19].
Kortikoidy
Kortikoidy tvoří základní součást preventivních režimů CINV, v klinických studiích prokázaly aditivní efekt v kombinacích s ostatními farmaky, nejvíce pro prevenci oddálené CINV [20]. Uskutečněná klinická hodnocení s dexametazonem měla velký rozptyl dávek, je nutné vnímat rizika a nežádoucí účinky. V posledních letech je tendence snižovat dávky, nejčastěji v rozpětí 8–12 mg/den v jedné ranní dávce. Takzvané dexametazon šetřící postupy se doporučují u středně emetogenních režimů a necisplatinových režimů HEC, dále v kombinaci s imunoterapií a buněčnou terapií.
Olanzapin
Olanzapin patří mezi atypická antipsychotika a představuje jedno z nejnověji užívaných antiemetik. Antagonizuje celou řadu receptorů (dopamin, serotonin, histamin, acetylcholin). Jeho klinický efekt byl potvrzen klinickými studiemi a jejich metaanalýzami [21]. Recentní klinická studie fáze III hodnotila přidání olanzapinu k léčebné kombinaci aprepitant + 5 HT3 RA + dexametazon u pacientů s HEC. Na základě tohoto klinického hodnocení je doporučen tento režim jako první volba u HEC nebo jako druhá volba po selhání ostatních režimů [22]. Vzhledem k blokádě dopaminových receptorů je nutné minimalizovat podávání spolu s haloperidolem nebo metoklopramidem pro riziko rozvoje extrapyramidových příznaků. Olanzapin může prodlužovat QT interval, opatrnosti je třeba při přítomnosti rizikových faktorů a souběžné medikace prodlužující QT interval. Kombinace nitrožilního olanzapinu a nitrožilních benzodiazepinů je kontraindikovaná. Vzhledem k sedativnímu potenciálu je nutná opatrnost u starých pacientů a u všech nemocných ohrožených rizikem pádů a ortostatické hypotenze, u těchto skupin se doporučuje zahajovat léčbu dávkou 5 mg [8].
Fenotiaziny
Fenotiaziny mají své místo v managementu průlomové CINV. Jejich hlavní nevýhoda spočívá v sedativním účinku, užíváme minimální účinné dávky a opatrně postupujeme u starých a křehkých pacientů. Sedace je výraznější u prometazinu než u prochlorperazinu. Konkomitantní užití fenotiazinů, haloperidolu nebo metoklopramidu zvyšuje rizika extrapyramidového syndromu.
Metoklopramid
Metoklopramid je účinné antiemetikum s prokinetickými vlastnostmi, jeho volba je tak vhodná při kombinaci nevolnosti s dalšími faktory (gastroparéza, parciální střevní obstrukce). Vzhledem k antidopaminergním účinkům vyvolává rizika extrapyramidových příznaků, riziko roste s dávkou a s frekvencí podávání. Výše bylo uvedeno, že je vhodné jej nekombinovat s olanzapinem, haloperidolem a s fenotiaziny. Při větších dávkách hrozí prodloužení QT intervalu.
Haloperidol
Haloperidol je vhodné antiemetikum druhé volby na průlomovou nevolnost a zvracení. Jsou možné všechny cesty podání, lze jej tak podávat i u trvajícího zvracení. Mezi rizika patří prodloužení QT intervalu, sedace a extrapyramidové příznaky v závislosti na dávce a na frekvenci podávání.
Kannabinoidy
Kannabinoidy představují farmakologickou skupinu s významným rozvojem použití v onkologii. Existuje celá řada dobře vedených klinických studií a jejich metaanalýz potvrzujících jejich efektivitu u celé řady symptomů [23]. Nevolnost a zvracení patří mezi indikované použití kannabinoidů. Jejich dávkování je velice individuální, neměli bychom překračovat dávky, které vyvolávají sedaci. U starších pacientů a pacientů s psychiatrickou anamnézou musíme být opatrní kvůli riziku rozvoje paranoie, halucinací a psychotických reakcí. Výhodou kannabinoidů je jejich stimulační účinek na zvýšení chuti k jídlu.
Obecné principy managementu CINV
Hlavním cílem úspěšné léčby je důsledná prevence, musí být zahájena před aplikací chemoterapie a trvat po dobu rizika CINV, přičemž riziko trvá přibližně tři dny po HEC a dva dny po poslední dávce MEC s ohledem na konkrétní chemoterapeutický režim a na aktuální situaci. Podávání parenterálních a perorálních 5 HT3 RA přináší srovnatelné výsledky, pokud jsou užity v odpovídajícím dávkování a intervalu. Výběr vhodného antiemetika závisí na emetogenním potenciálu chemoterapie, na předchozí zkušenosti s antiemetiky, na jejich nežádoucích účincích a na pacientských faktorech. Při aplikaci kombinované chemoterapie volíme antiemetika podle nejemetogennějšího cytostatika a odlišujeme riziko časné a oddálené CINV [5].
Je nezbytné brát v potaz další možné příčiny nevolnosti a zvracení u onkologických pacientů – střevní obstrukci, vestibulární poruchy, mozkové metastázy, uremii, hyperkalcemii, hyponatremii, hyperglykemii, konkomitantní farmakoterapii (opioidy), gastroparézu, ascites, úzkost a anticipační CINV. Neváháme užít H2 blokátory nebo inhibitory protonové pumpy (PPI) k prevenci a léčbě dyspepsie, která může nevolnost imitovat a zhoršovat. Důležité jsou také úpravy dietních zvyklostí (menší porce, pestrá a nedráždivá jídla, tekutiny spíše studené a mírně perlivé, vyloučení alkoholu), kontrola zácpy, dostatek pohybu, místo aplikace chemoterapie a další.
Pro bezpečnou a efektivní prevenci a léčbu CINV musíme stanovit plán, který podrobně probereme s pacientem. Jeho součástí musejí být vždy pevná preventivní opatření a postupy při průlomové nevolnosti a zvracení, poučení o správném užívání a vedlejších účincích antiemetik a jejich managementu.
Prevence časné a oddálené CINV u vysoce emetogenní chemoterapie
V současnosti máme několik možností prevence, základem
je kombinace 5 HT3 RA, NK1 RA
a dexametazonu (tab. 1).
V posledních doporučeních ESMO/MASCC a NC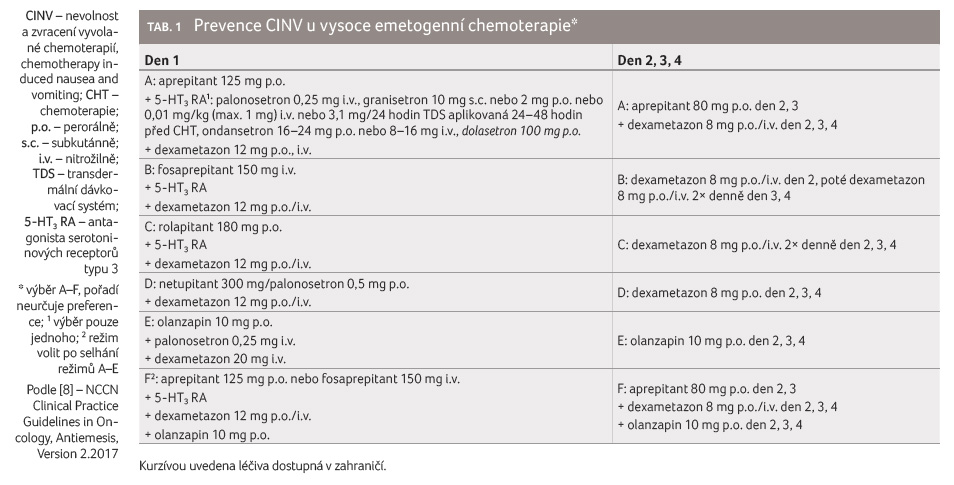 CN byly přidány
režimy obsahující olanzapin, které mají stejnou váhu doporučení
[5,8]. Ve studiích u pacientů s cisplatinovými
režimy vedlo přidání NK1 RA ke zvýšení
odpovědi na antiemetika v den 1 o 4–14 %, v den
2–5 o 8–21 % a v den 1–5 o 8–20 %
[4,18,19]. Tento výsledek je relevantní nejen statisticky, ale
i klinicky, protože kontrola CINV při prvním cyklu
chemoterapie se promítne do následujících cyklů. Stejná
doporučení jako pro režimy s cisplatinou platí pro režim
AC, pouze je snaha o mírnou redukci dávek dexametazonu
[24,25]. K prevenci oddálené CINV u HEC není doporučeno
podávat 5 HT3 RA v den 2–4, pouze v případě
opakované průlomové CINV a nebyl li použit palonosetron
nebo granisetron v TDS nebo v subkutánní formě. Pokud
není v prevenci CINV u režimu AC použit NK1
RA, je palonosetron doporučeným 5 HT3 RA [5].
CN byly přidány
režimy obsahující olanzapin, které mají stejnou váhu doporučení
[5,8]. Ve studiích u pacientů s cisplatinovými
režimy vedlo přidání NK1 RA ke zvýšení
odpovědi na antiemetika v den 1 o 4–14 %, v den
2–5 o 8–21 % a v den 1–5 o 8–20 %
[4,18,19]. Tento výsledek je relevantní nejen statisticky, ale
i klinicky, protože kontrola CINV při prvním cyklu
chemoterapie se promítne do následujících cyklů. Stejná
doporučení jako pro režimy s cisplatinou platí pro režim
AC, pouze je snaha o mírnou redukci dávek dexametazonu
[24,25]. K prevenci oddálené CINV u HEC není doporučeno
podávat 5 HT3 RA v den 2–4, pouze v případě
opakované průlomové CINV a nebyl li použit palonosetron
nebo granisetron v TDS nebo v subkutánní formě. Pokud
není v prevenci CINV u režimu AC použit NK1
RA, je palonosetron doporučeným 5 HT3 RA [5].
Prevence časné a oddálené CINV u středně emetogenní chemoterapie
Doporučení pro středně emetogenní režimy mají za svůj
základ 5 HT3 RA a dexametazon (tab. 2). Standardně není doporučen NK1 RA,
možností volby je u pacientů s více rizikovými faktory
CINV a po selhání předchozí prevence. Pokud není
v prevenci použit NK1 RA, je doporučeno užití
palonosetronu nebo subkutánníh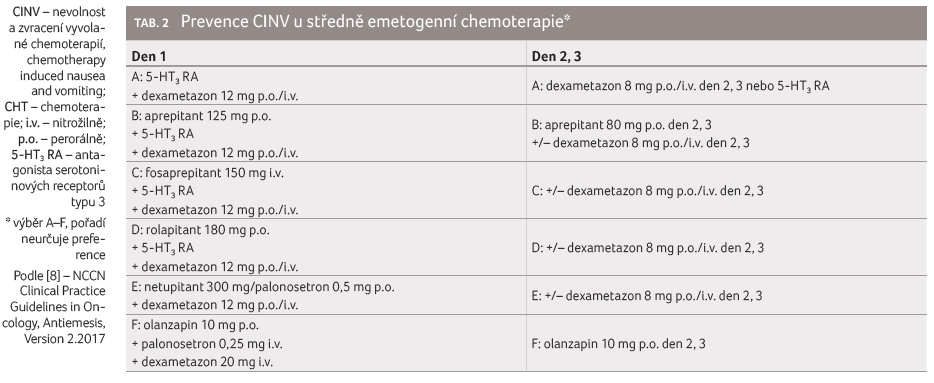 o retardovaného granisetronu
[15,26].
o retardovaného granisetronu
[15,26].
Doporučení pro prevenci oddálené CINV zařazují několikadenní podávání dexametazonu při léčbě cytostatiky s potenciálem rozvoje oddálené CINV (oxaliplatina, doxorubicin, cyklofosfamid) [5]. Ve studiích s karboplatinou vedlo přidání NK1 RA ke standardní profylaxi ke zlepšení kompletní odpovědi o 10–15 % a je doporučena rutinní prevence kombinací 5 HT3 RA, NK1 RA a dexametazonu [27,28].
Prevence časné a oddálené CINV u nízce a minimálně emetogenní chemoterapie
Pro pacienty léčené režimy s nízkým nebo minimálně
emetogenním potenciálem existuje velice málo dat z klinických
studií. Doporučení pro nízce emetogenní režimy vedle sebe staví
na stejnou úroveň dexametazon, metoklopramid a 5 HT3 RA
(tab. 3). U pacientů
s režimy minimálního rizika se nedoporučuje primární
prevence CINV, preventivní opatření se doporučují až po výskytu
ep izod CINV a volíme léky ze skupiny pro nízké riziko.
Pokud preventivní režimy pro nízké riziko nevedou k odpovídající
kontrole akutní a oddálené CINV, je vhodné při následujícím
cyklu chemoterapie aplikovat režim pro středně emetogenní
chemoterapii.
izod CINV a volíme léky ze skupiny pro nízké riziko.
Pokud preventivní režimy pro nízké riziko nevedou k odpovídající
kontrole akutní a oddálené CINV, je vhodné při následujícím
cyklu chemoterapie aplikovat režim pro středně emetogenní
chemoterapii.
Prevence časné a oddálené CINV u perorální chemoterapie
Pravidelná prevence CINV při podávání perorální
chemoterapie se doporučuje u režimů HEC a MEC s použitím
5 HT3 RA, které mohou být dle symptomatologie
doplněny H2 blokátory, PPI a benzodiazepiny (tab. 4). Pro nízce a minimálně emetogenní režimy není
rutinní profylaxe doporučována, antiemetika jsou používána
pouze dle potřeby při výskytu obtíží. V posledních
doporučeních jsou na stejné úrovni 5 HT3 RA,
metoklopramid a prochlorperazin, haloperidol byl z doporučení
CINV vyloučen.
Průlomová nevolnost a zvracení
Průlomová CINV představuje obtížnou situaci, protože
kontrola refrakterní a pokračující nevolnosti a zvracení
je náročná. Prevence CINV je významně jednodušší než její
léčba, rutinní a důsledné dodržování antiemetické
prevence je vysoce doporučované. Obecný princip medikace
na průlomovou CINV spočívá v užití farmak z odlišných
lékových skupin než těch, které byly užity v prevenci
po zohlednění souběžné medikace a komorbidit (tab. 5). Někteří pacienti vyžadují kombinovanou
farmakoterapii k léčbě průlomové CINV, musíme dávat pozor
na interakce a nežádoucí účinky antiemetik. Při
rozvoji průlomové CINV preferujeme podávání medikace pravidelně,
nikoliv dle potřeby a spíše parenterálně.
Součástí komplexního managementu je dostatečná hydratace, korekce minerálových dysbalancí a celková péče. Dále je nutné vyloučit jiné příčiny (mozkové metastázy, střevní obstrukci, komorbidity a další). Před aplikací následného cyklu chemoterapie provedeme revizi a úpravu preventivního režimu CINV. Pokud nebyl použit NK1 RA, zvolíme režim s NK1 RA. Po jeho selhání lze volit olanzapinový režim a po selhání těchto postupů můžeme vyzkoušet kombinovaný režim NK1 RA + olanzapin + 5 HT3 RA + dexametazon. Lze provést rotaci 5 HT3 RA, jedná se o léky s různými farmakokinetickými a farmakodynamickými profily a metabolismem, které mohou účinkovat odlišně u různých pacientů. Anxiolytika jsou vhodná u pacientů s výraznou úzkostí. Samozřejmostí je komplexní management deprese za užití nefarmakologických postupů a farmakoterapie. Pacienti s dyspepsií mohou mít prospěch ze souběžného podávání H2 blokátorů nebo PPI.
Principy managementu nevolnosti a zvraacení u vícedenních chemoterapií
Pacientům, kteří dostávají vícedenní chemoterapii, hrozí riziko akutní i oddálené CINV dle emetogenního potenciálu jednotlivých cytostatik, jejich dávkování a sekvence [29]. V důsledku těchto faktorů není jednoduché určit preferovaný režim prevence pro každý den, obzvláště když se mísí rizika akutní a oddálené CINV. Mezi další proměnné, které je třeba vzít v potaz, patří místo aplikace (ambulantně, hospitalizace), cesta podávání antiemetik, tolerovatelnost jejich vícedenní aplikace (kortikoidy, olanzapin), trvání účinku 5 HT3 RA a jejich dávkovací schéma a individuální rizikové faktory. Většina zdrojů se proto shoduje na individualizaci antiemetické prevence pro každý jednotlivý režim a pacienta při dobré znalosti klinických dat a farmakologie antiemetik a cytostatik. Základní principy pro jednotlivá antiemetika lze shrnout do následujících odstavců.
Dexametazon byl měl být podáván jednou denně u MEC a HEC a léčba by měla pokračovat 2–3 dny po jejich skončení s úpravami dle vývoje. Kortikoidy lze vynechat, pokud jsou obsaženy v chemoterapeutickém režimu, u středně rizikových a vysoce rizikových neplatinových režimů, u pacientů bez jiných rizikových faktorů rozvoje CINV a těch, kteří je netolerují [30,31].
Antagonisté serotoninových receptorů by měli být podáváni před první a každou následnou aplikací MEC a HEC s dodržením dávky dle doporučení a cesty aplikace. Palonosteron podávaný v dávce 0,25 mg jednorázově je dostatečný u režimů trvajících do 3 dnů, opakované dávky jsou na základě získaných údajů bezpečné, pro vícedenní režimy jsou klinická data zatím omezená [32]. Subkutánní retardovaný granisetron je efektivnější než ondansetron v prevenci oddálené CINV u MEC a HEC [14].
Antagonisté NK1 receptorů by měli být užiti u vícedenních MEC a HEC s vysokým rizikem oddálené CINV. U jednodenního chemoterapeutického režimu jsou data kategorie 1 dostupná pro aprepitant, fosaprepitant, netupitant a rolapitant v kombinaci s 5 HT3 RA a kortikoidem. U vícedenních režimů jsou omezená data účinnosti a bezpečnosti aprepitantu podávaného v den 4 a 5. Uskutečnila se randomizovaná klinická studie fáze III s podáváním 5denního cisplatinového režimu u pacientů s germinálními nádory s efektem na zlepšení kontroly oddálené CINV při prodloužené aplikaci aprepitantu [33]. Studie hodnotící opakované podávání fosaprepitantu, netupitantu a rolapitantu nebyly provedeny.
Anticipační nevolnost a zvracení
Anticipační nevolnost a zvracení jsou obtížně kontrolovatelné, nejlepší léčbou je optimální prevence CINV důsledně aplikovaná při každém cyklu chemoterapie [34]. Za rizikové faktory jsou považovány předchozí zkušenost s nevolností a zvracením z jakéhokoliv důvodu a špatná kontrola CINV při předchozí léčbě, incidence roste s počtem chemoterapií [35].
Mezi základní preventivní postupy patří celkové úpravy životního stylu, klidné prostředí při aplikaci chemoterapie s vyloučením silných pachů. U predisponovaných jedinců nebo u těch, kteří již dříve měli zkušenost s anticipační nevolností a zvracením, můžeme podávat anxiolytika, nejčastěji benzodiazepiny [36]. Je třeba mít na paměti jejich potenciál závislosti a kontrolovat jejich dávkování a užívání striktně jako prevenci anticipační CINV. V minulých letech byla uskutečněna celá řada studií s využitím behaviorální terapie (relaxace, systematická desenzitizace, hypnóza, řízená imaginace), akupunktury nebo akupresury s různými výsledky na prevenci a léčbu anticipační nevolnosti a zvracení, přesto se doporučuje zařadit tyto metody do léčebných opatření [37,38].
Závěr
Nevolnost a zvracení indukované chemoterapií představují významnou komplikaci protinádorové léčby, zvyšují distres, zhoršují kvalitu života a toleranci chemoterapie. V posledních letech došlo k pokroku v porozumění patofyziologii CINV a do klinické praxe byly uvedeny účinné přípravky pro prevenci a léčbu. Základem doporučení je dělení na chemoterapie podle emetogenity a důsledné dodržování preventivních opatření. Prevenci a léčbu poté upravujeme dle konkrétních režimů chemoterapie, pacientských faktorů a zkušenosti s nastavenou léčbou.
Seznam použité literatury
- [1] Herrstedt J. Antiemetics: an update and the MASCC guidelines applied in clinical practice. Nat Clin Pract Oncol 2008; 5: 32–43.
- [2] Singh P, Yoon SS, Kuo B. Nausea: a review of pathophysiology and therapeutics. Therap Adv Gastroenterol 2016; 9: 98–112.
- [3] American Gastroenterological Association medical position statement: nausea and vomiting. Gastroenterology 2001; 120: 261–263.
- [4] Roila F, Herrstedt J, Aapro M, et al. Guideline update for MASCC and ESMO in the prevention of chemotherapy‑ and radiotherapy induced nausea and vomiting: results of the Perugia consensus conference. Ann Oncol 2010; 21(Suppl 5): v232–v243.
- [5] Roila F, Molassiotis A, Herrstedt J, et al. 2016 MASCC and ESMO guidelines update for the prevention of chemotherapy‑ and radiotherapy‑induced nausea and vomiting and of nausea and vomiting in advanced cancer patients. Ann Oncol 2016; 27(Suppl 5): v119–v133.
- [6] Tageja N, Groninger H. Chemotherapy‑induced nausea and vomiting: an overview and comparison of three consensus guidelines. Postgrad Med J 2016; 92: 34–40.
- [7] Jordan K, Gralla R, Jahn F, Molassiotis A. International antiemetic guidelines on chemotherapy‑induced nausea and vomiting (CINV): content and implementation in daily routine practice. Eur J Pharmacol 2014; 722: 197–202.
- [8] NCCN Clinical Practice Guidelines in Oncology, Antiemesis, Version 2.2017, www.nccn.org
- [9] Jordan K, Jahn F, Aapro M. Recent developments in the prevention of chemotherapy induced nausea and vomiting (CINV): a comprehensive review. Ann Oncol 2015; 26: 1081–1090.
- [10] Grunberg SM, Warr D, Gralla RJ, et al. Evaluation of new antiemetic agents and definition of antineoplastic agent emetogenicity‑state of the art. Supp Care Cancer 2010; 19: S43–47.
- [11] Basch E, Prestrud AA, Hesketh PJ, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 2011; 29: 4189–4198.
- [12] Bilio A, Morello E, Clarke MJ. Serotonin receptor antagonists for highly emetogenic chemotherapy in adults. Cochrane Database Syst Rev 2010:CD006272.
- [13] Botrei TE, Clark OA, Clark L, et al. Efficacy of palonosetron (PAL) compared to other serotonin inhibitors (5‑HT3R) in preventing chemotherapy‑induced nausea and vomiting (CINV) in patients receiving moderately or highly emetogenic (MiHE) treatment: systematic review and meta‑analysis. Supp Care Cancer 2011; 19: 823–832.
- [14] Schnadig ID, Agajanian R, Dakhil C, et al. APF530 (granisetron injection extended‑release) in a three‑drug regimen for delayed CINV in highly emetogenic chemotherapy. Future Oncol 2016; 12: 1469–1481.
- [15] Raftopoulos H, Cooper W, O’Boyle, et al. Comparison of an extended‑release formulation of granisetron (APF530) versus palonosetron for the prevention of chemotherapy‑induced nausea and vomiting associated with moderately or highly emetogenic chemotherapy: results of a prospective, randomized, double‑blind, noninferiority phase 3 trial. Supp Care Cancer 2015; 23: 723–732.
- [16] Brygger L, Herrstedt J. 5‑hydroxyptrytamine3 receptor antagonists and cardiac side effects. Expert Opin Drug Saf 2014; 13: 1407–1422.
- [17] Dos Santos LV, Souza FH, Brunetto AT, et al. Neurokinin‑1 receptor antagonists for chemotherapy‑induced nausea and vomiting: a systematic review. J Natl Cancer Inst 2012; 104: 1280–1292.
- [18] Hesketh PJ, Rossi G, Rizzi G, et al. A randomized phase III study evaluating the efficacy and safety of NEPA, a fixed‑dose combination of netupitant and palonosetron, for prevention of chemotherapy‑induced nausea and vomiting following moderately emetogenic chemotherapy. Ann Oncol 2014; 25: 1340–1346.
- [19] Rapoport BL, Chasen MR, Gridelli C, et al. Safety and efficacy of rolapitant for prevention of chemotherapy‑induced nausea and vomiting after administration of cisplatin‑based highly emetogenic chemotherapy in patients with cancer: two randomized, active‑controlled, double‑bind, phase 3 trials. Lancet Oncol 2015; 16: 1079–1089.
- [20] Ioannidis JP, Hesketh PJ, Lau J. Contribution of dexamethasone to control of chemotherapy‑induced nausea and vomiting: a meta‑analysis of randomized evidence. J Clin Oncol 2000; 18: 3409–3422.
- [21] Chow R, Chiu L, Navari R, et al. Efficacy and safety of olanzapine for the prophylaxis of chemotherapy‑induced nausea and vomiting (CINV) as reported in phase I and II studies: a systematic review. Supp Care Cancer 2016; 24: 1001–1008.
- [22] Navari RM, Qin R, Ruddy KJ, et al. Olanzapine for the prevention of chemotherapy‑induced nausea and vomiting. N Engl J Med 2016; 375: 134–142.
- [23] Whiting PF, Wolff RF, Deshpande S, et al. Cannabinoids for medical use: A systematic review and meta‑analysis. JAMA 2015; 313: 2456−2473.
- [24] Schwartzberg LS, Modiano MR, Rapoport BL, et al. Safety and efficacy of rolapitant for the prevention of chemotherapy‑induced nausea and vomiting, after administration of moderately emetogenic chemotherapy or anthracycline and cyclophosphamide regimens in patients with cancer: a randomised, active‑controlled, double‑blind, phase 3 trial. Lancet Oncol 2015; 9: 1071–1079.
- [25] Aapro M, Rugo H, Rossi G, et al. A randomized phase III study evaluating the efficacy and safety of NEPA, a fixed‑dose combination of netupitant and palonosetron, for prevention of chemotherapy‑induced nausea and vomiting following moderately emetogenic chemotherapy. Ann Oncol 2014; 25: 1328–1333.
- [26] Saito M, Aogi K, Sekine I, et al. Palonosetron plus dexamethasone versus granisetron plus dexamethasone for prevention of nausea and vomiting during chemotherapy: a double‑blind, double‑dummy, randomized, comparative phase III trial. Lancet Oncol 2009; 10: 115–124.
- [27] Hesketh PJ, Schnadig ID, Schwartzberg LS, et al. Efficacy of the neurokinin‑1 receptor antagonist rolapitant in preventing nausea and vomiting in patients receiving carboplatin‑based chemotherapy. Cancer 2016; 122: 2418–2425.
- [28] Yahata H, Kobayashi H, Sonoda K, et al. Efficacy of aprepitant for the prevention of chemotherapy‑induced nausea and vomiting with a moderately emetogenic chemotherapy regimen: a multicenter, placebo‑controlled, double‑blind, randomized study in patients with gynecologic cancer receiving paclitaxel and carboplatin. Int J Clin Oncol 2016; 21: 491–497.
- [29] Ellebaek E, Herrstedt J. Optimizing antiemetic therapy in multiple‑day and multiple cycles of chemotherapy. Curr Opin Support Palliat Care 2008; 2: 28–34.
- [30] Matsuzaki K, Ito Y, Fukuda M, et al. Placebo‑controlled phase III study comparing dexamethasone on day 1 to day 1‑3 with NK1 receptor antagonist and palonosetron in high emetogenic chemotherapy. J Clin Oncol 2016; 34: abstract 10019.
- [31] Celio L, Bonizzoni E, Bajetta E, et al. Palonosetron plus single‑dose dexamethasone for the prevention of nausea and vomiting in women receiving anthracycline/cyclophosphamide‑containing chemotherapy: meta‑analysis of individual patient data examining the effect of age on outcome in two phase III trials. Supp Care Cancer 2013; 21: 565–573.
- [32] Giralt SA, Mangan KF, Maziarz RT, et al. Three palonosetron regimens to prevent CINV in myeloma patients receiving multiple‑day high‑dose melphalan and hematopoietic stem cell transplantation. Ann Oncol 2011; 22: 939–946.
- [33] Albany C, Bramea MJ, Fausel C, et al. Randomized, double‑blind, placebo‑controlled, phase III crossover study evaluating oral neurokinin‑1 antagonist aprepitant in combination with 5‑HT3 receptor antagonist and dexamethasone in patients with germ cell tumors receiving 5‑day cisplatin combination chemotherapy regimens: a hoosier oncology group study. J Clin Oncol 2012; 30: 3998–4003.
- [34] Roscoe JA, Morrow GR, Aapro MS, et al. Anticipatory nausea and vomiting. Supp Care Cancer 2011; 19: 1533–1538.
- [35] Kamen C, Tejani MA, Chandwani K, et al. Anticipatory nausea and vomiting due to chemotherapy. Eur J Pharmacol 2014; 722: 172–179.
- [36] Molassiolis A, Aapro M, Dicato M, et al. Evaluation of risk factors predicting chemotherapy‑related nausea and vomiting: results of a European prospective observational study. J Pain Symptom Manage 2014; 47: 839–848.
- [37] Ezzo J, Vickers A, Richardson MA, et al. Acupuncture point stimulation for chemotherapy‑induced nausea and vomiting. J Clin Oncol 2005; 23: 7188–7198.
- [38] Figueroa‑Moseley C, Jean‑Pierre P, Roscoe JA, et al. Behavioral interventions in treating anticipatory nausea and vomiting. J Natl Compr Canc Netw 2007; 5: 44–50.