Prevence cévních mozkových příhod hypolipidemickou léčbou
Vztah mezi výskytem cévních mozkových příhod (CMP) a hladinami krevních lipidů a lipoproteinů i význam léčby dyslipidémie v prevenci iktů jsou stále předmětem odborných debat. Hlavním zdrojem zájmu je na první pohled nápadný rozpor mezi výsledky epidemiologických observačních studií a intervenčních sledování. Zatímco epidemiologické práce ukazují, že neexistuje vztah mezi hladinou sérového cholesterolu a výskytem CMP, klinické studie s hypolipidemiky mimo jakoukoli pochybnost ukázaly, že snižování hladin celkového a LDL cholesterolu významně snižuje riziko mozkové ischémie bez nepříznivého vlivu na výskyt hemoragických iktů. Z tohoto hlediska je nejlépe dokumentován význam léčby hypercholesterolémie statiny, ale máme i důkazy z klinických studií svědčící o příznivém ovlivnění dalších složek plazmatického lipidového spektra – konkrétně o snižování koncentrace triglyceridů a zvyšování koncentrace HDL cholesterolu při léčbě fibráty. Vliv použití ostatních hypolipidemik na výskyt CMP je dokumentován podstatně méně. Ezetimib, niacin, pryskyřice a případně další léčiva ovlivňující plazmatické lipidy budeme u nemocných ve vysokém riziku nebo již po prodělaném iktu používat jako doplněk výše uvedených farmakologických postupů. V souladu s platnými doporučeními odborných společností lze hypolipidemickou léčbu považovat za nutnou součást terapie u všech nemocných po prodělané ischemické cévní mozkové příhodě nebo tranzitorní ischemické atace.
Dyslipidémie a cévní mozková příhoda – cholesterolový paradox
Termínem cholesterolový paradox je tradičně označována déle známá skutečnost. Zatímco zvýšená hladina celkového a LDL cholesterolu v plazmě je nezávislým rizikovým faktorem vzniku aterosklerózy a ischemické choroby srdeční, nebyl prokázán jednoznačný vztah mezi zvýšenou hladinou celkového a LDL cholesterolu a výskytem cévních mozkových příhod (CMP) [1, 2]. Snižování hladin cholesterolu a intervence dyslipidémie zejména s použitím statinů snižuje riziko první i opakované ischemické cévní mozkové příhody a na výskyt mozkové hemoragie má vliv neutrální. Paradox je dovršen dobře dokumentovaným vztahem mezi závažností aterosklerotického postižení karotického povodí a hladinami sérových aterogenních lipidů. Přitom ateroskleróza karotid je významným rizikovým faktorem CMP [3]. Tyto diskrepance stále provokují odbornou veřejnost k hledání vysvětlení, jichž zatím byla navržena celá řada. Jedním z nejdůležitějších je obtížná srovnatelnost epidemiologických studií a jejich metodologické limitace, které byly problémem zejména prvních sledování dokumentujících absenci korelace mezi výskytem CMP a cholesterolémií. Zásadním matoucím faktorem většiny uvedených analýz je nedostatečná klasifikace příčiny iktů. Pouze 30 % všech CMP je aterotrombotické etiologie, a právě tady bychom očekávali nejtěsnější vztah k hladinám krevních lipidů. V epidemiologických sledováních je přitom asi 50 % mozkových příhod označeno jako „nejasné příčiny“. Přibližně 15 % hodnocených iktů je hemoragických a u těch je vztah k hladinám cholesterolu v plazmě inverzní – nízká cholesterolémie zvyšuje riziko mozkového krvácení [4]. Hodnocení ischemických a hemoragických iktů současně tak logicky minimalizuje vliv sledovaných lipidových hladin na riziko iktu. Při hledání souvislostí mezi rizikem CMP a biochemickým ukazatelem (plazmatickými lipidy) je také nutné vzít v úvahu změny hladin sledovaného markeru navozené samotnou CMP. Podobně jako u akutních koronárních syndromů klesá v akutní fázi CMP hladina cholesterolu ve srovnání s bazálními podmínkami. V průběhu některých epidemiologických sledování byly stanoveny pouze koncentrace celkového cholesterolu (např. studie MRFIT). Přitom význam hladiny HDL cholesterolu (HDL-c) pro určení rizika CMP je dnes jasně prokázán a poměr celkového a HDL-c je z hlediska rizika CMP považován za nejdůležitější ze všech běžných lipidových ukazatelů [5, 6]. Toto jsou některá z možných vysvětlení diskrepantních nálezů mezi epidemiologickými a intervenčními studiemi sledujícími vztah dyslipidémie, hypolipidemické léčby a cévních mozkových příhod, které souhrnně označujeme jako cholesterolový paradox. Připomeňme si proto základní údaje z observačních studií a z klinických hodnocení s hypolipidemickou léčbou sledujících ovlivnění rizika iktů.
Dyslipidémie a cévní mozková příhoda v epidemiologických studiích
Ve snaze rozšifrovat cholesterolový paradox byla uspořádána a v roce 1995 publikována první analýza Prospective Studies Collaboration (PSC) [7]. Práce shrnula výsledky 45 prospektivních epidemiologických studií s délkou sledování 5–30 let, v nichž bylo zaznamenáno 13 397 případů cévní mozkové příhody. Většina z nich byla fatálních, protože 75 % zařazených studií sledovalo pouze mortalitu a nikoli incidenci příhod. Analýzou nebyla potvrzena žádná asociace mezi hladinou celkového cholesterolu a výskytem CMP. Výjimku tvořila skupina relativně mladších nemocných ve věku do 45 let při zařazení do studie, u nichž byla hypercholesterolémie spojena se zvýšením rizika iktu. Sami autoři analýzy připouštějí, že zásadním nedostatkem celého hodnocení byla nemožnost rozlišit mezi mozkovou ischémií a hemoragií. Významná část dat pocházela z údajů velkého sledování MRFIT, do něhož byli zařazeni jenom muži a ve kterém byla poprvé jednoznačně demonstrována rizikovost hypercholesterolémie z hlediska výskytu ischemických iktů a současně i nález nízké hladiny cholesterolu jako prediktoru intrakraniálního krvácení [5]. Limitace této studie byly zmíněny výše a platí i pro celý projekt Prospective Studies Collaboration.
Následné rozšířené zhodnocení Prospective Studies Collaboration mělo překonat nedostatky první analýzy [6]. Byl sledován vztah mezi fatálními vaskulárními příhodami, dyslipidémií a navíc také výší krevního tlaku. Celkem bylo v 61 hodnocených studiích zaznamenáno 11 663 úmrtí v důsledku cévní mozkové příhody. Přes veškerou snahu nebyla polovina případů CMP etiologicky definována. Ve zbylé polovině převažovaly hemoragické ikty nad ischemickými (2700 vs. 2134) i po vyloučení 869 subarachnoidálních krvácení. Již z této základní charakteristiky je ![Graf 1 Relativní riziko různých typů cévních mozkových příhod (CMP) podle věku při snížení celkového cholesterolu o 1 mmol/l oproti průměru; podle [6] – Prospective Studies Collaboration, 2007.](https://www.remedia.cz/photo-a-27413---.jpg) zřejmé, že se omezení předchozích studií nepodařilo zcela eliminovat – převaha krvácivých mozkových příhod nad ischemickými mozkovými příhodami neodpovídá běžné proporci CMP známé z klinické praxe. Výsledkem druhé analýzy PSC je potvrzení předchozího zjištění. Pozitivní vztah mezi koncentrací celkového cholesterolu a rizikem CMP byl nalezen pouze u ischemických iktů ve věkové kategorii 40–69, a to jen u nemocných se systolickým krevním tlakem nižším než 145 mm Hg. U hemoragických iktů byl vztah neutrální do středního věku. Se zvyšujícím se věkem a výší krevního tlaku bylo riziko mozkové hemoragie vyšší s klesající hladinou celkového cholesterolu, což lze interpretovat tak, že nízká hladina sérového cholesterolu zvyšuje u starších hypertoniků riziko hemoragického iktu (graf 1). Snahou autorů bylo i zhodnocení souvislosti s výší hladiny HDL-c a s rizikem CMP. Pozitivní asociace byla zjištěna mezi rizikem úmrtí na CMP (bez rozdílu typu) a poměrem celkového cholesterolu a HDL-c pouze u nemocných středního věku. Je však třeba uvést, že údaj o HDL-c mělo v celé databázi PSC pouze 437 zemřelých na CMP. Přes veškerou snahu o minimalizaci faktorů zkreslujících hodnocení, adjustaci a úsilí o co nejpodrobnější klasifikaci je i při hodnocení druhé analýzy PSC nutné brát v úvahu několik faktů. Nebylo možno zcela odfiltrovat možnost populační selekce. Zjednodušeně, osoby s dyslipidémií a pokročilou aterosklerózou mohou zemřít v důsledku cévní příhody v jiném povodí dříve, než se „dožijí“ CMP. Totéž platí o rizikovosti nízké cholesterolémie pro hemoragickou mozkovou příhodu. Nízká (normální) hladina cholesterolu „umožní“ nemocnému, aby se uplatnila jiná rizika než aterosklerotické cévní postižení, a pravděpodobnost hemoragie je relativně větší. Navíc byly hodnoceny pouze fatální ikty, takže PSC neposkytuje informace o rizikových faktorech u většiny pacientů, kteří iktus přežijí [8].
zřejmé, že se omezení předchozích studií nepodařilo zcela eliminovat – převaha krvácivých mozkových příhod nad ischemickými mozkovými příhodami neodpovídá běžné proporci CMP známé z klinické praxe. Výsledkem druhé analýzy PSC je potvrzení předchozího zjištění. Pozitivní vztah mezi koncentrací celkového cholesterolu a rizikem CMP byl nalezen pouze u ischemických iktů ve věkové kategorii 40–69, a to jen u nemocných se systolickým krevním tlakem nižším než 145 mm Hg. U hemoragických iktů byl vztah neutrální do středního věku. Se zvyšujícím se věkem a výší krevního tlaku bylo riziko mozkové hemoragie vyšší s klesající hladinou celkového cholesterolu, což lze interpretovat tak, že nízká hladina sérového cholesterolu zvyšuje u starších hypertoniků riziko hemoragického iktu (graf 1). Snahou autorů bylo i zhodnocení souvislosti s výší hladiny HDL-c a s rizikem CMP. Pozitivní asociace byla zjištěna mezi rizikem úmrtí na CMP (bez rozdílu typu) a poměrem celkového cholesterolu a HDL-c pouze u nemocných středního věku. Je však třeba uvést, že údaj o HDL-c mělo v celé databázi PSC pouze 437 zemřelých na CMP. Přes veškerou snahu o minimalizaci faktorů zkreslujících hodnocení, adjustaci a úsilí o co nejpodrobnější klasifikaci je i při hodnocení druhé analýzy PSC nutné brát v úvahu několik faktů. Nebylo možno zcela odfiltrovat možnost populační selekce. Zjednodušeně, osoby s dyslipidémií a pokročilou aterosklerózou mohou zemřít v důsledku cévní příhody v jiném povodí dříve, než se „dožijí“ CMP. Totéž platí o rizikovosti nízké cholesterolémie pro hemoragickou mozkovou příhodu. Nízká (normální) hladina cholesterolu „umožní“ nemocnému, aby se uplatnila jiná rizika než aterosklerotické cévní postižení, a pravděpodobnost hemoragie je relativně větší. Navíc byly hodnoceny pouze fatální ikty, takže PSC neposkytuje informace o rizikových faktorech u většiny pacientů, kteří iktus přežijí [8].
![Graf 2 Riziko fatálního iktu v závislosti na poměru apoB/apoA1 adjustované na hladiny celkového cholesterolu, triglyceridů, věk a pohlaví ve studii AMORIS; podle [9] – Walldius, et al., 2006.](https://www.remedia.cz/photo-a-27414---.jpg) Při hodnocení souvislostí mezi koncentracemi sérových lipidů a rizikem CMP je nutné zmínit studii AMORIS [9]. Toto rozsáhlé, více než 10 let trvající epidemiologické sledování zaznamenalo téměř 1200 fatálních iktů. Pouze 15 % všech případů CMP mělo neznámou příčinu, ostatní byly dobře klasifikovány. K posouzení rizikovosti dyslipidémie byl vybrán poměr koncentrací apolipoproteinu (apo) B a apoA1, vystihující nejlépe zastoupení aterogenních (nesoucích apoB) a protektivních (obsahujících apoA1) lipoproteinových částic [10]. Autoři dokumentovali těsný a lineární vztah mezi rizikem ischemické i hemoragické CMP a poměrem apoB/apoA1. Riziko iktu ve skupině osob s hodnotami poměru apoB/apoA1 v pásmu nejvyššího decilu bylo dvojnásobné ve srovnání s nejnižším decilem (graf 2). Ze závěrů studie AMORIS vyplývá, že pro vznik mozkové příhody je rozhodující rovnováha aterogenních a antiaterogenních lipoproteinových částic v séru spíše nežli absolutní hodnoty cholesterolu nebo triglyceridů.
Při hodnocení souvislostí mezi koncentracemi sérových lipidů a rizikem CMP je nutné zmínit studii AMORIS [9]. Toto rozsáhlé, více než 10 let trvající epidemiologické sledování zaznamenalo téměř 1200 fatálních iktů. Pouze 15 % všech případů CMP mělo neznámou příčinu, ostatní byly dobře klasifikovány. K posouzení rizikovosti dyslipidémie byl vybrán poměr koncentrací apolipoproteinu (apo) B a apoA1, vystihující nejlépe zastoupení aterogenních (nesoucích apoB) a protektivních (obsahujících apoA1) lipoproteinových částic [10]. Autoři dokumentovali těsný a lineární vztah mezi rizikem ischemické i hemoragické CMP a poměrem apoB/apoA1. Riziko iktu ve skupině osob s hodnotami poměru apoB/apoA1 v pásmu nejvyššího decilu bylo dvojnásobné ve srovnání s nejnižším decilem (graf 2). Ze závěrů studie AMORIS vyplývá, že pro vznik mozkové příhody je rozhodující rovnováha aterogenních a antiaterogenních lipoproteinových částic v séru spíše nežli absolutní hodnoty cholesterolu nebo triglyceridů.
Léčba statiny
Snížení výskytu cévních mozkových příhod bylo pozorováno již v prvních klinických studiích se statiny [11]. Ve všech následujících statinových hodnoceních byl dokumentován obdobně příznivý vliv léčby, a proto metaanalýza statinových studií publikovaná v roce 2005 mohla konstatovat, že relativní riziko CMP klesá při terapii statinem o 21 % [12]. Vliv léčby statinem závisí přímo na míře snížení LDL-c – pokles LDL-c o 10 % snižuje riziko iktu o 13,2 % – a není závislý na koncentraci cholesterolu před léčbou [13]. V hodnocených studiích nebylo podávání statinů spojeno se zvýšením rizika hemoragické CMP a bylo doloženo, že statiny jsou v prevenci iktu stejně účinné bez ohledu na pohlaví, věk, přítomnost diabetu či výši krevního tlaku [14]. Poslední klinická sledování účinnosti statinů srovnávající agresivní léčbu vysokými dávkami se standardně dávkovanou terapií potvrdila, že i v prevenci cerebrovaskulárních příhod platí: čím nižší LDL-c, tím lépe. Agresivní léčba u nemocných s koronární aterosklerózou snižuje pravděpodobnost vzniku iktu o 17 % ve srovnání s méně intenzivním přístupem, aniž by bylo ovlivněno riziko hemoragické CMP [14].
Zajímavý byl pohled na subanalýzy některých studií sledujících vliv léčby statinem na výskyt rekurentních mozkových příhod. Například v Heart Protection Study bylo riziko opakované CMP u nemocných léčených simvastatinem 10,3 %, zatímco u léčených placebem 10,4 % [15]. Žádná ze studií dokumentujících uvedený nález neměla hodnocení vlivu léčby na opakování CMP stanoveno jako primární sledovaný cíl. Proto byla provedena studie SPARCL, ve které byl srovnán vliv 80 mg atorvastatinu a placeba na opakování CMP u nemocných s anamnézou mozkové příhody v šesti měsících před zařazením do studie. Při léčbě statinem bylo dosaženo průměrné hladiny LDL-c 1,9 mmol/l a relativní riziko opakování CMP kleslo o 16 % (p = 0,03), přestože 25 % nemocných v placebové větvi byl v průběhu studie předepsán statin [16]. K omezení případného zkreslení výsledků tímto vysokým zastoupením uživatelů statinu v placebové větvi autoři studie provedli následnou analýzu, v níž se zaměřili na rozdíly mezi pacienty s výrazným (> 50 %) a méně znatelným snížením hladin LDL-c na konci studie ve srovnání s počáteční hodnotou. Výrazné snížení koncentrace LDL-c bylo spojeno s 31% poklesem výskytu CMP bez zvýšení rizika mozkové hemoragie [17]. Studie SPARCL tak mimo jakoukoli pochybnost dokumentovala příznivý vliv terapie vysokou dávkou statinu u nemocných v sekundární prevenci cerebrovaskulární příhody.
Poslední soubor údajů o vlivu podávání statinů na výskyt cerebrovaskulárních příhod přinesla studie JUPITER [18]. Obrovské klinické sledování účinnosti a bezpečnosti podávání 20 mg rosuvastatinu u 17 802 nemocných s nízkou hladinou LDL-c (průměrná hodnota při randomizaci byla 2,7 mmol/l) a zvýšeným C-reaktivním proteinem (průměrně 4,3 mg/l) bylo předčasně ukončeno po 1,9 letech pro výrazně pozitivní vliv aktivní léčby na sledované ukazatele. Jedním z nich byl i výskyt cévních mozkových příhod, jejichž počet byl aktivní léčbou rosuvastatinem snížen o 48 % ve srovnání s placebem. V rosuvastatinové větvi bylo 6 a v placebové 9 pacientů, kteří v průběhu 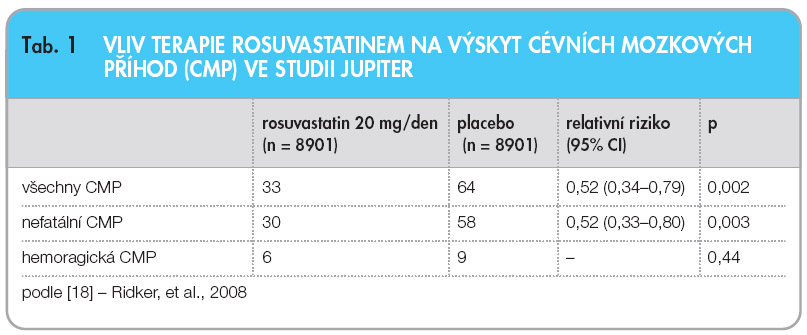 sledování prodělali hemoragickou CMP; tento rozdíl nebyl statisticky významný (p = 0,44), viz tab. 1. Studie JUPITER rozšířila naše poznatky o příznivém působení statinů na cerebrovaskulární povodí u osob nízkou hladinou LDL-c a maximálně středně zvýšeným kardiovaskulárním rizikem. Podobně jako v ostatních statinových sledováních nebyla léčba spojena se zvýšeným rizikem závažných nežádoucích účinků a byla nemocnými dobře snášena.
sledování prodělali hemoragickou CMP; tento rozdíl nebyl statisticky významný (p = 0,44), viz tab. 1. Studie JUPITER rozšířila naše poznatky o příznivém působení statinů na cerebrovaskulární povodí u osob nízkou hladinou LDL-c a maximálně středně zvýšeným kardiovaskulárním rizikem. Podobně jako v ostatních statinových sledováních nebyla léčba spojena se zvýšeným rizikem závažných nežádoucích účinků a byla nemocnými dobře snášena.
Jak zdůvodnit příznivé působení statinů na výskyt ischemických cévních mozkových příhod? Hlavní je (stejně jako v případě ostatních vaskulárních povodí) snižování hladiny LDL-c. Pro účinnou prevenci CMP statinem je nejdůležitější dosáhnout cílové koncentrace LDL-c < 2,6 mmol/l. Významnou roli jistě hrají i tzv. nelipidové účinky statinů. Protizánětlivé, antitrombogenní, antioxidační a další dokumentované vlastnosti jsou (stejně jako snižování hladin LDL-c) různě vyjádřeny u různých statinů, což je možným zdůvodněním rozdílů ve výsledcích klinických studií [19]. Na základě nashromážděných důkazů můžeme uzavřít, že statiny jsou účinné v prevenci ischemických cévních mozkových příhod u nemocných s manifestním kardiovaskulárním onemocněním (KVO) po prodělané tranzitorní ischemické atace (TIA) nebo po kompletním ischemickém iktu, ale i u osob se zvýšeným celkovým kardiovaskulárním rizikem bez anamnézy KVO.
Léčba fibráty
Agonisté PPAR-α receptorů – fibráty – jsou hypolipidemiky s dominantním vlivem na hladiny triglyceridů (TG) a HDL-c. Zvýšená hladina TG a nižší koncentrace HDL-c jsou rizikovými faktory ischemické CMP [20, 21]. Přesto ve srovnání s poznatky o statinech jsou naše znalosti o vlivu léčby fibrátem na výskyt iktů nesrovnatelně menší. Ve studii VA-HIT bylo podávání gemfibrozilu nemocným s ischemickou chorobou srdeční s nízkou hladinou HDL-c i LDL-c spojeno s významným poklesem rizika ischemických CMP o 31 % ve srovnání s placebem [22]. Tento účinek byl patrný již po 6 měsících léčby, zatímco ve statinových studiích bylo nutno léčbu podávat průměrně 3–3,5 roku k dosažení podobného efektu. Je možné, že při léčbě fibrátem se více uplatňují „nelipidové“ účinky na stabilizaci aterosklerotického plátu zlepšením endoteliální dysfunkce, protizánětlivým a antitrombogenním působením než samotný vliv na lipidové hladiny [23]. V helsinské primárně preventivní studii nebyl vliv gemfibrozilu na výskyt iktů potvrzen, je však pravdou, že v průběhu studie bylo zaznamenáno pouze 10 fatálních CMP v aktivní větvi a 6 fatálních CMP v placebové větvi sledování [24]. V dosud největší studii hodnotící vliv léčby fibrátem na výskyt kardiovaskulárních komplikací u diabetiků 2. typu FIELD nebylo podávání fenofibrátu spojeno s významným snížením rizika všech CMP ani podskupiny ischemických iktů (pokles rizika o 10 %, resp. 9 %) [25]. Studie FIELD měla řadu metodologických limitací a výsledky je třeba hodnotit s tímto vědomím. U subpopulace sledovaných v rámci studie FIELD, kteří splňovali kritéria metabolického syndromu včetně přítomnosti typické diabetické dyslipidémie, přinesla léčba fenofibrátem významné snížení rizika makrovaskulárních příhod o 26 % (p = 0,014) [26]. Hypolipidemická léčba fibrátem je v prevenci CMP indikována u osob s vysokým celkovým rizikem KVO, u nichž léčba statinem nevede k dostatečnému ovlivnění rizikových ukazatelů (TG a HDL-c) a u nichž i přes léčbu statinem zůstává vysoké tzv. reziduální riziko cévních příhod [27].
Ostatní hypolipidemickáléčba
Ačkoli údajů o významu podávání dalších hypolipidemik v rámci komplexní snahy o předcházení CMP je ještě méně než u fibrátů, zmíníme pro úplnost stručně ještě ostatní farmakologické možnosti ovlivnění aterogenní dyslipidémie.
Niacin je nejstarším hypolipidemikem, které ovlivňuje všechny složky plazmatického lipidového spektra. Za jeho hlavní antiaterosklerotický efekt lze považovat zvyšování hladiny HDL-c a snižování TG. Vliv niacinu na výskyt kardiovaskulárních příhod byl dokumentován v řadě studií [28]. Historický Coronary Drug Project doložil, že léčba niacinem snižuje u nemocných s ICHS relativní riziko ischemického iktu o 19 % [29]. Tento nález byl nepřímo potvrzen i studií ARBITER 2, kde byl zjištěn příznivý vliv kombinace niacin/statin na progresi aterosklerózy karotického povodí pomocí duplexního ultrazvukového vyšetření [30]. Tak jako v klinických studiích (a v analogii s fibráty) je místo niacinu v prevenci iktů nejspíše v kombinační léčbě se statiny.
Ezetimib je v léčbě dyslipidémie používán nejkratší dobu. Tento selektivní inhibitor intestinální absorpce cholesterolu má dobře dokumentovanou účinnost na snižování hladin celkového a především LDL cholesterolu v monoterapii i v kombinaci [31]. Z hlediska prevence CMP je jistě zajímavý a překvapující nález studie ENHANCE, v níž bylo více než 700 pacientů s familiární hypercholesterolémií randomizováno k terapii simvastatinem anebo k terapii simvastatinem v kombinaci s ezetimibem. Přestože kombinovaná léčba snížila hladiny LDL-c významně více než monoterapie statinem, nebyl po dvou letech trvání studie mezi léčebnými větvemi žádný rozdíl v tloušťce intimymedie karotických tepen hodnocené sonograficky [32]. Na adresu autorů studie se po publikaci jejích výsledků snesla lavina kritiky, protože design studie měl řadu problematických aspektů (délka a typ předchozí hypolipidemické léčby, délka trvání samotné studie, technika ultrazvukového hodnocení a další). Druhou studií s ezetimibem, která sledovala vliv kombinace ezetimibu se statinem na průběh onemocnění u pacientů s aortální stenózou, byla studie SEAS [33]. Snižování hladin krevních lipidů kombinační léčbou ve studii SEAS nemělo žádný vliv na progresi aortální stenózy. Sekundárními sledovanými cíli byla řada vaskulárních příhod včetně nehemoragické CMP. Výskyt tohoto předem specifikovaného sledovaného cíle nebyl léčbou ve studii SEAS nijak ovlivněn – v placebové větvi bylo zaznamenáno 29 a v aktivně léčené 33 ischemických mozkových příhod. Ani jedna z publikovaných studií s ezetimibem sledujících klinické příhody nebyla navržena k hodnocení vlivu léčby ezetimibem na riziko iktů. Bude tedy lépe ponechat definitivní závěr o pozici ezetimibu v prevenci mozkových vaskulárních příhod na dobu, kdy budou k dispozici výsledky velkých probíhajících klinických studií (SHARP a IMPROVE-IT), které souhrnně zkoumají více než 20 tisíc nemocných; lze předpokládat, že poskytnou dostatek dat k zodpovězení současných otázek.
O použití ezetimibu v prevenci cerebrovaskulárních příhod lze shrnout: u nemocných se zvýšeným rizikem CMP, kteří nedosahují cílové hodnoty celkového a LDL cholesterolu při maximální tolerované dávce statinu, je vhodné zahájit léčbu kombinací statinu s ezetimibem.
Závěr
Hypolipidemická farmakoterapie vedoucí k dosažení cílových hodnot celkového a LDL cholesterolu a současně k příznivému ovlivnění rizikových ukazatelů (koncentrací TG a HDL-c) je prokazatelně účinnou prevencí vzniku prvních i opakovaných ischemických cévních mozkových příhod. Každý nemocný po prodělané ischemické CMP nebo TIA by měl být léčen statinem k dosažení cílové hodnoty LDL-c < 2,0 mmol/l. U nemocných, kteří tohoto základního léčebného cíle dosáhnou, je vhodné zvážit kombinaci statinu s fibrátem k maximálnímu ovlivnění všech složek aterogenní dyslipidémie. Kromě statinů a fibrátů nemáme v současnosti pro podávání dalších hypolipidemik důkazy z klinických studií sledujících výskyt iktů. Použití hypolipidemik v prevenci cerebrovaskulárních příhod se řídí obecně platnými doporučeními pro prevenci oběhových komplikací aterosklerózy.
Částečně podpořeno výzkumným záměrem MŠMT 0021620807.
Seznam použité literatury
- [1] Law MR, Wald NJ, Thompson SG. By how much and how quickly does reduction in serum cholesterol concentration lower risk of ischaemic heart disease? BMJ 1994; 308: 367–372.
- [2] Amarenco P. Lipid lowering and reccurent stroke: another stroke paradox. Eur Heart J 2005; 26: 1818–1819.
- [3] Amarenco P, Labreuche J, Lavalle’e P, et al. Statins in stroke prevention and carotid atherosclerosis: systematic review and metaanalysis. Stroke 2004; 35: 2902–2909.
- [4] Qizilbash N. Are risk factors for stroke and coronary heart disease the same? Curr Opin Lipidol 1998; 9: 325–328.
- [5] Iso H, Jacobs DR, Wentworth D, for the MRFIT Research Group. Serum cholesterol levels and six-year mortality from stroke in 350 977 men screened for the multiple risk factor intervention trial. N Engl J Med 1989; 320: 904–910.
- [6] Prospective Studies Collaboration. Blood cholesterol and vascular mortality by age, sex, and blood pressure: meta-analysis of individual data from 61 prospective studies with 55 000 vascular deaths. Lancet 2007, 370: 1829–1839.
- [7] Prospective Studies Collaboration. Cholesterol, diastolic blood pressure, and stroke: 13,000 strokes in 450,000 people in 45 prospective cohorts. Lancet 1995, 346: 1647–1653.
- [8] Amarenco P, Steg PG. The paradox of cholesterol and stroke. Lancet 2007, 370: 1803–1804.
- [9] Walldius G, Aastveit AH, Jungner I. Stroke mortality and the apoB/apoAI ratio: results of the AMORIS prospective study. J Intern Med 2006; 259: 259–266.
- [10] Yusuf S, Hawken S, Ounpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364: 937–952. imaging techniques
- [11] Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344: 1383–1389.
- [12] Cholesterol Treatment Trialists’Collaborators. Efficacy and safety of cholesterol-lowering treatment: retrospective meta-analysis of data from 90056 participants of 14 randomised trials of statins. Lancet 2005; 366: 1267–1278.
- [13] Amarenco P. The effects of statins in stroke prevention. Curr Opin Lipidol 2005; 16: 614–618.
- [14] Mazighi M, Lavallée PC, Labreuche J, et al. Statin therapy and stroke prevention: what was known, what is new and what is next? Curr Opin Lipidol 2007; 18: 622–625.
- [15] Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet 2003; 361: 2005–2016.
- [16] Amarenco P, Bogousslavsky J, Callahan A 3rd, et al., for the SPARCL investigators. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006, 355: 549–555.
- [17] Amarenco P, Goldstein LB, Szarek M, et al., for the SPARCL Investigators. Effects of intense LDL-C reduction in patients with stroke or transient ischemic attack: the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) trial. Stroke 2007; 38: 3198–3204.
- [18] Ridker PM, Danielson E, Fonseca FAH, et al. For the JUPITER study group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008; 359: 2159–2207.
- [19] Nassief A, Marsh JD. Statin therapy for stroke prevention. Stroke 2008, 39: 1042–1048.
- [20] Amarenco P, Labreuche J, Touboul PJ. High-density lipoprotein-cholesterol and risk of stroke and karotid atherosclerosis: a systematic review. Atherosclerosis 2008; 196: 489–496.
- [21] Tanne D, Koren-Morag N, Graff E, et al. Blood lipids and first ever ischemic stroke/transient ischemic attack in the Bezafibrate Infarction Prevention (BIP) registry: high triglycerides constitute an independent risk factor. Circulation 2001; 104: 2892–2897.
- [22] Rubins HB, Davenport J, Babikian V, et al. Reduction in stroke with gemfibrozil in men with coronary heart disease and low HDL cholesterol: the Veterans Affairs HDL Intervention Trial (VA-HIT). Circulation 2001; 103: 2828–2833.
- [23] Staels B, Koenig W, Habib A, et al. Activation of human aortic smoothmuscle cells is inhibited by PPARa but not by PPARg activators. Nature 1998; 393: 790–793.
- [24] Frick MH, Elo O, Haapa K, et al. Helsinki Heart Study: primary prevention trial with gemfibrozil in middle-aged men with dyslipidemia. N Engl J Med 1987; 317: 1237–1245.
- [25] FIELD study investigators. Effect of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus /the FIELD study/: randomised controlled trial. Lancet 2005; 366: 1849–1861.
- [26] Keech A for the FIELD study investigators. Features of Metabolic Syndrome Identify Individuals with Type 2 Diabetes Mellitus at high risk for CV events and greater benefits of fenofibrate. AHA 2007, Orlando, Abstract.
- [27] Fruchart JC, Sacks FM, Hermans MP, et al. The residual risk reduction initiative: a call to action to reduce residual vascular risk in dyslipidaemic patients. Diabetes Vasc Dis Res 2008; 5: 319–335.
- [28] Carlson LA. Nicotinic acid: the broad spektrum lipid drug. A 50th anniversary review. J Intern Med 2005; 258: 94–114.
- [29] The Coronary Drug Project Research Group. Clofibrate and niacin in coronary heart disease. JAMA 1975; 231: 360–381.
- [30] Taylor AJ, Sullenberger LE, Lee HJ, et al. Arterial biology for the investigation of the treatment effects of reducing cholesterol (ARBITER) 2. A double-blind, placebo-controlled study of extended-release niacin on atherosclerosis progression in secondary prevention patients treated with statins. Circulation 2004; 110: 3512–3517.
- [31] Davidson MH, Ballantyne CM, Kerzner B, et al. Efficacy and safety of ezetimibe coadministered with statins: randomised, placebo-controlled, blinded experience in 2382 patients with primary hypercholesterolemia. Int J Clin Pract 2004; 58: 746–755.
- [32] Kastelein JJP, Akdim F, Stroes ESG, et al. Simvastatin with or withnout ezetimibe in familial hypercholesterolemia. N Engl J Med 2008; 358: 1431–1443.
- [33] Rossebo AB, Pedersen TR, Boman K, et al. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med 2008; 359: 1343–1356.