Prevence diabetu mellitu 1. typu
K predikci diabetu mellitu 1. typu u příbuzných prvního stupně lze využít kombinaci genetických, imunologických a endokrinologických metod. Stejné způsoby jsou užívány i pro predikci autoimunitního diabetu u všeobecné populace, pravděpodobnost predikce je však nižší. Základem preventivních metod, které jsou v klinické praxi užívány před manifestací diabetu v rámci primární prevence, je eliminace některých alloantigenů ze stravy rizikových dětí a nebo aplikace přirozených či modifikovaných epitopů autoantigenů, které mají zlepšit špatně navozenou imunologickou toleranci.
Po manifestaci diabetu se v rámci sekundární prevence užívají především alterované epitopy autoantigenů, imunosupresivní a nebo imunomodulační terapie. Cílem sekundární prevence je prodloužení postiniciální remise onemocnění. Metody primární a sekundární prevence lze kombinovat a zhodnocení jejich efektivity i bezpečnosti je předmětem řady probíhajících mezinárodních studií.
Úvod
Moderní diabetologie je charakterizována významným pokrokem v diagnostice i v léčbě diabetu mellitu 1. typu (T1DM) na straně jedné a značným rozvojem predikčních i preventivních metod tohoto onemocnění na straně druhé. Jaká je současnost i blízká budoucnost obou hlavních směrů rozvoje? Léčba diabetu, nebo jeho prevence? Incidence T1DM se neustále zvyšuje. Protože však nárůst incidence není lineární, dochází v některých zemích k přechodnému pozastavení dalšího vzestupu incidence T1DM, což někdy vede k prezentaci optimistických prognostických trendů. Na příkladu některých severských států lze ukázat, že zpomalení vzestupu incidence T1DM může být jen přechodné. Ve Finsku se incidence T1DM u dětí do 15 let výrazně zpomalila před 8–9 lety, kdy dosáhla hodnot vyšších než 40/100 000 dětí za rok. Po 4–5 letech relativní stagnace se však začala opět výrazně zvyšovat a podle předběžných kalkulací přesáhla v uplynulém roce 50/100 000/rok [1].
V České republice došlo v posledních 3–4 letech rovněž ke zpomalení vzestupu incidence T1DM u dětí. Na této skutečnosti se sice může spolupodílet i zhoršení přesnosti záchytu nově diagnostikovaných diabetických dětí v našich registrech, hlavní roli však zřejmě hraje fenomén nelineárního vzestupu incidence, který byl v uplynulých letech pozorován v některých zemích. S velkou pravděpodobností lze očekávat, že se bude incidence T1DM i v České republice nadále zvyšovat. Proto prevence tohoto onemocnění nabývá v moderní medicíně stále většího významu.
Ještě před 20–30 lety byl T1DM považován za onemocnění mladých jedinců s typickou manifestací před 35. rokem věku. Dnes však víme, že se autoimunitní diabetes může manifestovat v jakémkoliv věku. Ve srovnání s dětskými pacienty je průběh autoimunitní inzulitidy u dospělých v mnoha směrech odlišný. Inzulitida probíhá podstatně pomaleji a vzhledem k postupně narůstající inzulinové rezistenci stačí u starších jedinců ke klinické manifestaci T1DM destrukce podstatně menšího počtu β-buněk. Proto v dospělosti bývá většina pacientů s nově manifestovaným T1DM mylně diagnostikována jako diabetici 2. typu a vzhledem ke značnému množství zachovaných β-buněk může být léčba perorálními antidiabetiky efektivní celou řadu let.
U dospělých pacientů s nově manifestovaným T1DM je velmi obtížné odlišit diabetes 1. a 2. typu běžným klinickým či endokrinologickým vyšetřením. Z některých zahraničních pilotních studií však vyplývá, že ze všech diagnostikovaných pacientů s autoimunitním diabetem se téměř 40 % jedinců manifestuje po 19. roce věku a více než 15 % po 30. roce věku. Jiné studie však udávají ještě vyšší počet nově manifestovaných dospělých pacientů s T1DM [2]. Ani anamnestické údaje o výskytu diabetické ketoacidózy, nezbytnosti léčby inzulinem či o mladším věku pacientů při její manifestaci příliš nepomohou v diferenciálně-diagnostických úvahách o správném zařazení diabetického syndromu u postiženého jedince [3, 4]. Protože biopsie pankreatu nepatří k běžným vyšetřovacím postupům a metody pro stanovení epitopově specifických cytotoxických lymfocytů nejsou dosud dostatečně standardizovány, představuje stanovení autoprotilátek zatím nejspolehlivější metodu k odlišení obou hlavních typů diabetu. Při kombinovaném vyšetření autoprotilátek proti inzulinu, GAD65 a IA-2a lze alespoň jednu z uvedených protilátek prokázat u více než 90 % pacientů s T1DM a dvě nebo více protilátek lze nalézt u více než 80 % nově diagnostikovaných jedinců. Pilotní studie ukazují, že více než 10 % nově diagnostikovaných dospělých diabetiků představují jedinci s T1DM [5]. Nevyřešenou však zůstává otázka, zda a kdy zahájit u starších osob léčbu inzulinem.
Autoimunitní inzulitida
Z provedených studií u příbuzných prvního stupně je zřejmé, že autoimunitní inzulitida může probíhat celou řadu let, než dospěje do stadia manifestního diabetu. Ve srovnání s dětmi lze u dospělých pacientů s nově diagnostikovaným T1DM zjistit vyšší hladiny C peptidu a delší klinickou symptomatologii základního onemocnění [6]. Obecně platí, že autoimunitní inzulitida probíhá rychleji u malých dětí a mladších jedinců, z tohoto pravidla však existuje řada výjimek. T1DM se vyskytuje jen asi u 5–10 % blízkých příbuzných prvního stupně s nemocnými autoimunitním diabetem. Tyto údaje však vycházejí spíše z pilotních studií a z anamnestických dat než z dlouhodobého sledování a moderní diagnostiky T1DM – podobně jako údaje o konkordanci jednovaječných dvojčat pro T1DM. V klasické diabetologické literatuře se často traduje, že u rodičů a prarodičů dětí s T1DM se častěji vyskytuje diabetes 2. typu. Nové studie však prokázaly, že většina diabetických rodičů dětí s T1DM má rovněž autoimunitní diabetes [7].
Termín LADA (Latent Autoimmune Diabetes of Adults) je v současnosti užíván pro T1DM, který se manifestoval v dospělosti. Pro tento typ diabetu jsou charakteristické některé zvláštnosti, které nenalézáme u dětského T1DM. Průběh autoimunitní inzulitidy je u LADA velmi pomalý a ve srovnání s T1DM u dětí je jiný podíl genetických faktorů a vlivů zevního prostředí, jiné spektrum autoprotilátek, jiná charakteristika cytotoxických a regulačních lymfocytů, často jiný způsob léčby a další odchylky [8]. V literatuře lze nalézt studie, jež se snaží odlišit T1DM manifestovaný v dospělosti od LADA, ale z praktického hlediska nemá další subklasifikace autoimunitního diabetu manifestovaného v dospělosti žádný praktický význam. Dříve užívané termíny pro tento typ diabetu se dnes již používají jen výjimečně – (např. diabetes 1,5).
V současnosti můžeme predikovat T1DM s poměrně vysokou pravděpodobností u příbuzných prvního stupně s diabetickými pacienty – tedy u dětí diabetických rodičů, sourozenců diabetických dětí, ale také u rodičů diabetických dětí. Predikce není absolutní hodnotou, ale je vyjadřována jako percentuální riziko manifestace T1DM v daném časovém intervalu.
Predikce T1DM u všeobecné populace je jedním z hlavních cílů moderní diabetologie. V podstatě jsou užívány stejné metody jako pro predikci autoimunitního diabetu u příbuzných prvního stupně, většímu rozšíření prediktivních metod do běžné klinické praxe však zatím brání jejich vysoká ekonomická náročnost.
Predikce T1DM
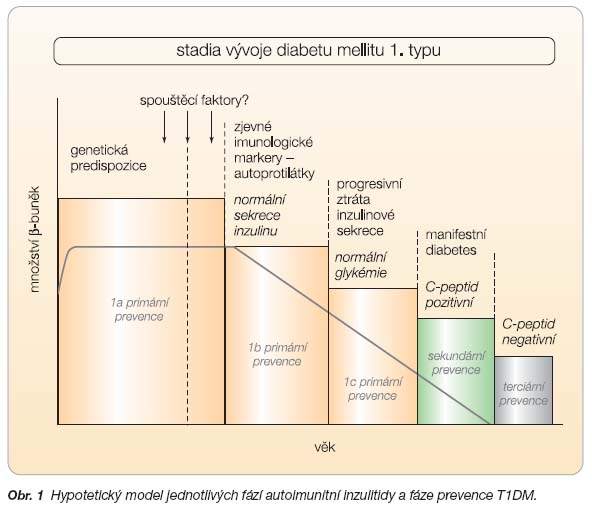 Účinná predikce T1DM u příbuzných prvního stupně i u všeobecné populace je nezbytnou podmínkou účinné prevence tohoto onemocnění. Predikce T1DM využívá kombinace tří metod, které odpovídají jednotlivým stadiím autoimunitní inzulitidy (obr. 1).
Účinná predikce T1DM u příbuzných prvního stupně i u všeobecné populace je nezbytnou podmínkou účinné prevence tohoto onemocnění. Predikce T1DM využívá kombinace tří metod, které odpovídají jednotlivým stadiím autoimunitní inzulitidy (obr. 1).
Metody genetické
V nedávné minulosti byly geny přinášející genetické riziko T1DM označovány jako IDDM geny. Jejich lokusy byly identifikovány jak asociačními studiemi, tak i vazebnými analýzami. Časem se však ukázalo, že některé z těchto lokusů již dále nezvyšují genetické riziko T1DM a přinášejí pouze falešnou pozitivitu.
Hlavní genetické riziko T1DM je přinášeno IDDM1 genem: polymorfismy HLA molekul II. třídy v lokusech DQ a DR (nejrizikovější genotyp DR3-DQ2/DR4-DQ8), které se podílejí asi 50 % na familiárním clusteringu (viz poznámka na konci podkapitoly). Dalších cca 5–10 % je přinášeno IDDM2 genem – VNTR polymorfismy inzulinového genu [9]. Řada dalších identifikovaných genů ovlivňuje nejen průběh autoimunitní inzulitidy, ale modifikuje průběh i jiných autoimunitních chorob – např. revmatoidní artritidy, juvenilní idiopatické artritidy, systémového lupus erythematosus, Crohnovy choroby, autoimunitních onemocnění štítné žlázy a dalších. V současnosti je například zkoumán vliv PTPN22, PTPN2, CTLA4, IL2RA/CD25 a dalších genů, které se podílejí na genetickém riziku nejen T1DM, ale i jiných autoimunitních chorob. Některé alely však přinášejí významnou protektivitu pro T1DM. Například haplotyp HLA DQA1*0102/DQB1*0602 je dominantně protektivní, i když ani protektivita přinášená tímto haplotypem není absolutní. Jako další příklad lze uvést některé alely VNTR polymorfismu inzulinového genu III. třídy. Při kalkulaci individuálního genetického rizika T1DM je třeba vzít v úvahu i roli „protektivních alel, haplotypů či genotypů“.
Pozn.: Clustering = shlukování – spočívá v rozdělení pozorovaných dat do určitého počtu homogenních skupin tak, aby si entity v nalezených skupinách byly co nejvíce podobné. Počet shluků může, ale nemusí být dopředu určen. I když shlukování má blízko ke klasifikaci, k interpretaci skupin dochází až po jejich vytvoření.
Metody imunologické
Tradiční stanovování hladin protilátek ICA (Islet Cell Antibodies), které jsou vyšetřovány nepřímou imunofluorescencí a jejichž zhodnocení je zatíženo prvkem subjektivity, bylo v posledních letech nahrazeno vyšetřováním protilátek proti rekombinantním antigenům (IAA – antiinzulinové protilátky, anti GAD65 – protilátky proti dekarboxyláze kyseliny glutamové, anti IA-2a – protilátky proti tyrozinové kináze).
U dětí je zřejmě hlavním iniciačním („primingovým“) antigenem inzulin, resp. proinzulin. Inzulin je jediným autoantigenem, který je přítomen pouze v β-buňkách ostrůvků, velmi často se IAA objevují u prediabetických dětí jako první a jejich hladina koreluje s rychlostí destrukce β-buněk [10]. Jejich laboratorní stanovení je však poměrně obtížné a při užití klasických laboratorních metod s precipitací polyethylenglykolem je zatíženo vysokou falešnou pozitivitou.
Méně jasná je situace u dospělých pacientů s T1DM. Velmi často se u nich jako první objevují anti GAD65 protilátky, nicméně tento antigen je exprimován i v a-buňkách ostrůvků. Po destrukci všech buněk produkujících inzulin autoimunitní inzulitida mizí, přestože přítomnost dekarboxylázy kyseliny glutamové (GAD) v ostrůvkových a-buňkách přetrvává. U 5–10 % pacientek s gestačním diabetem lze časem prokázat autoprotilátky proti antigenům β-buněk, především anti GAD65, a onemocnění je překlasifikováno jako T1DM. Podobně se v průběhu onemocnění objevují autoprotilátky u některých dospělých pacientů s diabetem 2. typu. Proto opakované vyšetřování především anti GAD65 protilátek u dospělých diabetických pacientů může pomoci při klasifikaci základního onemocnění i při případné změně léčby [11].
Anti IA-2a se objevují u prediabetických jedinců obvykle jako poslední, nicméně jejich význam pro predikci manifestního diabetu není zanedbatelný. Mezi další vyšetřované autoprotilátky, které mají prognostický význam, patří například anti IA-2b (fogrin) nebo v poslední době stanovované protilátky anti Zn-transporter 8 (ZnT8) [12].
Autoprotilátky u T1DM však nemají cytotoxický charakter. Hlavním efektorovým systémem u autoimunitní inzulitidy jsou cytotoxické CD4+ a CD8+ lymfocyty, NK buňky, makrofágy, prozánětlivé cytokiny, volné kyslíkové radikály, kysličník dusný, prostaglandiny, některé složky komplementu a další. Autoprotilátky jsou však cenným laboratorním markerem ke sledování průběhu inzulitidy a hrají důležitou diagnostickou roli v preventivní diabetologii.
V posledních letech je věnována mimořádná pozornost roli regulačních CD4+, CD25+, FoxP3+ (forkhead box P3) lymfocytů, které mohou významným způsobem ovlivnit rychlost i vlastní průběh autoimunitního procesu. V popředí zájmu jsou i prozánětlivé Th17 lymfocyty. Tyto buňky, které produkují důležitý IL-17, se diferencují pod vlivem IL-6 u myší a IL-1 u lidí a důležitou roli v procesu jejich diferenciace hrají také IL-21 a IL-23. Oba zmíněné typy buněk jsou předmětem intenzivního výzkumu se zaměřením na jejich možné využití v preventivní diabetologii.
Metody endokrinologické
Vyšetřením tzv. první fáze inzulinové sekrece u jedinců s genetickým rizikem T1DM a s přítomností jedné či více autoprotilátek lze diagnostikovat pacienty s preklinickou fází diabetu. Hodnota FPIR (First Phase of Insulin Release) je dána součtem hladin inzulinu za 1 a 3 minuty po intravenózní aplikaci glukózy. Glukóza je aplikována ve formě 20% roztoku v dávce 0,5 g/kg tělesné hmotnosti během 2–4 minut. První percentil FPIR odpovídá součtu hladin imunoreaktivního inzulinu (IRI) = 48 mU/l. Průměrná doba klinické manifestace diabetu je u jedinců s hodnotou FPIR pod 1. percentilem asi 1,8 roku. Protože u dětí je stimulovaná sekrece inzulinu nižší než u dospělých, byl ve finské studii DIPP užit součet hladin IRI v 1. + 3. minutě < 38 mU/l jako kritérium signifikantně porušené FPIR [13]. Je však nutno zdůraznit, že zejména u malých dětí je interindividuální i intraindividuální variabilita tohoto vyšetření značná. Asi u 50 % jedinců s pozitivitou dvou nebo více autoprotilátek a s hodnotou FPIR pod 1. percentilem se T1DM manifestuje do jednoho roku, zatímco u příbuzných s vyšší hodnotou FPIR do tří let.
Hodnota FPIR je odrazem funkce β-buněk a může být ovlivněna například aktuální hladinou kontraregulačních hormonů glycidového metabolismu. Proto se v současné diabetologii hledají metody, které by umožnily zobrazení β-buněk a zhodnocení jejich množství. Rozpracovávány jsou metody magnetické rezonance, izotopových scanů s využitím intravenózně podaného značeného IL-2, bioluminiscence, PET a další [14].
U diabetických pacientů, kteří jsou již léčeni inzulinem, lze zbytkovou inzulinovou sekreci vyšetřovat pomocí bazálních i postimulačních hladin C-peptidu, který v molekule proinzulinu spojuje inzulinové řetězce A a B (connecting peptide). Cílem intervenčních studií je co nejdelší zachování zbytkové sekrece inzulinu a tím i stabilizace základního onemocnění.
S rozšiřováním našich znalostí o etiologii a etiopatogenezi autoimunitní inzulitidy se rozšiřují i diagnostické metody a postupy a zpřesňuje se predikce T1DM. Současná preventivní medicína se navíc snaží identifikovat společné genetické i imunologické faktory, které ovlivňují manifestaci a průběh řady autoimunitních onemocnění. Cílem tohoto úsilí je optimalizace a individualizace prevence i léčby těchto chorob.
Prevence T1DM
Metody používané u rizikové populace před vlastní manifestací diabetu (tzv. primární prevence) jsou buď zaměřeny na prohloubení špatně navozené imunologické tolerance a nebo na ovlivnění faktorů zevního prostředí, které mohou ovlivnit iniciaci a průběh autoimunitní inzulitidy.
Centrální (thymovou) imunologickou toleranci T lymfocytů (CD4+ i CD8+) vůči autoantigenům ovlivňují prenatálně i postnatálně v thymu všichni členové trojice: HLA dendritických buněk – epitop autoantigenu – hlavní receptor T lymfocytů (TCR). Aplikace autoantigenů, jejich epitopů nebo alterovaných epitopů může zlepšit špatně navozenou imunologickou toleranci, která je typická pro všechna autoimunitní onemocnění. U spontánně diabetických myší (NOD myši) nebo krys (BB krysy) byla realizována řada studií s aplikací inzulinu nebo části jeho molekuly, proinzulinu, dekarboxylázy kyseliny glutamové (GAD), tyrozinové kinázy (IA-2a), části molekuly Heat Shock Proteinu (HSP60) a dalších [15].
Přestože je tento způsob často účinný u experimentálních zvířat, nelze závěry z těchto studií přenášet automaticky do humánní preventivní diabetologie. Lze sice nalézt mnoho paralel mezi autoimunitní inzulitidou u experimentálních 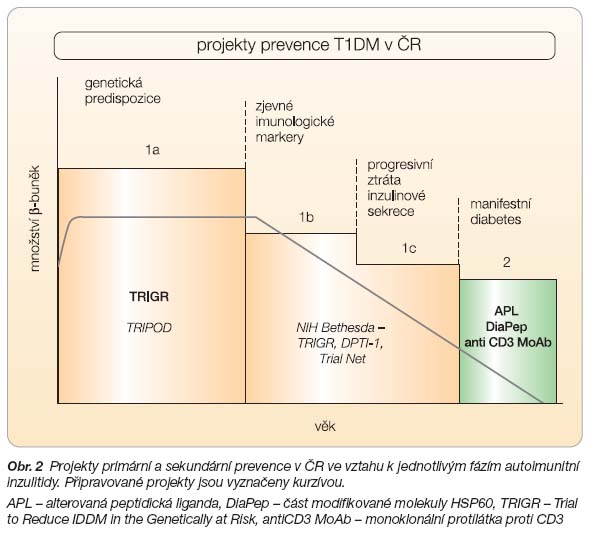 zvířat a u lidí, stejně tak ale známe řadu rozdílů. Z dosavadních provedených studií tohoto typu je zřejmé, že aplikace autoantigenů po manifestaci T1DM je u lidí málo efektivní. Eventuální využití autoantigenů před vlastní manifestací diabetu, ale i v rámci sekundární prevence onemocnění je předmětem řady klinických studií.
zvířat a u lidí, stejně tak ale známe řadu rozdílů. Z dosavadních provedených studií tohoto typu je zřejmé, že aplikace autoantigenů po manifestaci T1DM je u lidí málo efektivní. Eventuální využití autoantigenů před vlastní manifestací diabetu, ale i v rámci sekundární prevence onemocnění je předmětem řady klinických studií.
Druhý směr v primární prevenci je zaměřen na ovlivnění faktorů zevního prostředí, které mohou mít vliv na manifestaci onemocnění. Genetické faktory přinášejí zhruba polovinu rizika T1DM (více u malých dětí), druhá polovina rizika je podmíněna faktory zevního prostředí. Eliminace určitých bílkovin ze stravy experimentálních zvířat, využití probiotik, podávání vitaminu D či léčba scavengery kyslíkových radikálů může ovlivnit manifestaci autoimunitního diabetu u experimentálních zvířat. Jejich využití v humánní medicíně je opět předmětem klinického výzkumu.
Schematicky lze primární prevenci rozdělit na fáze (obr. 2):
- 1a: u pacientů s genetickým rizikem onemocnění,
- 1b: u jedinců s manifestací imunologických markerů – dnes především autoprotilátek,
- 1c: u lidí s porušenou FPIR.
Destrukce β-buněk autoimunitní inzulitidou pokračuje i po manifestaci diabetu. Alespoň parciální postiniciální remise se zachováním zbytkové sekrece β-buněk se vyskytuje asi u 1/5 až 1/3 pacientů s T1DM a může přetrvávat řadu týdnů až měsíců [16]. Remise bývá kratší u malých dětí, u chlapců, u dětí s vysokým titrem ICA a po prodělané těžké ketoacidóze [17]. Zda se může v této fázi přechodně zvýšit počet β-buněk, je předmětem recentních výzkumů. V tomto období se mohou v rámci sekundární prevence uplatnit metody intervenční, v nichž lze využít vakcinaci autoantigeny (inzulin, „heat shock“ proteiny, GAD), imunosupresivní léčbu (cyklosporin, azathioprin, methotrexát, prednison), imunostimulační či imunomodulační léčbu (BCG, nikotinamid, anti CD-3, anti CD-4, vysokodávkované intravenózní imunoglobuliny, linomid) a nebo lze snížit sekreci β-buněk, a tím i expresi některých povrchových antigenů (inzulin, diazoxid, oktreotid).
Primární prevence T1DM
Primární prevence 1a
V roce 2002 byla zahájena mezinárodní multicentrická studie TRIGR (Trial to Reduce IDDM in the Genetically at Risk) [17]. Tento projekt je financován z několika zdrojů a je koordinován americkým National Institutes of Health (NIH). Cílem projektu je objasnění vlivu hovězích bílkovin na manifestaci T1DM u novorozenců s definovaným genetickým rizikem a s výskytem autoimunitního diabetu u některého z příbuzných prvního stupně. Do této prospektivní a zaslepené studie jsou zařazeni novorozenci s rizikovými genotypy (HLA-DQB1*0302 a/nebo -DQB*02). Zařazené děti, jejichž matka, otec nebo sourozenec mají T1DM, dostávají při nedostatečném nebo nemožném kojení místo běžných kojeneckých přípravků speciální nutriční přípravek do šesti až osmi měsíců věku. Studie neomezuje kojení – pokud je dítě plně kojeno do 6 měsíců věku, dostává nutriční přípravek jako příkrm ke kojení mezi 6.–8. měsícem věku. Studie je randomizována – polovina přípravků obsahuje běžnou kojeneckou výživu na bázi kravského mléka, druhá polovina přípravek na bázi kaseinového hydrolyzátu, který plně zajišťuje veškeré nutriční potřeby novorozenců i kojenců. Po dobu intervence jsou ze stravy dětí vyloučeny také všechny potraviny obsahující bílkoviny kravského mléka [19]. V průběhu studie je sledován vliv této změny stravy na vznik autoprotilátek asociovaných s diabetem (ICA, GAD65, IA-2a a IAA) a na vlastní klinickou manifestaci diabetu.
V červenci 2006 se začala uskutečňovat II. etapa projektu, která bude ukončena v červnu 2011. Je plánována i III. etapa projektu TRIGR na léta 2011–2016. Na projektu participuje 77 diabetologických center z USA, Kanady, Austrálie a z 12 evropských zemí. Příjem dětí byl ukončen 31. 12. 2006, screening byl uskutečněn u 5156 novorozenců a randomizováno bylo 2162 dětí. V ČR bylo postupně zřízeno sedm výzkumných center: Praha, Brno, Olomouc, Zlín, Plzeň, České Budějovice a Ústí nad Labem. Screeningem prošlo 410 našich novorozenců a po stanovení genetického rizika bylo do projektu zařazeno 164 českých dětí. První výsledky probíhající studie budou zveřejněny, až nejmladší dítě zařazené do studie dosáhne věku 6 let.
Finská pilotní studie, která byla ukončena v roce 2000, prokázala, že eliminace hovězích bílkovin z potravy rizikových novorozenců do 6 (8) měsíců věku je provázena nižším výskytem antiinzulinových a anti IA-2a autoprotilátek, zatímco prevalence anti GAD65 protilátek se neliší od kontrolní skupiny. Ve věku 24 měsíců byla opakovaná pozitivita 1 až 3 protilátek prokázána ve skupině s eliminací hovězích bílkovin u 3,6 % dětí, zatímco u kontrolní skupiny byla pozitivita autoprotilátek zjištěna u 11,2 % dětí [20]. Rozdíl je statisticky významný. Abychom nabídli i dalším diabetickým rodinám možnost účasti v intervenční studii, připravili jsme v současnosti podobný projekt TRIPOD, který bude hodnotit úlohu probiotik u geneticky rizikových novorozenců v prvním stupni příbuzenství [21]. Projekt má být řešen v rámci 7. rámcového programu EU a koordinátorem bude opět Univerzita Helsinky.
Vliv faktorů zevního prostředí na manifestaci T1DM u geneticky rizikových jedinců je studován také v projektu TEDDY (The Environmental Determinants of Diabetes in the Young). V této mezinárodní multicentrické studii budou sledovány různé faktory zevního prostředí (strava, virové infekce, vakcinace, rodinné prostředí a další) u souboru více než 7000 novorozenců ze všeobecné populace a s genetickým rizikem T1DM přinášeným HLA genotypy a rovněž u souboru více než 700 novorozenců s genetickým rizikem z rodin s výskytem T1DM u některého z příbuzných prvního stupně. U sledovaných dětí budou v pravidelných intervalech vyšetřovány autoprotilátky a další imunologické parametry až do věku 15 let [22]. Studie, která se zabývá vlivem některých w-3 mastných kyselin (docosahexaenoic acid) na manifestaci T1DM u geneticky rizikových novorozenců s výskytem T1DM u některého z příbuzných prvního stupně, probíhá na řadě amerických univerzit pod názvem Nutritional Intervention to Prevent Diabetes (NIP).
Primární prevence 1b + 1c
Pokud se u dětí zařazených do studie TRIGR objeví autoprotilátky, bude jim v USA a v Kanadě nabídnuta účast v intervenční studii. Podle předběžných kalkulací z provedených pilotních studií se T1DM manifestuje asi u 5 % dětí zařazených do TRIGR. Do studie mohou vstupovat rovněž děti z projektů DPT-1 a Trial Net. Protokol projektu je v současnosti upřesňován a je projednávána účast evropských dětí v této studii [23].
Sekundární prevence T1DM
Sekundární prevence T1DM je zaměřena na prodloužení či udržení postiniciální remise. Při zachované zbytkové sekreci inzulinu je průběh diabetu stabilnější, lze dosáhnout lepší kompenzace základního onemocnění s nižší dávkou inzulinu, a lze tak snížit riziko chronických diabetických komplikací. Idea prevence T1DM je velmi stará, první důkaz o možném farmakologickém ovlivnění autoimunitní inzulitidy v humánní medicíně podali Stiller a Dupre již v roce 1983. Léčbou cyklosporinem dokázali navodit kompletní remisi u více než 40 % nově diagnostikovaných diabetických pacientů, nicméně po ukončení imunosupresivní léčby autoimunitní proces pokračoval. Postupně se v klinické praxi začaly zkoušet i další terapeutické postupy [24–26]. Z provedených klinických studií byl pozitivní efekt na prodloužení postiniciální remise prokázán při léčbě azathioprinem, kombinací azathioprin/steroidy, při léčbě cyklosporinem A, DiaPep (část modifikované molekuly HSP60), vysokodávkovanými intravenózními imunoglobuliny či linomidem (quinolin-3-carboxamid). Naopak žádný průkazný efekt nebyl zjištěn po léčbě nikotinamidem, inzulinem, methotrexátem, anti CD4 protilátkami, antioxidanty nebo po BCG vakcinaci [27].
I v České republice se uskutečnilo či v současnosti probíhá několik studií zaměřených na sekundární prevenci. Ve druhé polovině devadesátých let byl v mezinárodní multicentrické studii GETREM (Glucose Evaluation Trial for REMission in type 1 diabetes), které se zúčastnila i Česká republika a dalších 10 států, sledován vliv striktní kontroly diabetu na trvání postiniciální remise [28]. Studie potvrdila vliv kompenzace diabetu na trvání remise: kompletní remise bylo dosaženo u 11,6 % nově diagnostikovaných diabetických dětí a průměrně trvala 9,6 měsíce [29]. Rozdíly mezi jednotlivými participujícími centry však byly značné. Nicméně striktní kontrola základního onemocnění po jeho klinické manifestaci je i dnes předmětem klinického výzkumu.
V mezinárodní studii ENDIT (European Nicotinamide Diabetes Intervention Trial) byl testován protektivní efekt nikotinamidu na β-buňky při probíhající inzulitidě. V norské variantě zmíněné studie byl zhodnocen vliv HLA-DQ haplotypů a genotypů na efektivitu léčby nikotinamidem. Přestože některé pilotní studie naznačovaly příznivý efekt tohoto „zametače volných kyslíkových radikálů“ na průběh autoimunitní inzulitidy, při definitivním vyhodnocení projektu nebyl protektivní vliv nikotinamidu potvrzen. I dnes je však diskutován možný protektivní vliv preparátu v rámci primární prevence [30].
V roce 2006 byla v ČR ukončena mezinárodní, randomizovaná, zaslepená a placebem kontrolovaná studie zaměřená na sekundární prevenci T1DM (projekt NEUROCRINE). Do studie bylo zařazeno 188 pacientů s nově diagnostikovaným diabetem do 6 týdnů po diagnóze a ve věku 12–35 let z 9 států, včetně 26 českých dětí (Praha a Olomouc). Studie trvala 24 (26) měsíců a sledovala vliv aplikace tzv. alterované peptidické ligandy (APL) na průběh inzulitidy po manifestaci T1DM. APL je modifikovanou částí b-řetězce inzulinové molekuly. Epitop b-řetězce, který obsahuje 9. až 23. aminokyselinu, je hlavním sekvenčním epitopem inzulinové molekuly. Alterovaná liganda má vyměněnou 16. a 19. aminokyselinu peptidického řetězce (výměna 2 aminokyselin za alanin) a po její rekognoskaci systémem získané imunity dochází k inkompletní a aberantní aktivaci T lymfocytů. Lymfocyty aktivované APL tak neprocházejí restrikčním bodem v pozdní G0 proliferační fázi a podléhají apoptóze. V projektu byl sledován vliv APL na zbytkovou sekreci inzulinu. I když se preparát vyznačuje velmi dobrou tolerancí, nebyl prokázán statisticky významný efekt na zachování zbytkové sekrece inzulinu [31].
V současnosti pokračuje v ČR studie DEVELOGEN, která sleduje vliv 24aminokyselinového peptidu z molekuly Heat Shock Proteinu 60 (HSP60) z pozice 437–460 molekuly (DiaPep277). V této molekule jsou dvě molekuly cysteinu vyměněny za valin. Studie je zaměřena na sekundární prevenci u nově diagnostikovaných pacientů s T1DM ve věku 16–35 let a podobně jako v předchozím projektu je i v této studii sledován vliv aplikovaného peptidu na sekreci inzulinu a C-peptidu. Projektu se zúčastní 41 center z Evropy, Izraele a JAR, zařazeno bude 400 nově diagnostikovaných diabetiků, doba trvání studie je 25 měsíců. Studie začala v ČR v roce 2006. Předchozí provedené studie prokázaly signifikantní efekt alterovaného peptidu na prodloužení postiniciální remise zejména u dospívajících a dospělých pacientů s nově manifestovaným T1DM [32].
V dalších studiích je zkoumán efekt analogu glukagonu podobného peptidu 1 (exendin 4) a v evropské studii vliv vitaminu D3 (1,25 dihydrocholekalciferol).
T1DM a biologická léčba
Podobně jako v jiných oborech se i v preventivní diabetologii začíná uplatňovat biologická léčba. Humanizované či modifikované monoklonální protilátky proti cytokinovým nebo jiným receptorům, adhezním molekulám či jednotlivým lymfocytárním subpopulacím dále posouvají možnosti preventivní diabetologie. Jiným typem biologických preparátů jsou fúzní proteiny obsahující molekuly cytokinových receptorů nebo adhezních molekul a část Fc fragmentu imunoglobulinů, která zvyšuje stabilitu molekuly.
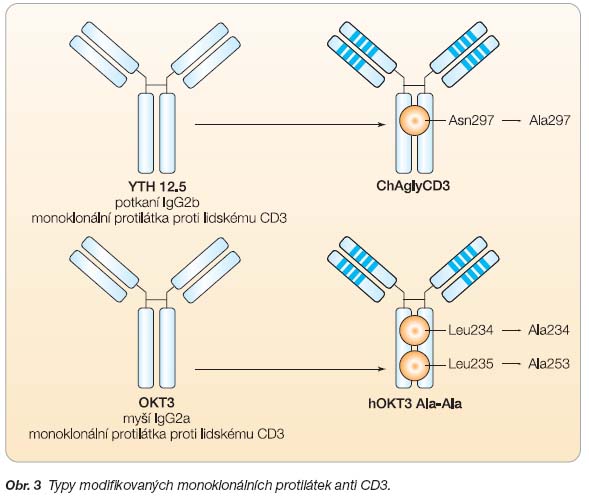 V roce 2007 začala i v ČR studie PROTÉGÉ – MacroGenics, která využívá modifikovanou monoklonální protilátku proti CD3 lymfocytům (anti CD3 MoAb, hOKT3 Ala-Ala). Tato humanizovaná myší protilátka má vyměněny 2 molekuly leucinu v Fc fragmentu IgG za alanin. Proto se velmi slabě váže na Fc receptory makrofágů a její podání není provázeno bouřlivou cytokinovou reakcí (obr. 3). Studie je zaměřena na prodloužení postiniciální remise u nově diagnostikovaných pacientů s T1DM ve věku 8–35 let do 12 týdnů po manifestaci diabetu. Pilotní studie J. Bluestonea a K. C. Herolda prokázaly, že zbytková sekrece inzulinu může zůstat zachována u nově diagnostikovaných pacientů s T1DM i několik let po ukončení jednoho terapeutického cyklu [33].
V roce 2007 začala i v ČR studie PROTÉGÉ – MacroGenics, která využívá modifikovanou monoklonální protilátku proti CD3 lymfocytům (anti CD3 MoAb, hOKT3 Ala-Ala). Tato humanizovaná myší protilátka má vyměněny 2 molekuly leucinu v Fc fragmentu IgG za alanin. Proto se velmi slabě váže na Fc receptory makrofágů a její podání není provázeno bouřlivou cytokinovou reakcí (obr. 3). Studie je zaměřena na prodloužení postiniciální remise u nově diagnostikovaných pacientů s T1DM ve věku 8–35 let do 12 týdnů po manifestaci diabetu. Pilotní studie J. Bluestonea a K. C. Herolda prokázaly, že zbytková sekrece inzulinu může zůstat zachována u nově diagnostikovaných pacientů s T1DM i několik let po ukončení jednoho terapeutického cyklu [33].
Důležitou roli v ovlivnění procesu probíhající inzulitidy hraje nejen destrukce CD3 lymfocytů, ale také indukce regulačních lymfocytů [34]. Zachovaná reziduální sekrece inzulinu umožňuje dosažení velmi dobré kompenzace základního onemocnění, snížení rizika chronických diabetických komplikací a u řady pacientů i redukci celkové denní dávky inzulinu, počtu denních injekcí i vyšetřovaných glykémií [35]. V současně probíhající studii bude za 6 měsíců terapeutický cyklus opakován ve snaze prodloužit efekt léčby.
V USA je klinický výzkum v preventivní diabetologii realizován v rámci sítí Trial Net a Immune Tolerance Network a do těchto preventivních studií jsou zapojena i některá pracoviště v Kanadě a v Evropě. V rámci sekundární prevence je například sledován vliv imunosupresivní léčby a také nových biologických preparátů na průběh autoimunitní inzulitidy.
Ve Spojených státech probíhá studie, která zkoumá vliv léčby mykofenolátem mofetilem v kombinaci s monoklonální protilátkou proti a-řetězci receptoru IL2 (anti CD25, daklizumab) na průběh postiniciální remise [36, 37]. Protože však IL2 je jedním z klíčových cytokinů pro navození imunologické tolerance vůči autoantigenům, je současně připravována studie, která bude sledovat vliv kombinované léčby sirolimem a rekombinantním IL2 na průběh autoimunitní inzulitidy. Testován je i efekt léčby monoklonální protilátkou proti CD20 (rituximab). I když nejsou autoprotilátky u T1DM cytotoxické a hlavním efektorovým systémem u inzulitidy jsou cytotoxické T lymfocyty, může se uplatnit i terapeutický účinek zaměřený na B lymfocytární řadu – podobně jako například u revmatoidní artritidy. Podobně se zkoumá vliv léčby perorálně podávaným rekombinantním interferonem a na uchování zbytkové sekrece inzulinu. Připravována je i studie s aplikací CTLA4-Ig (abatacept) nově diagnostikovaným diabetickým pacientům. Z výše uvedeného je zřejmě, že nové léčivé přípravky biologické léčby otevírají další možnosti pro preventivní a intervenční diabetologii.
Závěr
Zdokonalování současných diagnostických a terapeutických pomůcek a postupů umožňuje dosažení lepší kompenzace u stále většího počtu pacientů s T1DM, což snižuje riziko chronických diabetických komplikací. Na straně druhé však ani dlouhodobě dosažené „normální hladiny“ glykovaného hemoglobinu HbA1c nejsou zárukou prevence diabetických mikroangiopatií.
Rozhodujícími kritérii pro posouzení kompenzace jsou u autoimunitního diabetu indexy lability, jejichž užívání je však v běžné klinické praxi časově velmi náročné a interpretace závěrů pro úpravu terapie vyžaduje zkušeného specialistu s mnohaletými zkušenostmi v oboru.
Snaha o „normalizaci“ hladin HbA1c a předávkování inzulinem mohou být prvním, ale zároveň rozhodujícím krokem k navození „brittle“ diabetu, se všemi riziky, která „křehký“ diabetes přináší. Proto se úsilí v moderní preventivní diabetologii zaměřuje na další zpřesňování metod predikce autoimunitního diabetu a na hledání účinných metod prevence tohoto onemocnění. Při aplikaci výsledků klinických studií do běžné praxe je vždy nutné pečlivě zvážit přínos užitých preventivních metod a riziko vedlejších reakcí, které tyto postupy přinášejí.
Seznam použité literatury
- [1] Knip M. Současná incidence T1DM u finských dětí. Osobní sdělení 2007.
- [2] Laakso M, Pyo¨ra¨la¨ K. Age at onset and type of diabetes. Diab Care 1985; 8: 114–117.
- [3] Gilliam LK, Brooks-Worrell BM, Palmer JP, et al. Autoimmunity and clinical course in children with type 1, type 2, and type 1.5 diabetes. J Autoimmun 2005; 25: 244–250.
- [4] Palmer JP, Hampe CS, Chiu H, et al. Is latent autoimmune diabetes in adults distinct from type 1 diabetes or just type 1 diabetes at an older age? Diabetes 2005; 54 (Suppl. 2): S62–67.
- [5] Carlsson A, Sundkvist G, Groop L, et al. Insulin and glucagon secretion in patients with slowly progressing autoimmune diabetes (LADA). J Clin Endocrinol Metab 2000; 85: 76–80.
- [6] Karjalainen J, Salmela P, Ilonen J, et al. A comparison of childhood and adult type 1 diabetes mellitus. New Engl J Med 1989; 320: 881–886.
- [7] Douek IF, Gillespie KM, Bingley PJ, et al. Diabetes in the parents of children with Type 1 diabetes. Diabetologia 2002; 45: 495–501.
- [8] Gambelunghe G, Ghaderi M, Tortoioli C, et al. Two distinct MICA genes markers discriminate major autoimmune diabetes types. J Clin Endocrinol Metab 2001; 86: 3754–3760.
- [9] Achenbach P, Bonifacio E, Ziegler AG. Predicting type 1 diabetes. Curr Diab Rep 2005; 5: 98–103.
- [10] Achenbach P, Koczwara K, Knopff A, et al. Mature high-affinity immune responses to (pro)insulin anticipate the autoimmune cascade that leads to type 1 diabetes. J Clin Invest 2004; 114: 589–597.
- [11] Bottazzo GF, Bosi E, Cull CA, et al. IA-2 antibody prevalence and risk assessment of early insulin requirement in subjects presenting with type 2 diabetes. Diabetologia 2005; 48: 703–708.
- [12] Lampasona V, Bonifacio E, Achenbach P, et al. Autoantibodies to the Zinc transporter 8 COOH-terminal are highly specific for progression to type 1 diabetes. Acta Diabetol 2007; 44 (Suppl. 1): S 28.
- [13] Simell O. DIPP – (Type 1 diabetes prediction and prevention). 9th International Congress of the Imunology of Diabetes Society and American Diabetes Association, Miami Beach, 2007.
- [14] Turvey SE, Swart E, Denis MC, et al. Noninvasive imaging of pancreatic inflammation and its reversal in type 1 diabetes. J Clin Invest 2005; 115: 2454–2461.
- [15] Meier JJ, Bhushan A, Butler AE, et al. Sustained beta cell apoptosis in patients with long-standing type 1 diabetes: indirect evidence for islet regeneration? Diabetologia 2005; 48: 2221–2228.
- [16] Pozzili P, Manfrini S, Vavrinec J for CR, et al. Glucose evaluation trial for tremission in type 1 diabetes: a European multicentre study. Diabetes Res Clin Pract 2005; 68: 258–264.
- [17] Dost A, Herbst A, Kintzel K, et al. Shorter remission period in young versus older children with diabetes mellitus type 1. Exp Clin Endocrinol Diabetes 2007; 115: 33–37.
- [18] TRIGR Study Group. Study design of the Trial to Reduce IDDM in the Genetically at Risk. Pediatr Diabetes 2007; 8: 117–137.
- [19] Wilson DM, Buckingham B. Prevention of type 1a diabetes mellitus. Pediatr Diabetes 2001; 2: 17–24.
- [20] Akerblom HK, Virtanen SM, Ilonen J, et al. Dietary manipulation of beta cell autoimmunity in infants at increased risk of type 1 diabetes: a pilot study. Diabetologia 2005; 48: 829–837.
- [21] Ljungberg M, Korpela R, Ilonen J, et al. Probiotics for the prevention of beta cell autoimmunity in children at genetic risk of type 1 diabetes. Ann N Y Acad Sci 2006; 1079: 360–364.
- [22] Hagopian WA, Lernmark A, Rewers MJ, et al. TEDDY – The Environmental Determinants of Diabetes in the Young: an observational clinical trial. Ann N Y Acad Sci 2006; 1079: 320–326.
- [23] Krischer J. TRIGR IEC meeting 2007; Helsinki, Finland: 5–6.
- [24] Assan R, Feutren G, Sirmai J, et al. Plasma C-peptide levels and clinical remissions in recent-onset type 1 diabetic patients treated with cyclosporin A and insulin. Diabetes 1990; 39: 768–774.
- [25] Cook JJ, Hudson I, Harrison LC, et al. Double-blind controlled trial of azathioprine in children with newly diagnosed type I diabetes. Diabetes 1989; 38: 779–783.
- [26] Silverstein J, Maclaren N, Riley W, et al. Immunosuppression with azathioprine and prednisone in recent-onset insulin-dependent diabetes mellitus. N Engl J Med 1988; 319: 599–604.
- [27] Greenbaum C. Type 1 Diabetes Intervention Trials: What have we learned? A critical review of selected intervention trials. Clin Immunol 2002; 104: 97–104.
- [28] Browne PD, Lampeter E, Vavrinec J, et al. The GETREM Study: New preliminary findings for the clinical remission in IDDM using logistic regression. Diabetologia 1997; 40 (Suppl. 1): 1311.
- [29] Browne PD, Amodeo BM, Vavrinec J, et al. A multicenter European study for the evaluation of spontaneous clinical remission in IDDM. Diabetologia 1995; 38 (Suppl. 1): 100.
- [30] Gale EA, Bingley PJ, Emmett CL, et al. European Nicotinamide Diabetes intervention Trial (ENDIT): a randomised controlled trial of intervention before the onset of type 1 diabetes. Lancet 2004; 363: 925–931.
- [31] Harteman-Heurtier A, Mars LT, Bercovici N, et al. An altered self-peptide with superagonist activity blocks a CD8-mediated mouse model of type 1 diabetes. J Immunol 2004; 172: 915–922.
- [32] Raz I, Avion A, Tamir M, et al. Treatment of new-onset type 1 diabetes with peptide DiaPep 277 is safe and associations with preserved beta-cell function. Diabetes Metabolism Research and Reviews 2006; 23: 292–298.
- [33] Herold KC, Hagopian W, Auger JA, et al. Anti-CD3 monoclonal antibody in new-onset type 1 diabetes mellitus. N Engl J Med 2002; 346: 1692–1698.
- [34] Bisikirska B, Colgan J, Luban J, et al. TCR stimulation with modified anti-CD3 mAb expands CD8 T cell population and induces CD8CD25 Tregs. J Clin Invest 2005; 115: 2904–2913.
- [35] Herold KC, Gitelman SE, Mashrani U, et al. A single course of anti-CD3 monoclonal antibody in improvement in C-peptide response and clinical parameters fo at lest 2 years after onset of type 1 diabetes. Diabetes 2005; 54: 1763–1769.
- [36] Chase PH, Gottlieb P, Eisenbarth GS. Clinical trials for the prevention of Type I diabetes. In: Type I Diabetes: Molecular, Cellular, and Clinical Immunology, Capter 12. Online Edition, Version 2.5. http://www.uchsc.edu/misc/diabetes/.
- [37] Karounos DG. Prevention of diabetes Type 1 and Type 2. In: Diabetes and Carbohydrate Metabolism. Chapter 41. http: //www.endotext.org/diabetes/.