Rotaviry jsou nejčastějšími původci těžkých abakteriálních gastroenteritid u dětí na celém světě bez ohledu na socioekonomickou úroveň země [1]. Jejich výskyt je srovnatelný v rozvojových i vyspělých zemích, avšak následky onemocnění jsou mnohem závažnější v méně rozvinutých zemích, kde je počet úmrtí odhadován na 440 000 ročně [2]. V rozvinutých zemích je počet úmrtí mnohem nižší, v Evropě se pohybuje kolem 230 ročně, v České republice pak dochází k úmrtí jen ojediněle u dětí v kojeneckém věku či mezi seniory. V rozvinutých zemích představují rotavirové infekce i ekonomický problém pro své vysoké přímé i nepřímé náklady [3]. Počet onemocnění je ve světě odhadován ročně na 111 milionů případů, v Evropě pak asi na 3,6 milionu [2].
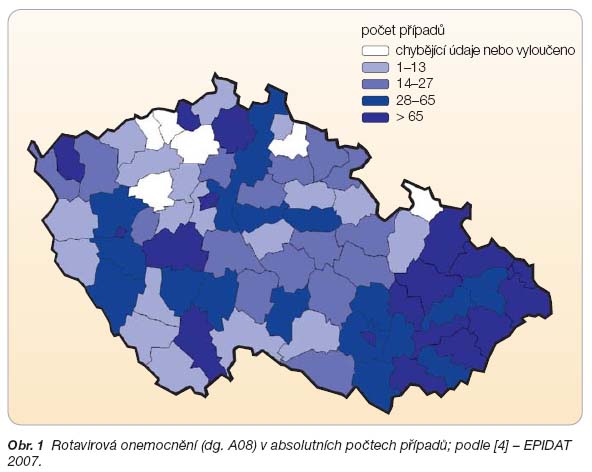
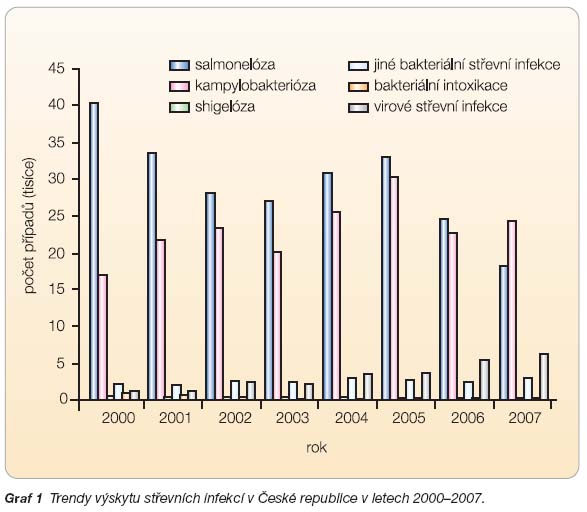
V České republice je výskyt rovněž vysoký, i když oficiální data hovoří poněkud jinak. Dle systému EPIDAT sledujícího u nás výskyt infekčních onemocnění bylo v roce 2007 hlášeno 3485 rotavirových infekcí [4]. Jejich diagnostika je však zejména v terénu nedostatečná a v jejich záchytu existují i výrazné rozdíly mezi jednotlivými kraji (obr. 1). Přes pozvolna se zvyšující počet virových střevních infekcí v posledních letech v databázi EPIDAT stále výrazně převažují bakteriální infekce (graf 1).
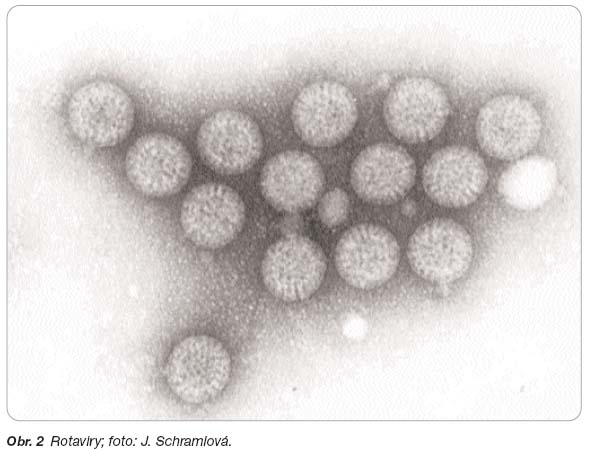
Rotaviry (čeleď Reoviridae) jsou kulaté viry o velikosti 70 nm připomínající kolo (obr. 2). Vyskytují se u lidí i u zvířat, ale zvířecí kmeny jsou zřejmě u lidí vzácné. Ze šesti známých skupin A–E je zdaleka nejčastější skupina A, která vyvolává ve světě nejvíce případů onemocnění. Skupina B je častější v jihovýchodní Asii, kde byla v minulosti původcem epidemií u dospělých v Číně, v současné době pak v Indii a Bangladéši [5]. Rotaviry ze skupiny C vyvolávají spíše sporadická onemocnění. K podrobnějšímu určení rotavirů se užívá dělení dle sérotypů G (glykoprotein G) a genotypů P (proteáza – senzitivní protein P). V současné době je známo celkem 15 sérotypů G a 23 genotypů P. Čtyři sérotypy mají celosvětový výskyt (G1–G4), dalším globálním sérotypem by mohl být sérotyp G9, jehož výskyt výrazně stoupá v různých regionech [6]. Z genotypů je nejběžnější P1A.
Rotaviry jsou invazivní patogeny a působí více mechanismy. Vedle nedostatku disacharidáz vedoucího k malabsorpci laktózy a k následujícímu osmotickému průjmu se zřejmě uplatňuje i produkce enterotoxinu a indukce sekrece tekutin a elektrolytů ve střevě aktivací nervového systému ve střevní stěně. Rotaviry se vylučují stolicí, délka vylučování se může pohybovat mezi 4–57 dny, ale dlouhodobé vylučování je typické spíše pro imunodeficitní pacienty [7]. Rotaviry jsou vysoce kontagiózní, k nákaze stačí jen 10 virových částic, zatímco počet rotavirů v 1 g stolice se udává až 1012 [1]. Vzhledem ke snadnému přenosu jsou rotaviry známými a obávanými nozokomiálními patogeny [8].
K přenosu dochází hlavně fekalorální cestou, přímým kontaktem mezi dětmi, kontaminovanými hračkami, předměty, méně často vodou a potravinami, udává se i přenos vzdušnou cestou [1]. Rotaviry vyvolávají časté menší epidemie v kolektivech dětí a v rodinách, velké epidemie jsou vzácné. Rotavirovou infekci prodělá alespoň jednou prakticky každé dítě do 5 let, nejpostiženějšími věkovými skupinami jsou kojenci a batolata mezi 6–23 měsíci [9]. Onemocnět však mohou lidé v každém věku, často se jedná o rodiče pečující o děti s rotavirovou infekcí či o seniory. Na rozdíl od tropů a subtropů, kde se vyskytují celoročně, mají rotaviry v oblastech mírného pásma typickou sezónnost v chladných měsících roku s maximem mezi únorem až dubnem [10].
Typickým klinickým obrazem je febrilní gastroenteritida s vysokými horečkami, zvracením a vodnatým průjmem, ale vzácností nejsou ani onemocnění s horečkou a zvracením bez průjmu či asymptomatický průběh. Onemocnění bývá někdy provázeno respiračními příznaky, z komplikací se objevují febrilní křeče, křeče na podkladě toxiinfekční encefalopatie či meningoencefalitida [11–13]. Téměř uniformním nálezem je parainfekční hepatopatie projevující se mírnou elevací transamináz.
Vzhledem k tomu, že neexistuje specifická léčba, je rozhodující prevence. Rotaviry jsou poměrně rezistentní vůči běžným dezinfekčním prostředkům, na rukou vydrží několik hodin, na pevných površích až několik dnů. V nemocnicích je proto nutná pečlivá dezinfekce a opakované mytí rukou u ošetřujícího personálu i matek doprovázejících děti. Izolace dětí s rotavirovou gastroenteritidou na samostatném pokoji není sice striktně nařizována, ale dle našich zkušeností je výhodnější, protože při kontaktu mezi dětmi dochází k častým nozokomiálním infekcím. I při dodržování těchto preventivních opatření se však vždy nevyvarujeme vzniku rotavirových onemocnění.
Po dlouhých letech vývoje a zkoušení očkovacích látek se rotavirové infekce konečně staly preventabilním onemocněním. Vývoj vakcín byl zahájen již v 70. letech 20. století a byla vyvinuta celá řada vakcín, které byly klinicky zkoušeny. K jejich přípravě byly použity nejdříve živé atenuované zvířecí rotaviry, pak reassortantní rotaviry zvířecí/lidské a konečně i atenuované lidské rotaviry. Zvířecí kmeny rotavirů sice vykazují zkříženou protekci s lidskými rotaviry, ale monovakcíny z nich připravené (bovinní z kmene RIT 4237 a WC3 a opičí RRV) se v praxi neosvědčily. Byly zkoušeny v řadě zemí, ale jejich účinnost byla nevyrovnaná, a proto byly opuštěny. Ani první monovalentní či bivalentní vakcíny na podkladě kombinovaných zvířecích a lidských rotavirů (opičí kmeny RRV či bovinní WC3 s hlavními lidskými sérotypy) neměly úspěch.
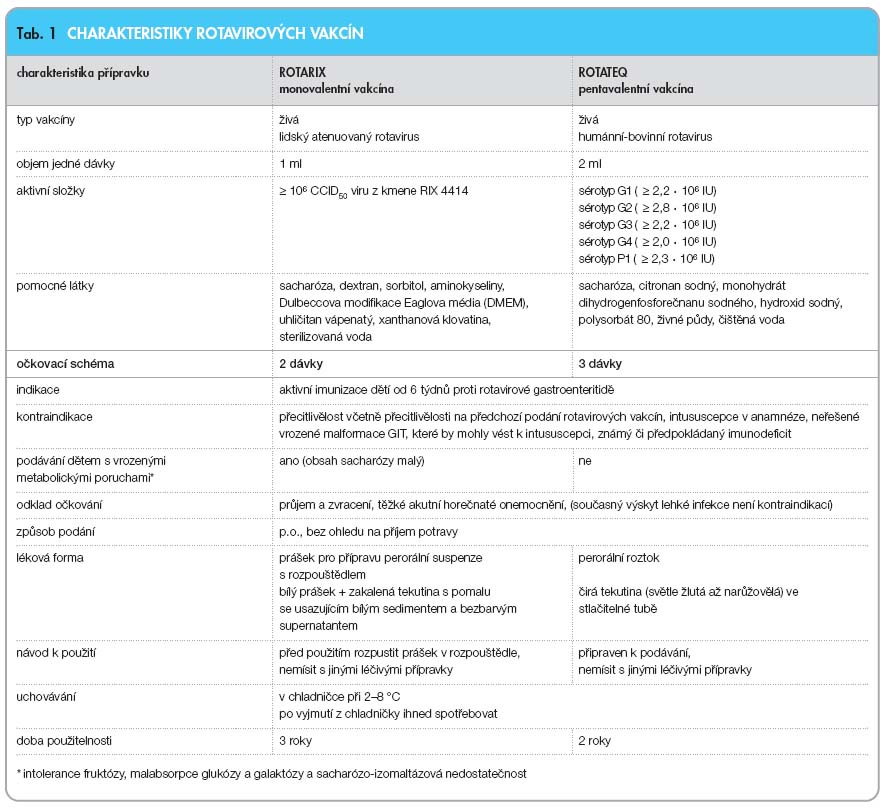
Nejnadějněji se jevila tetravalentní vakcína RRV-TV připravená kombinací opičího rhesus-rotaviru G3 a lidských sérotypů G1, G2 a G4 [14]. Tato vakcína byla schválena v roce 1998 v USA pod názvem Rotashield a doporučena k plošnému podávání. Již v roce 1999 však byla stažena z trhu pro výskyt intususcepcí*, které byly spojovány s vakcínou. Vývoj pokračoval přípravou dalších očkovacích látek, z nichž jako nejvhodnější se ukázaly dvě – monovalentní vakcína připravená z lidského rotaviru 89-12 a pentavalentní vakcína připravená z reassortantního kmene na bázi lidských kmenů (W179, W178, SC2, BrB) a bovinního kmene WC3. Obě tyto vakcíny jsou nyní komerčně vyráběny a jsou dostupné na trhu, jejich charakteristiky shrnuje tab. 1. V roce 2006 byly schváleny pro použití v Evropské unii, v květnu 2007 na kongresu ESPID v Portu pak bylo doporučeno dvěma pediatrickými evropskými společnostmi (ESPID a ESPHGAN) jejich plošné použití v EU [15]. V současné době již probíhá plošná vakcinace v Rakousku, Belgii, Lucembursku, připravuje se v Německu a dalších zemích. Plošně očkovány proti rotavirům jsou i děti v USA a v Austrálii. V České republice jsou zatím obě vakcíny dostupné při zájmu rodičů za úhradu.
Monovalentní vakcína
K přípravě monovalentní vakcíny byl použit lidský atenuovaný rotavirus typu G1P1A z kmene RIX 4414, vzniklý pasážováním na Vero buňkách z původního kmene 89-12 [16]. Tato vakcína je určena k aktivní imunizaci dětí ve věku od 6 týdnů proti rotavirové gastroenteritidě způsobené sérotypy G1P[8], G2P[4], G3P[8], G4P[8], G9P[8].
Vakcinační kmen se replikuje ve střevě a je vylučován do střeva s vrcholem kolem 7. dne po očkování [16]. Při detekci metodou ELISA byly rotavirové částice nalezeny ve stolici po podání první dávky v 50 % případů a po podání druhé dávky ve 4 % případů. Pokud však byly stolice testovány přímo na přítomnost vakcinačního kmene, pak byly pozitivní jen v 17 %. Byly pozorovány i případy přenosu viru na negativní kontakty, ale bez rozvoje klinických příznaků onemocnění. Opatrnosti je proto třeba při vakcinaci dětí, které jsou v rodině v úzkém kontaktu s imunokompromitovanými osobami či s osobami léčenými imunosupresivní terapií [17]. Při kontaktu s očkovaným dítětem je třeba dodržovat osobní hygienu, zejména při výměně plen. O podávání monovalentní rotavirové vakcíny u nedonošených dětí jsou jen omezené informace. Vakcínu u nich lze podávat, ale někdy může vyvolat nižší imunitní odpověď. Monovalentní vakcína může být podávána současně s dalšími pediatrickými monovalentními či kombinovanými vakcínami, např. s hexavalentní vakcínou (DTPa-HBV-IPV/Hib), s trivakcínami proti záškrtu, tetanu a černému kašli (s celobuněčnou i acelulární složkou proti černému kašli – DTPw, DTPa), s Hib, s inaktivovanou vakcínou proti poliomyelitidě, hepatitidě typu B, dále může být podávána s pneumokokovou konjugovanou vakcínou a s vakcínou proti meningokokům typu C [17]. Podle klinických studií není imunitní odpověď ani jejich bezpečnost současným podáním ovlivněna. Společné podání monovalentní rotavirové vakcíny s živou vakcínou proti poliomyelitidě nemění účinek poliovakcíny, ale může dojít k lehkému snížení imunitní odpovědi u rotavirové vakcíny. Účinek proti těžké rotavirové gastroenteritidě však není ovlivněn. Při podání obou vakcín v rozmezí 14 dnů nedochází ke změně účinku ani u jedné z nich. Monovalentní rotavirová vakcína není určena k podávání starším dětem či dospělým. Ochrana proti rotavirové gastroenteritidě vyvolaná očkováním touto vakcínou není snižována kojením. Imunogenita a bezpečnost vakcíny byla nejprve testována u dospělých v Belgii, u batolat v Německu a konečně u kojenců ve Finsku [16].
Účinnost
Účinnost monovalentní vakcíny proti těžké a proti jakékoli rotavirové gastroenteritidě byla hodnocena v klinických studiích probíhajících v Evropě a v Latinské Americe. Ve Finsku byla vakcína podávána ve dvou dávkách ve 2 a 4 měsících věku, účinnost proti těžké rotavirové gastroenteritidě byla v první rotavirové sezoně 90 %, proti jakékoli gastroenteritidě 73 % [16]. Tíže gastroenteritidy byla definována podle Vesikariho 20bodové škály, která hodnotí klinický obraz onemocnění (horečka, zvracení, průjem) a potřebu léčby. Od roku 2004 pak probíhala další studie zaměřená na účinnost vakcíny v 6 evropských zemích (Česká republika, Finsko, Francie, Německo, Itálie, Španělsko). Byly podávány dvě dávky monovalentní rotavirové vakcíny 2646 dětem ve věku 2–3 měsíce a 4–5 měsíců. Účinnost proti závažným rotavirovým infekcím byla 96 % a proti rotavirové gastroenteritidě vyžadující hospitalizaci pak 100 %. V klinických studiích v Latinské Americe (Mexiko, Venezuela, Brazílie) bylo hodnoceno více než 20 000 dětí v prvním a ve druhém roce po očkování, gastroenteritida byla definována podle kritérií WHO. V prvním roce byla účinnost proti těžké rotavirové gastroenteritidě 84,7 %, ve druhém roce pak 79 % [16]. Imunologický mechanismus, kterým působí monovalentní rotavirová vakcína proti rotavirové gastroenteritidě, není ještě úplné znám. Titry sérových protilátek IgA (≥≥ 20 U/ml) proti rotavirům 2–5 měsíců po aplikaci 2. dávky byly zjištěny v Evropě u 82,8–94 % osob a v Latinské Americe u 77,9 % osob [17].
Očkovací schéma
Očkovací schéma sestává ze dvou dávek. První se podává od 6. týdne, druhá pak v intervalu nejméně čtyř týdnů. Obě dávky by měly být podány nejlépe do 16 týdnů, nejpozději pak do 24 týdnů a očkování by mělo být provedeno vždy stejnou vakcínou. V případě ublinknutí či zvracení celé dávky během očkování by mohla být podána další ve stejný den.
Nežádoucí účinky
Nežádoucí účinky byly hodnoceny v 11 klinických studiích, které byly prováděny v Evropě a Latinské Americe. Studie byly randomizované, dvojitě zaslepené a kontrolované placebem. Dvě klinické studie probíhaly ve Finsku, kde byla vakcína podávána samostatně. Výskyt horečky, zvracení, průjmu a nechutenství se nelišil od skupiny s placebem; výskyt a závažnost byly vyšší po aplikaci druhé dávky. V dalších 9 studiích (Evropa, USA, Kanada, Singapur, Latinská Amerika, Jižní Afrika) byla monovalentní rotavirová vakcína podávána současně s dalšími pediatrickými vakcínami. Také zde byly vedlejší reakce stejné jako u skupiny s placebem či po očkování pediatrickými vakcínami. Velmi časté bylo nechutenství, podrážděnost, běžné byly průjem, zvracení, plynatost, bolesti břicha, zvracení, méně časté pláč, poruchy spánku, somnolence, zácpa. Vzácně se vyskytly infekce horních cest dýchacích, rýma, chrapot, dermatitida, rash a svalové křeče [17]. Riziko intususcepce bylo hodnoceno velkou bezpečnostní studií prováděnou ve Finsku (2060 dětí) a v 11 zemích Latinské Ameriky (Argentina, Brazílie, Chile, Kolumbie, Dominikánská republika, Honduras, Mexiko, Nikaragua, Panama, Peru, Venezuela), kde bylo zapojeno 63 225 dětí. Zvýšené riziko výskytu intususcepcí ve srovnání s placebem nebylo zjištěno. Do 31 dnů po první dávce se vyskytl jeden případ u očkovaných dětí a dva případy ve skupině s placebem, po aplikaci druhé dávky bylo zaznamenáno po pěti případech v každé skupině.
Pentavalentní vakcína
K přípravě živé pentavalentní vakcíny byly použity humánní-bovinní rotavirové reassortanty na základě bovinního kmene WC3 a lidského kmene P1A, které byly vyrobeny na Vero buňkách [18]. Vakcína je určena k aktivní imunizaci kojenců ve věku od 6 týdnů proti rotavirové gastroenteritidě způsobené sérotypy G1P1[8], G2P[4], G3P1[8], G4P1[8] a G9P1[8]. Případný rozsah ochrany proti dalším sérotypům není znám.
Vakcína se vylučovala stolicí jen u 8,9 % očkovaných s vrcholem kolem 7. dne [16]. Jen jedenkrát byly rotaviry zachyceny ve stolici po třetí dávce. Nelze proto zcela vyloučit přenos na séronegativní jedince a je třeba opatrnosti při očkování dětí, které jsou v rodině v kontaktu s imunodeficitními osobami či s osobami léčenými imunosupresivy [18]. Pentavalentní rotavirovou vakcínu lze podávat nedonošencům. Ve studii zahrnující 2066 nedonošenců ve věku 25.–36. gestačního týdne došlo k poklesu hospitalizací a návštěv pohotovosti o 100 % ve srovnání s placebem, výskyt jakékoli rotavirové gastronteritidy se snížil o 73 % [19]. Závažné nežádoucí účinky se objevily častěji u dětí s placebem (5,8 % vs. 5,5 %). K dispozici nejsou žádné údaje o použití vakcíny k profylaktickému podání po kontaktu s rotavirovou infekcí. Délka ochrany v období po druhé rotavirové sezoně již nebyla hodnocena.
Podobně jako monovalentní rotavirovou vakcínu je možné podávat i pentavalentní vakcínu společně s dalšími monovalentními či kombinovanými vakcínami. Při společném podání nedošlo k ovlivnění imunitních odpovědí ani bezpečnosti podávaných vakcín. Pentavalentní rotavirovou vakcínu je možné podávat společně s hexavakcínou (DTPa-HBV-IPV/Hib), s trivakcínou proti záškrtu, tetanu a černému kašli s acelulární složkou (DTPa), s vakcínou proti hemofilu skupiny b (Hib), společně s oběma typy vakcín proti poliomyelitidě (IPV, OPV), s vakcínou proti hepatitidě B (HBV) a spolu s konjugovanou pneumokokovou vakcínou [18]. Současné podání s OPV neovlivňuje imunitní odpověď na polioviry, ale může lehce snižovat odpověď na rotaviry. Pokud je OPV podána 2 týdny po aplikaci pentavalentní rotavirové vakcíny, odpověď není ovlivněna.
Účinnost
Účinnost vakcíny byla posuzována nejprve ve Finsku u 1946 dětí ve studii kontrolované placebem. Vakcína byla dobře tolerovaná a účinnost proti těžké rotavirové gastroenteritidě byla 100 %, proti jakékoli rotavirové gastroenteritidě 74 %. Dále byla hodnocena účinnost pentavalentní vakcíny ve velké, placebem kontrolované studii REST (Rotavirus Efficacy and Safety Trial), které se zúčastnilo více než 70 000 dětí v 11 zemích 3 kontinentů. Z toho bylo 5 evropských zemí (Finsko, Švédsko, Německo, Belgie, Itálie). Účinnost proti závažné rotavirové gastroenteritidě v první rotavirové sezoně po očkování byla 98 %, proti jakékoli gastroenteritidě 73,4 %, ve druhé sezoně pak 88 % vs. 62,6 % [20]. V uvedených evropských zemích došlo k poklesu počtu hospitalizací o 95 %, počet vyšetření lékařem byl nižší o 87 % a počet absencí rodičů v zaměstnání byl nižší až o 86 %.
Očkovací schéma
Očkovací schéma sestává ze tří dávek. První dávku je nutné podat mezi 6.–12. týdnem života, mezi dalšími dávkami musí být interval alespoň 4 týdny. Ideální je podání všech tří dávek do věku 20–22 týdnů, nejpozději pak do věku 26 týdnů. Při očkování není možné zaměnit některou dávku jinou vakcínou. Pokud dítě při očkování dávku vyplivne či vyzvrátí, může dostat při téže návštěvě ještě jednu náhradní dávku, ale ne více.
Nežádoucí účinky
Nežádoucí účinky byly hodnoceny u podskupiny kojenců ze tří studií kontrolovaných placebem, kterých se zúčastnilo celkem 11 690 dětí. Hodnocení probíhalo v době 42 dnů po očkování. Nežádoucí účinky se vyskytly u 47 % kojenců dostávajících pentavalentní vakcínu a u 45,8 kojenců dostávajících placebo [18]. Nejčastěji se objevila horečka (20,9 %), průjem (17,6 %) a zvracení (10,1 %). Z dalších nežádoucích účinků se objevily často infekce dýchacích cest, méně často nazofaryngitida, bolesti břicha a exantém. Rozdíl incidencí těchto příznaků mezi dětmi, které obdržely pentavalentní vakcínu či placebo, se pohyboval mezi 0,2–2,5 %. U všech účastníků studie, tj. více než 70 000 dětí, pak byly hodnoceny závažné vedlejší reakce (otitis media, bronchospasmus aj.). Celkový výskyt dosáhl 0,1 % u příjemců pentavalentní vakcíny a 0,2 % u příjemců placeba [18]. Riziko intususcepce bylo posuzováno ve studii kontrolované placebem. Ve 42denních obdobích po každé dávce se vyskytlo 6 případů intususcepce ve skupině 34 837 dětí s pentavalentní vakcínou a 5 případů mezi 34 788 příjemci placeba.
Doporučení České vakcinologické společnosti
Vzhledem k BCG vakcinaci novorozenců v České republice doporučuje Česká vakcinologická společnost podat první dávku rotavirových vakcín od 9. týdne života, další dávky pak nejméně v měsíčním intervalu společně s hexavakcínou. Očekává se i brzké kladné vyjádření dalších odborných lékařských společností. Ne zcela zhojená chránička po BCG vakcinaci není kontraindikací očkování, ale závažnější reakce ano. I když v současné době není v České republice zavedena plošná vakcinace proti rotavirům, lze v budoucnu očekávat diskusi na toto téma. Očkování by jistě bylo vhodné, neboť by určitě došlo k poklesu počtu onemocnění, hospitalizací, návštěv lékaře i k poklesu nepřímých nákladů spojených zejména s absencí rodičů v zaměstnání.
* Intususcepce – vchlípení jedné části střeva do části následující. Náhlá příhoda břišní, ke které dochází nejčastěji u malých dětí. Projevuje se silnou kolikovitou bolestí, neklidem dítěte, krvavou stolicí připomínající malinové želé. Bez léčby stav vyústí v gangrénu části střeva a životu nebezpečnou peritonitidu.



