Primární a sekundární prevence mikroalbuminurie u pacientů s diabetem 2. typu
Patogeneze diabetické nefropatie je multifaktoriální proces a je nepochybné, že aktivace renin-angiotenzinového systému v ní hraje jednu z nejdůležitějších rolí. Stupeň mikroalbuminurie, resp. proteinurie, je úzce spjat nejen s progresí diabetické nefropatie, ale i s výskytem kardiovaskulárních příhod. Je zřejmé, že snížení mikroalbuminurie je spojeno nejen se zpomalením poklesu glomerulární filtrace, ale i se zlepšením kardiovaskulární prognózy pacientů s diabetickou nefropatií a arteriální hypertenzí. Vyhlídky diabetiků s mikroalbuminurií se během posledních dvou dekád značně zlepšily, nepochybně i díky časnému agresivnímu snižování krevního tlaku, blokádě renin-angiotenzinového systému a těsné kontrole glykemie. Stále je však zapotřebí zdokonalovat strategii prevence diabetické nefropatie a její progrese do chronického selhání ledvin.
Úvod
Mikroalbuminurie (MAU) je definována jako exkrece albuminu v množství 20–200 mg/min (tj. 30–300 mg/24 hod.). Fyziologicky je albumin v malém množství filtrován do primární moče, avšak většina je resorbována zpět v proximálním tubulu. Možnost resorpce je saturována již při fyziologických 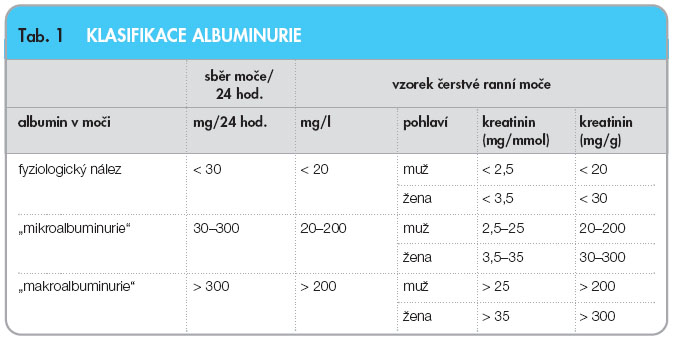 podmínkách a při hyperfiltraci je tento resorpční proces přetížen s následným zvýšením vylučování albuminu do moče – vzniká tzv. mikroalbuminurie. Zavedený pojem MAU však není z hlediska biochemického správný, protože se nejedná o nález „mikroalbuminu“ v moči, ale o průkaz velmi nízké koncentrace albuminu. Albumin se fyziologicky vylučuje v množství 15–25 mg/24 hod. Klasifikace albuminurie je uvedena v tab. 1.
podmínkách a při hyperfiltraci je tento resorpční proces přetížen s následným zvýšením vylučování albuminu do moče – vzniká tzv. mikroalbuminurie. Zavedený pojem MAU však není z hlediska biochemického správný, protože se nejedná o nález „mikroalbuminu“ v moči, ale o průkaz velmi nízké koncentrace albuminu. Albumin se fyziologicky vylučuje v množství 15–25 mg/24 hod. Klasifikace albuminurie je uvedena v tab. 1.
Ke kvantitativnímu stanovení albuminu se používají imunochemické metody (imunoturbidimetrie, imunonefelometrie, RIA a další). Běžné diagnostické proužky nebo chemická reakce s kyselinou sulfosalicylovou prokazují bílkovinu ve vzorku až od koncentrací 150 mg/24 hod. V poslední době se jako spolehlivější vyšetření doporučuje stanovení poměru koncentrace albumin/kreatinin v prvním ranním vzorku moče. Tento způsob vyšetření má však následující tři limitace:
-
Není jasné, jaký je nejvhodnější čas odběru moče. Nejrozsáhlejší studie, které byly provedeny počátkem 80. let, prokázaly nejlepší korelaci při ranním odběru ve srovnání s odběrem večerním [1]. Na druhou stranu později provedené studie zjistily nejlepší korelaci při ranním odběru moče, ačkoli rozdíly oproti vzorkům při okamžitém odběru v rozdílném čase během dne nebyly signifikantní [2];
-
Další problémy může způsobit tranzientní zvýšení exkrece albuminu [3], proto by např. pacient neměl mít 24 hodin před odběrem zvýšenou fyzickou námahu;
-
Výpovědní hodnota laboratorního měření může být ovlivněna i problémy vyplývajícími z vlastní močové exkrece kreatininu – např. exkrece albuminu může být podceněna u muskulaturního typu pacienta ve srovnání s jejím přeceněním u kachektického pacienta s menším relativním objemem svalové hmoty, a tudíž i močové exkrece kreatininu. Podobné problémy mohou vzniknout i při srovnání různých etnických skupin obyvatelstva, např. běloši versus černoši [4].
Nález zvýšené koncentrace albuminu v moči je projevem postižení cévní stěny v organismu a signalizuje hrozící postižení ledvin nejen u diabetiků, ale též u pacientů s hypertenzí. Stanovení albuminu ve sbírané moči je časným a ideálním parametrem pro diagnostiku počínající diabetické nefropatie (DN) a pro sledování jejího průběhu (tab. 2). Pro diagnostiku incipientní fáze DN je 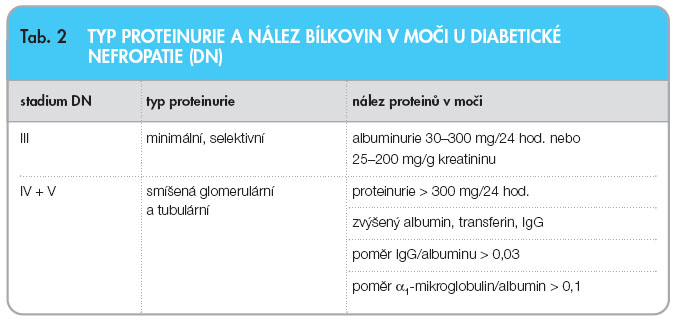 typický průkaz MAU alespoň ve dvou ze tří opakovaných měření v průběhu 6 měsíců. Pro screening MAU se doporučuje její vyšetření u diabetiků 1. typu v době diagnózy diabetu mellitu (DM) v pubertě, jinak dále v 5. roce trvání DM; při negativním nálezu další kontroly MAU 1krát ročně, v případě pozitivity kontroly každé 3 měsíce. U pacientů s DM 2. typu je vhodné provést vyšetření MAU vždy při zjištění diagnózy DM a dále 1krát ročně při negativním nálezu.
typický průkaz MAU alespoň ve dvou ze tří opakovaných měření v průběhu 6 měsíců. Pro screening MAU se doporučuje její vyšetření u diabetiků 1. typu v době diagnózy diabetu mellitu (DM) v pubertě, jinak dále v 5. roce trvání DM; při negativním nálezu další kontroly MAU 1krát ročně, v případě pozitivity kontroly každé 3 měsíce. U pacientů s DM 2. typu je vhodné provést vyšetření MAU vždy při zjištění diagnózy DM a dále 1krát ročně při negativním nálezu.
MAU je nezávislým rizikovým faktorem vzniku kardiovaskulárních chorob a významným časným markerem morbidity a mortality u diabetiků a hypertoniků. Nález MAU bývá často spojen s již přítomnou dyslipidemií a retinopatií. Důležitý je opakovaný průkaz, protože řada stavů může vést k náhodně zjištěné MAU. Při nálezu MAU musíme tedy zvážit, zda se jedná o stav způsobený DM, nebo jinými příčinami, nejčastěji při infekci močových cest nebo při gynekologickém fluoru. Albumin v moči však bývá zvýšen téměř u každé proteinurie, tj. u většiny glomerulopatií.
MAU, ale i proteinurie (nesprávně nazývaná „makroalbuminurie“) jsou důležitými markery jak pro časnou diagnostiku DN, tak i pro monitoraci jejích pokročilých fází. Pacienti s DM jsou vystaveni přibližně 20–50% riziku vývoje chronického selhání ledvin (CHRS) vyžadujícímu náhradu renální funkce dialýzou či transplantací. Primárním cílem léčby pacientů s DM 1. typu je tudíž prevence nebo oddálení mikrovaskulárních komplikací, tedy diabetické retinopatie a DN. Na rozdíl od diabetiků 2. typu lze pozorovat výrazné snížení prevalence DN u pacientů s DM 1. typu v průběhu posledních dvou dekád, což je nepochybně důsledkem intenzivnější léčby hyperglykemie, arteriální hypertenze a hyperlipoproteinemie.
Primární prevence vzniku mikroalbuminurie u diabetické nefropatie
V primární prevenci vzniku MAU se uplatňuje především kompenzace DM (kontrola glykemie) a léčba blokátory renin-angiotenzinového systému (RAS).
Kontrola glykemie
U pacientů s DM 2. typu je nedostatečná kompenzace diabetu spjata jak s rizikem vzniku MAU, tak s progresí MAU do proteinurie. Proto je vhodná těsná kontrola glykemie, jak bylo prokázáno i v několika studiích (zejména UKPDS a ADVANCE), jejichž výsledky potvrdily účinnost tohoto léčebného postupu [5–7]. Ve studii UKPDS (United Kingdom Prospective Diabetes Study) autoři sledovali efekt těsné kontroly glykemie u 3867 pacientů s čerstvým záchytem DM 2. typu [7], rozdělených do skupiny s intenzivní versus s konvenční léčbou a sledovaných po 10 let. Při vstupu do studie mělo 6,5 % pacientů MAU a 0,7 % proteinurii. Intenzivní léčba inzulinem byla sdružena se signifikantně nižším rozvojem MAU (19,2 % vs. 25,4 %, RR 0,76, IS: 0,62–0,91). Podobně pozitivní efekt byl zaznamenán i ve studii ADVANCE [5] zahrnující 11 140 pacientů s DM 2. typu, kteří byli randomizováni do skupiny intenzivní či standardní léčby. Po 5letém mediánu sledování byla intenzivní léčba sdružena s malou, ale signifikantní redukcí MAU (23,7 % vs. 25,7 %, RR snížení o 9 %).
Léčba blokátory RAS
V průběhu posledních dvou dekád byla provedena řada studií, které prokázaly účinnost léčby nejen blokátory či inhibitory RAS, ale i jinými léky v primární prevenci vzniku MAU u pacientů s DM 2. typu. Přesto použití inhibitorů angiotenzin konvertujícího enzymu (ACEI) a blokátorů receptorů 1. typu pro angiotenzin II (ARB) je dominující. U normotenzních pacientů byl ve studii ABCD (Appropriate Blood pressure Control in Diabetes) pozorován signifikantně nižší vznik MAU u pacientů léčených enalaprilem ve srovnání s placebem [8] a u pacientů léčených nisoldipinem ve srovnání s placebem [9], přičemž míra progrese do MAU byla u obou léčiv srovnatelná.
Podle některých hypotéz se předpokládá, že léčba antihypertenzivy, a zejména léčba blokátory/inhibitory RAS, by mimo svůj hlavní efekt, tedy kontrolu krevního tlaku (TK), měla vést k dalším pozitivním účinkům na diabetické mikrovaskulární komplikace, nezávislým na absolutním snížení TK [10]. Ve studii DIRECT (DIabetic REtinopathy Candesartan Trial) bylo celkem 5231 pacientů s DM 1. i 2. typu randomizováno k léčbě placebem, či kandesartanem (patřícím do skupiny ARB) v dávce 32 mg denně. Pacienti, v době zařazení všichni s normální MAU, normotenzní či s farmakologicky kontrolovanou hypertenzí lehkého stupně, byli sledováni 4 roky. Primárním sledovaným cílem studie (endpoint) byla prevence vzniku a progrese diabetické retinopatie u diabetiků 1. typu a její progrese/regrese u diabetiků 2. typu. Ačkoli výsledky studie z pohledu prevence či progrese retinopatie byly poněkud rozpačité, z pohledu nefrologa je zajímavější efekt této léčby na rozvoj MAU [11]. V kombinované kohortě diabetiků 1. i 2. typu byli sledováni pacienti s věkovým průměrem 40 roků a průměrnou dobou trvání DM 9 let. Průměrné hodnoty HbA1c byly relativně vysoké (vstupně 8,3 %) a v průběhu studie se podstatněji nezměnily. Většina pacientů (77 %) byla normotenzních (TK 118/74 mm Hg) a také u zbylých (23 %) pacientů s hypertenzí byla poměrně dobrá kontrola TK (139/79 mm Hg). Přestože kandesartan vedl ke snížení průměrného TK o 3,6/2,7 mm Hg, nebyl autory studie pozorován signifikantní účinek blokády RAS na výskyt MAU. Riziko vzniku MAU u normoalbuminurických pacientů bylo sníženo jen o pouhých 5 % během 4,5 roku trvajícího sledování (HR, hazard ratio – 0,95; 95% IS: 0,78–1,16; p = 0,60). Je ale zajímavé, že celkově byla incidence MAU mnohem nižší (asi o 9 % během 5 let), než bylo očekáváno na podkladě studií z minulých let. Ze závěrů studie lze tedy vyvodit, že u normotenzních normoalbuminurických diabetiků 2. typu je léčba indikována až teprve ve fázi perzistentní MAU [11] a že ve fázi normoalbuminurie by pacienti měli být pravidelně 2krát ročně podrobeni screeningu MAU.
U hypertenzních pacientů s DM 2. typu a s normoalbuminurií byla taktéž provedena řada studií prokazujících účinnost léčby blokátory RAS. Ve studii BENEDICT [12] u 1204 pacientů byl signifikantně nižší rozvoj MAU ve skupině léčené trandolaprilem ve srovnání s verapamilem či placebem (6,0 vs. 11,9 a 10,0 %). Podobného výsledku bylo dosaženo ve studii ADVANCE [13] provedené na 8278 pacientech s normoalbuminurií při vstupu do studie; byla srovnána kombinace perindopril/indapamid s ostatními antihypertenzivy (19,6 % vs. 23,6 %, snížení RR o 21 %, 95% IS: 14–27 %). Naopak, již výše zmíněná studie DIRECT neprokázala ve skupině hypertenzních pacientů efekt léčby kandesartanem na rozvoj MAU [11]. Opět lze uzavřít, že blokátory RAS jsou minimálně stejně, ale pravděpodobně více účinné v prevenci vzniku MAU u diabetiků 2. typu s hypertenzí.
Sekundární prevence – progrese z mikroalbuminurie do proteinurie
Výše popsaná studie UKPDS, která zahrnula 5100 pacientů s nově diagnostikovaným DM 2. typu, mj. prokázala výskyt proteinurie po 10 letech od stanovení diagnózy DM u 5,3 % pacientů a výskyt MAU u 25 % pacientů [14]. Pacienti s MAU měli významně vyšší riziko progrese do proteinurie než pacienti normoalbuminuričtí (RR 7,5, 95% IS: 5,2–10,9). Ostatními rizikovými faktory přispívajícími k progresi do proteinurie jsou vyšší vstupní albuminurie, horší kontrola glykemie (resp. vyšší hodnota glykosylovaného hemoglobinu), vyšší TK a kouření [15–17]. Mohou však být přítomny i jiné příčiny podílející se na progresi proteinurie, např. u starších pacientů to může být pomalu progredující vaskulární nefroskleróza.
Navíc je potřeba zdůraznit, že proteinurie je u pacientů s diabetem 2. typu typicky spjata s progresivním zhoršováním glomerulární filtrace (GF), postupujícím rychleji než u pacientů s MAU. Např. v práci Nelsona a kol. [18] bylo během 4letého sledování zjištěno zhoršení GF u proteinurických pacientů o 35 %, zatímco u pacientů s MAU jen o 3 %.
Pokud jde o regresi MAU do normoalbuminurie u pacientů s DM 2. typu, byly pozorovány podobné výsledky jako u pacientů s DM 1. typu, kdy minimálně u poloviny z nich nedávno provedené studie prokázaly regresi MAU zpět do normoalbuminurie [19]. Podobně ve studii japonských autorů zahrnující 216 pacientů s DM 2. typu a MAU [20] regredovalo během 6letého sledování do normoalbuminurie 51 % pacientů, zatímco 28 % progredovalo do ![Obr. 1 Algoritmus péče o diabetiky s mikroalbuminurií; podle [37] – Ritz, Tarng, 2001.](https://www.remedia.cz/photo-a-27927---.jpg) proteinurie. Mezi faktory, které byly zhodnoceny jako nezávislé a spojené s regresí MAU, patřilo krátkodobé trvání MAU, lepší kontrola glykemie (HbA1c < 7,0 %) a TK (systolický TK < 129 mm Hg), léčba ACEI či ARB. Následným sledováním navíc autoři prokázali signifikantní snížení úmrtnosti, počtu hospitalizací z nefrologických či kardiologických příčin a rychlost zhoršování GF [21]. Základními léčebnými opatřeními jak v regresi MAU do normoalbuminurie, tak v její progresi do proteinurie je kontrola glykemie a TK. Z antihypertenziv je významná zejména léčba blokátory/inhibitory RAS, tedy léčba ACEI nebo ARB [16, 20]. Pozitivní léčebný efekt vykazovalo i použití non-dihydropyridinových blokátorů kalciového kanálu (CCB). Algoritmus léčby diabetika s MAU je znázorněn na obr. 1 [37].
proteinurie. Mezi faktory, které byly zhodnoceny jako nezávislé a spojené s regresí MAU, patřilo krátkodobé trvání MAU, lepší kontrola glykemie (HbA1c < 7,0 %) a TK (systolický TK < 129 mm Hg), léčba ACEI či ARB. Následným sledováním navíc autoři prokázali signifikantní snížení úmrtnosti, počtu hospitalizací z nefrologických či kardiologických příčin a rychlost zhoršování GF [21]. Základními léčebnými opatřeními jak v regresi MAU do normoalbuminurie, tak v její progresi do proteinurie je kontrola glykemie a TK. Z antihypertenziv je významná zejména léčba blokátory/inhibitory RAS, tedy léčba ACEI nebo ARB [16, 20]. Pozitivní léčebný efekt vykazovalo i použití non-dihydropyridinových blokátorů kalciového kanálu (CCB). Algoritmus léčby diabetika s MAU je znázorněn na obr. 1 [37].
Kontrola glykemie
Pokud jde o kontrolu glykemie, jsou u pacientů s DM 2. typu k dispozici limitovaná data o účinnosti těsné kontroly glykemie z pohledu ovlivnění MAU. Například japonští autoři [6] zkoumali 55 pacientů s DM 2. typu, kteří měli nekomplikovanou retinopatii a MAU < 300 mg/24 h. Pacienti byli randomizováni do skupiny s intenzifikovanou vs. konvenční inzulinoterapií (s hodnotou HbA1c 7,1 % vs. 9,4 %). Po 6 letech sledování došlo k progresi z MAU do proteinurie či z normoalbuminurie do MAU u 11,5 % vs. 32,0 % pacientů.
Léčba inhibitory ACE
Renoprotektivní efekt léčby ACEI či ARB ve srovnání s placebem byl ověřen v řadě studií [13, 22–26]. Současně více klinických studií prokázalo účinnost podávání ACEI na zpomalení progrese MAU do fáze proteinurie a na zpomalení horšení renální funkce u pacientů s proteinurií [27–29]. Na druhou stranu je ovšem pravda, že progrese MAU je často pozorována navzdory zavedené léčbě ACEI, kdy hlavní determinanty progrese představují nedostatečná kontrola glykemie a hypercholesterolemie. Ve studii EURODIAB, ve které bylo po dobu 7 let sledováno celkem 352 mikroalbuminurických diabetiků 1. typu, progredovalo do fáze proteinurie 13,9 % pacientů, dalších 35,5 % nemocných zůstalo mikroalbuminurických a zbylých 50,6 % regredovalo do normoalbuminurie. Nezávislým rizikovým faktorem progrese do proteinurie byly hodnoty HbA1c (7,9 % vs. 6,8 %, p = 0,004) a tíže MAU (64,4 mg/min vs. 44,9 mg/min, p = 0,0001). Hodnoty TK u pacientů progredujících do proteinurie nebyly vyšší ve srovnání s těmi, u nichž nedošlo k progresi (127 Ī 19 mm Hg vs. 125 Ī 17,8 mm Hg, p = NS), zatímco hodnoty HbA1c u progredujících pacientů byly signifikantně vyšší již v době zahájení studie (7,9 Ī 2,0 % vs. 6,8 Ī 1,8 %; p = 0,004). Po sedmi letech sledování byl systolický TK signifikantně vyšší u pacientů progredujících do proteinurie (136 Ī 22 mm Hg) ve srovnání s pacienty, kteří zůstali mikroalbuminuričtí (125 Ī 21 mm Hg) či regredovali do normoalbuminurie (120 Ī 18 mm Hg; p < 0,01). Jak bylo možné předpokládat, signifikantně (p < 0,001) více pacientů bylo léčeno antihypertenzní medikací ve skupině progredujících do proteinurie (57 %) ve srovnání s pacienty neprogredujícími (42 %) či regredujícími do normoalbuminurie (24 %). Progrese byla pozorována i přesto, že 88 % z těchto pacientů bylo léčeno ACEI. Zajímavostí bylo zjištění, že mírná konzumace alkoholu (30–210 g/týden) ve srovnání s abstinencí či s minimální konzumací alkoholu vedla k signifikantnímu (p = 0,008) snížení rizika progrese do proteinurie.
Další nedávno provedená 10 let trvající observační studie, která zahrnovala celkem 373 pacientů s diabetem 1. typu, potvrdila, že významné procento mikroalbuminurických pacientů progreduje do fáze proteinurie navzdory léčbě ACEI [30]. Tato studie dále demonstrovala i význam chronické hyperglykemie jako hlavní determinanty glomerulárního poškození (i přes léčbu ACEI). Toto zjištění může být výsledkem snížené adherence pacientů k léčbě či nedostatečné biologické účinnosti této medikace.
Léčba ARB
V roce 2001 publikoval Parving a kol. studii [23], která jasně dokumentovala renoprotektivní efekt ARB. Zařazeno bylo 590 pacientů s DM 2. typu, arteriální hypertenzí a mikroalbuminurií. Pacienti byli randomizováni do skupiny léčené irbesartanem (150 či 300 mg/d), nebo placebem a sledováni byli 2 roky. Cílovým parametrem byl čas do vývoje albuminurie > 200 mg/24 h nebo její zvýšení alespoň o 30 % a bylo ho dosaženo signifikantně více ve skupině s placebem vs. ve skupině léčené irbesartanem (14,9 % vs. 9,7 % a 5,2 % při dávkování 150 mg, resp. 300 mg irbesartanu). Tento účinek nebyl spojen s rozdílným dosaženým TK, ačkoli systolický TK byl nesignifikantně, o 3 mm Hg, nižší u skupiny s irbesartanem podávaným v dávce 300 mg denně než u skupiny s placebem.
ACEI a ARB mají podobnou účinnost u pacientů s DM 2. typu a MAU. Jediná randomizovaná srovnávací studie, která porovnávala účinnost těchto látek u pacientů s DM 2. typu a MAU, byla studie DETAIL [31]. Celkem 250 pacientů bylo léčeno buď enalaprilem, nebo ARB telmisartanem a sledovaným parametrem byl pokles GF a MAU. Po 5letém sledování sice došlo k poněkud nižšímu, ale nesignifikantnímu, poklesu GF ve skupině léčené enalaprilem (14,9 vs. 17,9 ml/min), nicméně nebyl zaznamenán žádný rozdíl ve všech ostatních sledovaných parametrech, tj. roční změny GF, TK, hodnoty sérového kreatininu, MAU, ve vzniku terminálního selhání ledvin, kardiovaskulárních příhod a mortality. Jedinou limitací studie byl fakt, že ji dokončilo pouze 168 z původně 250 zařazených pacientů.
Téměř všechny studie zabývající se sledováním MAU zahrnovaly pacienty s hypertenzí. Pouze jedna rozsáhlejší studie zahrnovala jen normotenzní pacienty v celkovém počtu 94 [22, 26]. Během 7letého sledování byla léčba enalaprilem spjata se stabilní hodnotou sérového kreatininu a MAU na rozdíl od placeba. Je ovšem pravda, že většina pacientů nesplňovala hranici normotenze dle současných kritérií (130/80 mm Hg). Lze tedy uzavřít, že u pacientů s diabetem 2. typu a MAU je léčba ACEI či ARB stejně efektivní a že obě skupiny léků zpomalují progresi do proteinurie.
Duální blokáda RAS pomocí ACEI a ARB vs. ARB a inhibitoru reninu – recentní poznatky ze studií ONTARGET a AVOID
Studie CALM, ve které autoři ověřovali efekt duální blokády RAS při léčbě kandesartanem a lisinoprilem u pacientů s hypertenzí, MAU a DM 2. typu, přinesla slibné výsledky jak ve smyslu efektivního snížení TK, tak snížení MAU [24]. Tyto výsledky však již nebyly potvrzeny v následných rozsáhlejších studiích. Ve studii IMPROVE, která zjišťovala efekt léčby ramiprilem a irbesartanem u 405 diabetiků s hypertenzí, nebylo snížení MAU ve skupině pacientů léčených duální blokádou vyšší než ve skupině léčené pouze ACEI [32]. V další studii, ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) [33], zkoumající efekt duální blokády RAS, bylo zahrnuto celkem 25 620 pacientů s kardiovaskulárními komplikacemi či diabetiků s vysokým kardiovaskulárním rizikem (n = 6982), kteří byli sledováni po dobu 5 let. Dosažení primárních cílů celkově (vstup do dialýzy, zdvojení hladiny sérového kreatininu či úmrtí) bylo stejné pro telmisartan (13,4 %) i ramipril (13,5 %), ale bylo vyšší při jejich kombinační léčbě (14,5 %, HR 1,09; p = 0,037). Vstup do dialýzy či zdvojnásobení hladiny sérového kreatininu bylo stejné u telmisartanu i ramiprilu (2,21 % vs. 2,03 %), ale vyšší u kombinované léčby (2,49 %; HR 1,24; p = 0,038). Naopak zhoršení kalkulované glomerulární filtrace (eGRF) bylo méně patrné při léčbě ramiprilem než telmisartanem (-2,82 ml/ min/1,73 m2 vs. -4,12, p < 0,0001) či u kombinované léčby (-6,11; p < 0,0001), současně však zhoršení MAU bylo méně patrné u pacientů léčených telmisartanem (p = 0,004) či kombinovanou terapií (p = 0,001) než u pacientů léčených ramiprilem. Výsledky byly podobné pro podskupinu diabetiků i nediabetiků. Autoři proto studii uzavírali se závěrem, že u pacientů s vysokým kardiovaskulárním rizikem je „renální efekt“ léčby telmisartanem stejný jako při léčbě ramiprilem; ačkoli kombinační léčba vedla k více patrnému snížení proteinurie než monoterapie, celkově zhoršovala renální výstupy studie, a proto by kombinační léčba v této skupině pacientů neměla být doporučována.
Další studie, AVOID (Aliskiren in the Evaluation of Proteinuria in Diabetes), jejíž výsledky byly nedávno publikovány [34], zkoumala renoprotektivní účinek duální blokády RAS navozené přidáním aliskirenu (přímý inhibitor reninu) v dávce 300 mg denně k zavedené léčbě losartanem v dávce 100 mg denně u celkem 599 diabetiků 2. typu s nefropatií a hypertenzí. Tato léčba (ve srovnání s podáním placeba) vedla ke snížení průměrné hodnoty poměru močového albuminu/kreatininu o 20 % (p < 0,001), přičemž nebyl patrný signifikantní rozdíl v hodnotě TK mezi oběma skupinami. Výsledky studie však vedly k některým kritickým připomínkám [35]. Skutečnost, že kombinovaná léčba vyvolala u 24,7 % pacientů snížení poměru močového albuminu/kreatininu o 50 % či více, vedla k úvahám, že významná část pacientů nemusela vůbec odpovídat na inhibici reninu. Dále, TK u pacientů byl měřen jen jednorázově, nikoliv během 24 hodin (ABPM), takže nelze vyloučit významné rozdíly v hodnotách denního/nočního TK mezi oběma skupinami. Konečně, u zařazených pacientů byla poměrně špatná kontrola diabetu (HbA1c 8,0 Ī 1,5 %), takže nelze vyloučit, že aliskiren by mohl mít lepší efekt při dostatečně efektivní kontrole glykemie.
Léčba blokátory kalciového kanálu
CCB mají méně intenzivní antiproteinurický efekt ve srovnání s ACEI či ARB a tento efekt byl pozorován jen u diltiazemu a verapamilu, tedy non-dihydropyridinových CCB. Ve studii MARVAL bylo zahrnuto celkem 332 pacientů s DM 2. typu a MAU, kteří byli randomizováni k léčbě valsartanem, či amlodipinem [36]. K vysoce signifikantní redukci MAU došlo u 92 % vs. 56 % pacientů, ačkoli u obou skupin nebyl žádný rozdíl mezi TK dosaženým na konci studie.
Závěr
I přesto, že poznatky výše uvedených studií jasně hovoří pro cílení léčby DN na snižování MAU, není situace černobílá – není totiž známo, zda vylučování albuminu močí představuje rizikový faktor, nebo zda je pouze ukazatelem míry rizika. Na tuto otázku nebude tak snadné odpovědět, neboť většina léčebných postupů snižujících MAU ovlivňuje i krevní tlak. Informace o tom, zda má snížení MAU samo o sobě skutečně ochranný vliv, mohou poskytnout pouze studie neovlivňující další faktory kardiovaskulárního a renálního rizika, jakými jsou krevní tlak nebo sérová koncentrace cholesterolu. Každopádně však stanovení MAU představuje levný, neinvazivní a snadno hodnotitelný ukazatel míry rizika, jenž sám o sobě nevyžaduje návštěvu lékaře nebo zdravotnického zařízení, a je proto vhodným parametrem pro screening umožňující rozpoznávání osob s vysokým rizikem kardiovaskulárních a renálních onemocnění.
Seznam použité literatury
- [1] Ginsberg JM, Chang BS, Matarese RA, Garella S. Use of single voided urine samples to estimate quantitative proteinuria. N Engl J Med 1983; 309: 1543–1546.
- [2] Witte EC, Lambers Heerspink HJ, de Zeeuw, D, et al. First morning voids are more reliable than spot urine samples to assess microalbuminuria. J Am Soc Nephrol 2009; 20: 436–443.
- [3] Jefferson JG, Greene SA, Smith MA, et al. Urine albumin to creatinine ratio – response to exercise in diabetes. Arch Dis Child 1985; 60: 305–310.
- [4] Mattix HJ, Hsu Cy C, Shaykevich S, Curhan G. Use of the albumin/creatinine ratio to detect microalbuminuria: Implications of sex and race. J Am Soc Nephrol 2002; 13: 1034–1039.
- [5] Patel A, MacMahon S, Chalmers J, et al. Intensive Blood Glucose Control and Vascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2008; 358: 2560–2572.
- [6] Ohkubo Y, Kishikawa H, Araki E, et al. Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with non-insulin-dependent diabetes mellitus: A randomized prospective 6-year study. Diabetes Res Clin Pract 1995; 28: 103–117.
- [7] Intensive blood-glucose control with sulphonyl-ureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352: 837–853.
- [8] Ravid M, Brosh D, Levi Z, et al. Use of enalapril to attenuate decline in renal function in normotensive, normoalbuminuric patients with type 2 diabetes mellitus. A randomized, controlled trial. Ann Intern Med 1998; 128: 982–988.
- [9] Schrier RW, Estacio RO, Esler A, Mehler P. Effects of aggressive blood pressure control in normotensive type 2 diabetic patients on albuminuria, retinopathy, and strokes. Kidney Int 2002; 61: 1086–1097.
- [10] Parving HH, Mauer M, Ritz E. Diabetic nephropathy. In: Brenner BM, ed. Brenner & Rector’s the kidney. 8th ed., vol. 2. Philadelphia, Elsevier, 2008: 1265–1298.
- [11] Bilous R, Chaturvedi N, Sjolie AK, et al. Effect of candesartan on microalbuminuria and albumin excretion rate in diabetes: three randomized trials. Ann Intern Med 2009; 151: 11–20.
- [12] Ruggenenti P, Fassi A, Ilieva AP, et al. Preventing microalbuminuria in type 2 diabetes. N Engl J Med 2004; 351: 1941–1951.
- [13] Patel A, MacMahon S, Chalmers J, et al. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet 2007; 370: 829–840.
- [14] Adler AI, Stevens RJ, Manley SE, Bilous RW. Development and progression of nephropathy in type 2 diabetes: The United Kingdom Prospective Diabetes Study (UKPDS 64). Kidney Int 2003; 63: 225–232.
- [15] Mogensen CE. Microalbuminuria predicts clinical proteinuria and early mortality in maturity-onset diabetes. N Engl J Med 1984; 310: 356–360.
- [16] Klein R, Klein BE, Moss SE, et al. Ten-year incidence of gross proteinuria in people with diabetes. Diabetes 1995; 44: 916–923.
- [17] Rossing K, Christensen PK, Hovind P, et al. Progression of nephropathy in type 2 diabetic patients. Kidney Int 2004; 66: 1596–1605.
- [18] Nelson DG, Bennett PH, Beck GJ, et al. Development and progression of renal disease in Pima Indians with non-insulin-dependent diabetes mellitus. N Engl J Med 1996; 335: 1636–1642.
- [19] Perkins BA, Ficociello LH, Silva KH, et al. Regression of microalbuminuria in type 1 diabetes. N Engl J Med 2003; 348: 2285–2293.
- [20] Araki S, Haneda M, Sugimoto T, et al. Factors associated with frequent remission of microalbuminuria in patients with type 2 diabetes. Diabetes 2005; 54: 2983–2987.
- [21] Araki S, Haneda M, Koya D, et al. Reduction in microalbuminuria as an integrated indicator for renal and cardiovascular risk reduction in patients with type 2 diabetes. Diabetes 2007; 56: 1727–1730.
- [22] Ravid M, Savin H, Jutrin I, et al. Long-term stabilizing effect of angiotenzin-converting enzyme inhibition on plasma creatinine and on proteinuria in normotensive type II diabetic patients. Ann Intern Med 1993; 118: 577–581.
- [23] Parving HH, Lehnert H, Brochner-Mortensen J, et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med 2001; 345: 870–878.
- [24] Mogensen CE, Neldam S, Tikkanen I, et al. Randomised controlled trial of dual blockade of renin-angiotenzin system in patients with hypertension, microalbuminuria, and non-insulin dependent diabetes: the candesartan and lisinopril microalbuminuria (CALM) study. BMJ 2000; 321: 1440–1444.
- [25] Lebovitz HE, Wiegmann TB, Cnaan A, et al. Renal protective effects of enalapril in hypertensive NIDDM: Role of baseline proteinuria. Kidney Int Suppl 1994; 45: S150–S155.
- [26] Ravid M, Lang R, Rachmani R, et al. Long-term renoprotective effect of angiotenzin-converting enzyme inhibition in non-insulin-dependent diabetes mellitus. Arch Intern Med 1996; 156: 286–289.
- [27] Giorgino F, Laviola L, Cavallo Perin P, et al. Factors associated with progression to macroalbuminuria in microalbuminuric type 1 diabetic patients: The EURODIAB Prospective Complications Study. Diabetologia 2004; 47: 1020–1028.
- [28] Beulens JW, Kruidhof JS, Grobbee DE, et al. Alcohol consumption and risk of microvascular complications in type 1 diabetes patients: the EURODIAB Prospective Complications Study. Diabetologia 2008; 51: 1631–1638.
- [29] Mathiesen ER, Hommel E, Hansen HP, et al. Randomised, controlled trial of long term efficacy of captopril on preservation of kidney function in normotensive patients with insulin dependent diabetes and microalbuminuria. BMJ 1999; 319: 24–25.
- [30] Ficociello LH, Perkins BA, Silva KH, et al. Determinants of progression from microalbuminuria to proteinuria in patients who have type 1 diabetes and are treated with angiotenzin-converting enzyme inhibitors. Clin J Am Soc Nephrol 2007; 2: 461–469.
- [31] Barnett AH, Bain SC, Bouter P, et al. Angiotenzin-receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy. N Engl J Med 2004; 351: 1952–1961.
- [32] Bakris GL, Ruilope L, Locatelli F, et al. Treatment of microalbuminuria in hypertensive subjects with elevated cardiovascular risk: results of the IMPROVE trial. Kidney Int 2007; 72: 879–885.
- [33] Mann JF, Schmieder RE, McQueen M, et al. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double-blind, controlled trial. Lancet 2008; 372: 547–553.
- [34] Parving HH, Persson F, Lewis JB, et al. AVOID Study Investigators. Aliskiren combined with losartan in type 2 diabetes and nephropathy. N Engl J Med 2008; 358: 2433–2446.
- [35] Schernthaner G. Kidney disease in diabetology: lessons from 2008. Nephrol Dial Transplant 2009; 24: 396–399.
- [36] Viberti G, Wheeldon NM. Microalbuminuria reduction with valsartan in patients with type 2 diabetes mellitus: a blood pressure-independent effect. Circulation 2002; 106: 672–678.
- [37] Ritz E, Tarng DC. Renal disease in type 2 diabetes. Nephrol Dial Transplant 2001; 16 (Suppl. 5): 11–18.