Primární profylaxe febrilní neutropenie – klinický pohled
Jednou z modalit často používaných v terapii zhoubných nádorů je chemoterapie. Mezi její typické nežádoucí účinky patří riziko vzniku neutropenie a febrilní neutropenie. Pro nutnost udržení správné (plné) dávky v optimálním čase je třeba krvetvorbu podpořit aplikací růstových faktorů. Pro bílou krevní řadu máme k dispozici jednorázovou aplikaci pegfilgrastimu nebo dlouhodobé podávání denního filgrastimu. Tento přehled porovnává obě tyto formy především ve smyslu preference primární profylaxe těchto komplikací a z hlediska přínosů pro nemocné.
Úvod
Přestože u některých nádorových onemocnění lze v posledních letech pozorovat stabilní, nebo dokonce mírně klesající incidenci, výskyt řady tumorů se přes zavádění různých preventivních screeningových programů nedaří snižovat, byť je alespoň u některých z nich patrné nižší zastoupení pokročilých stadií v době diagnózy. Ale i u pacientů s lokalizovanými formami onemocnění patří podávání chemoterapie nadále mezi hlavní léčebné modality. Nedávný předpoklad, že kurabilní záměr naplní moderní cílená léčba, se zvláště u solidních nádorů nedaří uskutečnit. Důvodem je především omezená účinnost, která může spíše komplementárně doplňovat chemoterapii nebo ji částečně zastoupit a umožnit aplikaci, než aby ji svým samostatným podáváním nahradila. Chemoterapie tedy ještě dlouhou dobu zůstane základním stavebním kamenem léčby nádorových onemocnění.
Tato terapie je spojena s řadou nezpochybnitelných výhod, mezi kterými jednoznačně dominuje její celotělové, systémové působení, kdy by měla vést k eliminaci naprosté většiny nádorových projevů jak v místě primárního zdroje, tak i v lymfatických uzlinách nebo parenchymatózních orgánech. S tím však také souvisí široké spektrum nežádoucích účinků, vycházejících také z většiny tělesných systémů. Dnešní moderní doba s sebou nese naštěstí možnost ovlivnit řadu z nich, především toxicitu gastrointestinální (kortikoidy a moderní antiemetika), kožní (bohaté spektrum lokálních prostředků k ošetřování kůže), urologickou a další. Jednoduché může být rovněž zvládnutí hematotoxicity, kdy jak pro červenou krevní řadu, tak zejména pro normalizaci bílého krevního obrazu máme k dispozici řadu prostředků, abychom zabránili vzniku nepříjemné a další léčbu limitující, nebo dokonce život ohrožující reakce.
P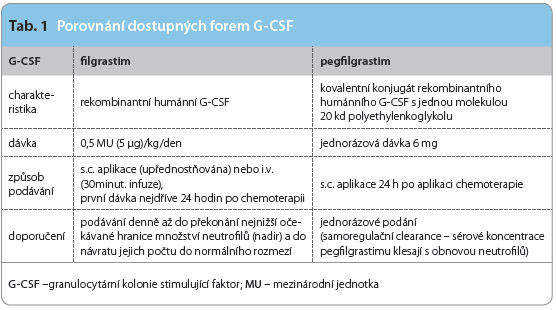 rávě nežádoucí účinky chemoterapie představované zejména neutropenií, respektive febrilní neutropenií, spojenou se zhoršením kvality života (slabostí, únavou, nechutenstvím, rizikem infekcí a dalšími konsekvencemi), lze v dnešní době poměrně dobře a jednoduše ovlivnit aplikací růstových faktorů stimulujících dělení a vyzrávání buněk bílé krevní řady – G-CSF (granulocytární kolonie stimulující faktor). Nejvýhodnějším přístupem by mělo být jejich podávání v primární profylaxi (tzv. up-front) tam, kde lze tuto toxicitu předpokládat.
rávě nežádoucí účinky chemoterapie představované zejména neutropenií, respektive febrilní neutropenií, spojenou se zhoršením kvality života (slabostí, únavou, nechutenstvím, rizikem infekcí a dalšími konsekvencemi), lze v dnešní době poměrně dobře a jednoduše ovlivnit aplikací růstových faktorů stimulujících dělení a vyzrávání buněk bílé krevní řady – G-CSF (granulocytární kolonie stimulující faktor). Nejvýhodnějším přístupem by mělo být jejich podávání v primární profylaxi (tzv. up-front) tam, kde lze tuto toxicitu předpokládat.
Následující stručný souhrn se snaží pojmenovat některé charakteristiky a porovnat úspěšnost obou forem dostupné léčby – denní aplikace filgrastimu a jednorázového podání pegfilgrastimu (tab. 1) – u rizikových pacientů.
Význam primární profylaxe, denní forma versus dlouhodobě působící jednorázová forma G-CSF
O vhodnosti a v některých případech i nutnosti podávání růstových faktorů (především bílé krevní řady) z hlediska zajištění tolerance léčby a compliance pacienta s jejím pokračováním bylo již mnoho napsáno. Z klinického pohledu je tak možné zaměřit se především na zjištění, do jaké míry lze primární nebo sekundární profylaxí přispět k naplnění většiny stanovených léčebných cílů. Mezi tyto cíle patří mimo jiné udržení časového rozložení jednotlivých sérií chemoterapie v plánovaném termínu, možnost podání plné dávky cytostatik, snížení potřeby podávání antibiotik, zkrácení pobytu v nemocničním zařízení, snížení potřeby následných kontrol a laboratorních odběrů, dokonce i možné snížení ekonomické náročnosti léčby. Profylaxe může představovat snahu o předcházení komplikacím již od samotného počátku léčby (primární), nebo až po jejich vzniku (sekundární). V takovém případě se však logicky jedná spíše o hašení požáru a snahu o co nejmenší škody, což je podle logiky věci ve výsledku vždy horší, delší, náročnější a nákladnější proces.
Jednou ze zásadních skutečností tak může být fakt, že primární profylaxe G-CSF mnohem účinněji snižuje riziko neutropenie stupně 3–4. V práci Mariny a kol. [1] poklesla neutropenie při profylaxi primární ve srovnání s profylaxí sekundární při podávání filgrastimu (z 39,1 % na 5,8 %) i pegfilgrastimu (z 35,1 % na 8,1 %) v podobném poměru, avšak při podávání denního růstového faktoru v suboptimálním režimu po dobu méně než 7 dní (což bylo u 60 % nemocných, v naší klinické praxi je však situace výrazně horší) byla její incidence významně vyšší (13,6 % vs. 3,7 %, p = 0,018). Toto zjištění naznačuje výhodnost primární profylaxe pegfilgrastimem nebo potřebu skutečně dlouhodobé aplikace filgrastimu, neboť v případě opačném je jeho přínos omezený.
Dalším zajímavým faktorem účinnosti – častěji hodnoceným při srovnávání léčebných režimů, zde však kupodivu zjištěným i v souvislosti s tímto typem podpůrné léčby – je přínos ve smyslu zlepšení přežívání. V posledních letech bylo opakovaně potvrzeno, že k jeho prodloužení může podstatnou měrou přispět i správná podpůrná léčba, např. nutriční, ale také podávání růstového faktoru typu G-CSF. To mimo jiné dokazuje, že aplikace růstových faktorů nestimuluje nádorový růst. V tomto směru se lze opřít o zcela recentní metaanalýzu Lymana a kol. [2], založenou na hodnocení 59 klinických studií s téměř 25 000 pacienty. Jejími primárními cíli bylo zjistit, zda byla dodržena relativní dávková intenzita (RDI), a provést hodnocení počtu úmrtí z jakékoliv příčiny. RDI byla výrazně častěji dodržena u pacientů s primární profylaxí než bez ní (1,21 vs. 0,92), což se následně promítlo v poklesu úmrtnosti (4251 vs. 5188 nemocných). Došlo tedy k výrazné redukci mortality (p = 0,0043), primární profylaxe tak na velmi rozsáhlém souboru prokazatelně přispěla ke zlepšení přežití.
Přínos z hlediska snížení časné mortality (v průběhu chemoterapie a na infekční komplikace po léčbě) byl potvrzen i v práci Kuderera a kol. [3]. Jednalo se o metaanalýzu 17 randomizovaných studií s 3493 pacienty se solidními nádory a lymfomy, kterým byl v profylaxi podáván filgrastim, lenograstim nebo pegfilgrastim. Zatímco v případě lenograstimu nebyl zjištěn významný rozdíl, bylo riziko takovéhoto úmrtí při podávání filgrastimu sníženo o 40 % (p = 0,010), a u pegfilgrastimu pak dokonce o 64 % (p = 0,047).
Následně také Lyman a kol. [4] hodnotili v prospektivní observační studii s téměř 4500 pacienty léčenými protinádorovou chemoterapií význam pegfilgrastimu, v polovině případů podávaného od prvního cyklu chemoterapie v primární profylaxi, pro celkové přežití a celkové bezpříznakové přežití. Proti skupině bez této podpůrné léčby vedla aplikace pegfilgrastimu k významnému prodloužení celkového přežití (hazard ratio – HR = 0,399, p = 0,001) i ke snížení mortality z jakékoliv příčiny (HR = 0,503, p = 0,023). Tento přípravek tak v obou hodnoceních vychází jako nejúčinnější a pro primární profylaxi nejvhodnější.
Také v nedávné publikaci [5] byla porovnávána profylaxe pegfilgrastimem a filgrastimem. Zařazeny byly pacientky (n = 239) s karcinomem prsu léčené v 89 % režimy s obsahem antracyklinu a taxanu a v 11 % taxanem (nejčastější kombinace FEC – fluorouracil/epirubicin/cyklofosfamid – a paklitaxel). V 61 % jim byla podávána primární profylaxe G-CSF (53 % filgrastim a 47 % pegfilgrastim, přičemž filgrastim byl podáván po dobu alespoň 7 dnů). Pegfilgrastim byl ve všech parametrech účinnější: k redukci dávkové denzity (prodloužení doby mezi aplikacemi nad optimální interval) chemoterapie bylo nutno přistoupit v 17 % vs. 27 % případů a k redukci intenzity (dodržení časového harmogramu léčby za cenu snížení velikosti dávky) v 19 % vs. 25 % případů. Incidence febrilní neutropenie pak dosahovala 14 % vs. 31 %, což představuje nejméně 50% redukci rizika jejího vzniku při aplikaci pegfilgrastimu. Uvedených 14 % febrilních neutropenií bylo spojeno nejčastěji s věkem pacientek (vyšší než 65 let), s podávaným režimem (u taxanů) a rizikovým faktorem bylo podávání filgrastimu (febrilní neutropenie u 28 % léčených filgrastimem oproti 8 % při léčbě pegfilgrastimem).
Retrospektivní údaje získané od 99 amerických onkologů léčících nemocné s karcinomem prsu, plic, ovarií, tračníku nebo nemocné s lymfomem dále ukazují, že prognózu ovlivňuje zejména doba zahájení aplikace G-CSF [6]. Zatímco její medián byl jen 2,4 dne u pegfilgrastimu, u filgrastimu dosáhl 9,6 dne. Po prvním cyklu chemoterapie byl pegfilgrastim podán téměř 90 % nemocných, filgrastim však jen asi pětině, čtvrtina pacientů jej dostala mezi 4.–9. dnem, a 52 % z nich dokonce až po desátém dni od chemoterapie. To vše vysvětluje horší výsledky podávání denní formy léku, i když z hlediska náročnosti pravidelných aplikací, kontrol a laboratorních odběrů se nelze divit, že tento způsob léčby je pro primární profylaxi mnohem méně vhodný. Spíše svádí k postupu „watch and wait“, který je u radikálně léčených pacientů velmi problematický.
Pokud zůstaneme u časového hlediska, je podávání denního G-CSF spojeno rovněž s rizikem předčasného ukončení léčby, což je jednoznačně provázeno poklesem účinnosti a projeví se v podobě zvýšení počtu neutropenií a febrilních neutropenií. Taková podpůrná léčba ztrácí na významu, ale hlavně na logice. Ve výše uvedené multicentrické observační studii [1], do níž byly zařazeny ženy s karcinomem prsu (n = 735) léčené chemoterapií (65 % pacientek dostávalo docetaxel, 28 % paklitaxel) s rizikem vzniku febrilní neutropenie 10 % a vyšším, činila incidence neutropenie stupně 3–4 při podávání filgrastimu po dobu méně než 7 dnů 13,6 %, zatímco při podávání po dobu 7 a více dnů dosahovala incidence neutropenie 3,7 %, v případě febrilní neutropenie představoval tento poměr 5,7 % vs. 2,4 %. Takový výrazný rozdíl naznačuje, že pro dosažení efektu je skutečně třeba dodržet doporučené dávkování, neboť aplikace několika málo dávek není spojena se žádoucím přínosem. Toto zjištění opět hovoří ve prospěch zajištění nemocných pegfilgrastimem jako výhodnějším profylaktickým postupem.
Výsledek analýzy 182 pacientů s non-Hodgkinovým lymfomem v databázi SEER (Surveillance, Epidemiology and End Results), která hodnotila riziko nutnosti hospitalizace v důsledku neutropenie při aplikaci denního G-CSF, vyznívá velmi podobně [7] – pokud není dodržena doba podávání filgrastimu alespoň 7 dní, je riziko prakticky zdvojnásobeno (risk ratio – RR = 1,97). Hospitalizaci vyžadovalo dokonce 27,8 % nemocných léčených suboptimálně (tedy v klinické praxi běžným způsobem), byť i 14,1 % hospitalizovaných při aplikaci filgrastimu přesahující dobu 7 dní je číslo poměrně vysoké.
![Graf 1 Porovnání účinnosti pegfilgrastimu a filgrastimu v dávkování dle SPC; podle [11, 12] – Misset, et al., 1999; Siena, et al., 2003.](https://www.remedia.cz/photo-a-29606---.jpg) Tato data by nás měla směrovat k nutnosti mnohem častěji a lépe zařazovat primární profylaxi, protože vynucený pobyt téměř třetiny nemocných na lůžku svědčí o nesplnění kritérií prevence komplikací a je zatěžující nejen pro pacienty samotné, ale pro celé zdravotnictví kvůli neúměrnému nárůstu nákladů spojených s léčbou. Je nutno podotknout, že mezi faktory negativně ovlivňující délku (zkrácení) podávání G-CSF v této studii patřily probíhající aktinoterapie nebo věk pacientů nad 75 let; reálná praxe by se ovšem měla přiklánět spíše k postupu opačnému, neboť tito nemocní jsou ke vzniku neutropenie náchylnější a uvedené riziko by mělo být kompenzováno raději prodlouženou dobou aplikace filgrastimu.
Tato data by nás měla směrovat k nutnosti mnohem častěji a lépe zařazovat primární profylaxi, protože vynucený pobyt téměř třetiny nemocných na lůžku svědčí o nesplnění kritérií prevence komplikací a je zatěžující nejen pro pacienty samotné, ale pro celé zdravotnictví kvůli neúměrnému nárůstu nákladů spojených s léčbou. Je nutno podotknout, že mezi faktory negativně ovlivňující délku (zkrácení) podávání G-CSF v této studii patřily probíhající aktinoterapie nebo věk pacientů nad 75 let; reálná praxe by se ovšem měla přiklánět spíše k postupu opačnému, neboť tito nemocní jsou ke vzniku neutropenie náchylnější a uvedené riziko by mělo být kompenzováno raději prodlouženou dobou aplikace filgrastimu.
Literární údaje hodnotící vliv délky podávání podpory G-CSF při chemoterapii hematologických nádorů jsou podobné i v případě malignit solidních. V americké kohortové studii [8] u nemocných s nádory tračníku, prsu nebo plic (n = 4903) byla průměrná délka profylaxe filgrastimem jen 4,5 dne, přičemž 94 % z nich jej dostávalo po dobu kratší než 10 dnů a 79 % méně než 7 dnů. Porovnání účinnosti léčby pegfilgrastimem a filgrastimem zobrazují grafy 1 a 2. Zatímco proti placebu je účinnost pegfilgrastimu neměnná, v případě suboptimálního dávkování filgrastimu velmi výrazně klesá.
Závěr
Doporučení pro podávání G-CSF se mezi jednotlivými odbornými společnostmi (ESMO, ASCO, NCCN apod.) [9] příliš neliší. Jsou založena na aplikaci dlouhodobě působícího peg-filgras![Graf 2 Porovnání účinnosti pegfilgrastimu a filgrastimu podávaného po dobu 6 dní; podle [13, 14] – Martin, et al., 2005; von Minckwitz, et al., 2008.](https://www.remedia.cz/photo-a-29607---.jpg) timu nebo na opakovaném podávání denního filgrastimu. K zahájení léčby by mě-
timu nebo na opakovaném podávání denního filgrastimu. K zahájení léčby by mě-
lo dojít 24 hodin po skončení chemoterapie a v případě denní formy léku by v podávání mělo být pokračováno tak dlouho, dokud se absolutní počet neutrofilů po nadiru nevrátí k normě nebo k velmi blízké hodnotě, což představuje 10–11 aplikací filgrastimu. Klinická praxe však bývá takovému požadavku velmi často vzdálená – aplikace bývá zahajována pozdě, nebo až při vzniku komplikací, což nespadá do kritérií primární profylaxe; aplikace také bývá ukončována předčasně při naznačení vzestupu počtu neutrofilů, kdy je její efekt velmi omezený, často je nutno další cyklus chemoterapie stejně odložit. Takový postup představuje nedodržení RDI a pro nemocné to bohužel může znamenat vyšší riziko opakování potíží, nebo dokonce zhoršení prognózy, což je v případě adjuvantního nebo kurativního záměru léčby nežádoucí.
Podávání filgrastimu znamená v každém případě zátěž spojenou s nutností opakovaných odběrů krevního obrazu, tedy návštěv zdravotnického zařízení a potřebného času zdravotníků, což v konečném důsledku náklady zvyšuje. Jednoznačně tak vše vyznívá pro výhodu primární profylaxe pegfilgrastimem. Ta spočívá v chybějící eliminaci glomerulární filtrací (samoregulační clearance je zprostředkována pouze neutrofily), v udržení potřebné sérové koncentrace po celou dobu trvání neutropenie a ve výrazném zjednodušení aplikace založené na podání jediné dávky.
Podáváním primární profylaxe pegfilgrastimem ve srovnání s filgrastimem (i správně dávkovaným, ještě výrazněji při podávání suboptimálním) lze mnohem účinněji dosáhnout výraznějšího poklesu incidence febrilních neutropenií, infekčních komplikací včetně spotřeby antibiotik, menšího počtu nutných hospitalizací a dalších kontaktů zdravotnických zařízení, a především dodržení RDI použité chemoterapie současně s její lepší tolerancí, vyšší účinností a zlepšeným přinejmenším krátkodobým přežitím nemocných.Tento postup lze tedy v indikovaných případech považovat za současný standard podpůrné léčby založené na aplikaci kombinací cytostatik s vyšší pravděpodobností hematotoxicity.
Z uvedených důvodů také naše odborné doporučení obsažené v Modré knize [10] konstatuje, že febrilní neutropenie je závažnou komplikací protinádorové léčby, která vyžaduje léčbu a nejlépe profylaxi. Je možné definovat skupinu pacientů (podle diagnózy: nemocní s lymfomy, nádory varlat, prsu, sarkomy a tumory dětského věku v dospělosti; podle použitého režimu: pokud riziko vzniku febrilní neutropenie přesahuje 20 %; na základě přidružených rizikových faktorů: věk nad 65 let, s dalšími komorbiditami nebo infekty, hůře spolupracující nebo přednostně léčení ambulantně) vhodných k profylaxi primární, v níž je pegfilgrastim nejúčinnější, a tedy představuje nejvhodnější terapeutickou volbu. Proti nákladům spojeným s moderní léčbou, především cílenou, jsou výdaje spojené s profylaxí nejenom febrilní neutropenie, ale i dalších nežádoucích účinků chemoterapie téměř zanedbatelné, přesto mohou ve svém důsledku být značným přínosem pro toleranci pacientů a prognózu jejich onemocnění.
Seznam použité literatury
- [1] Marina J, Carabantes FJ, Escrivá de Romani, et al. Current practice of prophylaxis with granulocyte colony-stimulating factors for preventing chemotherapy-induced neutropenia in breast cancer patients in Spain Eur J Cancer Supplements 2009; 7: 181 (abstract P-3019 and poster).
- [2] Lyman GH, Dale DC, Culakova E, et al. The impact of the granulocyte colony-stimulating factor on chemotherapy dose intensity and cancer survival: a systematic review and meta-analysis of randomized controlled trials. Ann Oncol 2013; 24: 2475–2484.
- [3] Kuderer NM, Dale DC, Crawford J, Lyman GH. Impact of Primary Prophylaxis With Granulocyte Colony-Stimulating Factor on Febrile Neutropenia and Mortality in Adult Cancer Patients Receiving Chemotherapy: A Systematic Review. J Clin Oncol 2007: 25: 3158–3167.
- [4] Lyman G, Kuderer NM, Crawford J, et al. Impact of pegfilgrastim on early all-cause mortality in patients receiving cancer chemotherapy. J Clin Oncol (Meeting Abstracts) 2008; 26, 15S (suppl.): 6552.
- [5] Altwairgi AK. Real-world impact of granulocyte-colony stimulating factor on febrile neutropenia. Curr Oncol 2013; 20: e171–e179.
- [6] Morrison VA, Wong M, Hershman D, et al. Observational study of the prevalence of febrile neutropenia in patients who received filgrastim or pegfilgrastim associated with 3–4 week chemotherapy regimens in community oncology practices. J Manag Care Pharm 2007; 13: 337–348.
- [7] Chrischilles EA, et al. Granulocyte Colony-Stimulating Factor Use during First Course Chemotherapy for Non-Hodgkin s Lymphoma: National SEER-Medicare Study. Blood 2003; 102: Abstract 1817.
- [8] Weycker D, Malin J, Kim J, et al. Risk of hospitalization for neutropenic complications of chemotherapy in patients with primary solid tumors receiving pegfilgrastim or filgrastim prophylaxis: A retrospective cohort study. Clin Ther 2009; 31: 1069–1081.
- [9] NCCN Myeloid Growth Factor Clinical Practice Guidelines in Oncology, v.1.2010.
- [10] http://www.linkos.cz/informace-pro-praxi/modra-kniha
- [11] Misset JL, Dieras V, Gruia G, et al. Dose-finding study of docetaxel and doxorubicin in first-line treatment of patients with metastatic breast cancer. Ann Oncol 1999; 10: 553–560.
- [12] Siena S, Piccart MJ, Holmes FA, et al. A combined analysis of two pivotal randomized trials of a single dose of pegfilgrastim per chemotherapy cycle and daily filgrastim in patients with stage II–IV breast cancer. Oncology Reports 2003; 10 : 715–724.
- [13] Martin M1, Pienkowski T, Mackey J, et al. Adjuvant docetaxel for node-positive breast cancer. N Engl J Med 2005; 352: 2302–2313.
- [14] von Minckwitz G, Kummel S, du Bois A, et al. Pegfilgrastim ± ciprofloxacin for primary prophylaxis with TAC (docetaxel/doxorubicin/cyclophosphamide) chemotherapy for breast cancer. Results from the GEPARTRIO study. Ann Oncol 2008; 19: 292–298.