Přímo působící antivirotika proti hepatitidě typu C a jejich lékové interakce
Klíčová slova: přímo působící antivirotika ‒ boceprevir ‒ simeprevir ‒ asunaprevir ‒ voxilaprevir ‒ grazoprevir ‒ glekaprevir ‒ daklatasvir ‒ ledipasvir ‒ ombitasvir ‒ pibrentasvir ‒ velpatasvir ‒ elbasvir ‒ sofosbuvir ‒ dasabuvir ‒ CYP3A4 ‒ P glykoprotein ‒ BCRP ‒ OATP1B1 ‒ lékové interakce.
Úvod
Infekce virem hepatitidy C (HCV) je v posledních letech nejčastějším typem virových hepatitid v České republice [1]. Podle zdrojů Světové zdravotnické organizace (WHO) je incidence HCV průměrně 8,7 na 100 000 osob ve státech Evropské unie [2]. Podle údajů Evropského střediska pro prevenci a kontrolu nemocí (ECDC) bylo v ČR v roce 2013 hlášeno 739 nových případů chronické infekce HCV [3]. Existují odhady, že infekcí HCV trpí v ČR 80 000 obyvatel [4]. Počty nových hlášení infekcí HCV sice nenarůstají, ale tak jako jiné vyspělé státy čelí rovněž ČR následkům neléčené, resp. nevyléčené chronické infekce HCV. Přirozený průběh choroby je podle WHO následující: zhruba 15‒45 % osob se během šesti měsíců od počátku infekce HCV spontánně uzdraví, u zbývajících 55‒85 % osob se vyvine chronická infekce HCV. Riziko vzniku cirhózy do 20 let od infekce u těchto nemocných činí 15‒30 %, u řady takových pacientů vzniká hepatocelulární karcinom.
Standardem léčby chronické infekce HCV až do začátku
21. století byla kombinace pegylovaného interferonu alfa
a ribavirinu. Jednalo se o léčbu dlouhodobou, která
pacienty zatěžovala vysokým výskytem nežádoucích účinků,
proto ji dokončilo pouze 50 % pacientů, z nichž bylo
skutečně vyléčeno maximálně několik desítek procent. V roce
2011 byly zavedeny do praxe telaprevir a boceprevir,
patřící do první generace inhibitorů proteáz, a od roku
2014 jsou k dispozici též inhibitory RNA polymeráz [1].
V současné době je v klinické praxi používáno více
než patnáct léčiv, která jsou označována jako přímo působící
antivirotika (directly acting antivirals, DAA) proti infekci HCV.
Kombinace DAA dokáží již během osmi nebo 12 týdnů vyléčit
více než 95 % nemocných, jimž není třeba aplikovat interferon
(tzv. interferon free therapy). Nástup nové, výrazně účinnější
a bezpečnější léčby však přináší také určit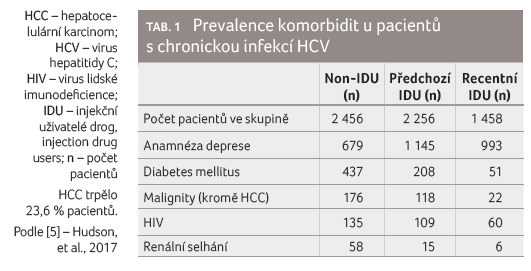 á
negativa ‒ kromě vysoké ceny takové léčby jsou důležitým
problémem lékové interakce, s nimiž je třeba počítat
zejména u pacientů, kteří se kromě infekce HCV léčí
i s dalšími chorobami.
á
negativa ‒ kromě vysoké ceny takové léčby jsou důležitým
problémem lékové interakce, s nimiž je třeba počítat
zejména u pacientů, kteří se kromě infekce HCV léčí
i s dalšími chorobami.
Britští autoři zjišťovali frekvenci komorbidit a frekvenci
užívání léků pro tyto komorbidity u 6 278 pacientů
s chronickou infekcí HCV, kteří byli indikováni k léčbě
DAA [5]. Medián věku pacientů byl 52 let a 70,4 % tvořili
muži. Tito pacienti byli rozděleni do tří skupin podle
vztahu k parenterálně podávaným návykovým látkám –
injekční uživatelé drog (injecting drug users, IDU). Do první
skupiny byli zařazeni pacienti, kteří nikdy návykové látky
parenterálně neužívali (non IDU), do druhé pacienti,
kteří parenterálně užívali návykové látky v minulosti
(předchozí IDU), a do třetí pacienti, kteří během
léčby parenterálně užívali návykové látky (recentní IDU).
Výsledky jsou uvedeny v tabulce 1, tabulka 2
pak uvádí počty pacientů užívajících vyjmenované skupiny
léků.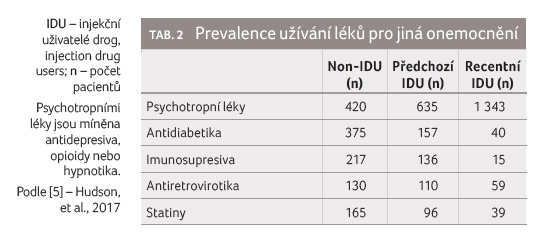
Další autoři zjistili, že pacienti léčení DAA pro chronickou infekci HCV užívali kromě výše uvedených lékových skupin též inhibitory angiotenzin konvertujícího enzymu nebo sartany, diuretika, betablokátory nebo blokátory kalciových kanálů, inhibitory protonové pumpy a řadu dalších léků [6]. Tři a více léků užívalo 40 % pacientů s nezávažným postižením jater a 51 % pacientů se závažnějším postižením jater. Proto nepřekvapí, že epidemiologická studie u 461 jedinců léčených DAA zjistila, že 60 % z nich bylo vystaveno klinicky závažné lékové interakci s alespoň jedním lékem ze skupiny DAA [7]. Z výše uvedeného je zřejmé, že pacienti léčení pro infekci HCV trpí kromě infekce virem lidské imunodeficience (HIV) i četnými tzv. civilizačními chorobami, jako je deprese, diabetes mellitus a hypercholesterolemie, a že v nezanedbatelné míře užívají léky na taková onemocnění. Z toho lze usuzovat, že i řada pacientů léčených DAA v ČR navštěvuje své praktické lékaře i jiné specialisty (např. psychiatr, diabetolog, internista), kteří jim předepisují vlastní léky a kteří si nemusejí být vědomi lékových interakcí s moderními léky na chronickou infekci HCV. Proto je tento článek cílen nejen na lékaře, kteří předepisují léky na chronickou infekci HCV, ale též na všechny ostatní lékaře, kteří pečují o pacienty léčící se (kromě jiného) i pro chronickou infekci HCV.
Vlastnosti přímo působících antivirotik proti infekci HCV z hlediska lékových interakcí
Přímo působící antivirotika proti infekci HCV lze rozdělit dle jejich mechanismu účinku do tří velkých skupin. Zaprvé jsou to inhibitory NS3/4A proteázy (boceprevir, simeprevir, paritaprevir, grazoprevir, glekaprevir, voxilaprevir, dosud neregistrovaný, ale prostřednictvím specifického lékového programu dostupný asunaprevir). Zadruhé se jedná o inhibitory nestrukturálního proteinu NS5A (daklatasvir, ledipasvir, ombitasvir, pibrentasvir, velpatasvir a elbasvir). Zatřetí jsou k dispozici inhibitory RNA polymerázy NS5B (dasabuvir a sofosbuvir). Příslušnost ke konkrétní skupině DAA lze snadno rozpoznat již z názvu léčivé látky. Inhibitory NS3/4A mají vždy název léčivé látky se zakončením previr, inhibitory NS5A využívají příponu asvir a inhibitory NS5B pak příponu buvir. Jednotlivá léčiva se ve skupinách obvykle rozdělují do generací, přičemž platí, že léčiva řazená do první generace jsou rizikovější z hlediska lékových interakcí.
Z tohoto hlediska je rovněž důležité, jaký mají jednotlivá léčiva osud v organismu, tj. jakou cestou se biotransformují a v organismu transportují, protože řada z nich působí jako inhibitory některých enzymových a transportních struktur, významná je též délka jejich biologického poločasu. Pro možnost vzájemného porovnání jsou tato léčiva (a jejich vlastnosti) v následujícím textu uvedena podle výše uvedených tří skupin.
Inhibitory NS3/4A
Z tabulky 3 je
zřejmé, že všechna léčiva je třeba k zajištění
optimální biologické dostupnosti užívat spolu s jídlem
nebo po jídle. Zvýšení hodnoty pH obsahu žaludku snižuje
biologickou dostupnost paritapreviru, voxilapreviru a glekapreviru.
Všechna léčiva se minimálně eliminují močí a prakticky
úplně se eliminují žlučí, a proto lze očekávat lékové
interakce ve fázi eliminace především na transportních
systémech v hepatocytech. Boceprevir, paritaprevir
a glekaprevir mají kratší biologický poločas než ostatní
léčiva, z tohoto důvodu lékové interak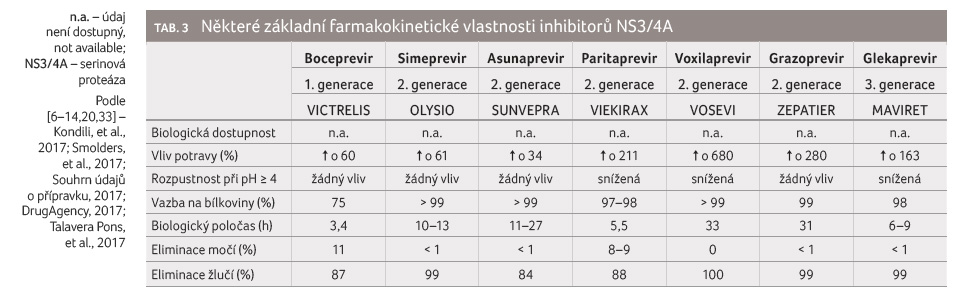 ce založené
na inhibici budou mít u těchto léčiv kratší dobu
trvání.
ce založené
na inhibici budou mít u těchto léčiv kratší dobu
trvání.
Všechny inhibitory NS3/4A jsou substráty efluxních
transportních systémů P glykoproteinu a s výjimkou
asunapreviru a paritapreviru i proteinu rezistence
karcinomu prsu (breast cancer resistance protein, BCRP). Současně
jsou všechny substráty influxních transportérů OATP1B1 a OATP1B3
(dále jen OATP1B1/3, tj. transportér organických aniontů, organic
anion transporting polypeptide), které se účastní první fáze
eliminace těchto léčiv hepatocytem. Všechny inhibitory NS3/4A
jsou dále substráty cytochromu P450 3A4 (CYP3A4). Tyto vlastnosti
vysvětlují lékové interakce, při nichž dochází k ovlivnění
a změnám farmakokinetiky (tab. 4). Inhibitory a induktory CYP3A4 zvyšují, resp.
snižují expozici inhibitorům NS3/4A, a proto je obvykle
podávání induktorů CYP3A4 kontraindikováno (kvůli riziku
poklesu až ztráty účinku) a podávání inhibitorů CYP3A4
obvykle není doporučeno (kvůli zvýš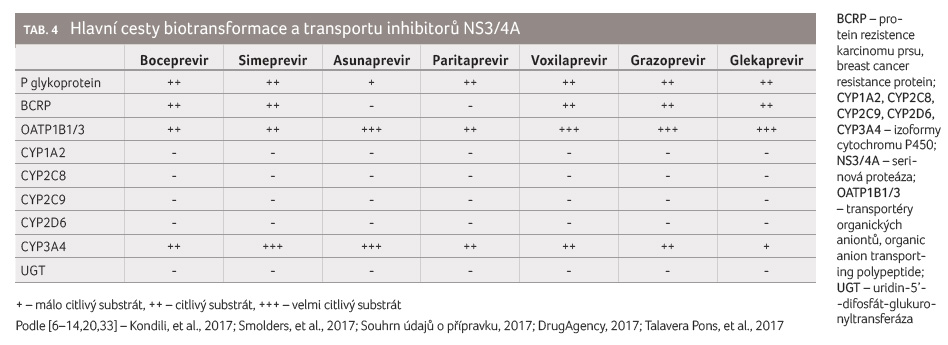 ení expozice a možnosti
vzniku nežádoucích účinků). Například simeprevir je velmi
citlivý substrát CYP3A4, a proto opakované užívání
silného inhibitoru CYP3A4 ritonaviru zvyšuje u zdravých
dobrovolníků expozici simepreviru o 618 % [15]. Paritaprevir
je méně citlivý substrát CYP3A4, z tohoto důvodu opakované
podávání silného inhibitoru CYP3A4 ketokonazolu zvyšuje expozici
paritapreviru o 117 % [16]. Glekaprevir je málo citlivý
substrát CYP3A4, a proto silné inhibitory CYP3A4 jen klinicky
nevýznamně vedou ke zvýšení expozice glekapreviru, zatímco
inhibitory CYP3A4 současně inhibující OATP1B1/3 (např.
atazanavir) tak činí velmi významně (až o 653 %) [17].
Obdobně silný inhibitor OATP1B1/3 rifampicin (v jednorázové
dávce) klinicky vysoce významně zvyšuje expozici dalším velmi
citlivým substrátům OPTP1B1/3, jako jsou asunaprevir (o 1 381 %)
[18], voxilaprevir (o 691 %) [12] nebo grazoprevir (o 921 %)
[19].
ení expozice a možnosti
vzniku nežádoucích účinků). Například simeprevir je velmi
citlivý substrát CYP3A4, a proto opakované užívání
silného inhibitoru CYP3A4 ritonaviru zvyšuje u zdravých
dobrovolníků expozici simepreviru o 618 % [15]. Paritaprevir
je méně citlivý substrát CYP3A4, z tohoto důvodu opakované
podávání silného inhibitoru CYP3A4 ketokonazolu zvyšuje expozici
paritapreviru o 117 % [16]. Glekaprevir je málo citlivý
substrát CYP3A4, a proto silné inhibitory CYP3A4 jen klinicky
nevýznamně vedou ke zvýšení expozice glekapreviru, zatímco
inhibitory CYP3A4 současně inhibující OATP1B1/3 (např.
atazanavir) tak činí velmi významně (až o 653 %) [17].
Obdobně silný inhibitor OATP1B1/3 rifampicin (v jednorázové
dávce) klinicky vysoce významně zvyšuje expozici dalším velmi
citlivým substrátům OPTP1B1/3, jako jsou asunaprevir (o 1 381 %)
[18], voxilaprevir (o 691 %) [12] nebo grazoprevir (o 921 %)
[19].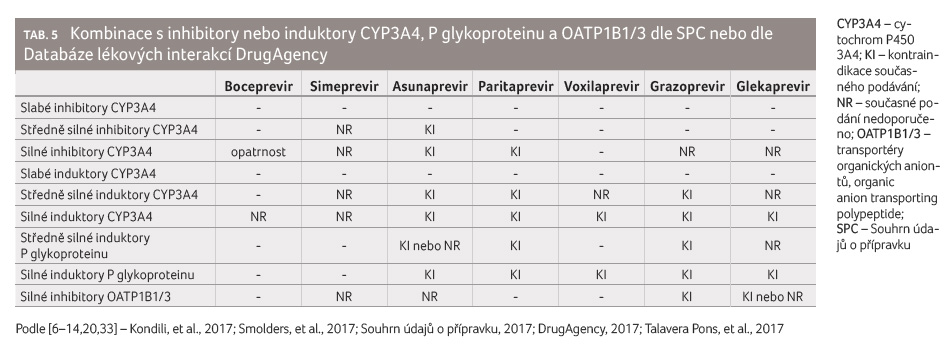
Expozici a tím i účinnost a bezpečnost léčby některými inhibitory NS3/4A ovlivňují současně podávaná léčiva, která mají inhibiční nebo indukční účinek na CYP3A4, OATP1B1/3 nebo na P glykoprotein. Stručný přehled vycházející z údajů držitelů rozhodnutí o registraci a informací uvedených v Souhrnu údajů o přípravku (SPC) je uveden v tabulce 5.
Na otázku, která léčiva jsou slabé, středně silné
nebo silné inhibitory či induktory výše uvedených enzymových
nebo transportních systémů, odpovídá tabulka 6, která příslušná léčiva s inhibičním nebo
indukčním účinkem uvádí dle síly jejich působení.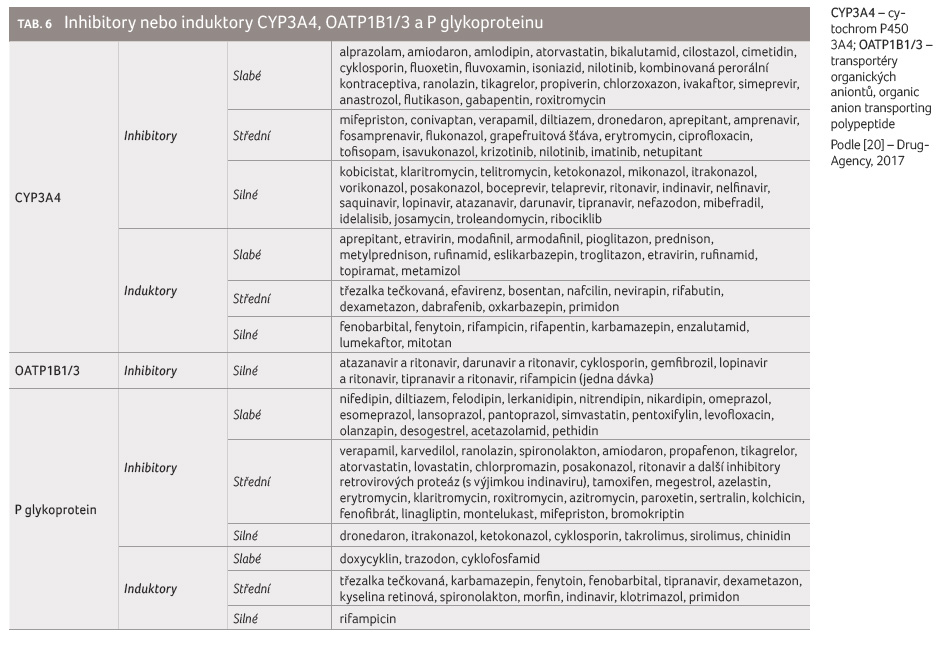
Samozřejmostí by při terapii inhibitory NS3/4A mělo být
vyloučení pití grapefruitové šťávy a pojídání
grapefruitů (nebo plodů pomela), neboť látky obsažené v těchto
citrusových plodech působí jako středně silný až silný
inhibitor CYP3A4 a P glykoproteinu, a potenciálně
tak mohou vést ke zvýšení expozice všem inhibitorům NS3/4A
a zvýšení výskytu jejich nežádoucích účinků. Naproti
tomu ind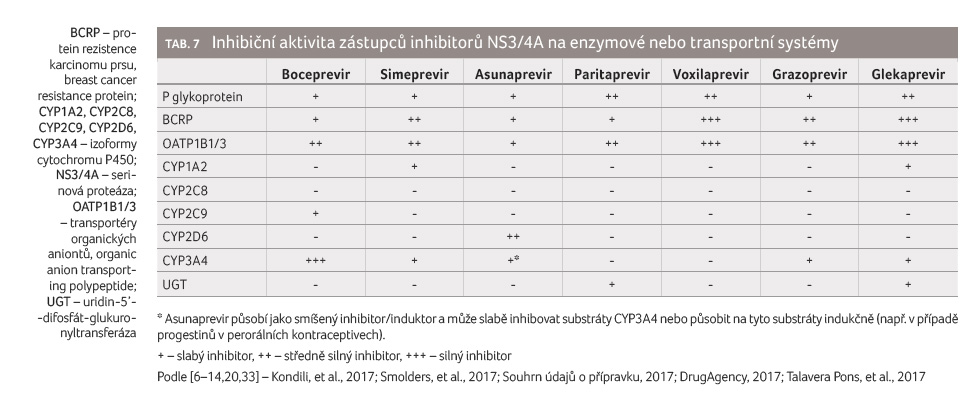 uktory CYP3A4 a P glykoproteinu, jako je třezalka
tečkovaná, šalvěj červenokořenná, ženšen pravý a řada
dalších rostlinných léčiv, by mohly vést k poklesu až
ztrátě antivirového účinku těchto léčiv.
uktory CYP3A4 a P glykoproteinu, jako je třezalka
tečkovaná, šalvěj červenokořenná, ženšen pravý a řada
dalších rostlinných léčiv, by mohly vést k poklesu až
ztrátě antivirového účinku těchto léčiv.
Inhibitory NS3/4A jsou slabými až velmi silnými inhibitory řady
enzymových nebo transportních systémů (tab. 7). Boceprevir je silný inhibitor CYP3A4. Glekaprevir je
silný inhibitor BCRP a OATP1B1/3, zatímco voxilaprevir je
silný inhibitor BCRP a velmi silný inhibitor OATP1B1/3.
Typickým substrátem transportních systémů BCRP a OATP1B1/3
je rosuvastatin. Podávání glekapreviru zvyšuje expozici
rosuvastatinu o 115 % a jeho maximální plazmatické koncentrace o 462 % [14]. Podávání voxilapreviru zvyšuje
expozici rosuvastatinu o 640 %, a jeho maximální
plazmatické koncentrace dokonce o 1 790 % [12]. Vliv
inhibitorů NS3/4A na expozici statinům je obecně významný
(tab. 8).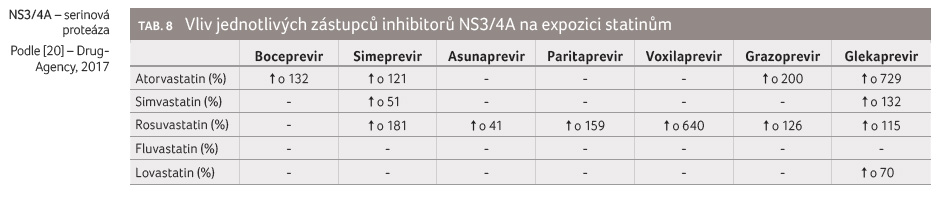
V případě bocepreviru je kontraindikováno současné podávání simvastatinu a lovastatinu (tedy statinů metabolizovaných cestou CYP3A4). V případě simepreviru je nabádáno k opatrnosti s nutností pečlivého titrování dávky statinů. V případě asunapreviru je též nabádáno k opatrnosti. V případě paritapreviru je současné podávání simvastatinu, lovastatinu i atorvastatinu (tedy statinů metabolizovaných cestou CYP3A4) kontraindikováno (kontraindikace je však způsobena obsahem ritonaviru ve fixní kombinaci s paritaprevirem, nikoliv samotným tímto léčivem). Podávání pravastatinu nebo rosuvastatinu je s opatrností možné. V případě voxilapreviru je současné užívání rosuvastatinu kontraindikováno, podávání ostatních statinů (s výjimkou pravastatinu) se nedoporučuje, protože dosud není známo, zda k lékovým interakcím s těmito statiny dochází. V případě grazopreviru je třeba opatrnosti a redukce dávek statinů (např. nepřekračovat denní dávku rosuvastatinu ve výši 10 mg). V případě glekapreviru je kontraindikováno současné podávání atorvastatinu a simvastatinu, podávání lovastatinu není doporučeno a dávky pravastatinu a rosuvastatinu se mají snížit na 20 mg, resp. na 5 mg denně.
Klinicky relevantní inhibiční efekt většiny inhibitorů
NS3/4A na efluxní transportní systém P glykoproteinu se může
projevit lékovou interakcí se substráty P glykoproteinu, jako jsou
digoxin, dabigatran etexilát nebo cyklosporin. V případě
užívání voxilapreviru nebo glekapreviru došlo ke zvýšení
expozice dabigatranu o 161 % [12], resp. o 138 % [14].
Opatrnost při podávání inhibitorů NS3/4A a antagonistů
vitaminu K souvisí se změnami v aktivitě enzymu
vitamin K reduktáza a se schopností jaterní tkáně
syntetizovat koagulační faktory, přičemž tyto změny mohou být
během terapie infekce HCV klinicky významné. Monitorování
hodnoty INR (international normalized ratio)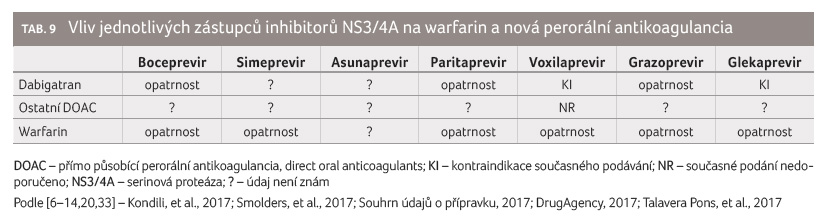 a případná
úprava dávky warfarinu jsou také plně namístě. Též podávání
DAA působícího jen málo lékových interakcí, jako je
sofosbuvir, může vést k nutnosti zvýšení dávek warfarinu
až na 77,5 mg týdně během dvanáctitýdenní terapie
infekce HCV [21] (tab. 9).
a případná
úprava dávky warfarinu jsou také plně namístě. Též podávání
DAA působícího jen málo lékových interakcí, jako je
sofosbuvir, může vést k nutnosti zvýšení dávek warfarinu
až na 77,5 mg týdně během dvanáctitýdenní terapie
infekce HCV [21] (tab. 9).
Asunaprevir jako jediný inhibitor NS3/4A je středně silným inhibitorem CYP2D6 a jeho podávání zvyšuje expozici typickému substrátu CYP2D6 dextrometorfanu o 294 % [18]. Tato vlastnost asunapreviru je velmi významná, neboť substrátem CYP2D6 je řada běžně používaných léčiv (tramadol, tamoxifen, metoprolol, řada antidepresiv nebo antipsychotik).
Inhibitory NS5A
K zajištění optimální biologické dostupnosti je třeba
ombitasvir a pibrentasvir užívat spolu s jídlem nebo
po jídle, zatímco velpatasvir, daklatasvir, ledipasvir
a elbasvir, u nichž jídlo klinicky význ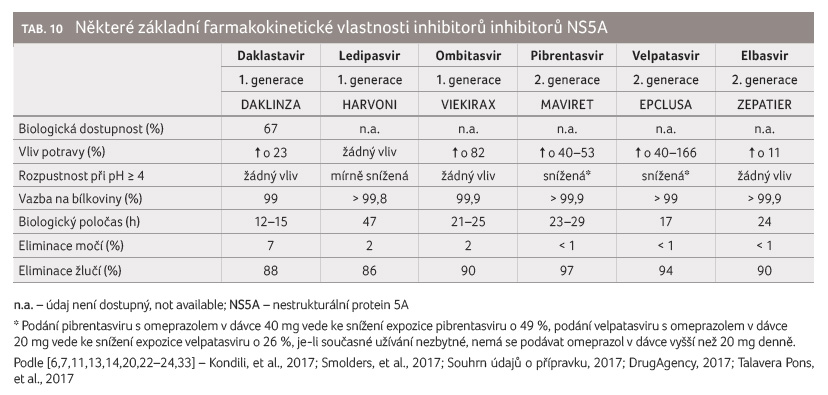 amně neovlivňuje
biologickou dostupnost, je možné podávat nezávisle na jídle.
Zvýšení hodnoty pH obsahu žaludku snižuje biologickou dostupnost
pibrentasviru a velpatasviru. To má význam z hlediska
souběžného podávání inhibitorů protonové pumpy. V případě
pibrentasviru se nedoporučuje překračovat denní dávku omeprazolu
20 mg (případně ekvivalentu jiného inhibitoru protonové
pumpy). V případě velpatasviru se podávání inhibitorů
protonové pumpy nedoporučuje, je li však nezbytné, nemá se
překračovat denní dávka 20 mg omeprazolu, kterou je navíc
nutné užít alespoň čtyři hodiny po podání velpatasviru.
Všechna léčiva se minimálně eliminují močí, a proto lze
očekávat lékové interakce ve fázi eliminace především
na transportních systémech v hepatocytech. Všechna
léčiva mají dlouhý biologický poločas, z tohoto důvodu
lze očekávat, že lékové interakce založené na inhibici
budou mít u těchto léčiv dlouhou dobu trvání (tab. 10).
amně neovlivňuje
biologickou dostupnost, je možné podávat nezávisle na jídle.
Zvýšení hodnoty pH obsahu žaludku snižuje biologickou dostupnost
pibrentasviru a velpatasviru. To má význam z hlediska
souběžného podávání inhibitorů protonové pumpy. V případě
pibrentasviru se nedoporučuje překračovat denní dávku omeprazolu
20 mg (případně ekvivalentu jiného inhibitoru protonové
pumpy). V případě velpatasviru se podávání inhibitorů
protonové pumpy nedoporučuje, je li však nezbytné, nemá se
překračovat denní dávka 20 mg omeprazolu, kterou je navíc
nutné užít alespoň čtyři hodiny po podání velpatasviru.
Všechna léčiva se minimálně eliminují močí, a proto lze
očekávat lékové interakce ve fázi eliminace především
na transportních systémech v hepatocytech. Všechna
léčiva mají dlouhý biologický poločas, z tohoto důvodu
lze očekávat, že lékové interakce založené na inhibici
budou mít u těchto léčiv dlouhou dobu trvání (tab. 10).
Jak již bylo uvedeno, je zvláštností fixní kombinace ombitasviru s paritaprevirem přidání ritonaviru (léčivý přípravek Viekirax), což je silný smíšený inhibitor/induktor CYP3A4 a středně silný inhibitor CYP2D6 a P glykoproteinu. Ritonavir je ve fixní kombinaci obsažen k optimalizaci farmakokinetických vlastností ombitasviru i paritapreviru (zvyšuje jejich plazmatické koncentrace a prodlužuje jejich biologický poločas). Vlivem obsahu ritonaviru (denní dávka ritonaviru činí 100 mg) má tato fixní kombinace patrně nejvíce závažných lékových interakcí [25,26]. Ritonavir dokonce u pacienta léčeného budesonidem vyvolal Cushingův syndrom [27].
Všechny inhibitory NS5A jsou citlivé substráty efluxních
transportních systémů P glykoproteinu a BCRP (tab. 11).
Inhibitory a induktory těchto transportních systémů vedou
obvykle k závažným lékovým interakcím, v jejich
důsledku dochází ke zvýšení expozice a zvýšení
rizika vzniku nežádoucích účinků, resp. k poklesu až
ztrátě antivirového účinku. Z tohoto důvodu jsou kombinace
inhibitorů NS5A zejména se silnými induktory P glykoproteinu
(a/nebo CYP3A4) považovány za nedoporučené nebo
kontraindikované. Na rozdíl od inhibitorů NS3/4A nejsou
inhibitory NS5A substráty OATP1B1/3, výjimkou je pouze velpatasvi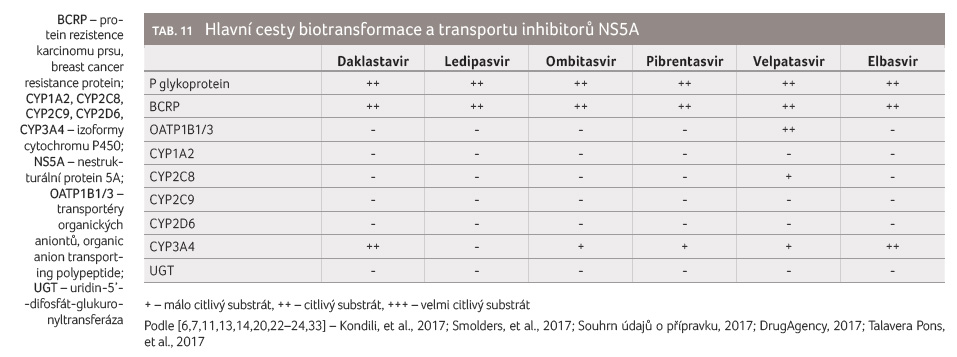 r,
který je citlivým substrátem OATP1B1/3.
r,
který je citlivým substrátem OATP1B1/3.
Vzhledem k tomu, že všechny inhibitory NS5A jsou citlivé substráty BCRP, je nezbytná opatrnost při jejich kombinaci s přírodními inhibitory BCRP, jako je např. kurkuma. Byly totiž publikovány výsledky studie, v níž byla zdravým dobrovolníkům podána jednorázová dávka sulfasalazinu (typický substrát BCRP) ve výši 0,1 mg nebo 2 g za 30 minut po užití jednorázové dávky kurkuminu ve výši 2 g [28]. V případě mikrodávky sulfasalazinu zvýšil kurkumin jeho expozici o 86 %, v případě plné terapeutické dávky sulfasalazinu došlo ke zvýšení jeho expozice o 222 %.
Některé inhibitory NS5A působí též jako inhibitory některých
enzymových nebo transportních struktur (tab. 12).
Nejvý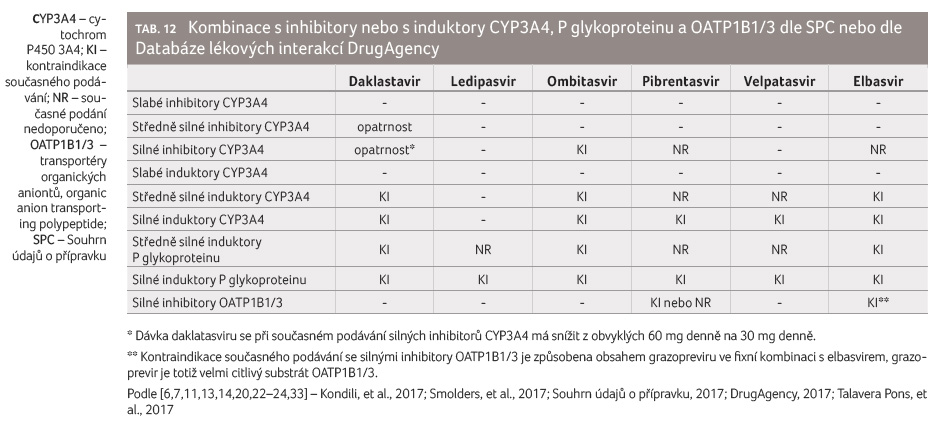 znamnější inhibiční efekt na BCRP má ledipasvir,
který zvyšuje expozici citlivému substrátu BCRP rosuvastatinu
o 699 %, a jeho maximální plazmatické koncentrace
zvyšuje dokonce o 1 670 %. Dalším mechanismem
uplatňujícím se při této lékové interakci je inhibice
OATP1B1/3 ledipasvirem. Tato interakce je také důvodem pro
kontraindikaci současného podávání ledipasviru s rosuvastatinem.
znamnější inhibiční efekt na BCRP má ledipasvir,
který zvyšuje expozici citlivému substrátu BCRP rosuvastatinu
o 699 %, a jeho maximální plazmatické koncentrace
zvyšuje dokonce o 1 670 %. Dalším mechanismem
uplatňujícím se při této lékové interakci je inhibice
OATP1B1/3 ledipasvirem. Tato interakce je také důvodem pro
kontraindikaci současného podávání ledipasviru s rosuvastatinem.
Podobně jako u inhibitorů NS3/4A působí některé
inhibitory NS5A blokádu P glykoproteinové efluxní pumpy (tab. 13).
V důsledku této blokády může docházet ke zvýšení
expozice substrátům P glykoproteinu, jako jsou digoxin nebo
dabigatran etexilát.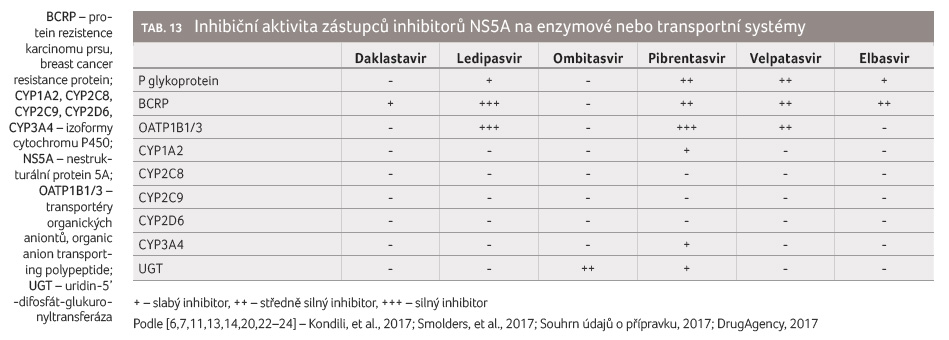
Ombitasvir a pibrentasvir inhibují UGT1A1 (uridin 5’ difosfát glukuronyltransferáza 1A1), což je enzym odpovědný za konečnou fázi biotransformace (glukuronizaci) řady léčiv, např. raltegraviru nebo irinotekanu. Inhibice pibrentasvirem není klinicky významná, inhibice ombitasvirem však klinicky významná může být.
Inhibitory NS5B
Z tabulky 14
je zřejm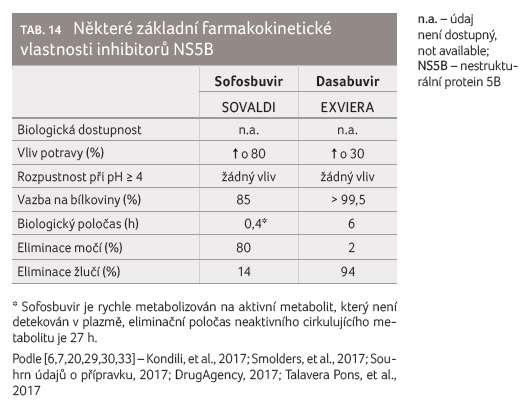 é, že obě léčiva je třeba k zajištění
optimální biologické dostupnosti užívat spolu s jídlem
nebo po jídle. Zvýšení hodnoty pH obsahu žaludku nesnižuje
biologickou dostupnost sofosbuviru ani dasabuviru. Sofosbuvir se
eliminuje převážně močí, dasabuvir se eliminuje prakticky úplně
žlučí. Obě léčiva mají kratší biologický poločas, a proto
lékové interakce založené na inhibici budou mít u těchto
léčiv kratší dobu trvání.
é, že obě léčiva je třeba k zajištění
optimální biologické dostupnosti užívat spolu s jídlem
nebo po jídle. Zvýšení hodnoty pH obsahu žaludku nesnižuje
biologickou dostupnost sofosbuviru ani dasabuviru. Sofosbuvir se
eliminuje převážně močí, dasabuvir se eliminuje prakticky úplně
žlučí. Obě léčiva mají kratší biologický poločas, a proto
lékové interakce založené na inhibici budou mít u těchto
léčiv kratší dobu trvání.
Oba inhibitory NS5B jsou substráty efluxních transportních
systémů P glykoproteinu i BCRP (tab. 15). Dasabuvir je navíc citlivým substrátem OATP1B1/3.
Dasabuvir je jako jediné DAA citlivým substrátem CYP2C8. Současné
podávání dasabuviru se silným inhibitorem CYP2C8 gemfibrozilem
vedlo k jedenáctinásobnému zvýšení expozice dasabuviru,
a proto držitel rozhodnutí o registraci dasabuviru
považuje současné užívání silných inhibitorů CYP2C8
za kontraindikované [31]. V této souvislosti je nezbytné
uvést, že gemfibrozil není v ČR registrován. Na trhu
s léčivy je však jiný silný inhibitor CYP2C8, a to
klopidogrel.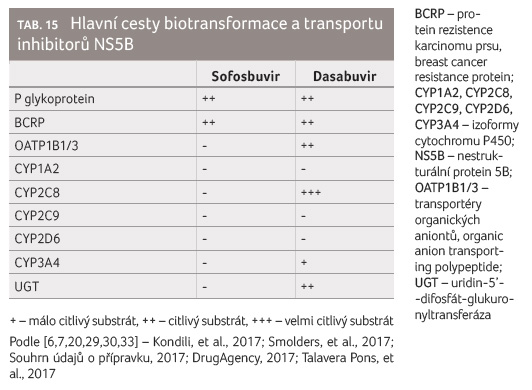
Dasabuvir je dále málo citlivý substrát CYP3A4. Přesto je
jeho podávání se silnými inhibitory CYP3A4 kontraindikováno.
Důvodem je skutečnost, že dasabuvir se podává vždy současně
s fixní kombinací ombitasvir, paritaprevir a ritonavir,
u které je současné podávání silných inhibitorů CYP3A4
kontraindikováno. Induktory CYP3A4 snižují expozici dasabuvi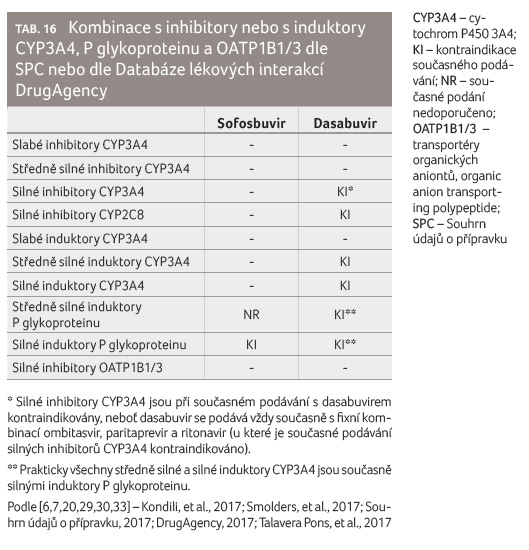 ru,
a proto je podávání silných induktorů CYP3A4
kontraindikováno (pro riziko snížení až ztráty účinku).
Sofosbuvir je substrát P glykoproteinu, a proto je jeho
současné podávání se silnými induktory P glykoproteinu
kontraindikováno a v případě středně silných
induktorů P glykoproteinu není doporučeno (tab. 16).
ru,
a proto je podávání silných induktorů CYP3A4
kontraindikováno (pro riziko snížení až ztráty účinku).
Sofosbuvir je substrát P glykoproteinu, a proto je jeho
současné podávání se silnými induktory P glykoproteinu
kontraindikováno a v případě středně silných
induktorů P glykoproteinu není doporučeno (tab. 16).
Na otázku, která léčiva jsou slabé, středně silné nebo silné inhibitory CYP2C8, odpovídá tabulka 17, jež příslušná léčiva s inhibičním nebo indukčním účinkem uvádí podle síly jejich působení.
Sofosbuvir nemá lékové interakce způsobené jeho inhibičním účinkem, zatímco dasabuvir působí jako silný inhibitor BCRP a OATP1B1/3 a středně silný inhibitor UGT1A1 (tab. 18).
Přehled důsledků kombinací DAA s běžně užívanými
léčivými přípravky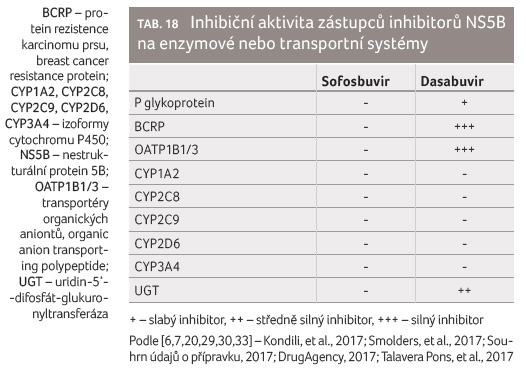
Jak již bylo uvedeno, jsou u pacientů trpících infekcí
HCV poměrně často přítomny komorbidity, a proto tito
nemocní poměrně běžně užívají více léčiv. Přímo
působící antivirotika představují řadu klinicky závažných
lékových interakcí, jimž je nejlépe předcházet výběrem
vhodných alternativ [32‒35]. Z důvodu jednoznačnosti
v náhledu na bezpečnou komedikaci byl připraven seznam
60 potenciálně nejčastěji užívaných léčiv a bylo
kvantifikováno riziko lékových interakcí vyplývajících
z takových kombinací. Přehledný seznam přináší tabulka 19.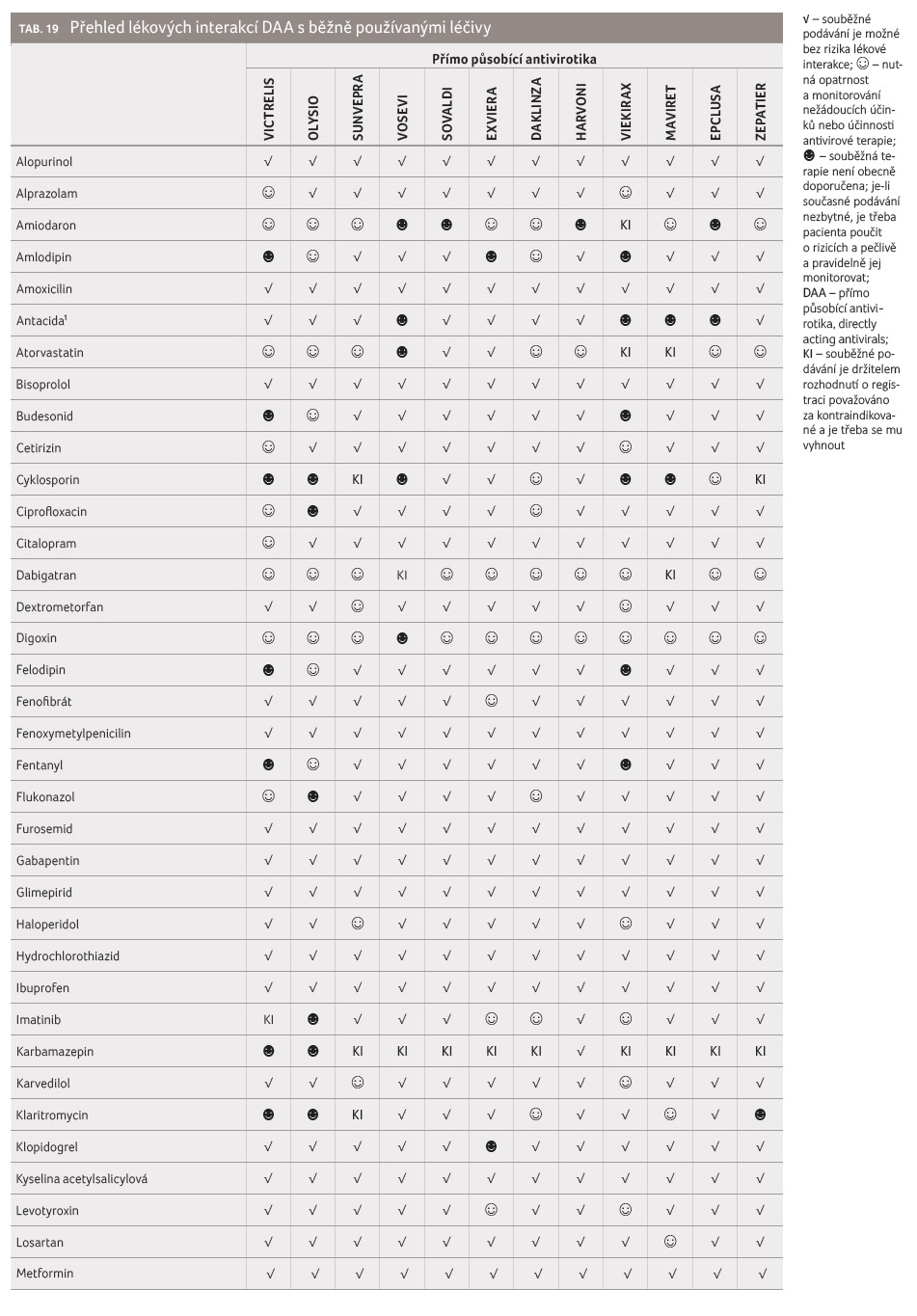
Obdobný přehled (tab. 20) byl zpracován i pro některá běžně užívaná fytofarmaka s indukčním (jinan dvoulaločný, lékořice lysá, máta peprná, rdesno hlavaté, sója luštinatá, šalvěj červenokořenná, třapatka nachová, třezalka tečkovaná, ženšen pravý) nebo inhibičním (klanopraška čínská, kurkuma dlouhá, pepř černý, šišák bajkalský) účinkem na systém CYP3A4/P glykoproteinu.
Závěr
Z výše uvedeného je zřejmé, že u DAA byla zjištěna
řada důležitých lékových interakcí, které mohou ovlivnit
jednak plazmatické koncentrace DAA a jejich účinnost, jednak
naopak DAA mohou ovlivnit plazmatické koncentrace jiných, současně
užívaných léčiv. Ačkoliv DAA mají mnohem méně nežádoucích
účinků než dosud užívané kombinace interferonu s ribavirinem
a jsou výrazně účinnější, podávání DAA
s interagujícími léčivy by mohlo poměr přínosů a rizik
DAA zvrátit nežádoucím směrem. Podávání silných nebo středně
silných induktorů CYP3A4 a/nebo P glykoproteinu (např.
karbamazepin, fenytoi n, dexametazon, třezalka tečkovaná) snižuje
plazmatické koncentrace většiny DAA, a navozuje tak
„rezistenci“ pacienta k této léčbě. To má negativní
důsledky nejen klinické, ale i ekonomické vzhledem k vysoké
ceně takové léčby. Kromě třezalky tečkované má indukční
efekt na CYP3A4 a/nebo P glykoprotein řada dalších léčivých
rostlin (např. sója luštinatá, ženšen pravý) a také
potravinových doplňků, které extrakty z rostlin nebo
purifikované látky z nich obsahují. Jsou popsány případy
selhání protinádorové terapie při podávání takových
potravinových doplňků, po jejichž vysazení se protinádorový
účinek opět dostavil v plné síle. Totéž lze očekávat
i v případě léčby DAA, proto by měl lékař pacienty
o riziku podávání příslušných doplňků stravy řádně
poučit.
n, dexametazon, třezalka tečkovaná) snižuje
plazmatické koncentrace většiny DAA, a navozuje tak
„rezistenci“ pacienta k této léčbě. To má negativní
důsledky nejen klinické, ale i ekonomické vzhledem k vysoké
ceně takové léčby. Kromě třezalky tečkované má indukční
efekt na CYP3A4 a/nebo P glykoprotein řada dalších léčivých
rostlin (např. sója luštinatá, ženšen pravý) a také
potravinových doplňků, které extrakty z rostlin nebo
purifikované látky z nich obsahují. Jsou popsány případy
selhání protinádorové terapie při podávání takových
potravinových doplňků, po jejichž vysazení se protinádorový
účinek opět dostavil v plné síle. Totéž lze očekávat
i v případě léčby DAA, proto by měl lékař pacienty
o riziku podávání příslušných doplňků stravy řádně
poučit.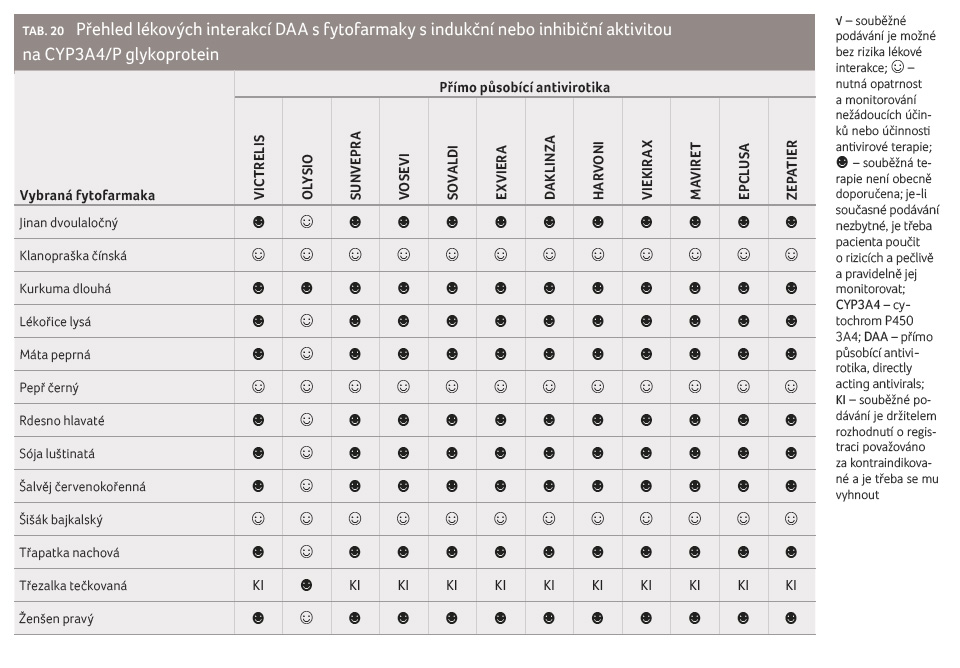
Léčba DAA může trvat také pouze osm týdnů a lékaři mohou mít pocit, že za tak krátkou dobu se nemohou projevit žádné závažné důsledky interakce DAA se statiny, jako je například rhabdomyolýza. Důkazy dostupné z populačních studií, kde krátkodobé podávání klaritromycinu (inhibitor CYP3A4 a P glykoproteinu) zvýšilo počet nežádoucích účinků statinů včetně rhabdomyolýz a mělo za následek i vzestup mortality, dokazují opak, neboť klaritromycin byl obvykle podáván pouze po dobu 7‒10 dnů [36,37]. Z toho lze usoudit, že přinejmenším některá DAA jsou schopná poškodit pacienty podobným způsobem, neboť podobně jako klaritromycin i ona zvyšují plazmatické koncentrace statinů několikanásobně (viz tab. 8).
Pacienty mohou poškodit rovněž lékové interakce DAA, které dosud nebyly prokázány, ale které pravděpodobně existují a zřejmě budou klinicky významné alespoň u některých pacientů. Z tabulky 2 je zřejmé, že pacienti s chronickou infekcí HCV nejčastěji užívají psychotropní léky, resp. antidepresiva. Přitom prakticky všechna antidepresiva jsou substráty P glykoproteinu. Z tabulek 7, 13 a 18 je zřejmé, že řada inhibitorů NS3/4A, řada inhibitorů NS5A a dasabuvir jsou inhibitory P glykoproteinu. Inhibicí P glykoproteinu, který je kromě jiného exprimován ve střevě a na hematoencefalické bariéře, se takové antidepresivum vstřebá větší měrou do systémového oběhu a větší měrou též přechází přes hematoencefalickou bariéru do centrálního nervového systému. To samozřejmě může vyvolat vznik nežádoucích účinků včetně obávaného serotoninového syndromu (zejména u selektivních inhibitorů zpětného vychytávání serotoninu, které jsou nejvíce užívanou skupinou antidepresiv). Z toho je zřejmé, že i pacientův psychiatr by měl vědět, že dotyčný podstupuje léčbu DAA, a měl by s tímto faktem počítat při rozhodování o indikaci a dávkování psychofarmak. Také lékař předepisující warfarin by měl vědět, že v průběhu léčby DAA se pravděpodobně bude měnit terapeutická odpověď na warfarin a že dávky bude nutno znovu vytitrovat na potřebnou úroveň. Podobně to bude u lékařů předepisujících klaritromycin (u něhož bylo prokázáno, že i krátkodobé podání může pacienta poškodit lékovou interakcí), u lékařů předepisujících inhibitory protonové pumpy, amlodipin, verapamil nebo jiné běžně užívané léky.
Pacienti postupně začínají užívat řadu nových, velmi účinných a bezpečných léků, k nimž kromě antidiabetik, léků na HIV nebo imunosupresiv nově patří i DAA. Lékaři, kteří takové léky předepisují, si problematiku jejich podávání brzy osvojí, ostatní ošetřující lékaři takových pacientů by měli alespoň vědět, že indikací určitých léků mohou nemocné poškodit a že se mají včas seznámit s úskalími takové specializované medikace, kterou jejich pacient užívá.
Seznam použité literatury
- [1] Husa P. Novinky v léčbě hepatididy C. Interní Med 2015; 17: 26‒27.
- [2] WHO, regional office for Europe: Data and statistics, Fact sheet – Hepatitis C in the WHO European Region. Dostupné na: http://www.euro.who.int/en/health‑topics/communicable‑diseases/hepatitis/data‑and‑statistics
- [3] European Centre for Disease Prevention and Control (ECDC), Hepatitis C surveillance in Europe 2013. Dostupné na: https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/hepatitis‑c‑surveillance‑in‑europe‑2013.pdf
- [4] Chlíbek R, Smetana J, Šošovičková R, et al. Výsledky séroprevalenční studie HCV infekce u dospělých v ČR, prezentováno v rámci Hradeckých virologických dnů, Hradec Králové 12.‒13. října 2016.
- [5] Hudson B, Walker AJ, Irving WL. Comorbidities and medications of patients with chronic hepatitis C under specialist care in the UK. J Med Virol 2017; 89: 2158‒2164.
- [6] Kondili LA, Gaeta GB, Ieluzzi D, et al. Real‑life data on potential drug‑drug interactions in patients with chronic hepatitis C viral infection undergoing antiviral therapy with interferon‑free DAAs in the PITER Cohort Study. PLoS One 2017; 12: e0172159.
- [7] Smolders EJ, Berden FA, de Kanter CT, et al. The majority of hepatitis C patients treated with direct acting antivirals are at risk for relevant drug‑drug interactions. United European Gastroenterol J 2017; 5: 648‒657.
- [8] SPC Victrelis (boceprevir 200 mg), Merck Sharp & Dohme 11/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑ _Product_Information/human/002332/WC500109786.pdf
- [9] SPC Olysio (simeprevir 150 mg), Janssen‑Cilag 8/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/002777/WC500167867.pdf
- [10] Sunvepra (asunaprevir 100 mg), Swords Laboratories 6/2017. Dostupné na: http://www.sukl.cz/modules/medication/search.php
- [11] SPC Viekirax (ombitasvir 12,5 mg, paritaprevir 75 mg a ritonavir 50 mg), AbbVie 11/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003839/WC500183997.pdf
- [12] SPC Vosevi (sofosbuvir 400 mg, velpatasvir 100 mg a voxilaprevir 100 mg), Gilead Science 9/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004350/WC500235373.pdf
- [13] SPC Zepatier (elbasvir 50 mg a grazoprevir 100 mg), Merck Sharp & Dohme 5/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004126/WC500211235.pdf
- [14] SPC Maviret (glekaprevir 100 mg a pibrentasvir 40 mg), AbbVie 8/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004430/WC500233677.pdf
- [15] Sekar V, et al. Poster No 1076 prezentovaný v rámci 45th Annual Meeting of the European Association for the Study of the Liver (EASL), Vídeň 14.‒18. dubna 2010.
- [16] Badri PS, Dutta S, Wang H, et al. Drug Interactions with the Direct‑Acting Antiviral Combination of Ombitasvir and Paritaprevir‑Ritonavir. Antimicrob Agents Chemother 2015; 60: 105‒114.
- [17] Lin CW, Dutta S, Zhao W, et al. Pharmacokinetic Interactions and Safety of Coadministration of Glecaprevir and Pibrentasvir in Healthy Volunteers. Eur J Drug Metab Pharmacokinet 2017, Jul 7; doi: 10.1007/s13318‑017‑0428‑8
- [18] Eley T, Han YH, Huang SP, et al. Organic Anion Transporting Polypeptide‐Mediated Transport of, and Inhibition by, Asunaprevir, an Inhibitor of Hepatitis C Virus NS3 Protease. Clin Pharmacol Ther 2015; 97: 159‒166.
- [19] Caro L, et al. Pharmacokinetic interaction between the HCV protease inhibitor MK‑5172 and IV and oral rifampicin in healthy volunteers. Hepatology 2013; 58 (Suppl): 446A‒447A.
- [20] Databáze lékových interakcí DrugAgency, DrugAgency 2017. Dostupné na: http://www.lekoveinterakce.cz
- [21] Peterson D, Van Ermen A. Increased warfarin requirements in a patient with chronic hepatitis C infection receiving sofosbuvir and ribavirin. Am J Health Syst Pharm 2017; 74: 888‒892.
- [22] SPC Daklinza (daklatasvir 30 mg, 60 mg nebo 90 mg), Bristol‑Myers Squibb 3/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003768/WC500172848.pdf
- [23] SPC Harvoni (ledipasvir 90 mg a sofosbuvir 400 mg), Gilead Sciences 12/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003850/WC500177995.pdf
- [24] SPC Epclusa (sofosbuvir 400 mg a velpatasvir 100 mg), Gilead Sciences 10/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004210/WC500211151.pdf
- [25] González‑Colominas E, Londoño MC, Morillas RM, et al. Potential Drug‑Drug Interactions of Ombitasvir, Paritaprevir/Ritonavir ± Dasabuvir ± Ribavirin in Clinical Practice. J Gastroenterol Hepatol 2017, Oct 10; doi: 10.1111/jgh.14014
- [26] Shebley M, Liu J, Kavetskaia O, et al. Mechanisms and Predictions of Drug‑Drug Interactions of the Hepatitis C Virus Three Direct‑Acting Antiviral Regimen: Paritaprevir/Ritonavir, Ombitasvir, and Dasabuvir. Drug Metab Dispos 2017; 45: 755‒764.
- [27] Yeoh SW. Iatrogenic Cushing Syndrome from Interaction Between Ritonavir and Oral Budesonide During Direct Acting Antiviral Hepatitis C Therapy. J Clin Exp Hepatol 2016; 6: 246‒249.
- [28] Kusuhara H, Furuie H, Inano A, et al. Pharmacokinetic interaction study of sulphasalazine in healthy subjects and the impact of curcumin as an in vivo inhibitor of BCRP. Br J Pharmacol 2012; 166: 1793‒1803.
- [29] SPC Sovaldi (sofosbuvir 400 mg), Gilead Sciences 10/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/002798/WC500160597.pdf
- [30] SPC Exviera (dasabuvir 250 mg), AbbVie 12/2017. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003837/WC500182233.pdf
- [31] Menon RM, Badri PS, Wang T, et al. Drug‑drug interaction profile of the all‑oral anti‑hepatitis C virus regimen of paritaprevir/ritonavir, ombitasvir, and dasabuvir. J Hepatol 2015; 63: 20‒29.
- [32] Kiser JJ. Clinically Significant Drug‑Drug Interactions Between Hepatitis C Virus and HIV Treatments. Top Antivir Med 2016; 24: 106‒110.
- [33] Talavera Pons S, Boyer A, Lamblin G, et al. Managing drug‑drug interactions with new direct‑acting antiviral agents in chronic hepatitis C. Br J Clin Pharmacol 2017; 83: 269‒293.
- [34] Binda C, Tortora A, Garcovich M, et al. Toxicity and risks from drug‑to‑drug interactions of new antivirals for chronic hepatitis C. Eur Rev Med Pharmacol Sci 2017; 21(Suppl 1): 102‒111.
- [35] Langness JA, Nguyen M, Wieland A. Optimizing hepatitis C virus treatment through pharmacist interventions: Identification and management of drug‑drug interactions. World J Gastroenterol 2017; 23: 1618‒1626.
- [36] Patel AM, Shariff S, Bailey DG, et al. Statin toxicity from macrolide antibiotic coprescription: a population‑based cohort study. Ann Intern Med 2013; 158: 860‒876.
- [37] Li DQ, Kim R, McArthur E, et al. Risk of adverse events among older adults following co‑prescription of clarithromycin and statins not metabolized by cytochrome P450 3A4. CMAJ 2015; 187: 174‒180.