Pro, anebo proti? Omega‑3 mastné kyseliny a nová data
Souhrn:
Vrablík M. Pro, anebo proti? Omega‑3 mastné kyseliny a nová data. Remedia 2019; 29: 129–135.
O omega‑3 polynenasycených mastných kyselinách (MK) a jejich roli v prevenci kardiovaskulárních příhod se hovoří desítky let. Za tu dobu se nakumulovalo velké množství dat, z nichž některá zvýšenou konzumaci omega‑3 MK podporují, zatímco jiná spíše žádný prospěch suplementace potravy těmito složkami nedoložila. Potenciálně příznivých účinků omega‑3 MK, zejména těch rybího původu, na úrovni metabolismu, regulace buněčných funkcí i hemodynamických parametrů prokázaly experimentální práce celou řadu. I proto možná stále hledáme místo uplatnění omega‑3 MK v době, kdy máme k dispozici množství prokazatelně účinných postupů zlepšujících prognózu nemocných ohrožených kardiovaskulárními příhodami. Nedávno jsme získali další data z dobře provedených klinických studií, které měly odpovědět na tuto otázku zkoumáním různých populací s odlišnými použitými formami omega‑3 MK. Studie ASCEND, VITAL a REDUCE‑IT přinesly odlišná zjištění a zřejmě neposkytly definitivní odpověď na to, kam máme zařadit suplementaci omega‑3 MK v dnešní době. V každém případě nadále nelze doporučovat plošnou suplementaci přípravky s obsahem omega‑3 MK s cílem prevence cévních příhod.
Summary:
Vrablik M. For or against? Omega-3 fatty acids and new findings. Remedia 2019; 29: 129–135.
For decades, omega‑3 fatty acids and their role in prevention of cardiovascular events has been discussed. Over this time, substantial evidence has accumulated, some supporting increased consumption of omega‑3 fatty acids while other did not seem to prove any benefit for supplementing food with these substances. Number of potentially beneficial effects of omega‑3 fatty acids, especially from fish oil, on metabolism, cell function regulation and hemodynamic parameters have been proved. This might also be the reason why we are still seeking a place for omega‑3 fatty acids, even though a lot of proven effective approaches improving the prognosis of patients in risk of cardiovascular event are available. Recently, additional data from well‑designed clinical trials have been accumulated that aimed to answer this question in different populations with distinct formulations of omega‑3 fatty acids. ASCEND, VITAL and REDUCE‑IT trials achieved dissimilar results and have not provided a definitive answer to the question of role of omega‑3 fatty acid supplementation in the current time. In any case, wide supplementation with omega‑3 fatty acid products to prevent vascular events is no longer advised.
Key words: omega‑3 fatty acids, EPA, DHA, cardiovascular risk, cardiovascular events
Úvod
V souvislosti s recentně publikovanými novými daty se vracíme k otázce suplementace omega 3 mastnými kyselinami (MK) a jejího významu z hlediska prevence a léčby kardiovaskulárních (KV) onemocnění. Není to dlouho, co jsme si říkali, že omega 3 MK již v tomto směru odpověděly na všechny otázky a jejich role byla posunuta spíše do úrovně „sice neškodí, ale pravděpodobně ani nepomáhají“. V poslední verzi doporučených postupů evropských odborných společností nalezneme zmínku o omega 3 MK pouze v souvislosti se zvládáním významné hypertriglyceridemie, kdy guidelines uvádějí možnosti použití gramových dávek těchto látek [1]. Velmi čerstvá doporučení American Heart Association pro primární prevenci KV onemocnění omega 3 MK vůbec neuvádějí, byť konstatují, že rybí pokrmy představují nepochybně součást zdravého stravování [2]. Navíc na sklonku roku 2018 Evropská léková agentura (EMA) vydala stanovisko s názvem „Omega 3 mastné kyseliny nejsou nadále považovány za efektivní v prevenci kardiovaskulárních onemocnění“ [3]. Má tedy smysl se k tématu omega 3 MK vracet? Přibyla skutečně nová data na stranu „pro“ a jsou skutečně tak pádná, aby převážila „proti“? Nad tím se zamyslíme v následujícím textu.
Plus první: detailní znalost biochemie a fyziologie omega 3 MK
Dlouhé období zájmu o tyto látky umožnilo shromáždění detailních poznatků o zdrojích i metabolismu omega 3 MK v lidském organismu. Dostatek těchto znalostí tak berme za první „pro“, v oblasti biochemie a fyziologie omega 3 MK víme vše potřebné. Omega 3 MK patří mezi polynenasycené mastné kyseliny s velmi dlouhým řetězcem. Základní (a esenciální) omega 3 MK je kyselina alfa linolenová (ALA), která se vyskytuje v potravinách rostlinného původu (vlašské ořechy, sója, řepka a jejich oleje). Produktem metabolismu je například kyselina arachidonová, jejíž další metabolity (eikosanoidy) mají v organismu řadu důležitých funkcí. Kyselina alfa linolenová je prekurzorem dalších omega 3 MK s ještě delším řetězcem – kyseliny eikosapentaenové (EPA) a dokosahexaenové (DHA), na něž je bohaté zejména rybí maso, resp. rybí tuk (losos, makrela, pstruh). Odhaduje se, že EPA a DHA jsou v rybím oleji zastoupeny v poměru 2 : 3. Vzhledem k tomu, že méně než 5 % ALA je v organismu přeměněno na EPA a DHA, je příjem posledních dvou jmenovaných v potravě rovněž velmi důležitý [4].
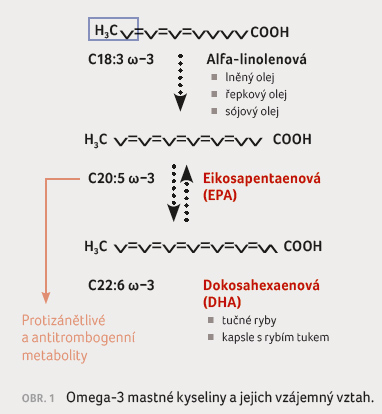
Základně tedy můžeme rozlišit omega 3 MK na rostlinné (ALA) a rybí (EPA a DHA, obr. 1).
V zásadě tedy podle původu dělíme omega 3 MK na rostlinné a rybí. Většina kardiovaskulárních studií experimentálních i humánních testovala vlivy rybích omega 3 MK na různé mechanismy srdečně cévního postižení a regulace vaskulárních funkcí. Proto v následujícím textu vynecháme z úvah ALA a budeme se věnovat výhradně datům pro EPA a DHA nebo jejich deriváty.
Plus druhé: experimentální dokumentace potenciálně výhodných mechanismů omega 3 MK z hlediska kardiovaskulárních onemocnění
Existuje velké množství laboratorních, experimentálních i klinických studií, které sledovaly vliv podávání omega 3 MK na hodnoty rizikových faktorů, funkci cévní stěny, ale i na výskyt koronárních příhod a iktů a také na celkovou a KV úmrtnost. Problémem těchto studií je často nesprávné uspořádání, malé počty účastníků, nepřesná definice podávaného typu a dávky MK, absence kontrolní skupiny. Proto je třeba, abychom při interpretaci výsledků studií byli opatrní. Na druhé straně musíme uznat, že přes uvedená úskalí patří omega 3 MK k nejvíce prozkoumaným substancím v KV medicíně vůbec. Doložené příznivé působení rybích omega 3 MK na několika úrovních vzniku a rozvoje aterosklerózy ukazuje tabulka 1.
Některé z popsaných vlivů se z klinického hlediska zdají být zvláště výhodnými, a proto se na ně zaměříme blíže.
Ovlivnění funkce buněčné membrány
Při podávání omega 3 MK dochází k jejich inkorporaci do membrán buněčných stěn i organel a tak vysvětlujeme experimentálně doložený příznivý vliv na celulární funkce. Tento mechanismus je zodpovědný za potlačení projevů endoteliální dysfunkce, spolupodílí se na zlepšení funkcí trombocytů i kardiomyocytů, což se v konečném důsledku může projevovat jako snížení rizika vzniku trombotických komplikací či maligních arytmií pozorované v klinických studiích s omega 3 MK [5].
Ovlivnění lipidového metabolismu
Dobře známý je efekt omega 3 MK na hodnotu triglyceridů. V závislosti na vstupních hodnotách triglyceridů můžeme očekávat pokles až o 45 %. Současně se vlivem DHA zvyšuje koncentrace HDL cholesterolu a mění se velikost LDL částic, které se zvětšují a stávají se méně aterogenními. Všechny popsané efekty se dostavují až při podávání vysokých dávek v rozmezí 2‒4 g denně [6]. Nesmírně důležitým faktem je, že popsané efekty jsou aditivní k současně podávané léčbě statiny při současně zachovaném příznivém bezpečnostním profilu [7]. Dokumentace však není rozsáhlá a chybějí důkazy o přídatném vlivu omega 3 MK v kontextu vysoce intenzivní statinové terapie.
Ovlivnění destičkových funkcí
Obě základní omega 3 MK mají významný vliv na trombocytární funkce. Nejen výše zmíněný membrány stabilizující účinek, ale především kompetice omega 3 MK s arachidonovou kyselinou o aktivitu cyklooxygenázy vedoucí k poklesu produkce vazoaktivních eikosanoidů (tromboxanu A2 ad.) jsou vysvětlením poklesu agregability trombocytů po podávání omega 3 MK až o třetinu [5]. Také tyto účinky mají rovněž vazbu na dávku a nejsou patrné při dávkování nižším než 2 g denně.
Ovlivnění aktivity zánětu
Zánětlivou reakci považujeme za jeden ze základních patogenetických mechanismů vzniku a rozvoje aterosklerózy a jejích komplikací. Omega 3 MK modifikují expresi cytoadhezivních molekul, snižují koncentrace zánětlivých cytokinů (interleukinu 6, tumor nekrotizujícího faktoru alfa) i některých dalších [8].
Kromě uvedených je známa řada dalších potenciálních mechanismů vysvětlujících ochranné účinky omega 3 MK na KV systém jako ovlivnění funkce adipocytů, inzulinové rezistence, fibrinolýzy, hemodynamické působení a další [5,8,9]. Je pravděpodobné, že u každého jednotlivce bude relativní význam jednotlivých složek působení omega 3 MK jiný. Široké spektrum účinků je příslibem možnosti využití omega 3 MK v různých klinických situacích a většinou současně s dalšími léčebnými možnostmi.
Pro všechny z uvedených vlivů máme k dispozici experimentální dokumentaci, některé byly ověřeny v klinických studiích u lidí.
Opět narážíme na problém obvyklý u prací s omega 3 MK ‒ různé studie používají k intervenci různé zdroje omega 3 MK, což zásadně ovlivňuje porovnatelnost výsledků jednotlivých prací. Souhrnně však lze říci, že dokumentace účinku omega 3 MK na KV regulace a rizikové faktory aterosklerózy byla většinově pozitivní. Z klinického hlediska představují výše uvedené mechanismy bezpochyby důležitá východiska pro využití omega 3 MK, nikoliv však důkazy o jejich skutečném přínosu ke snížení KV rizika. Tyto nejcennější údaje mohou poskytnout pouze dobře organizované klinické studie. A následuje první proti.
Proti první: nejednoznačné výsledky klinických pozorování s omega 3 MK
S ohledem na délku zkoumání omega 3 MK se i v oblasti intervenčních studií sledujících výskyt příhod nahromadilo velké množství důkazů. Bohužel jejich hodnocení a srovnání je často obtížné z více důvodů. Především je to zcela nesrovnatelné (a mnohdy špatné) uspořádání bez kontrolní skupiny, s nepřesně definovanou dávkou a typem omega 3 MK; často byly studie prováděny nezaslepeně. Je nemožné srovnat výsledky studií užívajících doporučení zvýšení konzumace rybích pokrmů s těmi, kde byly podávány potravinové doplňky s obsahem omega 3 MK v přesně definovaném množství a složení. Proto je nesnadné výsledky hodnocení vlivů omega 3 MK na KV systém popsat v souhrnných metaanalýzách. Ze stejného důvodu je při hodnocení výsledků studií s omega 3 MK nutné brát v úvahu výběr sledované populace a uvědomovat si, pro které osoby výsledky platí. Typickým příkladem „nešťastného uspořádání“ může být studie DART. Diet And Reinfarction Trial zařadila 2 033 mužů po infarktu myokardu. Polovina z nich byla instruována ke zvýšení spotřeby rybích pokrmů tak, aby denní příjem omega 3 MK byl přibližně 900 mg. Na konci sledování byla celková mortalita v intervenované skupině nižší o 29 % a incidence reinfarktu klesla o 32 % ve srovnání s kontrolami. Zajímavé je, že při hodnocení kohorty účastníků po 10 letech od ukončení studie DART měli původně intervenovaní pacienti sice nadále mírně vyšší spotřebu rybích pokrmů, ale riziko KV úmrtí bylo dokonce o 31 % vyšší než u původních kontrol [10]. Jako každá následná analýza i tato naráží na zásadní problém nejasných (a nezjistitelných) dalších okolností, které k pozorovanému rozdílu vedly.
Proti druhé: metaanalýzy studií ukazují, že podávání omega 3 MK nepřináší snížení kardiovaskulárního rizika
V posledních 12 měsících byly publikovány dvě rozsáhlé metaanalýzy k otázce suplementace omega 3 MK a jejího vlivu na KV riziko. V rámci první z nich hodnotili autoři více než 77 000 účastníků 10 studií, v nichž aktivní léčbu představovalo podávání rybích omega 3 MK v širokém dávkovém rozmezí 226‒1 800 mg denně. Věkový průměr byl 64 let a pacienti byli sledováni po průměrnou dobu 4,4 roku. Metaanalýza měla robustní základ ‒ hodnotila celkem 6 273 koronárních příhod a 12 001 velkých vaskulárních příhod. Autoři uzavírají, že suplementace omega 3 MK neovlivnila výskyt úmrtí v důsledku ischemické choroby srdeční (relativní riziko [RR] 0,93; 99% interval spolehlivosti [CI] 0,83‒1,03; p = 0, 05), nefatálního infarktu myokardu (RR 0,97; 99% CI 0,87‒1,08; p = 0,43) ani koronární příhody (RR 0,96; 95% CI 0,90‒1,01; p = 0,12). Ani ostatní hodnocené vaskulární parametry podávání aktivní léčby neovlivňovalo [11]. Závěr metaanalýzy: použití přípravků s obsahem omega 3 MK neovlivňuje výskyt vaskulárních příhod a současné doporučení autorit k jejich významu v prevenci KV onemocnění není opodstatněné.
Druhou prací je metaanalýza 79 klinických studií shrnující data celkem od 112 079 zařazených pacientů. Autoři této nezávislé Cochrane metaanalýzy v souhlase s výše citovanou prací uzavírají, že důkazy ze studií vysoké a uspokojivé kvality (ze 79 nalezených studií bylo hodnoceno jenom 25 splňujících kvalitativní požadavky) ukazují, že zvýšení příjmu EPA a DHA neovlivňuje riziko úmrtí z KV příčiny ani kardiovaskulární zdraví. Publikace těchto prací přispěla ke skepsi stran použití omega 3 MK a v literatuře najdete několik přehledů o „posledních hřebících do rakve“ těchto kyselin v KV oblasti [12].
Pro ilustraci připojme ještě další metaanalytický pohled. V roce 2016 vyšla v British Medical Journal jiná velká metaanalýza, která sledovala vztah mezi biomarkery saturace omega 3 MK (stanovení koncentrace EPA, DHA a ALA v plazmě, tukové tkáni a fosfolipidové frakci) a rizikem koronárních příhod. V celkem 19 zařazených studiích s 45 637 účastníky bylo zaznamenáno 7 973 KV příhod (z toho 2 781 fatálních) a 7 157 nefatálních infarktů myokardu. Medián věku sledovaných byl 59 let, 62,8 % byli muži. V multivariantní analýze bylo zvýšení hodnoty všech sledovaných biomarkerů saturace organismu omega 3 MK spojeno s přibližně 10% poklesem relativního rizika fatální KV příhody [13]. Pozitivní vyznění metaanalýzy kalí její uspořádání. Sice využívá hodnocení biomarkerů, což překonává nepřesnost anamnestických údajů při sledování konzumace rybích pokrmů hodnocených pomocí frekvenčních dotazníků, ale i tak jde o retrospektivní hodnocení dat a biochemických ukazatelů měřených různými metodikami a laboratořemi, což činí interpretaci výsledků velmi obtížnou. Celkově tedy i tato práce patří spíše do odstavce argumentů „proti“.
Proti třetí: negativní výsledky nových studií s omega 3 MK
I přes nemalé množství studií
a jejich následných a souhrnných analýz hodnotících
omega 3 MK a jejich vztah k různým úrovním KV
rizika jsme se nedávno dočkali dalších dat. Ta zčásti
překonávají metodické nedokonalosti kritizované u řady
dřívějších projektů, ale i v jejich uspořádání
najdeme nejasnosti. Studie ASCEND (A Study of Cardiovascular
Events in Diabetes) hodnotila více než 15 000 diabetiků 2. typu
bez anamnézy manifestního KV onemocnění (proto autoři uvádějí,
že šlo o studii u osob v primární prevenci KV
onemocnění) [14]. Uspořádání studie kromě podávání omega 3
MK hodnotilo také význam nízkodávkované acetylsalicylové
kyseliny v této populaci. Ve větvi testující mastné
kyseliny byli pacienti randomizováni k podávání 1 g
omega 3 (s obsahem 340 mg EPA a 380 mg DHA) nebo
k podávání placeba (olivový olej) denně. Po více než
sedmi letech sledování nebyly pozorovány žádné rozdíly
ve výskytu sledovaných KV událostí. Suplementace omega 3
MK byla spojena s nižším výskytem úmrtí z vaskulárních
příčin (RR sníženo o 18 %), toto pozorování však
nevysvětluje ani nižší počet koronárních, ani
cerebrovaskulárních příhod a při nenaplnění primárního
cíle studie jej musíme považovat za „hypotézu generující“
(graf 1).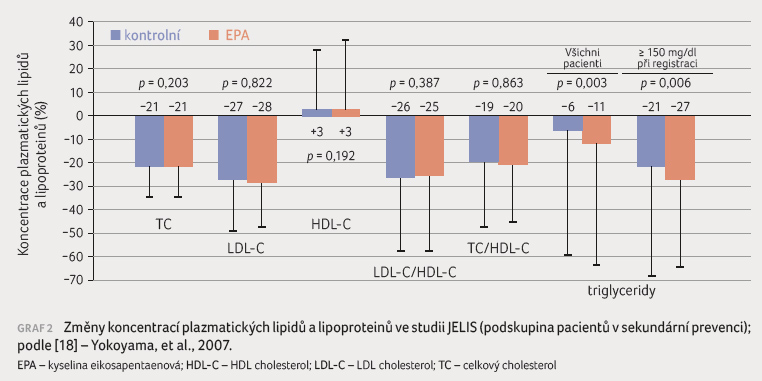
Můžeme opět spekulovat, co ovlivnilo výsledky studie ASCEND. Jak by výsledky vypadaly, kdyby byla použita vyšší dávka omega 3 MK, ev. jejich jiná forma, nebo kdyby adherence k léčbě ve studii byla vyšší (udávaná adherence dosahovala 76 %). Ale opusťme spekulace a podívejme se na další z nedávno publikovaných studií.
Americká multietnická studie VITAL (The Vitamin D and Omega 3 Trial) randomizovala téměř 26 000 osob v primární prevenci KV onemocnění k podávání 1 g omega 3 MK (obsahující 460 mg EPA a 380 mg DHA) anebo k podávání placeba (s obsahem 1 g olivového oleje). Výskyt velkých cévních příhod klesl při podávání aktivní léčby nevýznamně (poměr rizik [HR] 0,92; 95% CI 0,80‒1,06; p = 0,24). Složený ukazatel všech KV příhod léčba ovlivnila rovněž nevýznamně (HR 0,93; 95% CI 0,82‒1,04). Z komponent složeného KV cíle se podařilo snížit riziko infarktu myokardu (HR 0,72; 95% CI 0,59‒0,90), ostatní ukazatele zůstaly bez rozdílu oproti placebové větvi. Analýza podskupin naznačila, že omega 3 MK mohou mít výraznější vliv u těch, kteří mají nižší konzumaci rybích pokrmů, a u černošské populace. Léčba byla bezpečná, výskyt nežádoucích účinků byl srovnatelný v aktivní i placebové větvi studie [15]. Závěr autorů podobně jako u studie ASCEND zní: suplementace omega 3 MK nesnižuje riziko KV příhod v kontextu primární prevence. Studie ASCEND a VITAL reprezentují moderní a dobře uspořádané práce, navíc s dostatečnou délkou trvání i počtem sledovaných. Výsledkům se tedy „dá věřit“. Odsoudíme proto omega 3 MK definitivně jako neefektivní? Najdeme vůbec nějaké argumenty do odstavce „pro“?
Pro první: historicky úspěšné projekty se suplementací omega 3 MK
První z prací, které se podařilo prokázat prospěch suplementace omega 3 MK z hlediska KV rizika, byla studie GISSI Prevenzione. Celkem 11 323 nemocných po infarktu myokardu bylo rozděleno do skupin užívajících 850 mg EPA/DHA denně a do skupiny běžné péče. Již po čtyřech měsících léčby kleslo riziko úmrtí ze všech příčin o statisticky významných 28 %, zejména proto, že bylo redukováno riziko náhlého úmrtí o 45 % [16]. Studii GISSI je vyčítána hlavně absence řádně zaslepené kontrolní skupiny, suboptimální konkomitantní KV terapie a další. Výsledky studie GISSI Prevenzione ale podpořila i její navazující studie zaměřená na nemocné se srdečním selháním. Celkem 3 494 pacientům bylo ke standardní léčbě přidáno 850 mg směsi EPA/DHA, 3 481 dostalo odpovídající placebo. I po adjustaci k dalším faktorům bylo podávání omega 3 MK spojeno s významným poklesem celkové mortality (‒9 %, p = 0,041) i počtu hospitalizací z KV příčin (‒8 %, p = 0,009) [17].
Další prací, která dokumentovala
prospěch suplementace omega 3 MK, byla studie JELIS (JELIS:
Japan EPA Lipid Intervention Study), rozsáhlé sledování 18 645
Japonců s hyperlipidemií, z nichž více než 3 500
mělo anamnézu vaskulární příhody [18]. Pacienti byli
randomizováni k léčbě samotným statinem nebo kombinací
statinu a 1,8 g EPA denně. Po pěti letech byl výskyt
primárního sledovaného cílového ukazatele (složeného z úmrtí,
revaskularizace, infarktu myokardu a nestabilní anginy
pectoris) ve skupině léčené kombinací EPA a statinu
o 19 % nižší ve srovnání s monoterapií
statinem. Při hodnocení podskupiny nemocných s anamnézou KV
příhody byl zjištěn srovnatelný rozdíl ve prospěch
kombinace EPA + statin s poklesem výskytu primárního
sledovaného cíle o 23 %. Nejvýraznější prospěch
z podávání EPA měli pacienti v primární prevenci,
kteří při zařazení do studie měli vyšší hodnotu
triglyceridů a nízkou koncentraci HDL cholesterolu. U nich
bylo relativní riziko sníženo o 53 %. Studie JELIS
vykazovala podstatné rozdíly v uspořádání ve srovnání
s ostatními, většinou neúspěšnými projekty s omega 3
MK. Především užívala vyšší dávku, a navíc koncentrát
obsahující pouze EPA. Největší prospěch měli léčení se
vstupní hypertriglyceridemií a nízkou hodnotou HDL
cholesterolu. Zajímavé výsledky přinesla následně publikovaná
analýza sekundárně preventivní kohorty 3 664 pacientů
s anamnézou ischemické choroby srdeční [19]. U nich
autoři dokumentovali také významný pozitivní vliv suplementace
EPA na výskyt cévních příhod, jejichž riziko se snížilo
o 23 %. Ale i v této analýze najdeme řadu
otazníků. Všichni pacienti při vstupu do studie dostávali
nízkodávkovanou terapii statinem (pravastatin 10 mg nebo
simvastatin 5 mg denně). Při vstupní průměrné LDL
cholesterolemii 4,6 mmol/l taková léčba zdaleka nemohla přivést
pacienty k potřebné redukci. Koncentrace lipidů
a lipoproteinů se také měnily pouze minimálně (graf 2).
Jedinou statisticky významnou změnu z hlediska lipidogramu představoval pokles triglyceridemie ve skupině užívající EPA, patrný více u pacientů s vyššími hodnotami triglyceridů vstupně. Při pohledu na analýzu jednotlivých sledovaných vaskulárních cílových událostí nás musí zaujmout, že hlavním „tahounem“ celkově pozitivního výsledku byl vliv na výskyt epizod nestabilní anginy pectoris.
Přitom právě tento parametr tradičně bývá nejvíce diskutován, neboť se jeví jako nejméně spolehlivý. V souvislosti s výše uvedeným se přinejmenším výsledky sekundárně preventivní kohorty studie JELIS jeví jako diskutabilní a vlastně bychom je mohli spíše zařadit do odstavce argumentů proti použití omega 3 MK. Máme tedy k dispozici alespoň nějaká data, která jejich použití v prevenci KV onemocnění skutečně podporují?
Pro druhé: Studie REDUCE IT ‒ hlavní důvod pro pokračování zájmu o omega 3 MK
Téměř pět let sledování ve studii
REDUCE IT přineslo velmi zajímavé a pozitivní výsledky,
ale jak v oblasti omega 3 MK bývá tradicí, zanechalo
také hodně otázek. Studie zařadila 8 179 velmi vysoce
rizikových osob (více než 70 % s anamnézou KV onemocnění,
60 % diabetiků) [20]. Jako další vstupní kritérium museli
zařazení pacienti splnit podmínku vyšších hodnot triglyceridů
(medián jejich koncentrace při zahájení byl 2,44 mmol/l). Jako
zástupce omega 3 MK byl použit etylester EPA (E EPA,
icosapent ethyl) – vysoce purifikovaný derivát EPA s lepší
biologickou dostupností. Navíc dávka použitá v projektu
REDUCE IT byla podstatně vyšší než v dříve komentovaných
studiích – 4 gramy denně rozdělené do dvou dávek.
Relativní riziko primárního sledovaného cíle (KV úmrtí,
infarkt myokardu, cévní mozková příhoda, revaskularizace,
nestabilní angina pectoris) bylo ve srovnání s placebem
sníženo o 25 % (KV příhoda se vyskytla u 17,2 %
aktivně léčených a u 22 % pacientů užívajících
placebo). Výskyt sekundárního léčebného cílového ukazatele
(KV úmrtí, infarkt myokardu, cévní mozková příhoda) léčba
E EPA redukovala o 26 %. Jednotlivé složky hodnocených
cílových ukazatelů se rovněž dařilo aktivní léčbou příznivě
ovlivnit, jak přehledně shrnuje graf 3.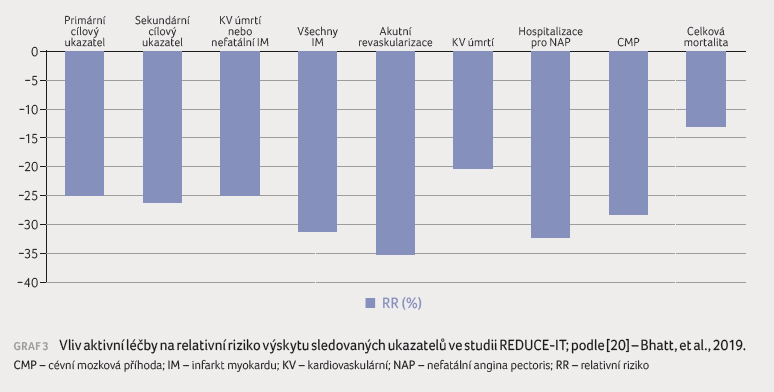
Příznivé působení bylo patrné ve všech analyzovaných podskupinách a autoři nezaznamenali žádnou vazbu prospěchu na vstupní hodnotu triglyceridů či terapií zprostředkovanou míru jejich redukce. Uvedené naznačuje, že efekt není zprostředkován vlivem podávané léčby na metabolismus částic bohatých na triglyceridy. Snížení rizika nezprostředkoval ani antiarytmický účinek uváděný jako možný mechanismus v některých předchozích studiích s omega 3 MK. Pacienti v REDUCE IT měli dokonce vyšší výskyt fibrilace síní v aktivně léčené skupině než v placebové větvi (3,1 % vs. 2,1 %; p = 0,004).
Studie REDUCE IT po delší době přináší další důkaz ve prospěch podávání omega 3 MK. Výsledek překvapil a diskuse o tom, kterými faktory jej vysvětlit, pokračují. Jistě je možné, že v REDUCE IT použitý nový derivát omega 3 MK s vyšším biologickým účinkem má odlišné působení a ovlivňuje cévní a srdeční funkce lépe. Dávka ve studii překročila dávkování použité ve většině ostatních projektů minimálně dvakrát. Studie REDUCE IT zařadila kohortu velmi vysoce rizikových pacientů s velmi dobrou úrovní souběžné farmakoterapie. Hypolipidemickou léčbu užívalo 99,7 % zařazených pacientů (11,7 % mělo při vstupu do studie vysoce intenzivní terapii statinem), čemuž odpovídá i relativně těsná kontrola koncentrace LDL cholesterolu při vstupu do studie (průměrně 1,94 mmol/l). Přestože u pacientů v aktivně léčené skupině zaznamenali autoři studie vyšší výskyt krvácivých komplikací (2,7 % vs. 2,1 % v placebové větvi; p = 0,06), antitrombogenní efekt použité intervence pravděpodobně není hledaným mediátorem pozorovaných benefitů. Pohled na separaci Kaplanových‒Meierových křivek sledovaného primárního cíle naznačuje, že šlo především o antiaterogenní vliv. Ale i to nás musí mírně překvapit ‒ u uživatelů E EPA bylo zaznamenáno průměrné snížení koncentrace non HDL cholesterolu 0,36 mmol/l, což by se mělo promítnout do redukce výskytu aterotrombotických cévních příhod maximálně o 8 %. Studie však ukázala více než trojnásobně větší prospěch. Připočteme li absenci vazby na koncentrace triglyceridů před léčbou i ty dosažené terapií, nemůžeme označit za hlavní příčinu pozitivního výsledku ani „lipidové efekty“. Při hledání odpovědi na to, co jej tedy způsobilo, se rozhořela poměrně bouřlivá diskuse, zda za mimořádně příznivým výsledkem pozorovaným v aktivní větvi studie nestojí souběžné zhoršení stavu u pacientů v placebové větvi [21]. K němu skutečně došlo ‒ u placebových pacientů zaznamenali autoři studie vzestup hodnoty vysoce senzitivního C reaktivního proteinu (hsCRP) o 30 %, takže celkový rozdíl proti aktivně léčeným byl téměř 40 %. Současně v placebové větvi mírně stoupla koncentrace LDL cholesterolu i apolipoproteinu B, čímž se opět zvýraznil rozdíl mezi hodnocenými rameny studie. Uvedené efekty někteří zdůvodňují laxativním účinkem minerálního oleje, který byl použit v placebových kapslích a snížil tak absorpci podávaných statinů (v placebové větvi byl nevýznamně vyšší výskyt průjmu ve srovnání s aktivně léčenými). Takové vysvětlení se však jeví jako spíše méně pravděpodobné a pravou příčinu změn v placebové větvi neznáme.
Pro a proti omega 3 MK v roce 2019 a dále
I s novými daty, která máme k dispozici, nemůžeme zformulovat jednoduchý závěr. Paušální doporučení pro suplementaci doplňky stravy s obsahem rybích omega 3 MK nelze jistě podporovat – důkazy v tomto směru chybějí. V souhlase s úrovní (a rozporuplností) důkazů se v doporučených postupech můžeme dočíst, že podávání omega 3 MK je bezpečné a rozhodně má být zváženo (v dávkách 3‒4 g denně) u osob s významnou hypertriglyceridemií. Jako opatření k prevenci vzniku první nebo opakované KV příhody je však nadále budeme považovat spíše za předmět výzkumu než za etablovaný postup klinické praxe. Přenesení výsledků studie REDUCE IT do naší praxe narazí na řadu problémů – prvním z nich bude zajištění specifického derivátu omega 3 MK (E EPA) použitého ve studii. Je totiž možné, že příznivé efekty nejsou projevem účinku třídy, ale jsou specificky vázané na použití konkrétního přípravku v určité dávce. Jestli tomu tak skutečně je, se dozvíme relativně brzy. Ke svému závěru by letos měla dospět další z velkých klinických studií sledujících nový přípravek omega 3 MK ‒ epanova. Epanova představuje směs hydrolyzovaných omega 3 MK, které na rozdíl od běžných formulí s etylestery EPA a DHA nevyžadují další hydrolýzu ve střevě, a tím se zvyšuje jejich biologická dostupnost. Studie STRENGTH testuje v placebem kontrolovaném uspořádání přidání 4 g epanova do medikace pacientů ve velmi vysokém KV riziku s hodnotou hypertriglyceridemie v rozmezí 2‒5,6 mmol/l. Do studie bylo randomizováno více než 13 000 pacientů a nábor byl ukončen v červenci 2014 s předpokladem délky trvání kolem 4,5 roku [22].
Omega 3 mastné kyseliny a jejich postavení v prevenci a léčbě kardiovaskulárních onemocnění
Ačkoliv výzkum pokračuje, současný stav poznání a kritické zhodnocení všech pro a proti nás nabádá k rezervovanosti. Data podporující suplementaci omega 3 MK nejsou aktuálně tak robustní, abychom ji mohli v oblasti KV prevence doporučit. Zatím tedy zůstanou deriváty omega-3 MK v podobě gramových dávek prostředkem ke snížení významné hypertriglyceridemie. Nízké dávky EPA a DHA neprokázaly přínos v kontextu moderní farmakoterapie a neměly by být doporučovány jako prostředek k ovlivnění rizika a prognózy. V případě, že studie STRENGTH potvrdí nálezy projektu REDUCE IT a vnese více světla do možných mechanismů působení, bude možná náš postoj k použití vysokých dávek derivátů omega 3 MK nutno přehodnocovat. Na to ale počkejme do publikace výsledků, jež by měla být k dispozici do roka.
Podpořeno MZ ČR – RVO VFN64165.
Seznam použité literatury
- [1] Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J 2016; 37: 2999‒3058.
- [2] Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease. Circulation 2019; doi.org/10.1161/CIR.0000000000000678
- [3] Omega‑3 fatty acid medicines no longer considered effective in preventing heart disease. EMA/19056. Dostupné na: https://www.ema.europa.eu/en/documents/referral/omega‑3‑fatty‑acid‑medicines‑omega‑3‑fatty‑acid‑medicines‑no‑longer‑considered‑effective‑preventing_en.pdf
- [4] Mourek J, a kol. Omega‑3 mastné kyseliny. Zdraví a vývoj. Praha/Kroměříž: Triton, 2007, s. 174.
- [5] Woodman RJ, Mori TA, Burke V, et al. Effects of purified eicosapentaenoic acid and docosahexaenoic acid on platelet, fibrinolytic and vascular function in type 2 diabetic patients. Atherosclerosis 2003; 166: 85–93.
- [6] Mori TA, Burke V, Puddey IB, et al. Purified eicosapentaenoic and docosahexaenoic acids have differential effects on serum lipids and lipoproteins, LDL particle size, glucose, and insulin in mildly hyperlipidemic men. Am J Clin Nutr 2000; 71: 1085–1094.
- [7] Davidson MH, Stein EA, Bays HE, et al. COMBination of prescription Omega‑3 with Simvastatin (COMBOS) Investigators. Efficacy and tolerability of adding prescription omega‑3 fatty acids 4 g/d to simvastatin 40 mg/d in hypertriglyceridemic patients: an 8‑week, randomized, double‑blind, placebo controlled study. Clin Ther 2007; 29: 1354‒1367.
- [8] Grimsgaard S, Bonaa KH, Hansen JB, et al. Effects of highly purified eicosapentaenoic acid and docosahexaenoic acid on hemodynamics in humans. Am J Clin Nutr 1998; 68: 52–59.
- [9] Itoh M, Suganami T, Satoh N, et al. Increased adiponectin secretion by highly purified eicosapentaenoic acid in rodent models of obesity and human obese subjects. Arterioscler Thromb Vasc Biol 2007; 27: 1918‒1925.
- [10] Ness AR, Hughes J, Elwood PC, et al. The long‑term effect of dietary advice in men with coronary disease: follow‑up of the Diet and Reinfarction trial (DART). Eur J Clin Nutr 2002; 56: 512‒518.
- [11] Aung T, Halsey J, Kromhout D, et al; Omega‑3 Treatment Trialists’ Collaboration. Associations of Omega‑3 Fatty Acid Supplement Use With Cardiovascular Disease Risks: Meta‑analysis of 10 Trials Involving 77 917 Individuals. JAMA Cardiol 2018; 3: 225‒234.
- [12] Abdelhamid AS, Brown TJ, Brainard JS, et al. Omega‑3 fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev 2018; 11: CD003177; doi:10.1002/14651858
- [13] Del Gobbo LC, Imamura F, Aslibekyan S, et al. Omega‑3 Polyunsaturated Fatty Acid Biomarkers and Coronary Heart Disease. JAMA Intern Med 2016; 176: 1155–1166.
- [14] Bowman L, Mafham M, Wallendszus K, et al; ASCEND Study Collaborative Group. Effects of n‑3 Fatty Acid Supplements in Diabetes Mellitus. N Engl J Med 2018; 379: 1540‒1550.
- [15] Manson JE, Cook NR, Lee IM, et al; VITAL Research Group. Marine n‑3 Fatty Acids and Prevention of Cardiovascular Disease and Cancer. N Engl J Med 2019; 380: 23‒32.
- [16] GISSI‑Prevenzione Investigators. Dietary supplementation with n‑3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI‑Prevenzione trial. Lancet 1999; 354: 447–455.
- [17] Tavazzi L, Maggioni AP, Marchioli R, et al; Gruppo Italiano per lo Studio della Sopravvivenza nellʼInsufficienza cardiaca. GISSI‑HF. Effects of n‑3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI‑HF trial): a randomized double‑blind, placebo‑controlled trial. Lancet 2008; 372: 1223‒1230.
- [18] Yokoyama M, Origasa H, Matsuzaki M, et al. Japan EPA lipid intervention study (JELIS) Investigators. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomized open‑label, blinded endpoint analysis. Lancet 2007; 369: 1090‒1098.
- [19] Matsuzaki M, Yokoyama M, Saito Y, et al. Incremental Effects of Eicosapentaenoic Acid on Cardiovascular Events in Statin‑Treated Patients With Coronary Artery Disease. Secondary Prevention Analysis From JELIS. Circ J 2009; 73: 1283–1290.
- [20] Bhatt DL, Steg PG, Miller M, et al; REDUCE‑IT Investigators. Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. N Engl J Med 2019; 380: 11‒22.
- [21] Kastelein JJP, Stroes ESG. FISHing for the Miracle of Eicosapentaenoic Acid. N Engl J Med 2019; 380: 89‒90.
- [22] Nicholls SJ, Lincoff AM, Bash D, et al. Assessment of omega‑3 carboxylic acids in statin‑treated patients with high levels of triglycerides and low levelsʼ of high‑density lipoprotein cholesterol: Rationale and design of the STRENGTH trial. Clin Cardiol 2018; 41: 1281‒1288.