Probiotika v gastroenterologii
Probiotika jsou živé mikroorganismy, jejichž aplikace vede ke změnám ve složení střevní mikroflóry s příznivými důsledky lokálními (ve střevě) i systémovými. V lidském těle působí řadou mechanismů závislých nejen na vlastnostech probiotika, ale také na hostitelském organismu. Tyto mechanismy zahrnují: a) modifikaci střevní mikroflóry a blokádu patogenních mikroorganismů a jejich produktů (toxinů); b) regulaci intestinální homeostázy podporou ochranné funkce střeva a jeho reparačních schopností; c) regulaci imunitní odpovědi na úrovni přirozené imunity, ale též zásahem do procesů adaptivní imunity. Probiotika mají schopnost modulovat signální cesty v buňkách střevní sliznice a ovlivňovat jejich funkční stav i morfologii. Praktické využití potenciálu probiotik v humánní medicíně nedosahuje v současné době úrovně odpovídající teoretickým možnostem. Mezi hlavní indikace probiotik patří gastrointestinální infekce včetně dysmikrobie indukované antibiotiky a klostridiové infekce, idiopatické střevní záněty (pouchitida, ulcerózní kolitida) a dráždivý tračník. Významné postavení mají také v prevenci a léčbě střevních infekcí u dětí, zejména nedonošenců. Mezi jednotlivými probiotiky existují značné rozdíly nejen v mechanismu působení, ale i v klinickém účinku.
Úvod
Střevní mikroflóra tvoří nedílnou a významnou součást lidského organismu. Je tvořena obrovským množstvím bakteriálních kmenů, ale též tzv. archey (prokaryota podobná bakteriím), viry, houbami a dalšími mikroorganismy. Podle současných představ převyšuje celkovým počtem genů střevní mikroflóra (mikrobiální genom, mikrobiom) až 100násobně genom lidský. Metody sekvenční analýzy ribozomální DNA a RNA naznačují, že počet mikrobiálních kmenů přítomných ve střevní mikroflóře může dosahovat až 40 000 (tedy mnohonásobně více než donedávna uváděných 400–500) [1].
Střevní mikroorganismy vytvářejí spolu s hostitelským organismem dynamický ekosystém nezbytný pro udržení homeostázy. Jeho vývoj začíná bezprostředně po porodu a závisí zejména na způsobu výživy novorozence a na okolním prostředí v nejranějších fázích života. V průběhu života se relativní zastoupení jednotlivých mikrobiálních druhů mění; zásadní zlom ve složení střevní flóry nastává po ukončení kojení, kdy v bakteriálním osídlení střeva dochází k postupné přeměně a zformování flóry „dospělého typu“. Ta je u zdravých jedinců v průběhu života relativně stabilní a její složení je, kromě jiného, ovlivněno mnoha faktory na straně hostitelského organismu. Z více než 99 % je tvořena mikroorganismy striktně anaerobními [2]. Výzkumy poslední dekády ukazují, že střevní ekosystém člověka má sice společné základní rysy, současně se však mezi jedinci liší. V tomto ohledu jej lze dokonce považovat za jakýsi „otisk palce“. Je proto pochopitelné, že změny střevní mikroflóry mají u různých jedinců různé důsledky a také „terapeutické“ zásahy do tohoto systému nemají univerzální efekt, ale mohou mít účinky velmi odlišné [3].
Probiotika jsou definována jako „živé mikroorganismy převážně lidského původu, jejichž aplikace v přiměřeném množství příznivě ovlivňuje zdraví člověka“. V literatuře jsou opakovaně zmiňována kritéria, která by měl splňovat mikroorganismus, který můžeme označit za probiotikum [4]. Patří k nim především lidský původ, detailní typizace včetně molekulárněgenetické charakteristiky, absence patogenních vlastností, rezistence vůči žaludeční kyselině a žluči a současně schopnost kolonizovat trávicí trubici po podání v podobě živé kultury. Je pochopitelné, že hlavní pozornost je zaměřena na účinnost a také na bezpečnost příslušného mikroba. V současné době však jen minimum komerčně dostupných preparátů splňuje beze zbytku všechny výše uvedené podmínky.
Cílem následujícího textu je seznámit čtenáře se základními mechanismy působení probiotik na lidský organismus a ukázat jejich účinnost v konkrétních klinických situacích.
Mechanismy účinku probiotik
 Je velmi pravděpodobné, že značná část účinků probiotik na lidský organismus nebyla dosud odhalena. Naše znalosti se opírají především o experimentální práce, které sice umožňují „technicky“ výzkum provádět, současně však mnohdy nežádoucím způsobem zjednoduší pohled na zkoumaný problém. Typickým příkladem tohoto zjednodušení je využití stolice ke zkoumání střevní mikroflóry. V současnosti přitom již není pochyb o tom, že mikroflóra obsažená ve stolici se může podstatným způsobem lišit od mikrobiálního osídlení slizničního povrchu [1].
Je velmi pravděpodobné, že značná část účinků probiotik na lidský organismus nebyla dosud odhalena. Naše znalosti se opírají především o experimentální práce, které sice umožňují „technicky“ výzkum provádět, současně však mnohdy nežádoucím způsobem zjednoduší pohled na zkoumaný problém. Typickým příkladem tohoto zjednodušení je využití stolice ke zkoumání střevní mikroflóry. V současnosti přitom již není pochyb o tom, že mikroflóra obsažená ve stolici se může podstatným způsobem lišit od mikrobiálního osídlení slizničního povrchu [1].
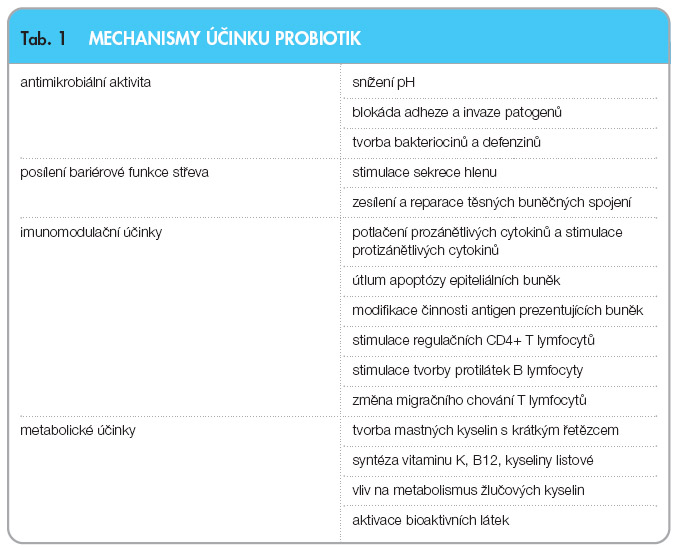
Mechanismy působení probiotik lze rozdělit do 4 základních skupin (tab. 1):
- Antimikrobiální aktivita a modifikace střevní mikroflóry hostitelského organismu
- Podpora a posílení bariérové funkce střevní sliznice
- Imunomodulace
- Metabolické účinky
Antimikrobiální aktivita
Antagonistické působení probiotik vůči střevním patogenům je zajištěno několika mechanismy. Jedním z nich je schopnost vytvářet pro život patogenních mikrobů nepřátelské, kyselé prostředí. Probiotické bakterie produkují značná množství organických kyselin, zejména kyseliny máselné, octové, mléčné a propionové. V klinických studiích bylo snížení intraluminálního pH zjištěno např. po podání probiotického koktejlu VSL#3 u nemocných s ulcerózní kolitidou [5].
Probiotika dále snižují adhezivitu patogenních bakterií i jejich toxinů k epiteliálním buňkám střevní sliznice. Některé kmeny laktobacilů či bifidobakterií brání kompetitivní inhibicí nejen v přilnutí k epitelu, ale dokáží „vytlačit“ i mikroby již uchycené. Probiotický kmen E. coli Nissle 1917 prokázal v experimentu in vitro nejen antiadhezivní schopnosti, ale zabránil též invazi některých enteroinvazivních kmenů E. coli [6].
Významnou součástí protizánětlivého působení probiotik je jejich schopnost produkovat či stimulovat tvorbu přirozených antimikrobiálních látek, tzv. bakteriocinů a defenzinů. Bakteriociny vytvářené probiotickými bakteriemi jsou látky peptidové povahy schopné vytvářet póry v cytoplazmatické membráně citlivých mikrobů, popřípadě interferovat s klíčovými enzymatickými procesy uvnitř buňky. Naproti tomu defenziny jsou součástí přirozené imunity a jsou produkovány jak leukocyty, tak buňkami střevní sliznice, zejména Panethovými buňkami. Některá probiotika (např. E. coli Nissle 1917) indukují zvýšenou produkci těchto látek, které mají nejen antibakteriální, ale též antimykotickou a antivirovou účinnost. V posledních letech bylo zjištěno, že snížená produkce defenzinů je jedním z klíčových momentů v etiopatogenezi idiopatických střevních zánětů.
Posílení bariérové funkce
Bariérová funkce střevní sliznice je zajištěna řadou vzájemně se doplňujících mechanismů, mezi něž patří produkce hlenu, sekrece vody a chloridů, a zejména soudržnost epiteliálních buněk díky tzv. těsným spojením (tight junctions). Poruchu epitelové bariéry lze prokázat u idiopatických střevních zánětů, střevních infekcí, celiakie, ale rovněž u dalších, vesměs autoimunitních chorob (např. diabetes mellitus 1. typu) [7].
Schopnost posílit bariérovou funkci střevní sliznice pomocí probiotik byla pozorována v mnoha experimentech, je však závislá nejen na typu probiotika, ale i na mechanismu postižení střeva. Zatímco např. u metotrexátem indukované kolitidy lze aplikací kmene Lactobacillus plantarum posílit ochrannou funkci epitelu, v případě TNBS kolitidy (kolitida vyvolaná experimentálně pomocí 2,4,6-trinitrobenzensulfonové kyseliny) mu tato schopnost chybí [8]. L. plantarum 299v, VSL#3 a také E. coli Nissle 1917 zvyšují expresi genů pro některé složky slizničního hlenu [9]. Jiná probiotika tlumí sekreci vody a chloridů v odpovědi na patologický stimul. Streptococcus thermophilus a L. acidophilus jsou schopny potlačit zvýšenou sekreci vody a chloridů způsobenou enteroinvazivními kmeny E. coli [10]. Studie in vitro s různými probiotickými kmeny (VSL#3, L. acidophilus, E. coli Nissle 1917) rovněž dokazují protektivní či reparativní účinky těchto bakterií v oblasti těsných buněčných spojení v případě poškození střevními patogeny [7].
Imunomodulační účinky probiotik
Trávicí trubice a především tenké střevo jsou sídlem rozsáhlého imunitního aparátu, jehož funkce spočívá v ochraně organismu před zevními škodlivinami (patogenní bakterie, toxiny apod.), ale také v nastolení a udržení imunotolerance vůči komensálním mikroorganismům. Rovnováha mezi nezbytně nutnou obranou a excesivní reakcí, která již organismus poškozuje, je typicky narušena např. u idiopatických střevních zánětů, stejně jako u jiných, mimostřevních chorob autoimunitního původu.
Studie in vitro a in vivo ukazují, že různá probiotika mají schopnost ovlivnit imunitní reaktivitu hostitelského organismu: jejím posílením zvyšují schopnost vypořádat se s infekčním agens nebo potlačit vznik nádorového bujení, tlumivý efekt pak může příznivě ovlivnit vznik či průběh alergie nebo střevního zánětu.
Střevní imunitní systém je tvořen složitou sítí zahrnující složky přirozené i získané imunity. Příznivý vliv probiotik se může proto uplatnit na různých úrovních:
a) vliv probiotik na epiteliální buňky střeva
Buňky střevního epitelu mají vedle své bariérové funkce také významnou roli imunomodulační. Některé probiotické kmeny mají schopnost příznivě ovlivňovat zapojení epiteliálních buněk do imunitní odpovědi na patologický stimul např. potlačením sekrece prozánětlivého interleukinu 8 (IL-8) nebo inhibicí aktivace transkripčního faktoru NF-kapaB (VSL#3). Jiné (např. L. casei) stimulují tvorbu protektivních cytokinů (IL-10) interakcí s membránovými receptory určenými k rozeznávání struktur patogenních mikrobů (tzv. toll-like receptory, TLR). Příznivý vliv probiotického kmene L. rhamnosus GG je zprostředkován aktivací antiapoptotických a stimulací proapoptotických kaskád; tento mechanismus zvyšuje přežívání epiteliálních buněk a udržení integrity střevní výstelky [11].
b) vliv probiotik na dendritické buňky střeva, monocyty a makrofágy
Dendritické buňky patří mezi tzv. antigen prezentující buňky a z funkčního hlediska stojí na pomezí přirozené a získané imunitní odpovědi organismu. Podobně monocyty, resp. tkáňové makrofágy prezentují antigeny T buňkám. Některá probiotika významně ovlivňují produkci pro- či protizánětlivých cytokinů uvedenými typy buněk. VSL#3 a L. reuteri stimulují tvorbu protizánětlivého IL-10 dendritickými buňkami, jiná probiotika (např. Bifidobacterium infantis) nemají vliv na hladinu IL-10, ale potlačují produkci prozánětlivých cytokinů IL-12 a TNF (tumor nekrotizující faktor) v antigen prezentujících buňkách [7].
c) vliv probiotik na lymfocyty
Experimentální práce, ale též pozorování z klinické praxe svědčí pro efekt některých probiotik na všechny hlavní skupiny lymfocytů. Ovlivnění aktivity B lymfocytů dokládá skutečnost, že současné podání probiotika (např. L. casei, L. rhamnosus GG) spolu s vakcinací (rotavirová nebo salmonelová vakcína) zvyšuje signifikantně protilátkovou odpověď na podaný antigen [12].
Aplikace L. rhamnosus nemocným s Crohnovou chorobou vedla ke snížení produkce IFN-g a IL-2 periferními T lymfocyty. Jiný kmen, L. casei, v experimentu na myších potlačoval kontaktní alergickou reakci přímou i nepřímou stimulací regulačních CD4+ T lymfocytů [13]. Unikátním mechanismem ovlivňuje chování T lymfocytů probiotikum Saccharomyces boulardii. Zvyšuje schopnost endoteliálních buněk mezenteriálních lymfatických uzlin zadržet T lymfocyty. Změna migračního chování T buněk tak má za následek snížení produkce prozánětlivých cytokinů ve sliznici střeva [14].
Metabolické účinky střevní mikroflóry
Jedním z typických rysů střevní mikroflóry je její obrovská metabolická aktivita, která významně přispívá k homeostáze hostitelského organismu. Je schopna přeměňovat komplexní látky, především vlákninu a střevní hlen, na jednoduché sloučeniny (cukry, mastné kyseliny s krátkým řetězcem), které mohou být absorbovány. Některé z nich (butyrát) jsou nezbytnými nutrienty pro buňky střevního epitelu. Střevní mikroflóra se podílí také na syntéze některých esenciálních vitaminů (vitamin K, B12, kyselina listová), přispívá k metabolismu žlučových kyselin, transformaci potenciálních kancerogenů a k aktivaci bioaktivních látek (např. fytoestrogenů). V poslední době je metabolická aktivita střevní flóry zkoumána v souvislosti s patogenezí některých civilizačních chorob (např. obezita, diabetes mellitus) [1].
Probiotika v prevenci a v léčbě gastrointestinálních chorob
Prokázané i předpokládané mechanismy příznivého působení na lidský organismus a především na gastrointestinální trakt naznačují velký terapeutický potenciál probiotik. Skutečný preventivní nebo léčebný efekt je však nutno potvrdit jednak v kontrolovaných zkouškách a jednak vlastní klinickou praxí. A zde je nutno podotknout, že klinická účinnost probiotik neodpovídá vždy teoretickým předpokladům. Hlavním důvodem je ve většině případů multifaktoriální etiopatogeneze daného onemocnění (např. dráždivý tračník, idiopatické střevní záněty). Klinická praxe také potvrzuje, že účinnost probiotika je zpravidla tím větší, čím méně „extramikrobiálních“ faktorů se na vzniku nemoci podílí.
Idiopatické střevní záněty
Typickým příkladem onemocnění, kde praxe nenaplňuje zcela teoretická očekávání, jsou idiopatické střevní záněty (IBD). Tato skupina zahrnuje 2 základní nozologické jednotky: Crohnovu chorobu (CD) a ulcerózní kolitidu (UC). Patogeneze obou nemocí je velmi úzce spjata s přítomností střevních bakterií, bez nichž tyto záněty ve střevě nevzniknou (jak bylo prokázáno v experimentu na bezmikrobních zvířatech). Přesto je současné využití probiotik v léčbě IBD relativně malé a je omezeno na 2 situace. První a nejvýznamnější je zánět v ileálním vaku (pouchi) u nemocných s UC a ileopouchanální anastomózou (IPAA). Probiotický koktejl VSL#3 je směsí 8 bakteriálních kmenů (Lactobacillus acidophilus, L. casei, L. plantarum, L. delbrueckii, Bifidobacterium longum, B. breve, B. infantis a Streptococcus salivarius spp. thermophilus) a jeho aplikace u nemocných s chronickou pouchitidou signifikantně snižuje riziko relapsu akutního zánětu [15, 16]. Stejná substance má i profylaktický efekt u pacientů s nově vytvořenou IPAA, kde vedla k významnému snížení výskytu pouchitidy po dobu 1 roku od operace [17].
Druhou indikací k zavedení probiotické léčby u nemocných s IBD je udržovací terapie UC [18]. Tři klinické studie potvrdily ekvivalenci probiotického kmene E. coli Nissle 1917 v udržovací léčbě UC v porovnání s tradičně užívaným mesalazinem [19–21]. Zejména studie Kruiseho a kol., do níž bylo zařazeno téměř 330 nemocných, potvrdila, že tento unikátní kmen je rovnocennou náhradou u pacientů, kteří nemohou z jakéhokoli důvodu užívat dlouhodobě mesalazin. Naproti tomu, v současné době nemáme jednoznačné důkazy dosvědčující efektivitu probiotik v léčbě akutní ataky UC.
Podobně nejasná situace panuje ve využití probiotik v léčbě Crohnovy choroby. Ačkoli Malchow a kol. v roce 1997 referovali o příznivém efektu E. coli Nissle 1917 na potlačení aktivity CD [21], další přesvědčivé důkazy zde chybějí. Rozsáhlá studie se stejným kmenem (E. coli Nissle 1917), která probíhala i na našem území na přelomu milénia u nemocných s CD, nebyla dosud v žádné podobě publikována.
Poměrně slibným se jeví využití nepatogenní kvasinky Saccharomyces boulardii jako pomocného léku CD. Guslandi a kol. popsali příznivý účinek kombinované léčby mesalazinem a S. boulardii v udržovací terapii CD. Jedním z potenciálních mechanismů může být příznivý efekt tohoto mikroba na snížení patologicky zvýšené střevní permeability u pacientů s CD [23, 24].
Dráždivý tračník
Tato funkční porucha je nejrozšířenější gastrointestinální chorobou v populaci. S ohledem na multifaktoriální původ je její léčba celkově málo účinná, mezi používanými léky se často objevují i probiotika. Důvodem je jejich schopnost měnit složení a metabolickou aktivitu střevní flóry, zejména podporou tvorby mastných kyselin s krátkým řetězcem. Sekundárně probiotika ovlivňují rovněž motorickou a sekreční aktivitu střeva a tím mohou přispívat ke zmírnění projevů dráždivého tračníku. Z praktického hlediska lze nejlepší výsledek očekávat u nemocných s postinfekční formou dráždivého tračníku.
Objektivní posouzení účinku probiotik u nemocných s dráždivým tračníkem je velmi ztíženo heterogenitou této populace. Přestože byla provedena řada kontrolovaných i otevřených studií s různými probiotickými kmeny, jejich výsledky nedávají jednoznačný návod, jaké probiotikum použít v konkrétní klinické situaci. Typickým příkladem konfliktních výsledků jsou studie s probiotikem VSL#3, které publikoval Kim a kol. U nemocných s průjmovou formou dráždivého tračníku pozoroval nejprve významné snížení pocitu vzedmutí břicha, nikoli však prodloužení doby pasáže trávicí trubicí (tzv. transit time). Když následně aplikoval stejný preparát pacientům, u nichž bylo vzedmutí břicha dominujícím symptomem, nezjistil žádné zlepšení v této oblasti, a naopak došlo k signifikantnímu prodloužení doby pasáže (transit time) [25, 26].
Střevní dysmikrobie a postantibiotický průjem
Narušení střevní mikroflóry antibiotickou, resp. antimikrobiální léčbou je velmi časté. V závislosti na typu antibiotika a dalších faktorech na straně hostitelského organismu se objevují postantibiotické průjmy nebo střevní dyspepsie až u jedné třetiny léčených pacientů [2]. Mezi rizikové léky patří zejména penicilinová antibiotika (ampicilin, amoxycilin klavulanát), linkosamidy (klindamycin) a některé cefalosporiny. K projevům střevní dysmikrobie může dojít jak během užívání léku či bezprostředně po skončení antibiotické léčby, tak i s odstupem až několika týdnů. Tuto skutečnost je třeba mít na paměti při hodnocení možné kauzální souvislosti střevních obtíží s dříve užívanými léky.
Jednoznačně spolehlivá terapie postantibiotických průjmů neexistuje. V rozsáhlé metaanalýze, která zahrnula 25 randomizovaných kontrolovaných studií, byl zjištěn celkově příznivý preventivní vliv podávání probiotik na vznik postantibiotických průjmů (RR 0,43) [27]. Stratifikací v závislosti na typu použitého probiotika dospěli autoři k závěru, že statisticky významné zlepšení nastává při použití 2 samostatných kmenů (S. boulardii a L. rhamnosus GG) anebo při aplikaci směsi 2 probiotik.
Přibližně 30 % postantibiotických průjmů je vyvoláno toxinem bakterie Clostridium difficile [28]. Většina nemocných (80 %) dobře reaguje na standardní léčbu vankomycinem nebo metronidazolem, u části pacientů se však projevuje sklon k častým recidivám (20–30 %). Výše zmíněná metaanalýza rovněž potvrdila příznivý vliv probiotik na léčbu a prevenci kolitidy indukované bakterií Clostridium difficile (RR 0,59). Statisticky významné účinnosti ovšem dosáhla pouze léčba S. boulardii. Vzhledem k tomu, že mechanismus účinku S. boulardii se liší od antimikrobiálního efektu antibiotika, je výhodné podávat oba preparáty od počátku léčby současně.
Infekční průjmy
Akutní infekční průjmy jsou nejčastěji virového původu. Většina studií provedených v této indikaci se týkala dětské populace. Jejich výsledky sice vesměs potvrzují příznivý efekt podávání probiotik na urychlení léčby střevní infekce, tento efekt ale není nijak robustní. Podobně jako v jiných indikacích, i zde je účinnost probiotické terapie závislá na použitém kmeni a jeho dávce. Bylo zjištěno, že efekt probiotik je podstatně vyšší u infekcí virových ve srovnání s infekcemi bakteriálními či mykotickými [29]. Ovlivnění tzv. cestovatelských průjmů aplikací probiotik nebylo v klinických studiích jednoznačně prokázáno. I zde platí, že výsledky se liší v závislosti na použitém léčivu a také v závislosti na navštívené destinaci.
Preventivní efekt podávání probiotik u novorozenců
Kolonizace gastrointestinálního traktu bezprostředně po porodu zásadně ovlivňuje vyzrávání střevního imunitního systému a má vliv nejen na lokální, ale i na systémovou imunitní reaktivitu. U nedonošených novorozenců stoupá riziko vzniku průjmů a riziko závažné nekrotizující enterokolitidy, v jejíž patogenezi může hrát jednu z významných rolí nevyzrálost imunitního systému střeva. Aplikace probiotik (nepatogenní E. coli) má u nedonošených novorozenců preventivní efekt na vznik průjmových onemocnění i nekrotizující enterokolitidy [30].
Ostatní indikace probiotik
Probiotika byla testována u řady dalších gastrointestinálních chorob. Wildt a kol. hodnotili ve studii kontrolované placebem efekt probiotik u nemocných s kolagenní kolitidou. Neprokázali signifikantní zlepšení celkového stavu, následná analýza však ukázala příznivý efekt na některé symptomy [31].
Léčba E. coli Nissle 1917 byla testována také u nemocných se zácpou. V 8týdenní studii byl pozorován statisticky významný efekt na zvýšení počtu stolic ve skupině 70 nemocných, kteří měli při vstupu do studie nejvýše 2 stolice týdně [32].
Potenciální indikací probiotické terapie může být také divertikulární nemoc. V této indikaci jsou probiotika testována v dlouhodobé udržovací terapii s cílem omezit riziko akutního vzplanutí zánětu v terénu divertiklů tlustého střeva [33].
Postavení probiotik v současné gastroenterologické praxi
Praktické používání probiotik se řídí nejen výsledky klinických studií, ale především klinickou zkušeností konkrétního lékaře. Většina probiotických preparátů na našem trhu má v současné době status potravinového doplňku a jsou k dispozici ve volném prodeji. Mezi léky dostupné pouze na lékařský předpis byly zařazeny např. E. coli Nissle 1917 nebo S. boulardii.  Ve skupině nemocných s IBD je v našich podmínkách hlavní indikací udržovací terapie UC u pacientů, kteří netolerují běžně používaný mesalazin. Preparátem volby je E. coli Nissle 1917. Probiotická léčba pouchitidy, eventuálně její prevence, je u nás komplikována skutečností, že preparát prokazatelně účinný v této indikaci není v ČR na trhu (VSL#3). Protože nevíme, který (nebo které) z probiotických kmenů obsažených v tomto léku je především zodpovědný za příznivý efekt léčby, je možno v běžné praxi sáhnout po jiném probiotiku, v němž je jeden či více příslušných kmenů rovněž přítomno. Většina těchto preparátů je volně prodejná a náleží do skupiny potravinových doplňků. Bakteriální kmeny nejčastěji obsažené v probiotických preparátech uvádí tab. 2.
Ve skupině nemocných s IBD je v našich podmínkách hlavní indikací udržovací terapie UC u pacientů, kteří netolerují běžně používaný mesalazin. Preparátem volby je E. coli Nissle 1917. Probiotická léčba pouchitidy, eventuálně její prevence, je u nás komplikována skutečností, že preparát prokazatelně účinný v této indikaci není v ČR na trhu (VSL#3). Protože nevíme, který (nebo které) z probiotických kmenů obsažených v tomto léku je především zodpovědný za příznivý efekt léčby, je možno v běžné praxi sáhnout po jiném probiotiku, v němž je jeden či více příslušných kmenů rovněž přítomno. Většina těchto preparátů je volně prodejná a náleží do skupiny potravinových doplňků. Bakteriální kmeny nejčastěji obsažené v probiotických preparátech uvádí tab. 2.
U nemocných s dráždivým tračníkem nepatří obvykle probiotika k lékům první volby. Výjimkou mohou být nemocní s tzv. postinfekčním dráždivým tračníkem, u nichž může obnova střevní flóry zmírnit nepříjemné střevní symptomy. Z praktického hlediska se zdá být u pacientů s dráždivým tračníkem výhodné sáhnout po některém ze synbiotik; přítomnost vlákniny může zvýraznit příznivý efekt probiotika. Volba konkrétního preparátu, resp. probiotického kmene, plně závisí na zkušenosti lékaře, klinické studie zde spolehlivý návod nedávají.
Nepochybně významnou roli mohou hrát probiotika v léčbě a zejména v prevenci postantibiotických průjmů. S. boulardii a L. rhamnosus GG jsou prokazatelně účinnými kmeny; S. boulardii navíc snižuje riziko recidivy klostridiové kolitidy. Vzhledem k vysokému riziku relapsu i po ukončeném podávání antibiotické léčby lze doporučit automatické podání S. boulardii u všech nemocných s prodělanou klostridiovou kolitidou.
Seznam použité literatury
- [1] Mai V, Draganov PV. Recent advances and remaining gaps in our knowledge of associations between gut microbiota and human health. World J Gastroenterol 2009; 15: 81–85.
- [2] Jonkers D, Stockbrüger R. Review article: probiotics in gastrointestinal and liver diseases. Aliment Pharmacol Ther 2007; 26 (Suppl. 2): 133–148.
- [3] Eckburg PB, Bik EM, Bernstein CN, et al. Diversity of the human intestinal microbial flora. Science 2005; 308: 1635–1638.
- [4] Frič P. Probiotics in Gastroenterology. Z Gastroenterol 2002; 40: 197–201.
- [5] Venturi A, Gionchetti P, Rizzello F, et al. Impact on the composition of the faecal flora by a new probiotic preparation: preliminary data on maintenance treatment of patients with ulcerative colitis. Aliment Pharmacol Ther 1999; 13: 1103–1108.
- [6] Boudeau J, Glasser AL, Julien S, et al. Inhibitory effect of probiotic Escherichia coli strain Nissle 1917 on adhesion to and invasion of intestinal epithelial cells by adherent-invasive E. coli strains isolated from patients with Crohn’s disease. Aliment Pharmacol Ther 2003; 18: 45–56.
- [7] Ng SC, Hart AL, Kamm MA, et al. Mechanisms of action of probiotics: recent advances. Inflamm Bowel Dis 2009; 15: 300–310.
- [8] Kennedy RJ, Hoper M, Deodhar K, et al. Probiotic therapy fails to improve gut permeability in a hapten model of colitis. Scand J Gastroenterol 2000; 35: 1266–1271.
- [9] Otte JM, Podolsky DK. Functional modulation of enterocytes by Gram-positive and Gram-negative microorganisms. Am J Physiol Gastrointest Liver Physiol 2004; 286: G613–G626.
- [10] Resta-Lenert S, Barrett KE. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive E. coli (EIEC). Gut 2003; 52: 988–997.
- [11] Yan F, Polk DB. Probiotic bacterium prevents cytokine-induced apoptosis in intestinal epithelial cells. J Biol Chem 2002; 277: 50959–50965.
- [12] Fang H, Elina T, Heikki A, et al. Modulation of humoral immune response through probiotic intake. FEMS Immunol Med Microbiol 2000; 29: 47–52.
- [13] Chapat L, Chemin K, Dubois B, et al. Lactobacillus casei reduces CD8+ T cell-mediated skin inflammation. Eur J Immunol 2004; 34: 2520–28.
- [14] Dalmasso G, Cottrez F, Imbert V, et al. Saccharomyces boulardii inhibits inflammatory bowel disease by trapping T cells in mesenteric lymph nodes. Gastroenterology 2006; 131: 1812–1825.
- [15] Gionchetti P, Rizzello F, Venturi A, et al. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology 2000; 119: 305–309.
- [16] Mimura T, Rizzello F, Helwig U, et al. Once daily high dose probiotic therapy (VSL#3) for maintaining remission in recurrent or refractory pouchitis. Gut 2004; 53: 108–114.
- [17] Gionchetti P, Rizzello F, Helwig U, et al. Prophylaxis of pouchitis onset with probiotic therapy: a double-blind, placebo-controlled trial. Gastroenterology 2003; 124: 1202–1209.
- [18] Lukáš M. Escherichia coli (Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1) jako probiotikum v klinické praxi. Remedia 2003; 13: 283–286.
- [19] Kruis W, Schutz E, Fric P, et al. Double-blind comparison of an oral E. coli preparation and mesalazine in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther 1997; 11: 853–858.
- [20] Rembacken BJ, Snelling AM, Hawkey PM, et al. Non-pathogenic E. coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial. Lancet 1999; 354: 635–639.
- [21] Kruis W, Fric P, Pokrotnieks J, et al. Maintaining remission of ulcerative colitis with the probiotic E. coli Nissle 1917 is as effective as with standard mesalazine. Gut 2004; 53: 1617–1623.
- [22] Malchow HA. Crohn’s disease and Escherichia coli. A new approach in therapy to maintain remission of colonic Crohn’s disease? J Clin Gastroenterol 1997; 25: 653–658.
- [23] Guslandi M, Mezzi G, Sorghi M, Testoni PA. Saccharomyces boulardii in maintenance treatment of Crohn’s disease. Dig Dis Sci 2000; 45: 1462–1464.
- [24] Garcia Vilela E, De Lourdes De Abreu Ferrari M, Oswaldo Da Gama Torres H, et al. Influence of Saccharomyces boulardii on the intestinal permeability of patients with Crohn’s disease in remission. Scand J Gastroenterol 2008; 43: 842–848.
- [25] Kim HJ, Camilleri M, McKinzie S, et al. A randomized controlled trial of a probiotic, VSL#3, on gut transit and symptoms in diarrhoe-predominant irritable bowel syndrome. Aliment Pharmacol Ther 2003; 17: 895–904.
- [26] Kim HJ, Vasquez Roque MI, Camilleri M, et al. A randomized controlled trial of a probiotic combination VSL#3 and placebo in irritable bowel syndrome with bloating. Neurogastroenterol Motil 2005; 17: 687–696.
- [27] McFarland LV. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am J Gastroenterol 2006; 101: 812–822.
- [28] McFarland LV. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea. Dig Dis 1998; 16: 292–307.
- [29] Saavedra J. Probiotics and infectious diarrhea. Am J Gastroenterol 2000; 95 (Suppl. 1): S16–18.
- [30] Lodinová-Zádníková R, Sonnenborn U. Effect of preventive administration of a non-pathogenic E. coli strain on the colonization of the intestine with microbial pathogens in newborn infants. Biol Neonate 1997; 71: 224–232.
- [31] Wildt S, Munck LK, Vinter-Jensen L, et al. Probiotic treatment of collagenous colitis: a randomized, double-blind, placebo-controlled trial with L. acidophilus and Bifidobacterium animalis subsp. lactis. Inflamm Bowel Dis 2006; 12: 395–401.
- [32] Möllenbrink M, Bruckschen E. Treatment of chronic constipation with physiologic E. coli bacteria. Results of a clinical study of the effectiveness and tolerance of microbiological therapy with the E. coli Nissle 1917 strain (Mutaflor). Med Klin 1994; 89: 587–593.
- [33] Fric P, Zavoral M. The effect of non-pathogenic E. coli in symptomatic uncomplicated diverticular disease of the colon. Eur J Gastroenterol Hepatol 2003; 15: 313–315.