Renální karcinom. Jak dále po selhání léčby inhibitory angiogeneze?
Česká republika je zemí s nejvyšším výskytem karcinomu ledviny. Přibližně u poloviny nemocných dojde během vývoje této choroby k metastatickému šíření, které vyžaduje systémovou léčbu. Přes dlouholetou absenci nových léků bylo v posledních pěti letech schváleno šest nových účinných látek. Pro 1. linii nepředléčeného metastatického karcinomu je to bevacizumab v kombinaci s interferonem alfa, sunitinib, pazopanib a sorafenib u pacientů, pro něž není vhodná léčba cytokiny, a temsirolimus u vysoce rizikové skupiny nemocných. Pro 2. linii terapie je schválen sorafenib, sunitinib a pazopanib po selhání léčby cytokiny a everolimus po selhání terapie inhibitory angiogeneze.
Renální karcinom je nejčastěji se vyskytujícím nádorem ledvin a představuje přibližně 90 % všech zhoubných novotvarů tohoto orgánu. Celkem 25–30 % nemocných s renálním karcinomem je diagnostikováno ve stadiu metastatické choroby a u 20–30 % pacientů, kteří podstoupí nefrektomii, dojde k recidivě onemocnění či k vývoji vzdálených metastáz [1]. Prognóza metastatického karcinomu ledviny je špatná. Četností výskytu mezi zhoubnými ![Obr. 1 Zavádění nových účinných látek do léčby metastatického karcinomu ledviny; podle [24–28] – Quesada, et al., 1983; de Kernion, et al., 1983; Rosenberg, et al., 1985; Latif, et al., 1993; Yang, et al., 2003.](https://www.remedia.cz/photo-a-28140---.jpg) novotvary se karcinom ledvin řadí na 14. místo, v České republice představuje pátou nejčastější malignitu u mužů a sedmou nejčastější malignitu u žen. Česká republika (ČR) společně s Estonskem a Islandem patří k zemím s nejvyšší incidencí. V roce 2007 bylo v ČR diagnostikováno 1756 nových onemocnění u mužů a 1039 nových případů u žen; karcinom ledviny tak tvoří 6,3 % všech malignit u mužů a 4,1 % všech malignit u žen. Incidence vykazuje trvale rostoucí trend, dochází však k nárůstu podílu časně diagnostikovaných stadií tohoto onemocnění, především díky zavedení přesnějších diagnostických metod, a ke stabilizaci mortality s prodlužujícím se pětiletým přežitím nemocných s tímto nádorem. Nicméně četnost pětiletého přežívání v ČR se pro stadia III a IV v posledních 10 letech výrazně nezměnila, činí 63,8–60,7 % pro stadium III a 17,7–15,3 % pro stadium IV [2]. Vzhledem k tomu, že v posledních pěti letech schválila Evropská léková agentura (European Medicine Agency, EMA) několik nových léčebných přípravků (obr. 1), lze doufat i ve zlepšené přežívání pro nemocné s pokročilým karcinomem ledviny, jež dlouhou dobou stálo mimo zájem výzkumu farmaceutického průmyslu.
novotvary se karcinom ledvin řadí na 14. místo, v České republice představuje pátou nejčastější malignitu u mužů a sedmou nejčastější malignitu u žen. Česká republika (ČR) společně s Estonskem a Islandem patří k zemím s nejvyšší incidencí. V roce 2007 bylo v ČR diagnostikováno 1756 nových onemocnění u mužů a 1039 nových případů u žen; karcinom ledviny tak tvoří 6,3 % všech malignit u mužů a 4,1 % všech malignit u žen. Incidence vykazuje trvale rostoucí trend, dochází však k nárůstu podílu časně diagnostikovaných stadií tohoto onemocnění, především díky zavedení přesnějších diagnostických metod, a ke stabilizaci mortality s prodlužujícím se pětiletým přežitím nemocných s tímto nádorem. Nicméně četnost pětiletého přežívání v ČR se pro stadia III a IV v posledních 10 letech výrazně nezměnila, činí 63,8–60,7 % pro stadium III a 17,7–15,3 % pro stadium IV [2]. Vzhledem k tomu, že v posledních pěti letech schválila Evropská léková agentura (European Medicine Agency, EMA) několik nových léčebných přípravků (obr. 1), lze doufat i ve zlepšené přežívání pro nemocné s pokročilým karcinomem ledviny, jež dlouhou dobou stálo mimo zájem výzkumu farmaceutického průmyslu.
Začátek 21. století je v onkologii ve znamení nebývalého rozvoje výzkumu nových léčivých přípravků cílené terapie. Výzkumná oddělení farmaceutického průmyslu soustřeďují svoji pozornost nejen na endemicky se vyskytující onemocnění, ale i na celou řadu vzácných onemocnění s výskytem nižším než 5 nemocných na 10 000 obyvatel, kam patří také zhoubné nádory ledviny.
![Obr. 2 Místa zásahu preparátů užívaných v cílené léčbě metastatického renálního karcinomu; volně podle [31, 32] – Rini, Small, 2005; Rini, 2009.](https://www.remedia.cz/photo-a-28141---.jpg) Základy tomuto vývoji položili především molekulární genetici a biologové objevem signálních cest, které transportují esenciální informace pro růst a proliferaci nejen nádorových buněk, ale i buněk tvořících mikroprostředí nádorů, jehož vývoj je nutný pro nádorovou transformaci a růst. Vývoj účinných léčivých přípravků je založen na poznání základních patologických mechanismů vedoucích k maligní transformaci, identifikaci esenciálních signálních transdukčních cest, genů, které se podílejí na tomto procesu a jejichž inhibice bude mít zásadní význam pro další život nádoru (obr. 2).
Základy tomuto vývoji položili především molekulární genetici a biologové objevem signálních cest, které transportují esenciální informace pro růst a proliferaci nejen nádorových buněk, ale i buněk tvořících mikroprostředí nádorů, jehož vývoj je nutný pro nádorovou transformaci a růst. Vývoj účinných léčivých přípravků je založen na poznání základních patologických mechanismů vedoucích k maligní transformaci, identifikaci esenciálních signálních transdukčních cest, genů, které se podílejí na tomto procesu a jejichž inhibice bude mít zásadní význam pro další život nádoru (obr. 2).
První nové léčivé přípravky registrované pro terapii pokročilého karcinomu ledviny inhibují blokádou vaskulárního endoteliálního růstového faktoru novotvorbu cév.
Inhibitory angiogeneze
Sorafenib a sunitinib byly prvními léčivými přípravky cílené terapie schválenými pro 2. linii léčby metastatického karcinomu ledviny. Základem pro schválení sorafenibu byla randomizovaná studie fáze II u předléčených nemocných (n = 202) s mediánem doby do progrese 24 týdnů (medián doby do progrese po podání placeba byl 6 týdnů) [3]. Jeho účinnost potvrdily výsledky randomizované studie fáze III srovnávající efekt sorafenibu u 903 nemocných s metastatickým karcinomem, kteří byli předléčeni cytokiny, interferonem alfa či interleukinem (celkem předléčeno 83 % mužů a 81 % žen), oproti placebu. V aktivním rameni bylo dosaženo statisticky významného prodloužení doby do progrese onemocnění, a to 5,5 měsíce oproti 2,8 měsíce u nemocných dostávajících placebo. Statisticky významný rozdíl nebyl zaznamenán v primárním cíli studie, jímž byla doba celkového přežívání [4, 5]. Sunitinib získal registraci na základě dvou klinických studií fáze II (n = 63; n = 106) u nemocných s předléčeným metastatickým onemocněním s dosažením doby do progrese onemocnění 8,3 a 8,7 měsíce; v jedné studii byl dosažen medián přežití 16,4 měsíce, ve druhé studii medián celkového přežití dosažen nebyl, ale 79 % pacientů přežívalo 6 měsíců. Základem rozšíření indikace sunitinibu pro 1. linii léčby byla randomizovaná studie fáze III srovnávající jeho efekt u nepředléčených nemocných s interferonem alfa (n = 750), která prokázala prodloužení doby do progrese ve srovnání s cytokinem (11 měsíců oproti 5 měsícům). Celkové přežití u pacientů léčených sunitinibem činilo 28 měsíců, u pacientů léčených interferonem alfa 14,1 měsíce [6–8]. V roce 2007 schválila EMA bevacizumab – první monoklonální protilátku proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF) – v kombinaci s interferonem pro první linii léčby. Ve dvou randomizovaných studiích fáze III (n = 649; n = 732) prokázal bevacizumab v kombinaci s interferonem alfa ve srovnání s monoterapií interferonem alfa u nepředléčených pacientů delší dobu bez progrese onemocnění – medián 10,2 vs. 5,4 měsíce a 8,4 vs. 4,9 měsíce. Konečná analýza neprokázala signifikantní rozdíl v celkovém přežívání ani v jedné z uvedených studií [9, 10]. Poslední molekulou, kterou EMA schválila v letošním roce pro 1. a 2. linii léčby metastatického karcinomu ledviny, je pazopanib, multikinázový inhibitor s blokádou VEGFR-1,2,3, PDGFR-a,b a KIT. Schválení se uskutečnilo na základě randomizované klinické studie fáze III, která srovnávala účinek pazopanibu u 233 nepředléčených nemocných a v terapii 202 nemocných předléčených cytokiny (interferonem alfa či interleukinem 2) ve srovnání s placebem. Statisticky významného prodloužení doby do progrese onemocnění bylo dosaženo v rameni s pazopanibem oproti rameni s placebem, 9,2 měsíce vs. 4,2 měsíce. Data pro hodnocení přežití nebyla v době registrace ještě dostatečná [11, 12]. Limitujícím faktorem této studie je, že léčba cytokiny selhala u poloviny pacientů a studie neměla aktivní rameno, ale srovnávala účinek léčby pazopanibem s placebem. EMA udělila pazopanibu registraci za zvláštních podmínek označovaných jako tzv. podmíněné schválení (conditional approval), což znamená, že Evropská léková agentura bude každý rok hodnotit nové informace o tomto preparátu a aktualizovat souhrn údajů o přípravku. Vzhledem k tomu, že tento preparát v době registrace neprokázal signifikantní přínos, významný ve smyslu účinnosti či bezpečnosti ve srovnání s přípravky již schválenými pro léčbu tohoto onemocnění, byl odstraněn z registru léčivých přípravků pro vzácná onemocnění. Designace léčivého přípravku pro vzácná onemocnění mu byla udělena Evropskou komisí v době klinického vývoje. V současné době probíhá randomizovaná studie srovnávající účinnost sunitinibu a pazopanibu v první linii metastatického karcinomu ledviny. Nábor pacientů byl již zastaven. Výsledky jsou očekávány na jaře 2011.
Inhibitory mTor
Savčí receptor pro rapamycin (mammalian target of rapamycine, mTOR) je serin/ threoninová kináza, která hraje významnou úlohu v regulaci buněčných procesů kontrolujících růst, proliferaci, motilitu a též zasahujících do procesů angiogeneze. U řady patologických procesů, nejen nádorových, je tato cesta výrazně aktivována. První inhibitor mTOR temsirolimus byl schválen pro léčbu pokročilého karcinomu ledviny. Jeho účinnost byla prokázána pouze u skupiny nemocných se špatnou prognózou, definovanou jako přítomnost tří a více prediktivních faktorů krátkého přežití dle kritérií MSKCC (Memorial Sloan-Kettering Cancer Center). Těmito kritérii jsou: 1,5krát vyšší LDH, hladina hemoglobinu nižší než stanovená norma, hladiny korigovaného sérového vápníku vyšší než 10 mg/dl, Karnofského index 60–70 %, vícečetné orgánové metastatické postižení a méně než jeden rok od stanovení diagnózy. Pro takto přísně definovanou skupinu nemocných bylo dosaženo statisticky významného rozdílu mezi terapií interferonem alfa a monoterapií temsirolimem jak v době do progrese onemocnění (5,6 měsíce oproti 3,2 měsíce), tak i v délce celkového přežití (10,9 měsíce oproti 7,3 měsíce). Je to jediný preparát, jehož podávání v klinických studiích fáze III vedlo k prodloužení celkové doby přežití [13, 14].
![Graf 1 Doba do progrese (PFS) onemocnění u pacientů ve studii RECORD-1; podle [16] – Motzer, et al., 2010.](https://www.remedia.cz/photo-a-28142---.jpg) Druhým inhibitorem mTOR registrovaným pro terapii renálního karcinomu je everolimus [6]. Jedná se o jediný léčivý přípravek, který prokázal účinnost u nemocných předléčených inhibitory angiogeneze. Dvojitě slepá placebem kontrolovaná klinická studie fáze III (RECORD-1) randomizovala celkem 410 nemocných do ramen léčených everolimem v dávce 10 mg či placebem. Statisticky významného rozdílu bylo dosaženo v primárním cíli studie, tj. v době do progrese onemocnění, která představovala 4,9 měsíce ve skupině pacientů léčených everolimem ve srovnání s 1,9 měsíce u nemocných, kteří dostávali placebo (graf 1). Statisticky významný rozdíl byl prokázán ve všech podskupinách nemocných s příznivou, střední a i špatnou prognózou dle kritérií MSKCC [15, 16].
Druhým inhibitorem mTOR registrovaným pro terapii renálního karcinomu je everolimus [6]. Jedná se o jediný léčivý přípravek, který prokázal účinnost u nemocných předléčených inhibitory angiogeneze. Dvojitě slepá placebem kontrolovaná klinická studie fáze III (RECORD-1) randomizovala celkem 410 nemocných do ramen léčených everolimem v dávce 10 mg či placebem. Statisticky významného rozdílu bylo dosaženo v primárním cíli studie, tj. v době do progrese onemocnění, která představovala 4,9 měsíce ve skupině pacientů léčených everolimem ve srovnání s 1,9 měsíce u nemocných, kteří dostávali placebo (graf 1). Statisticky významný rozdíl byl prokázán ve všech podskupinách nemocných s příznivou, střední a i špatnou prognózou dle kritérií MSKCC [15, 16].
Doporučené léčebné postupy
Vezmeme-li v úvahu výše zmíněné randomizované studie, máme stanoveny léčebné algoritmy vycházející z postulátů medicíny založené na důkazech (Evidence Based Medicine, EBM, tab. 1) pro první a druhou linii léčby metastatického karcinomu ledviny. Léčebné algoritmy jsou doporučovány jak EORTC (European Organisation for 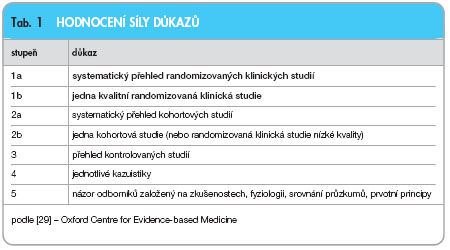 Research and Treatment of Cancer), tak i Evropskou urologickou společností (European Association of Urology, EAU), tab. 2, 3, a Evropskou společností klinické onkologie (European Society of Medical Oncology, ESMO) [17–20] a jsou reflektovány i v doporučení České onkologické společnosti (ČOS) platném od 1. 8. 2010 [30]. Pro nemocné se střední a dobrou prognózou je doporučována léčba sunitinibem či kombinací interferonu alfa s bevacizumabem. Indikace k léčbě sorafenibem je
Research and Treatment of Cancer), tak i Evropskou urologickou společností (European Association of Urology, EAU), tab. 2, 3, a Evropskou společností klinické onkologie (European Society of Medical Oncology, ESMO) [17–20] a jsou reflektovány i v doporučení České onkologické společnosti (ČOS) platném od 1. 8. 2010 [30]. Pro nemocné se střední a dobrou prognózou je doporučována léčba sunitinibem či kombinací interferonu alfa s bevacizumabem. Indikace k léčbě sorafenibem je 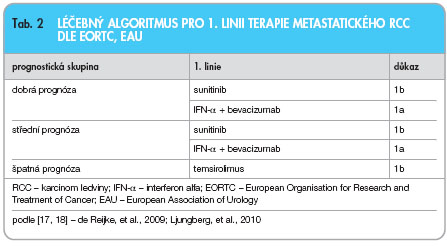 podložena daty a schválením regulačních agentur pro 1. linii léčby nemocných, kteří nejsou indikováni k terapii cytokiny. Pazopanib, jehož podávání bylo nedávno schváleno, není momentálně v České republice kategorizován a není hrazen z prostředků zdravotního pojištění. Everolimus je indikován po selhání terapie inhibitory angiogeneze a sorafenib je indikován po selhání léčby cytokiny. Doporučení ČOS uvádí pro 2. linii léčby metastatického karcinomu ledviny i sunitinib a pazopanib po selhání terapie cytokiny.
podložena daty a schválením regulačních agentur pro 1. linii léčby nemocných, kteří nejsou indikováni k terapii cytokiny. Pazopanib, jehož podávání bylo nedávno schváleno, není momentálně v České republice kategorizován a není hrazen z prostředků zdravotního pojištění. Everolimus je indikován po selhání terapie inhibitory angiogeneze a sorafenib je indikován po selhání léčby cytokiny. Doporučení ČOS uvádí pro 2. linii léčby metastatického karcinomu ledviny i sunitinib a pazopanib po selhání terapie cytokiny.
Sekvenční terapie inhibitory tyrozinkinázy
 Přes existující validní data stále probíhají diskuse kolem otázky sekvenční terapie inhibitory angiogeneze po předchozím selhání léčby s mechanismem účinku cílícím na stejné buněčné pochody. V současné době nemáme k dispozici data o protinádorové účinnosti, která by v podmínkách běžné klinické praxe opravňovala k užití sekvenční terapie inhibitory tyrozinkináz. V literatuře najdeme výsledky retrospektivních studií či studií fáze II ve formě pouze abstrakt s malými počty pacientů. Na základě těchto dat je možno pouze navrhovat klinické studie fáze III [21, 22]; tyto výsledky by však neměly být východiskem léčebných standardů, protože nepodávají validní data o účinnosti a bezpečnosti jednotlivých léčebných přípravků. Jediná publikovaná studie fáze II prokázala omezenou účinnost sorafenibu u nemocných refrakterních na sunitinib [23]. Autoři závěrem konstatují nezbytnost dalších klinických studií srovnávajících především inhibitory tyrozinkinázy s mTOR inhibitory pro druhou linii léčby metastatické choroby. V současné době probíhá několik studii fáze III, které zjišťují efekt sekvenčního či kombinovaného podávání již schválených léčivých přípravků. Až na základě jejich výsledků budeme moci eventuálně korigovat naše standardní terapeutické postupy.
Přes existující validní data stále probíhají diskuse kolem otázky sekvenční terapie inhibitory angiogeneze po předchozím selhání léčby s mechanismem účinku cílícím na stejné buněčné pochody. V současné době nemáme k dispozici data o protinádorové účinnosti, která by v podmínkách běžné klinické praxe opravňovala k užití sekvenční terapie inhibitory tyrozinkináz. V literatuře najdeme výsledky retrospektivních studií či studií fáze II ve formě pouze abstrakt s malými počty pacientů. Na základě těchto dat je možno pouze navrhovat klinické studie fáze III [21, 22]; tyto výsledky by však neměly být východiskem léčebných standardů, protože nepodávají validní data o účinnosti a bezpečnosti jednotlivých léčebných přípravků. Jediná publikovaná studie fáze II prokázala omezenou účinnost sorafenibu u nemocných refrakterních na sunitinib [23]. Autoři závěrem konstatují nezbytnost dalších klinických studií srovnávajících především inhibitory tyrozinkinázy s mTOR inhibitory pro druhou linii léčby metastatické choroby. V současné době probíhá několik studii fáze III, které zjišťují efekt sekvenčního či kombinovaného podávání již schválených léčivých přípravků. Až na základě jejich výsledků budeme moci eventuálně korigovat naše standardní terapeutické postupy.
Léčebné algoritmy založené na validních výsledcích klinických studií prověřených nezávislým hodnocením odborníků regulačních lékových agentur i z řad kliniků mohou přinést prospěch nemocnému. Na těchto principech by měla spočívat nejen denní klinická praxe, ale i rozhodování plátců zdravotní péče, zvláště v období omezených finančních zdrojů.
Řada nemocných zůstává v klinicky dobrém stavu i po selhání dvou až tří linií léčby vycházející z EBM, tito pacienti jsou potenciálně indikováni k další terapii. Vzhledem k tomu, že chybějí data o sekvenčním podávání inhibitorů tyrozinkináz, základním cílem by měla být možnost účasti klinických pracovišť v dobře navrhovaných klinických studiích s novými léčebnými přípravky, která bude vhodným nemocným nabídnuta. Jen údaje a závěry takovýchto studií mohou přinést zlepšení léčebných výsledků pokročilého renálního karcinomu.
Metastatický karcinom ledviny zůstává i přes zavedení nových léčivých přípravků cílené terapie inkurabilním onemocněním. Identifikace nových molekulárně patologických mechanismů podílejících se na vzniku jak familiárního, tak sporadického karcinomu ledviny přispěla k vývoji nových léčebných molekul. Zůstává však stále velké množství nezodpovězených otázek. Jedním z klíčových problémů je identifikace biomarkerů, na jejichž základě bychom určili pacienta, který by měl prospěch z cílené terapie. Tato otázka je také zásadním faktorem podmiňujícím úspěch personifikované onkologické léčby 21. století.
Seznam použité literatury
- [1] Escudier B, Gore M. Renal Carcinoma, First publishing, London: Classe Publishing 2010.
- [2] SVOD analýza, http://www.svod.cz/
- [3] Ratain MJ, Eisen T, Stadler WM, et al. Phase II placebo-controlled randomized discontinuation trial of sorafenib in patiens with metastatic renal carcinoma. J Clin Oncol 2006; 24: 2505–2512.
- [4] Nexavar, EPAR, http://www.ema.europa.eu Accessed 30. 10. 2010.
- [5] Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356: 125–134.
- [6] Motzer RJ, Michaelson MD, Redman DG, et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal carcinoma. J Clin Oncol 2006; 24: 16–24.
- [7] Motzer RJ, Rini BI, Bukowski RM, et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA 2006; 295: 2516–2524.
- [8] Motzer RJ, Hutson TE, Tomczak P, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007; 356: 115–124.
- [9] Escudier B, Pluzanska A, Koralewski P, et al. Bevacizumab plus interferon alfa-2a for treatment of metastatic renal carcinoma: a randomised, double blind phase III trial. Lancet 2007; 370: 2103–2111.
- [10] Rini BI, Halabi S, Rosenberg JE, et al. Phase III trial of bevacizumab plus interferon alfa versus interferon monotherapy in patients with metastatic renal cell carcinoma: final results of CALGB 90206. J Clin Oncol 2010; 28: 2137–2143.
- [11] Votrient, EPAR, http://www.ema.europa.eu Accessed 30. 10. 2010.
- [12] Sternberg C, Davis ID, Mardiak J, et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol 2010; 28: 1061–1068.
- [13] Torisel, EPAR, http://www.ema.europa.eu Accessed 30. 10. 2010.
- [14] Hudes G, Carducci M, Tomczak P, et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356: 2271–2281.
- [15] Afinitor, EPAR, http://www.ema.europa.eu Accessed 30. 10. 2010.
- [16] Motzer RJ, Escudier B, Oudard S, et al. Phase 3 trial of everolimus for metastatic renal cell carcinoma: final results and analysis of prognostic factors. Cancer 2010; 116: 4256–4265.
- [17] de Reijke TM, Bellmunt J, von Poppel H, et al. EORTC-GU group expert opinion on metastatic renal cancer. Eur J Cancer 2009; 45: 765–773.
- [18] Ljungberg B, Cowan NC, Hanbury DC, et al. EAU Guidelines on Renal Cell Carcinoma: The 2010 Update. Eur Urol 2010; 58: 398–403.
- [19] Escudier B, Katja V. Renal cell carcinoma. ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009; 20 Suppl. 4: iv81–iv82.
- [20] Escudier B, Kataja V. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21: S5: v137–v139.
- [21] Sablin MP, Negrier S, Ravaud A, et al. Sequential sorafenib and sunitinib for Renal Cell Carcinoma. J Urol 2009; 182: 29–34.
- [22] Tamaskar I, Garcia JA, Elson P, et al. Antitumor effect of sunitinib or sorafenib in patients with renal cell carcinoma who received prior antiangiogenic therapy. J Urol 2008; 179: 81–86.
- [23] Di Lorenzo G, Carteni G, Autorino R, et al. Phase II study of sorafenib in patients with sunitinib-refractory metastatic renal cell cancer. J Clin Oncol 2009; 27: 4469–4474.
- [24] Quesada JR, Swanso`n DA, Trindade A, Gutterman JU. Renal cell carcinoma: antitumor effects of leukocyte interferon. Cancer Res 1983; 43: 940–947.
- [25] de Kernion JB, Sarna G, Figlin R, et al. The treatment of renal cell carcinoma with human leukocyte alpha-interferon. J Urol 1983; 130: 1063–1066.
- [26] Rosenberg SA, Lotze MT, Muul LM, et al. Observations on the systemic administration of autologous lymphokine-activated killer cells and recombinant interleukin-2 to patients with metastatic cancer. N Engl J Med 1985; 313: 1485–1492.
- [27] Latif F, Tory K, Gnarra J, et al. Identification of the von Hippel-Lindau disease tumor suppressor gene. Science 1993; 260: 1317–1320.
- [28] Yang JC, Haworth L, Sherry RM, et al. A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J Med 2003; 349: 427–434.
- [29] Oxford Centre for Evidence-based Medicine. http: //www.cebm.net/ Accessed 30. 10. 2010.
- [30] Zásady cytostatické léčby maligních onkologických onemocnění. 11. vyd. Brno: Česká onkologická společnost ČLS JEP, 2010.
- [31] Rini BI, Small EJ. Biology and clinical development of vascular endothelial growth factor-targeted therapy in renal cell carcinoma. J Clin Oncol 2005; 23: 1028–1043.
- [32] Rini BI. Metastatic renal cell carcinoma: many treatment options, one patient. J Clin Oncol 2009; 27: 3225–3234.