Renální karcinom – přehled léčby pokročilého a metastatického onemocnění
V systémové terapii metastatického renálního karcinomu (mRCC) se plně prosadily cílené inhibitory klíčových buněčných procesů. Tato cílená léčba sice nepřináší vyléčení, ale významně prodlužuje přežití většiny nemocných při dobré kvalitě života. Základním problémem terapie mRCC je správné využití všech léčebných možností a zvládání často netypických nežádoucích účinků cílené terapie.
Přehled epidemiologie a patogeneze
Karcinom ledviny (renal cell carcinoma, RCC) je nejčastějším primárním nádorem ledviny mimo ledvinnou pánvičku. V roce 2009 dosahovala jeho incidence v České republice 27/100 000 obyvatel a mortalita 11/100 000 obyvatel. Výskyt karcinomu ledviny se ve vyspělých zemích světa zvyšuje asi o 2 % ročně, u nás je při velmi vysoké incidenci (nejvyšší ze sledovaných zemí) posledních 15 let výskyt RCC stabilizovaný (při zohlednění stárnutí populace) [1].
Mezi prokázané rizikové faktory RCC patří kouření a obezita. Nosiči mutace von Hippelova-Lindauova (VHL) genu (výskyt 1/39 000–1/50 000 osob) mají 40% pravděpodobnost onemocnění RCC, který u nich bývá multiplicitní a bilaterální. U sporadických RCC je gen VHL inaktivován asi v 75 % případů.
Nejčastějším histologickým typem RCC je světlobuněčný karcinom. Přibližně u 25 % pacientů je diagnostikován jiný histologický typ karcinomu, jako například papilární karcinom typu 1 nebo 2 (15 %), multilokulární cystický karcinom (3 %), chromofobní karcinom (5 %), karcinom z buněk sběrných kanálků (< 1 %), renální medulární karcinom (< 1 %) a nefroblastom dospělého věku (< 1 %).
Klinický průběh a diagnostika
Počáteční stadia RCC jsou nejčastěji asymptomatická. Později se nemoc může projevit hematurií, bolestí břicha nebo lumbální oblasti nebo hmatným nádorem v břiše. Občas se při invazi RCC do vena renalis nebo vena cava inferior nebo při zevním útlaku spermatické žíly objemným nádorem objevuje varikokéla. Při metastatickém onemocnění bývá přítomno hubnutí, bolesti zad či paraneoplastické projevy (polyglobulie, trombocytemie, hyperkalcemie, horečky).
RCC metastazuje lymfatickou cestou do retroperitoneálních lymfatických uzlin a hematogenně do plic, jater, kostí, kůže a mozku.
Nádor ledviny je často objeven při sonografickém vyšetření břicha pro nesouvisející příčinu. V rámci stagingu (stanovení klinické pokročilosti onemocnění) je standardem CT břicha (v indikovaných případech včetně CT angiografie) k objasnění rozsahu a operability nádoru. CT hrudníku slouží k vyloučení metastatického rozsevu do plic. Scintigrafie skeletu je indikována při podezření na metastázy do kostí při příznacích jako hyperkalcemie, elevace alkalické fosfatázy nebo při bolestech. Pozitronová emisní tomografie (PET) je relativně nevýtěžná pro posouzení rozsahu primárního nádoru, protože radionuklidem značená glukóza se vylučuje do moči, má však vysokou senzitivitu pro detekci metastáz. V současnosti ovšem není standardním stagingovým vyšetřením [2].
Prognóza metastatického karcinomu ledviny
P ro volbu terapie metastatického karcinomu ledviny (mRCC) je zásadní stratifikace pacientů podle kritérií Memorial Sloan-Kettering Cancer Centre (MSKCC). Podle této klasifikace se pacienti s mRCC rozdělují do tří prognostických skupin podle přítomnosti rizikových faktorů. Dnes se kritéria MSKCC používají v modifikované verzi (tab. 1) [3]. U nemocných s dobrou a střední prognózou je medián přežití přibližně 2–3 roky, 5 let přežívá kolem 15 % pacientů. Molekulární prediktory relapsu se intenzivně zkoumají, ale dosud nejsou dostatečně validované pro klinickou praxi.
ro volbu terapie metastatického karcinomu ledviny (mRCC) je zásadní stratifikace pacientů podle kritérií Memorial Sloan-Kettering Cancer Centre (MSKCC). Podle této klasifikace se pacienti s mRCC rozdělují do tří prognostických skupin podle přítomnosti rizikových faktorů. Dnes se kritéria MSKCC používají v modifikované verzi (tab. 1) [3]. U nemocných s dobrou a střední prognózou je medián přežití přibližně 2–3 roky, 5 let přežívá kolem 15 % pacientů. Molekulární prediktory relapsu se intenzivně zkoumají, ale dosud nejsou dostatečně validované pro klinickou praxi.
Lokoregionální léčebné postupy u mRCC
Nefrektomie se u nemocných s mRCC doporučuje tehdy, pokud jsou splněny podmínky resekability a operability. Kandidáty na nefrektomii jsou pacienti se světlobuněčným mRCC v dobrém celkovém stavu (PS 0–1) a s adekvátními respiračními a kardiálními funkcemi. Cytoredukce (snížení buněčné hmoty nádoru) by měla dosáhnout alespoň 75 %.
Význam cytoredukční nefrektomie byl zkoumán ve dvou randomizovaných studiích u nemocných s mRCC léčených interferonem alfa (IFN-α) [4, 5]. V obou studiích se prokázal příznivý vliv nefrektomie na celkové přežití (11,1 vs. 8,1 měsíce, p = 0,05; 17 vs. 7 měsíců, p = 0,03). U pacientů s nesvětlobuněčným mRCC nebyl efekt cytoredukční nefrektomie dostatečně prozkoumán. V současnosti probíhají randomizované studie s cílem objasnit přínos nefrektomie u pacientů s mRCC léčených cílenou léčbou.
Kompletní metastazektomie je potenciálně kurativním výkonem u mRCC s postižením plic, jater nebo mozku. Na tuto léčebnou možnost je potřeba myslet zejména proto, že metastáza karcinomu ledviny, často solitární, se může objevit i po mnoha letech po odstranění primárního nádoru. Metastazektomie nebyla nikdy zkoumána v randomizované studii (kontrolní rameno by bylo neetické). Pětileté přežití u pacientů po kompletní metastazektomii v retrospektivní studii dosáhlo 45 % ve srovnání s 23 % u nemocných s nekompletní metastazektomií a 8 % u pacientů bez metastazektomie (p < 0,001) [6].
Dalšími možnostmi lokální terapie u mRCC jsou paliativní cévní intervenční výkon s embolizací krvácejícího inoperabilního nádoru a radioterapie při bolestivých nádorových ložiskách, zvláště v kostech.
Systémová léčba mRCC
Cytokinová terapie a alogenní transplantace krvetvorných buněk
Cytokiny interferon (IFN), interleukin-2 (IL-2) nebo jejich kombinace (případně ještě i s chemoterapií) byly donedávna hlavní modalitou léčby mRCC. I při nízké účinnosti (počet pacientů s regresí nádorů nepřesahující15 %) byla za standard považována monoterapie IFN.
Na základě uskutečněných randomizovaných srovnání s cílenou léčbou však monoterapii IFN dnes považujeme za obsolentní léčebnou možnost. Léčba IFN se v současnosti používá v kombinaci s cílenou léčbou, konkrétně s bevacizumabem (viz níže).
Léčba vysokodávkovaným IL-2 je velmi potentní a také velmi toxická imunoterapie, jejímž podáváním bylo dosaženo u zlomku nemocných s mRCC úplného vyléčení. V ČR tato modalita v současnosti není dostupná pro její vysokou technickou a cenovou náročnost a nepředvídatelné výsledky.
Alogenní transplantací krvetvorných buněk lze u mRCC navodit reakci štěpu proti nádoru. V minulosti byly po transplantacích zaznamenány občasné dlouhodobé remise mRCC. Cenou je ovšem vysoká mortalita, morbidita a finanční náročnost této léčby, která proto nepatří mezi doporučené postupy.
Chemoterapie
U mRCC lze dosáhnout nádorové odpovědi (tj. zmenšení nádorové masy) různými režimy chemoterapie, například podáváním kombinace gemcitabin plus doxorubicin nebo kombinace irinotekan/mitomycin/cisplatina. Podíl pacientů s mRCC dosahujících parciální remise po chemoterapii se pohybuje kolem 20 %. Prodloužení přežití při podání u mRCC nebo snížení rizika rekurence při adjuvantní chemoterapii se ovšem prokázat nepodařilo. Chemoterapie mRCC by mohla být jednou z možností léčby nemocných se sarkomatoidním typem RCC, pokud selžou ostatní léčebné postupy, jako je chirurgická léčba a léčba cílená.
Cílená léčba
V s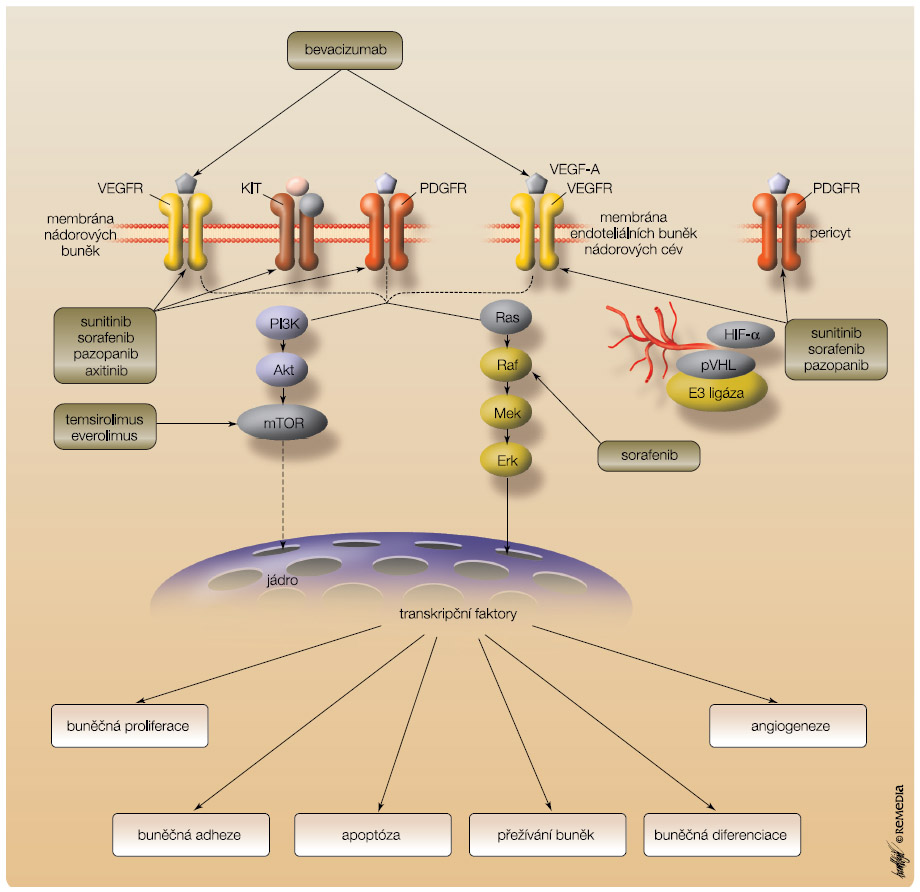 ystémové léčbě mRCC se prosadila cílená terapie zaměřená zejména na inhibici signální dráhy vaskulárního endoteliálního růstového faktoru (VEGF) a molekuly mTOR, která je centrálním „spínačem“ ovládajícím angiogenezi, buněčnou proliferaci a apoptózu (obr. 1).
ystémové léčbě mRCC se prosadila cílená terapie zaměřená zejména na inhibici signální dráhy vaskulárního endoteliálního růstového faktoru (VEGF) a molekuly mTOR, která je centrálním „spínačem“ ovládajícím angiogenezi, buněčnou proliferaci a apoptózu (obr. 1).
Sunitinib
Sunitinib je cíleným léčivem ze skupiny tyrozinkinázových inhibitorů (TKI) s účinností hlavně proti signální dráze VEGF. Je registrován pro první linii léčby pacientů s mRCC s dobrou nebo střední prognózou. Monoterapie sunitinibem byla v randomizované studii srovn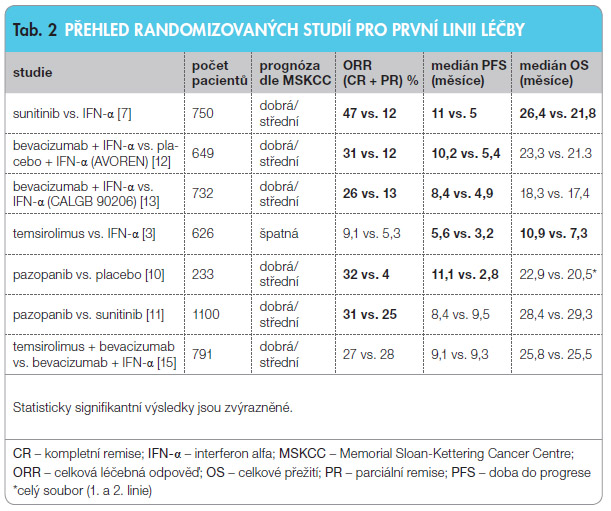 ávána s monoterapií IFN u nemocných se světlobuněčným mRCC. Studie prokázala významné prodloužení přežití bez progrese ve prospěch sunitinibu (tab. 2). Nejčastější projevy toxicity sunitinibu jsou typické pro léčbu perorálními inhibitory VEGF a patří mezi ně průjem (61 %), únava (54 %), nevolnost (52 %), hypertenze (30 %) a palmoplantární (neboli hand-foot) syndrom (20 %) [7]. Sunitinib je dosud považován za zlatý standard v léčbě mRCC a existují obsáhlé zkušenosti s jeho podáváním v rámci klinických studií i mimo ně.
ávána s monoterapií IFN u nemocných se světlobuněčným mRCC. Studie prokázala významné prodloužení přežití bez progrese ve prospěch sunitinibu (tab. 2). Nejčastější projevy toxicity sunitinibu jsou typické pro léčbu perorálními inhibitory VEGF a patří mezi ně průjem (61 %), únava (54 %), nevolnost (52 %), hypertenze (30 %) a palmoplantární (neboli hand-foot) syndrom (20 %) [7]. Sunitinib je dosud považován za zlatý standard v léčbě mRCC a existují obsáhlé zkušenosti s jeho podáváním v rámci klinických studií i mimo ně.
Sorafenib
Sorafenib je registrován k léčbě pacientů s mRCC, u nichž došlo k progresi onemocnění během léčby cytokiny, nebo u pacientů, u nichž je cytokinová léčba kontraindikována. Základní registrační studií sorafenibu v léčbě mRCC byla randomizovaná studie TARGET, zaměřená na pacienty, u nichž došlo během terapie cytokiny nebo při jiné systémové léčbě (chemoterapii nebo hormonální terapii) k progresi onemocnění [8]. Sorafenib vedl k prodloužení doby do progrese ve srovnání s placebem podávaným v kontrolním rameni (protože standardní léčbou pacientů s progresí onemocnění při podávání cytokinů byla do t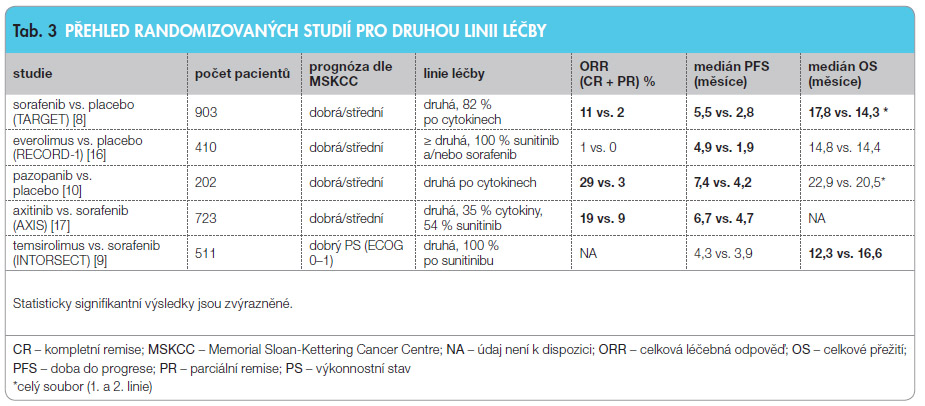 é doby léčba symptomatická), viz tab. 3. Mezi nežádoucí účinky léčby sorafenibem patří průjem (48 %), exantém (41 %) a palmoplantární syndrom (33 %).
é doby léčba symptomatická), viz tab. 3. Mezi nežádoucí účinky léčby sorafenibem patří průjem (48 %), exantém (41 %) a palmoplantární syndrom (33 %).
Protože cytokiny se dnes v léčbě m RCC již prakticky nepoužívají, je pozice sorafenibu v léčebných algoritmech poněkud nejasná. Sorafenib se nicméně ukázal jako účinný lék v rámci sekvenční terapie před podáním nebo po podávání jiných TKI [9]. Často se podává také po progresi onemocnění při léčbě kombinací bevacizumab/IFN-α.
Pazopanib
Pazopanib je dalším TKI s registrací pro první linii léčby mRCC určené pro pacienty s dobrou a střední prognózou a také pro pacienty po progresi nádorové choroby, k níž došlo během léčby cytokiny. Pazopanib v první linii nebyl v registrační studii srovnáván se standardní léčbou v době zahájení studie (tj. cytokiny) [10], což poněkud oslabovalo jeho pozici v první linii terapie až do provedení dalšího klinického hodnocení. V něm byl pazopanib přímo srovnáván se sunitinibem [11]. Ukázalo se, že terapie pazopanibem je minimálně stejně účinná a lépe tolerovaná než terapie sunitinibem (tab. 2 a 3). Nejčastějšími projevy toxicity pazopanibu jsou průjem (48 %), exantém (41 %) a palmoplantární syndrom (33 %), ale v klinické praxi se tyto nežádoucí účinky nevyskytují tak často a s takovou závažností jako při léčbě staršími TKI. Častým nežádoucím účinkem pazopanibu je reverzibilní hepatocelulární toxicita (53 %) která si vyžaduje dočasnou úpravu dávky. Závažná (stupeň 3–4) hyperbilirubinemie se však vyskytuje jen u 2 % případů.
Bevacizumab
Bevacizumab je monoklonální protilátka proti VEGF používaná v řadě onkologických i neonkologických indikací. Kombinace bevacizumab + IFN-α je doporučena pro první linii léčby mRCC pro pacienty s dobrou a střední prognózou [12, 13]. Pro praxi je důležité vědět, že dávku IFN-α lze v této kombinaci snížit na minimum (3 MU třikrát týdně) bez ovlivnění účinnosti terapie [14]. Nespornou výhodou terapie bevacizumabem v kombinaci s IFN-α je příznivý profil toxicity ve srovnání s TKI. Nejvážnějšími, ale naštěstí málo častými nežádoucími účinky bevacizumabu v kombinaci s IFN jsou tromboembolie (4 %), zhoršené hojení ran a gastrointestinální perforace (méně než 1 %).
Temsirolimus
Temsirolimus, selektivní inhibitor kinázy mTOR, je v současnosti jediným lékem úspěšně vyzkoušeným u pacientů se špatnou prognózou podle kritérií MSKCC. Podává se v intravenózní injekci jednou týdně. V randomizované studii fáze III významně prodloužil jak přežití bez progrese, tak celkové přežití ve srovnání s léčbou IFN-α (tab. 2) [3]. Tato studie jako jediná z randomizovaných studií fáze III u mRCC zařadila i významný počet pacientů s nesvětlobuněčným RCC, a proto se temsirolimus doporučuje v první linii i v této indikaci. Jeho kombinace s bevacizumabem ovšem úspěšná nebyla [15].
Léčba temsirolimem může vést k alergickým až anafylaktickým infuzním reakcím. Dále se vyskytují hyperglykemie, kožní reakce (47 %) a kašel (26 %). Inhibitory mTOR jsou deriváty imunosupresiva rapamycinu, a léčba může být tudíž komplikována oportunními infekcemi. Ty se ovšem vyskytují méně často u pacientů s mRCC než u nemocných po orgánových transplantacích, kde se inhibitory mTOR podávají v kombinaci s jinými imunosupresivy.
Everolimus
Everolimus je další inhibitor kinázy mTOR, na rozdíl od temsirolimu se však podává perorálně. Everolimus je určen k léčbě pacientů se světlobuněčným mRCC po progresi onemocnění při léčbě sunitinibem, sorafenibem nebo oběma jmenovanými TKI (tab. 3) [16]. Everolimus je obecně dobře snášen, ale je nutné pacienty pečlivě sledovat kvůli riziku vzniku intersticiálního plicního procesu až fibrózy (14 %), hyperglykemie (57 %) a hyperlipidemie (77 %).
Axitinib
Axitinib je velmi potentní TKI tzv. druhé generace s vysokou selektivitou pro receptory pro VEGF. Je registrován pro nemocné, u nichž dochází k progresi onemocnění při jiné cílené léčbě zaměřené na VEGF, jako je sunitinib, sorafenib nebo bevacizumab (tab. 3). Studie AXIS ukázala, že toxicita axitinibu a sorafenibu byla srovnatelná, odlišný byl profil nežádoucích účinků. Vážná toxicita (stupeň 3–4) byla ve studii AXIS vyšší u axitinibu ve srovnání se sorafenibem pro průjem, hypertenzi a únavu, naopak nižší pro exantém a palmoplantární syndrom. Laboratorní odchylky byly častější u nemocných léčených sorafenibem. Axitinib prodlužoval dobu přežití bez progrese onemocnění více než sorafenib [17]. Axitinib se teprve nyní dostává do širšího použití v České republice, takže větší zkušenosti s ním dosud chybějí.
Erlotinib
Erlotinib je perorální TKI receptoru pro epidermální růstový faktor (EGFR – epidermal growth factor receptor), který se používá zejména v léčbě nemalobuněčného karcinomu plic. Léčbu erlotinibem obvykle dobře tolerují i nemocní vyššího věku či se závažnými komorbiditami. I když erlotinib nepatří mezi léčiva registrovaná k použití u nemocných s mRCC, byla publikována studie fáze II u nemocných s nesvětlobuněčným (papilárním) mRCC. Léčba erlotinibem dosáhla 64 % parciálních odpovědí nebo stabilizací onemocnění a medián celkového přežití byl až 27 měsíců [18]. Tyto výsledky jsou zajímavé, protože naznačují aktivitu léku ve skupině nemocných, pro něž není definována žádná standardní léčba. Ověření účinnosti erlotinibu ve studii fáze III je však nutné.
Inhibitory receptoru PD-1
PD-1 je inhibiční receptor nacházející se na T lymfocytech. Jeho ligandem je molekula PD-L1 (dříve označovaná jako B7-H1), která je často exprimována nádorovými buňkami. Inhibice T lymfocytů prostřednictvím PD-1 je jedním z hlavních mechanismů imunologického úniku nádorových buněk. U RCC byla prokázána spojitost mezi vysokou expresí PD-L1 nádorovými buňkami, přítomností cirkulujících PD-1(+) lymfocytů a pokročilým stadiem nádoru [19]. Ve studii fáze I byla prokázána aktivita anti-PD-1 monoklonální protilátky proti několika nádorům včetně mRCC. Tento nový způsob terapie je dále intenzivně zkoumán, i když toxicita léčby není zanedbatelná (hlavně pneumonitida) [20, 21].
Sekvenční terapie cílenými léčivy
Sekvenční terapie je terapie zaměřená na rozdílné způsoby aktivace nádorových buněk. Podle našich zkušeností je řada nemocných schopna léčby několika léky sekvenčně, přičemž se tito pacienti vyznačují poměrně dobrou prognózou. Podle údajů z národního registru pacientů s karcinomem ledvin léčených cílenou léčbou pro mRCC, který je označován zkratkou RENIS, se celkové přežití u pacientů léčených sekvenční terapií blíží pěti letům. Za tyto výsledky dílem zodpovídají pokroky v léčbě mRCC, ale také (a hlavně) specifické charakteristiky pacientů schopných sekvenční terapie – jedná se o nemocné s poměrně neagresivním průběhem choroby [22].
Ve studii fáze III RECORD-1 se u nemocných po selhání léčby sorafenibem a/nebo sunitinibem prokázala účinnost a bezpeč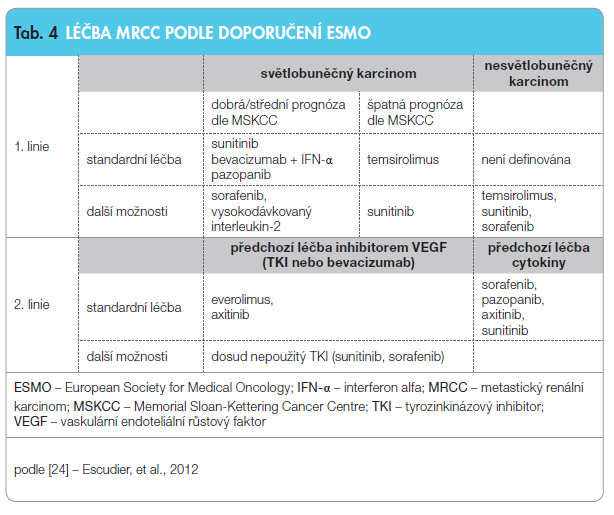 nost inhibitoru mTOR everolimu, což poskytuje důkaz pro použití sekvence TKI/mTOR. Na druhou stranu byly v dalších randomizovaných klinických studiích publikovaných v roce 2011 a 2012 (studie AXIS a studie INTORSECT) a také v retrospektivních a observačních studiích podány důkazy o dobré účinnosti a snášenlivosti sekvenční léčby TKI-TKI [9, 17, 22, 23]. Proto odborná veřejnost intenzivně diskutuje o výhodách a nevýhodách sekvencí TKI-mTOR(-TKI) versus TKI-TKI-mTOR. Podle českého doporučení pro rok 2013 a posledního doporučení ESMO je ve druhé linii léčby nejlepší možností podat buď inhibitor mTOR everolimus nebo TKI axitinib [24].
nost inhibitoru mTOR everolimu, což poskytuje důkaz pro použití sekvence TKI/mTOR. Na druhou stranu byly v dalších randomizovaných klinických studiích publikovaných v roce 2011 a 2012 (studie AXIS a studie INTORSECT) a také v retrospektivních a observačních studiích podány důkazy o dobré účinnosti a snášenlivosti sekvenční léčby TKI-TKI [9, 17, 22, 23]. Proto odborná veřejnost intenzivně diskutuje o výhodách a nevýhodách sekvencí TKI-mTOR(-TKI) versus TKI-TKI-mTOR. Podle českého doporučení pro rok 2013 a posledního doporučení ESMO je ve druhé linii léčby nejlepší možností podat buď inhibitor mTOR everolimus nebo TKI axitinib [24].
Závěr
V posledních několika letech dochází ke konsolidaci poznatků o systémové léčbě mRCC. Díky novým studiím přímo srovnávajícím cílené léky získáváme lepší představu o léčebných strategiích vedených tak, aby přínos terapie byl co největší. Podle publikovaných výsledků se také zdá, že léčba mRCC současnými léky dosáhla maxima svých možností, které u nemocných s dobrou a střední prognózou představuje přibližně 30měsíční střední dobu přežití (median survival). Další zlepšení by mohlo přinést zavedení molekulárních prediktorů do klinické praxe tak, aby bylo možné vybrat pro konkrétního nemocného ten nejúčinnější lék. Léčebné výsledky jsou nadále nedostatečné pro pacienty s nesvětlobuněčným mRCC a pacienty v nejvyšší rizikové skupině dle kritérií MSKCC.
Seznam použité literatury
- [2005] , [cit. 2013-1-07]. Dostupný na: http://www.svod.cz
- [2] Ljungberg B, Cowan NC, Hanbury DC, et al. EAU guidelines on renal cell carcinoma: the 2010 update. Eur Urol 2010; 58: 398–406.
- [3] Hudes G, Carducci M, Tomczak P, et al; Global ARCC Trial. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356: 2271–2281.
- [4] Flanigan RC, Salmon SE, Blumenstein BA, et al. Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal-cell cancer. N Engl J Med 2001; 345: 1655–1659.
- [5] Mickisch GH, Garin A, van Poppel H, et al. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: a randomised trial. Lancet 2001; 358: 966–970.
- [6] Weikert S, Miller K. Surgery. In: Escudier B, Gore M (eds): Renal cell carcinoma, a handbook. Class Publishing, London 2010, 54–73.
- [7] Motzer RJ, Hutson TE, Tomczak P, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007; 356: 115–124.
- [8] Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356: 125–134.
- [9] Hutson T, Escudier B, Esteban E, et al. Temsirolimus vs Sorafenib as Second Line Therapy in Metastatic Renal Cell Carcinoma: Results From the INTORSECT Trial. Presented at the 37th Congress of the European Society for Medical Oncology (ESMO), Vienna, Austria, September 28-October 2, 2012. Abstract LBA22.
- [10] Sternberg CN, Davis ID, Mardiak J, et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol 2010; 28: 1061–1068.
- [11] Motzer RJ, Hutson TE, Reeves J, et al. Randomized, open label, phase III trial of pazopanib versus sunitinib in first-line treatment of patients with metastatic renal cell carcinoma (mRCC); Results of the COMPARZ trial. Presented at the 37th Congress of the European Society for Medical Oncology (ESMO), Vienna, Austria, September 28-October 2, 2012. Abstract LBA8.
- [12] Escudier B, Pluzanska A, Koralewski P, et al; AVOREN Trial investigators. Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet 2007; 370: 2103–2111.
- [13] Rini BI, Halabi S, Rosenberg JE, et al. Phase III trial of bevacizumab plus interferon alfa versus interferon alfa monotherapy in patients with metastatic renal cell carcinoma: final results of CALGB 90206. J Clin Oncol 2010; 28: 2137–2143.
- [14] Melichar B, Koralewski P, Ravaud A, et al. First-line bevacizumab combined with reduced dose interferon-alpha2a is active in patients with metastatic renal cell carcinoma. Ann Oncol 2008;19:1470–1476.
- [15] Rini BI, Bellmunt J, Clancy J, et al. Randomized Phase IIIb Trial of Temsirolimus and Bevacizumab versus Interferon and Bevacizumab in Metastatic Renal Cell Carcinoma: Results from INTORACT. Presented at the 37th Congress of the European Society for Medical Oncology (ESMO), Vienna, Austria, September 28-October 2, 2012. Abstract LBA21.
- [16] Motzer RJ, Escudier B, Oudard S, et al. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet 2008; 372: 449–456.
- [17] Rini BI, Escudier B, Tomczak P, et al: Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial. Lancet 2011; 378: 1931–1939.
- [18] Gordon MS, Hussey M, Nagle RB, et al. Phase II study of erlotinib in patients with locally advanced or metastatic papillary histology renal cell cancer: SWOG S0317. J Clin Oncol 2009; 27: 5788–5793.
- [19] Thompson RH, Dong H, Lohse CM, et al. PD-1 is expressed by tumor-infiltrating immune cells and is associated with poor outcome for patients with renal cell carcinoma. Clin Cancer Res 2007; 13: 1757–1761.
- [20] Brahmer JR, Tykodi SS, Chow LQ et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med 2012; 366: 2455–2465.
- [21] Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012; 366: 2443–2454.
- [22] Buchler T, Klapka R, Melichar B, et al. Sunitinib followed by sorafenib or vice versa for metastatic renal cell carcinoma – data from the Czech registry. Ann Oncol 2012; 23: 395–401.
- [23] Liewen H, Chastonay R, Haile SR, et al. Sequential therapy with sorafenib and sunitinib in metastatic renal cell carcinoma: A retrospective multi-center study and pooled analysis of available trials. Oncology 2012; 82: 333–340.
- [24] Escudier B, Eisen T, Porta C, et al. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 Suppl 7: vii65–71.