Renální osteopatie a možnosti léčby
Renální osteopatie představuje závažnou doprovodnou komplikaci selhávání ledvin. Podle současné definice se řadí mezi tři komponenty CKD-MBD (kostní a minerálová porucha při chronických onemocněních ledvin). Hlavní a nejčastěji se vyskytující formou je kostní nemoc s vysokým kostním obratem (sekundární hyperparatyreóza) a tzv. adynamická osteopatie, časté jsou však také přechodné či kombinované formy.
Farmakoterapie renální osteopatie je v současné době cílena na mechanismy, které indukují kostní i cévní změny (kalcémie, fosfatémie, hladiny vitaminu D), a na potlačení nepřiměřeně vysoké aktivity příštítných tělísek (VDR aktivátory a kalcimimetika). Selektivní VDR aktivátory (aktivátory receptoru pro vitamin D) mají nižší kalcemizující a fosfatemizující efekt. Důležitou součástí léčby jsou i látky snižující vstřebávání fosfátů v zažívacím traktu (kovové a nekovové vazače).
Farmakologické postupy jsou voleny podle doporučených cílových koncentrací kalcia, fosforu a PTH (parathormon) v séru; současně však v kontextu dalších faktorů, zejména časové posloupnosti změn. Nežádoucí účinky jsou ovlivnitelné úpravou dávkování, resp. volbou přípravku. V současné době se věnuje velká pozornost i systémovým účinkům léčivých látek používaných v terapii renální kostní nemoci.
Úvod
Dialyzační nefrologie řeší nejen techniku náhrady funkce ledvin (eliminační metody), ale i řadu klinických komplikací, které jsou sekundárním důsledkem poklesu až zániku funkce ledvin. K nejvýznamnějším komplikacím patří komplexní porucha metabolismu vápníku a fosforu, v současnosti konsenzuálně označovaná jako CKD-MBD (chronic kidney disease-mineral and bone disorder – kostní a minerálové změny v důsledku selhání ledvin). Jednou ze tří komponent CKD-MBD je renální osteopatie [1].
Kostní změny při selhání ledvin jsou vyjádřené vždy, avšak nikoliv jednotně. V histologickém obraze lze rozlišit dvě hlavní formy změn: kostní postižení s neúměrně vysokým kostním obratem (projev akcentované sekundární hyperparatyreózy) a kostní změny se sníženým kostním obratem (adynamická osteopatie) [2]. Znalosti patogeneze sekundární hyperparatyreózy jsou nyní považovány za dostatečně podrobné, byť jistě nikoliv konečné [3]. Díky tomu máme v současné době poměrně širokou paletu farmakologických léčebných zákroků pro tuto formu kostních změn, resp. pro prevenci a léčbu sekundární hyperparatyreózy. Jejich přehled je uveden níže. Adynamická kostní nemoc je objasněna podstatně méně, je však jisté, že stejně jako sekundární hyperparatyreóza má souvislost s postižením ostatních orgánů, zejména cév a srdce [1]. Terapeutická opatření proto mají za cíl minimalizovat výskyt i této kostní poruchy.
Přehled farmakologických postupů
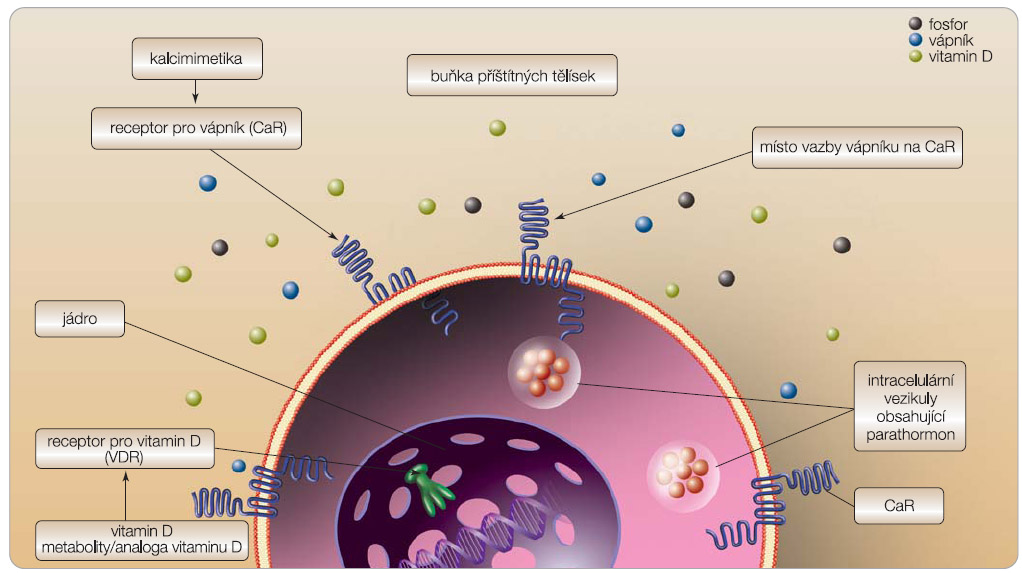 Cílem základních preventivních a léčebných postupů je upravit činnost příštítných tělísek, a tím normalizovat kostní obrat [4–6]. Podmínkou je udržet pokud možno neutrální kalciovou bilanci, zamezit pozitivní bilanci fosfátů, zajistit aktivaci receptoru pro vitamin D v jádře buněk příštítných tělísek (VDR; transkripční faktor regulující produkci PTH) a zajistit potřebnou aktivaci receptoru pro kalcium (CaR, calcium sensing receptor; hlavní regulátor sekrece PTH), viz obr. 1.
Cílem základních preventivních a léčebných postupů je upravit činnost příštítných tělísek, a tím normalizovat kostní obrat [4–6]. Podmínkou je udržet pokud možno neutrální kalciovou bilanci, zamezit pozitivní bilanci fosfátů, zajistit aktivaci receptoru pro vitamin D v jádře buněk příštítných tělísek (VDR; transkripční faktor regulující produkci PTH) a zajistit potřebnou aktivaci receptoru pro kalcium (CaR, calcium sensing receptor; hlavní regulátor sekrece PTH), viz obr. 1.
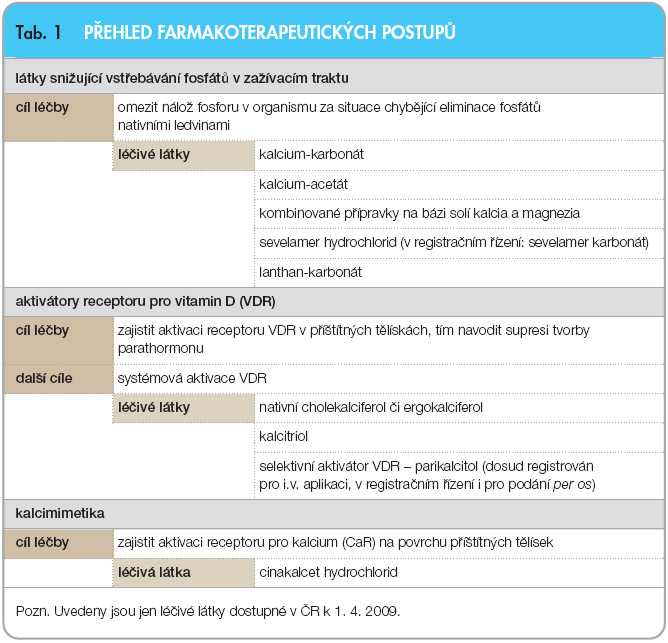
K základním farmakologickým skupinám používaným v léčbě a prevenci renální kostní nemoci patří:
- metabolity a analoga vitaminu D (resp. látky aktivující receptor pro vitamin D, tj. VDR aktivátory) – kalcitriol, parikalcitol,
- vazače fosfátů v zažívacím traktu (resp. látky snižující vstřebávání fosfátů z GIT) – kalcium-karbonát, octan vápenatý bezvodý, sevelamer, lanthan-karbonát a jiné,
- kalcimimetika – cinakalcet,
- případně kalciové přípravky pro suplementaci kalcia a některá další doprovodná opatření (tab. 1).
Výše uvedená pravidla jsou zdánlivě jasná a terapeutická paleta léčivých
 látek je v současné době i prakticky plně pokrývá. Celý postup má však při selhání ledvin, resp. u pacientů léčených pro selhání ledvin, určitá úskalí. K nim patří především nepříznivá tendence k pozitivní bilanci fosfátů (eliminační metody v běžném provedení odstraní jen limitované množství fosfátů, které je nižší než přívod fosforu v potravě), cyklické změny vnitřního prostředí včetně změn koncentrací kalcia, fosforu, hydrogenkarbonátů (změny pH) apod. Dále může být přítomna porucha receptorů VDR a CaR (jejich snížená denzita při pokročilé hyperparatyreóze, tj. kvantitativní změny spolu se změnami kvalitativními), případně obvyklé snížení hladin vitaminu D v organismu. Dalším úskalím je délka trvání a intenzita stimulů indukujících hyperparatyreózu již v období snížení (a nikoliv až v období zániku) renálních funkcí a mnohé další. Proto není prevence ani léčba renální osteopatie jednoduchá [4–6].
látek je v současné době i prakticky plně pokrývá. Celý postup má však při selhání ledvin, resp. u pacientů léčených pro selhání ledvin, určitá úskalí. K nim patří především nepříznivá tendence k pozitivní bilanci fosfátů (eliminační metody v běžném provedení odstraní jen limitované množství fosfátů, které je nižší než přívod fosforu v potravě), cyklické změny vnitřního prostředí včetně změn koncentrací kalcia, fosforu, hydrogenkarbonátů (změny pH) apod. Dále může být přítomna porucha receptorů VDR a CaR (jejich snížená denzita při pokročilé hyperparatyreóze, tj. kvantitativní změny spolu se změnami kvalitativními), případně obvyklé snížení hladin vitaminu D v organismu. Dalším úskalím je délka trvání a intenzita stimulů indukujících hyperparatyreózu již v období snížení (a nikoliv až v období zániku) renálních funkcí a mnohé další. Proto není prevence ani léčba renální osteopatie jednoduchá [4–6].
Dalším problémem je skutečnost, že sice směřujeme k dosažení pokud možno optimální struktury kosti, ale volba postupu a jeho monitorování jsou založeny na odvozených a nepřímých ukazatelích – sérových koncentracích fosforu, kalcia a parathormonu, někdy s využitím dalších laboratorních parametrů, jako je alkalická fosfatáza, hladiny kalcidiolu a kalcitriolu [1]. Tyto ukazatele poskytují jen orientační obraz o tíži a průběhu změn, navíc jsou odvislé i od vzájemných interakcí a vývoje v čase.
V roce 2003 byla publikována a následně mezinárodně akceptována doporučení cílových hodnot kalcia, fosforu a PTH [7] formulovaná KDOQI (Kidney Disease Outcome Quality Initiative, iniciativa americké nadace pro nemoci ledvin). Tato doporučení vycházejí nikoliv ze spojitosti laboratorních hodnot a kostních změn, ale z epidemiologických, klinických a experimentálních poznatků a jako cílové jsou zvoleny ty koncentrace, které jsou „nejbezpečnější“. Pro ilustraci – cílová koncentrace fosforu byla stanovena podle epidemiologických dat poukazujících na mortalitu, která narůstá se stoupající koncentrací fosforu. Tato souvislost byla opakovaně potvrzena a v současné době má i patofyziologické opodstatnění (fosfor je prokazatelný uremický toxin, mimo jiné pro svou aktivní roli v genezi cévních kalcifikací) [8–10].
Doporučení KDOQI jsou konsenzuálně a široce akceptovaná. V nejbližší době se očekává jejich revize, resp. doporučení K/DIGO (Kidney Disease Improving Global Outcomes, nadnárodní, resp. globální nefrologická odborná iniciativa). Lze očekávat, že změny nebudou velké, lépe řečeno požadavky na cílové koncentrace nebudou mírnější, spíše naopak. Níže je uveden základní přehled farmakoterapeutických skupin a jednotlivých látek, přitom hlavní důraz je kladen spíše na podstatu zásahu do patogenetických mechanismů a na vzájemné souvislosti (základní data o přípravcích jsou dostupná v obvyklých zdrojích, včetně SPC).
Kalcimimetika
Dosud jediným kalcimimetikem je cinakalcet hydrochlorid, uvedený do praxe před čtyřmi lety. Kalcimimetika jsou tedy „nejmladší“ lékovou skupinou ve farmakoterapii renální osteopatie [11–13]. Kalcimimetika představují allosterické modulátory povrchového receptoru pro kalcium (CaR). Tím zvyšují citlivost tohoto receptoru na extracelulární koncentraci kalcia. Důsledkem je snížení sekrece parathormonu a pokles jeho koncentrace v krvi. Receptor CaR má řadu dalších biologických rolí, proto se kalcimimetika přinejmenším teoreticky uplatňují v širším kontextu. Je pravděpodobné, že se účastní inhibice růstu příštítných tělísek a ve zvýšení exprese receptoru pro vitamin D.
Maximum poklesu koncentrace parathormonu v krvi nastává přibližně po 4 hodinách, do 24 hodin se opět zvyšuje, avšak nikoliv až k původní hodnotě. Protože přechodné snížení může představovat až 70 % iniciální hodnoty, je pro posuzování výsledků léčby kalcimimetiky naprosto nutné znát interval mezi podáním látky a odběrem krve na stanovení hladiny parathormonu. Tento aspekt je někdy v praxi opomíjen. Analogicky jako koncentrace PTH kolísá i koncentrace kalcia v krvi a do určité (menší) míry i koncentrace fosforu (pozor, při selhání ledvin koncentrace fosforu po podání kalcimimetik klesá, avšak při méně pokročilých nemocech ledvin naopak stoupá). Pokles sérových hladin kalcia a fosforu u dialyzovaných pacientů je unikátní vlastností tohoto přípravku, mechanismus není přesně znám, dosud se považuje za sekundární projev poklesu hladiny parathormonu, a tím snížení kostní resorpce; jedná se však o vysvětlení pouze hypotetické. Cinakalcet hydrochlorid je určen pro léčbu dialyzovaných pacientů se sekundární hyperparatyreózou (stadium CKD 5, end stage renal disease, ESRD = terminální stadium renálního onemocnění). Může se uplatnit i v potrasplantačním období ke korekci akcentované hyperparatyreózy s hyperkalcémií, zkušenosti s tímto podáním jsou menší, avšak existují [14]. Podle současných poznatků není cinakalcet určen pro léčbu sekundární hyperparatyreózy při stadiích CKD 3 a CKD 4 z toho důvodu, že v těchto stadiích nesnižuje fosfatémii, ale naopak ji zvyšuje (inhibice fosfaturického účinku parathormonu) [13].
Podávání cinakalcetu začíná dávkou 30 mg 1krát denně a podle efektu, který je kontrolován laboratorními ukazateli (kalcium, fosfor, PTH), je možné zvýšení postupně až na povolených 180 mg denně. Podle našich zkušeností postačují u většiny pacientů v chronickém dialyzačním programu dávky 30–60 mg, výjimečně 90 mg denně. Nežádoucí účinky se vyskytují přibližně u 10–20 % osob (zažívací obtíže u 5–15 % a hypokalcémie u 5–10 % léčených). Zažívací obtíže jsou někdy přechodné, občas si však vyžádají přerušení léčby. S odstupem času se lze k léčbě vrátit a znovu zkusit léčivou látku podávat. Nežádoucím účinkům je do jisté míry možné předcházet důsledným podáním léčivého přípravku až po jídle. Snížení kalcémie je součástí farmakologického efektu, hypokalcémie je tedy vlastně akcentací očekávaného účinku. Míra snížení kalcémie je dána dávkou kalcimimetika i přídatnými opatřeními (tj. riziko hypokalcémie je nižší při současné substituci kalcia). Při klinické zkušenosti a znalosti lékových mechanismů lze hypokalcémii předcházet, nebo ji alespoň včas řešit. I když je hypokalcémie přechodná a obvykle asymptomatická, může být i závažná. V každém případě je třeba efekt léčivé látky v tomto smyslu monitorovat, pokles kalcémie u dialyzovaných pacientů je naprostým pravidlem a jde prakticky o to, abychom využili tento pokles pro udržení cílových koncentrací kalcia i PTH v krvi.
VDR aktivátory
Tímto termínem lze označit větší skupinu látek odvozených od vitaminu D. Aktivátory receptoru pro vitamin D je širší termín pro dvě skupiny – metabolity vitaminu D a analoga vitaminu D. Jako metabolity označujeme látky, které jsou sice synteticky připravené, ale jejich molekula je shodná s fyziologickou aktivní molekulou, kalcitriolem (dihydroxycholekalciferol). Analoga mají shodnou schopnost vazby na VDR a aktivace následné odpovědi, jejich molekula je však do určité míry změněná. Příkladem u nás registrovaného a užívaného analoga vitaminu D je parikalcitol. Další i u nás užívanou látkou je prekurzor kalcitriolu (molekula hydroxylovaná v poloze 1alfa), kdy další potřebná hydroxylace (v poloze 25) nastává po podání v organismu. Samostatným okruhem, kterému je však v poslední době věnována zvýšená pozornost, je podání nativního vitaminu D při chronických nemocech ledvin, či dokonce při selhání ledvin [15]. Mechanismus účinku metabolitů či analog vitaminu D spočívá v aktivaci receptoru pro vitamin D (VDR). V užším smyslu je tato aktivace cílena na příštítná tělíska (suprese genové transkripce, tj. snížení tvorby PTH), avšak souběžně nastává aktivace VDR i v jiných orgánech a systémech (pleiotropní efekt vitaminu D) [16, 17]. Velmi významný je efekt na VDR v zažívacím traktu (kost, příštítná tělíska a zažívací trakt patří k tzv. klasickým cílovým orgánům; imunitní systém a mnohé další tkáně k netradičním místům účinku). Obecně platí, že tzv. selektivní aktivátory VDR mají více vyjádřený efekt na příštítná tělíska a relativně nižší efekt v zažívacím traktu. Současně mají i jiné odlišnosti působení, které jsou předmětem intenzivních výzkumů.
Kalcitriol byl poprvé použit na začátku 70. let [18]. Při perorálním podávání sice částečně upravil nadměrnou tvorbu parathormonu, avšak průvodním jevem byly časté hyperkalcémie a vzestup hladin fosforu v krvi. V polovině 80. let byl kalcitriol poprvé aplikován parenterální formou, která obcházela zažívací trakt, a tím umožnila vyšší míru účinku v příštítných tělískách při nižším kalcemizujícím a fosfatemizujícím efektu [19]. Stále však byl výskyt vyšší koncentrace kalcia a fosforu považován za hlavní riziko léčby. Částečnou kompenzaci přinesly například strategie se snížením koncentrace kalcia v dialyzačním roztoku. V 90. letech přicházejí do praxe analoga vitaminu D. Nejznámějším a u nás dosud jediným registrovaným zástupcem je parikalcitol (19-nor-1, 25 dihydroxyvitamin D2) [20, 21]. Až dosud byl dostupný ve formě pro parenterální aplikaci, v nejbližší době bude i u nás k dispozici forma perorální (tím bude umožněno i praktické využití například při peritoneální dialýze a u pacientů se sekundární hyperparatyreózou při pokročilém onemocnění ledvin, avšak dosud nedialyzovaných).
Při aplikaci VDR aktivátorů se někdy rozlišují dva cíle podávání a podle nich se modifikuje časové schéma. Pokud směřujeme k substituci chybějícího (aktivního) vitaminu D ve smyslu hormonu, podáváme kontinuálně (denně) malé dávky (např. kalcitriol 0,25 mg denně), nebo v případě deficitu nativního vitaminu D podáváme cholekalciferol či ergokalciferol v dávce 600 IU, ale i 1000 IU či více denně). Při indikaci sekundární hyperparatyreózy je namístě supresivní léčba, která obvykle využívá vyšší intermitentní dávky, podávané parenterálně – např. dříve kalcitriol po hemodialýze do dialyzačních krevních návratových setů, tj. 3krát týdně, obvykle 1–2 mg; tomu odpovídá současná léčba parikalcitolem v dávce 5–10 mg 3krát týdně, s modifikací dávek dle odpovědi, resp. dle vývoje sérových koncentrací PTH. Například podle jedné z prvních prací byl pokles PTH o 30 % u 75 % pacientů při dávkách 0,04–0,24 mg/kg [22]. Jak je patrné, intravenózní podání u hemodialyzovaných pacientů neznamená intravenózní vpich, ale využívá se aplikace do hadiček mimotělního oběhu.
Parikalcitol má řadu vlastností shodných s kalcitriolem (vazba na vazebný protein, biologický poločas), avšak jak již bylo uvedeno, vykazuje významně nižší efekt v zažívacím traktu a vysoce pravděpodobné jsou i některé další odlišnosti, včetně ochranného efektu na cévní stěnu a myokard (v současné době intenzivní klinický výzkum) [23]. Dávky VDR aktivátorů by měly být voleny tak, aby suprese příštítných tělísek byla přiměřená. Uvádí se, že příčinou adynamické osteopatie (viz výše) může být i „overtreatment“ neboli přílišná suprese příštítných tělísek léčebnými postupy, včetně suprese VDR aktivátory.
Vazače fosfátů v zažívacím traktu
Udržení neutrální fosfátové bilance znamená denní vyloučení přibližně 650 mg fosforu renální cestou, což při selhání ledvin chybí. Protože eliminační techniky nejsou dostatečně účinné z hlediska eliminace fosforu (s výjimkou denních hemodialýz), mají velký význam strategie, které snižují vstřebání fosforu v zažívacím traktu.Samozřejmým doporučením je omezení přísunu fosforu v dietě (vynechání potravin s vysokým obsahem fosforu – ryby, mléčné výrobky, sýry). Omezení fosforu ve stravě je však spojeno s omezením příjmu bílkovin, a nízkobílkovinná dieta při dialyzačním léčení není doporučována pro riziko malnutrice [24]. Součástí léčby pacientů se selháním ledvin je podávání látek, které snižují vstřebávání fosforu ze zažívacího traktu. Tyto látky lze rozdělit na vazače fosfátů v GIT traktu a na látky inhibující intestinální fosfátový transport (Na-Pi-2b transportní systém). V klinickém užívání jsou v současné době výhradně vazače fosfátů v zažívacím traktu, inhibitory fosfátového transportu jsou zatím jen ve fázi preklinických zkoušek [25, 26]. Vazače fosfátů v zažívacím traktu lze rozdělit na dvě hlavní skupiny – vazače na bázi kovů a vazače typu pryskyřic. Kovové vazače lze dále dělit na kalciové a nekalciové. K nekalciovým vazačům se řadí aluminiové sloučeniny, které však pro svou toxicitu byly prakticky opuštěny (byť jsou vazebně velmi účinné). Dále sem lze zařadit nedávno schválený lanthan-karbonát a dosud nepříliš rozšířené sloučeniny na bázi magnezia; zkoumány jsou také sloučeniny na bázi železa.
Všechny kovové vazače mají shodný princip účinku: kov se v kyselém prostředí žaludku uvolní a v další části traktu se naváže na fosfát, se kterým vytvoří pevnou a nerozpustnou sloučeninu, jež je vyloučena zažívacím traktem. Všem vazačům založeným na tomto principu je společná i absorpce větší či menší (či velmi malé) části volného kovu ze zažívacího traktu do systému. Vylučování této absorbované složky je velmi problematické, zejména u aluminia a kalcia (lanthan se podle současných znalostí vylučuje biliárním systémem) [27]. Aluminiová akumulace je prokazatelně toxická (toxické projevy jsou natolik patognomické a závažné, že dnes prakticky nikdo neriskuje jejich vznik, a tyto vazače nepředepisuje). Kalciová akumulace je méně evidentní, a to přinejmenším proto, že kalcium na rozdíl od aluminia (či lanthanu) je látka tělu vlastní a nemáme žádné klinické možnosti, jak určit, zda organismus je v depleci, či má nadbytek kalciových iontů. Problematiku navíc komplikuje i aspekt redistribuce (přesun kalcia ze skeletu do jiného „poolu“) [28]. V současné době je intenzivně studováno a široce diskutováno suspektní riziko abnormálního deponování kalcia do cév [29].
Kalciové (nealuminiové) vazače jsou v současné době stále rutinně používány, ovšem za pečlivé kontroly hladin kalcia a klinického stavu pacienta. Druhou skupinou vazačů jsou nekovové sloučeniny, zejména sloučeniny na bázi pryskyřic. Jsou zcela nevstřebatelné, a tedy bezpečné z hlediska jakékoliv akumulace. Nejrozšířenější je sevelamer hydrochlorid. Byl registrován v roce 1998 a dnes je poměrně rozšířený, zejména pro svou zcela neutrální absorpci a někdy i pro více či méně předpokládané pleiotropní účinky [30, 31]. Výzkum vazačů fosfátů a vývoj nových preparátů dále pokračuje [24, 25]. Ve fázi klinických zkoušek je několik sloučenin železa (např. citrát, chlorid, dále i komplexní sloučeniny – polymery dextranu železa a další). Dosud byly zkoušeny v experimentu, některé z nich dospěly do fáze klinických zkoušek. Systémová absorpce železa je malá, a navíc je i žádoucí vzhledem k obvyklé nutnosti doplňovat železo dialyzovaným pacientům léčeným pro anémii přípravky ESA (erythropoiesis stimulating agents). K dalším ověřovaným preparátům patří smíšené sloučeniny kovu a hydroxylu karbonátu (metalhydroxy-carbonate compounds, MMH), ve kterých je inkorporované železo buď s kalciem, či s magneziem. Jsou považovány za slibné. Dále jsou zkoušeny například colestilan (MCI-196), látka na bázi pryskyřice, která stejně jako sevelamer váže nejen fosfor, ale i žlučové kyseliny, a má tedy i hypolipidemizující efekt.
Inhibitory transportu fosfátů v zažívacím traktu dosud nevstoupily do klinických zkoušek, resp. byly užity zcela ojediněle. Patří sem například nikotinamid (derivát kyseliny nikotinové). V experimentu se kromě snížení fosfatémie prokázalo i zpomalení progrese nefropatií, ovšem jedná se pouze o pilotní experimentální nálezy. V nejbližší době bude dostupná modifikace sevelameru, kdy hydrochlorid bude nahrazen karbonátem (sevelamer karbonát). Oproti sloučenině s hydrochloridem nebude ovlivněna hladina hydrogenkarbonátu v krvi [32].
Aditivní účinky léčivých látek užívaných v léčbě renální osteopatie
Podávání všech uvedených léčivých látek je spojeno s určitým rizikem nežádoucích účinků. Tato oblast je poměrně dobře prozkoumána. Někdy plyne nežádoucí účinek ze samotného mechanismu účinku a z cílového působení léčivé látky, je vlastně akcentací cíleného, resp. očekávaného efektu (hypokalcémie u kalcimimetik, hyperkalcémie u VDR aktivátorů, přičemž u selektivních molekul je toto riziko podstatně nižší). Dále je třeba vzít v úvahu fakt, že potlačení aktivity příštítných tělísek může být nadměrné a že sice upravíme určitou patologii, ale můžeme vyvolat jinou (dříve typický projev aluminiových vazačů – rozvoj aluminiové akumulace a intoxikace; dnes „overtreatment“ při užití preparátů suprimujících příštítná tělíska, pravděpodobně i důsledky pozitivní kalciové bilance při podávání kalciových vazačů).
Dalším případem jsou nežádoucí účinky bez souvislosti s cíleným efektem – příkladem jsou klinické gastrointestinální komplikace provázející léčbu kalcimimetiky a prakticky podávání všech vazačů fosfátů (nauzea, zvracení, nadýmání, nechutenství, průjmy anebo naopak zácpa), přitom tyto účinky jsou obvykle přechodné, resp. proměnlivé. Při zvažování účinků léčivých látek užívaných (resp. indikovaných) v léčbě renální osteopatie je třeba však zmínit i určité aditivní přínosy, které jsou buď důsledkem úpravy poruchy fosfokalciového metabolismu (resp. hladin vápníku, fosforu a PTH), či jsou v přímém vztahu k působení látky na jiném místě, než vyplývá z vlastní indikace (jedinou indikací pro VDR aktivátory při selhání ledvin je sekundární hyperparatyreóza, avšak observační studie opakovaně ukázaly tzv. aditivní benefity) [33, 34].
VDR aktivátory jsou podle observačních studií spojeny s lepší prognózou nemocných, přitom míra zlepšení je vyšší u selektivních látek. V současné době se intenzivně studuje podstata tohoto aditivního efektu, který pravděpodobně souvisí s pleiotropní rolí VDR v organismu. Z klinických účinků byly popsány například regrese hypertrofie levé komory, snížení proteinurie, dále i inhibice osy RAS (renin-angiotenzin systém) a imunomodulační efekt [17, 35].Rovněž kalcimetika jsou sledována nejen z hlediska laboratorní odpovědi organismu, ale i z hlediska klinického účinku. Bylo popsáno nižší kardiovaskulární riziko, další data přinesou až probíhající studie [36]. Kalciové vazače nepředstavují žádný přínos ve srovnání s ostatními látkami. Je předmětem rozsáhlé polemiky, zdali jejich užívání není naopak negativní, a to z hlediska (příliš) pozitivní kalciové bilance s depozity extraoseálně (zejména do cév a myokardu) [28, 29]. Lanthanové vazače toto riziko akumulace nemají, avšak na definitivní závěry je vzhledem ke krátké době jejich užívání ještě brzy. Vazače na bázi pryskyřice (dosud rutinně používán pouze sevelamer) znamenají přínos i z hlediska ovlivnění metabolismu lipidů a v případě sevelameru byly skutečně doloženy určité přínosy v oblasti zpomalení cévních a chlopenních kalcifikací [37]. V uvažovaném kontextu je však třeba dodat, že sebelepší ovlivnění metabolismu vápníku a fosforu a renální osteopatie je nutno nazírat v souvislosti s mnoha dalšími klinickými i laboratorními komplikacemi a abnormalitami, které jsou spojeny se selháním ledvin.
Jednotlivé látky, které jsou uvedeny výše, se v principech svých účinků značně odlišují a v cílovém efektu se navzájem doplňují, někdy i potencují [5, 38]. Podle současných patogenetických znalostí se navíc zdá, že farmakologické možnosti v současné době pokrývají všechna cílová místa (VDR aktivátory, CaR modulátory, zásah proti pozitivní fosfátové bilanci). Renální osteopatii tedy můžeme léčit podstatně komplexněji, než tomu bylo dříve. Je otázkou dalšího vývoje, zda tento příslib skutečně povede k ústupu této závažné doprovodné komplikace dlouhodobého dialyzačního léčení.
Seznam použité literatury
- [1] Moe S, Drueke T, Cunningham J, et al. Definition, evaluation, and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2006; 69: 1946–1963.
- [2] Malluche HH, Mawad H, Monier–Faugere MC. Effects of treatment of renal osteodystrophy on bone histology. Clin J Am Soc Nephrol 2008; 3: S157–S163.
- [3] de Francisco AL. Secondary hyperparathyroidism: review of the disease and its treatment. Clin Ther 2004; 26: 1976–1993.
- [4] Dusilová Sulková S, et al. Renální osteopatie. Jessenius Maxdorf, Praha 2007.
- [5] Drueke TB, Ritz E. Treatment of secondary hyperparathyroidism in CKD patients with cinacalcet and/or vitamin D derivatives. Clin J Am Soc Nephrol 2009; 4: 234–241.
- [6] Martin KJ, Gonzalez EA. Metabolic bone disease in chronic kidney disease. J Am Soc Nephrol 2007; 18: 875–885.
- [7] National Kidney Foundation. K/DOQI Clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003; 42 (Suppl. 3) S1–S201.
- [8] Amann K, Gross ML, London GM, Ritz E. Hyperphosphataemia – a silent killer of patients with renal failure? Nephrol Dial Transplant 1999; 14: 2085–2087.
- [9] Block GA, Hulbert-Shearon TE, Levin NW, Port FK. Association of serum phosphorus and calcium x phosphate product with mortality risk in chronic hemodialysis patients: a national study. Am J Kidney Dis 1998; 31: 607–617.
- [10] Burke SK. Phosphate is a uremic toxin. J Ren Nutr 2008; 18: 27–32.
- [11] Block GA, Martin KJ, de Francisco AL, et al. Cinacalcet for secondary hyperparathyroidism in patients receiving hemodialysis. N Engl J Med 2004; 350: 1516–1525.
- [12] Dusilová Sulková S. Cinacalceti hydrochloridum. Remedia 2005; 15: 235–245.
- [13] Evenepoel P. Calcimimetics in chronic kidney disease: evidence, opportunities and challenges. Kidney Int 2008; 74: 265–275.
- [14] Serra AL, Braun SC, Starke A, et al. Pharmacokinetics and pharmacodynamics of cinacalcet in patients with hyperparathyroidism after renal transplantation. Am J Transplant 2008; 8: 803–810.
- [15] Oksa A, Spustova V, Krivosikova Z, et al. Effects of long-term cholecalciferol supplementation on mineral metabolism and calciotropic hormones in chronic kidney disease. Kidney Blood Press Res 2008; 31: 322–329.
- [16] Maalouf NM. The noncalciotropic actions of vitamin D: recent clinical developments. Curr Opin Nephrol Hypertens 2008; 17: 408–415.
- [17] Andress DL. Vitamin D in chronic kidney disease: a systemic role for selective vitamin D receptor activation. Kidney Int 2006; 69: 33–43.
- [18] Massry SG, Goldstein DA, Malluche HH. Current status of the use of 1,25(OH)2D3 in the management of renal osteodystrophy. Kidney Int 1980; 18: 409–418.
- [19] Slatopolsky E, Weerts C, Thielan J, et al. Marked suppression of secondary hyperparathyroidism by intravenous administration of 1,25-dihydroxy-cholecalciferol in uremic patients. J Clin Invest 1984; 74: 2136–2143.
- [20] Brown AJ, Finch J, Slatopolsky E. Differential effects of 19-nor-1,25-dihydroxyvitamin D(2) and 1,25-dihydroxyvitamin D(3) on intestinal calcium and phosphate transport. J Lab Clin Med 2002; 139: 279–284.
- [21] Dusilová-Sulková S. Vitamin D metabolism and vitamin D traditional and nontraditional, target organs: implications for kidney patients. J Ren Care 2009; 35 (Suppl. 1): 39–44.
- [22] Llach F, Keshav G, Goldblat MV, et al. Suppression of parathyroid hormone secretion in hemodialysis patients by a novel vitamin D analogue: 19-nor-1,25-dihydroxyvitamin D2. Am J Kidney Dis 1998; 32 (Suppl. 2): S48–S54.
- [23] Coyne D, Acharya M, Qiu P, et al. Paricalcitol capsule for the treatment of secondary hyperparathyroidism in stages 3 and 4 CKD. Am J Kidney Dis 2006; 47: 263–276.
- [24] Rufino M, de Bonis E, Martin M, et al. Is it possible to control hyperphosphataemia with diet, without inducing protein malnutrition? Nephrol Dial Transplant 1998; 13 (Suppl. 3): 65–67.
- [25] Hutchison AJ. Oral phosphate binders. Kidney Int 2009; 75: 906–914.
- [26] Bellasi A, Kooienga L, Block GA. Phosphate binders: new products and challenges. Hemodial Int 2006; 10: 225–234.
- [27] D’Haese PC, Spasovski GB, Sikole A, et al. A multicenter study on the effects of lanthanum carbonate (Fosrenol) and calcium carbonate on renal bone disease in dialysis patients. Kidney Int 2003; 63 (Suppl. 85): S73–S78.
- [28] Moe SM, Chertow GM. The case against calcium-based phosphate binders. Clin J Am Soc Nephrol 2006; 1: 697–703.
- [29] Block GA, Spiegel DM, Ehrlich J, et al. Effects of sevelamer and calcium on coronary artery calcification in patients new to hemodialysis. Kidney Int 2005; 68: 1815–1824.
- [30] Emmett M. A comparison of clinically useful phosphorus binders for patients with chronic kidney failure. Kidney Int 2004; 66 (Suppl. 90): S25–S32.
- [31] Ferramosca E, Burke S, Chasan-Taber S, et al. Potential antiatherogenic and anti-inflammatory properties of sevelamer in maintenance hemodialysis patients. Am Heart J 2005; 149: 820–825.
- [32] Mathew S, Lund RJ, Strebeck F, et al. Reversal of the adynamic bone disorder and decreased vascular calcification in chronic kidney disease by sevelamer carbonate therapy. J Am Soc Nephrol 2007; 18: 122–130.
- [33] Teng M, Wolf M, Lowrie E, et al. Survival of patients undergoing hemodialysis with paricalcitol or calcitriol therapy. N Engl J Med 2003; 349: 446–456.
- [34] Teng M, Wolf M, Ofsthun M, et al. Activated injectable vitamin D and hemodialysis survival: a historical cohort study. J Am Soc Nephrol 2005; 16: 1115–1125.
- [35] Sochorová K, Bartůňková J. Vitamin D a imunitní systém – teorie a vlastní zkušenosti. Interní medicína 2007, 1: 28–30.
- [36] Cunningham J, Danese M, Olson K, et al. Effects of calcimimetic cinacalcet HCl on cardiovascular disease, fracture, and health-related quality of life in secondary hyperparathyroidism. Kidney Int 2005; 68: 1973–1800.