Rezistence k antibiotikům – včera, dnes a zítra…
Souhrn:
Adámková V, Závora J. Rezistence k antibiotikům – včera, dnes a zítra… Remedia 2020; 30: 538–544.
Antibiotika jsou nenahraditelným přírodním dědictvím. Když byla v minulém století uvedena na trh, lidstvo se domnívalo, že zvítězilo v bitvě s infekčními chorobami. Avšak bakterie, v důsledku přirozeného původu antibiotik, jsou schopny rozvinout rezistenci vůči jakémukoliv antibiotiku, které bylo objeveno. Mezi nejdůležitější mechanismy rezistence patří snížený průnik antibiotika do buňky, modifikace vazebného místa, aktivní eflux či inaktivace účinné látky. Všechny tyto mechanismy mohou být primární, nezávislé na předchozí expozici antibiotiku, nebo získané. Získaná rezistence může být pouze přechodná nebo trvalá. Mezi nejvíce používaná antibiotika patří betalaktamy, kde jedním z nejčastějších mechanismů bakteriální rezistence vůči nim je jejich inaktivace betalaktamázami. Betalaktamázy jsou enzymy hydrolyzující betalaktamový kruh v molekule antibiotika. Inhibitory betalaktamáz dokážou vazbou na tyto enzymy ochránit samotné betalaktamové antibiotikum.
Summary:
Adamkova V, Zavora J. Antibiotic resistance – yesterday, today, and tomorrow… Remedia 2020; 30: 538–544.
Antibiotics are irreplaceable natural heritage. When antibiotics were introduced in the last century, humankind thought that the war against bacteria and infectious diseases is won. However, bacteria can develop resistance to any of the drugs that were discovered. The most important mechanisms of resistance are limiting uptake of the antibiotic, modification of target place, active efflux and drug inactivation. All these mechanisms can be intrinsic, independent of previous antibiotic exposure, or acquired. Acquired resistance may be transient or permanent. The most widely used group of antibiotics is beta‑lactams. One of the most important mechanism of resistance to beta‑lactams is drug inactivation by beta‑lactamases. Beta‑lactamases hydrolyze a specific site in the beta‑lactam ring structure, causing the ring to open. Inhibitors of beta‑lactamases are capable of protecting the molecule of the antibiotic by binding to these enzymes.
Key words: bacterial resistance, beta‑lactamases, MRSA
Úvod
Infekční onemocnění provázela lidstvo po celou dobu jeho existence, protože mikroorganismy zde byly dříve než vyšší živočichové a s největší pravděpodobností tu budou i po nás.
Objev penicilinu a jeho uvedení do praxe během druhé světové války znamenaly obrovský průlom v medicíně. Avšak již Sir Alexander Fleming v roce 1945 během své přednášky u příležitosti udělení Nobelovy ceny upozornil na fakt, že není obtížné „udělat“ bakterii rezistentní k penicilinu. Ta doba prý nastane, až si lidstvo bude moci koupit penicilin v obchodě a člověk kvůli své neznalosti a ignorantství si antibiotikum poddávkuje, přičemž tato expozice subinhibičním dávkám povede k selekci rezistentních bakterií [1]. Jeho slova se záhy potvrdila. Objevení se a rychlé šíření rezistentních bakterií během posledních dvou dekád nám odkrylo hloubku našich neznalostí o evoluci bakteriální rezistence a o ekologických procesech uvnitř mikrobiální populace.
Masivní nárůst rezistence v posledních letech spolu s omezeným spektrem nových účinných antibiotik je důvodem zamyslet se nad racionálním přístupem k antiinfekční terapii [2]. Determinanty rezistence cirkulují v mikrobiomu miliony let a existovaly i před érou komerčně připravovaných antibiotik, jak dokládají metagenomické analýzy pravěké DNA z permafrostu, které identifikovaly geny kódující rezistenci k betalaktamům, tetracyklinům a glykopeptidům a tyto geny jsou velmi podobné genům dnes izolovaným od rezistentních bakterií vyvolávajících infekce spojené s poskytovanou zdravotní péčí [3]. Na druhé straně mnoho studií dokumentuje korelaci mezi spotřebou antibiotik ve veterinární sféře a výskytem rezistence k těmto antibiotikům u humánních izolátů, a dokonce přímý efekt selekce rezistence při užívání antibiotik na individuální úrovni. Malhotra Kumar a kol. prokázali v randomizované, dvojitě zaslepené studii na velké skupině dobrovolníků, že sedmidenní expozice makrolidům vede ke vzniku rezistence u bakterií v ústní mikrobiotě [4].
Počet infekcí vyvolaných bakteriemi rezistentními k běžně užívaným antibiotikům se celosvětově zvyšuje [5]. Při příležitosti Světového dne zdraví v roce 2011 ředitelka Světové zdravotnické organizace (World Health Organization, WHO) varovala před narůstající rezistencí s tím, že svět míří k postantibiotické éře, kterou později komentovala slovy „the end of modern medicine as we know it“ („konec moderní medicíny, jak ji známe“) [6,7].
Aby byla zachována účinnost stávajících antibiotik a s tím související možnost efektivní léčby, je nezbytná aktivní spolupráce kliniků a mikrobiologů v monitorování a predikci výskytu rezistence [8]. V roce 2015 připravila WHO globální akční plán, kde surveillance mikrobiální rezistence (AMR) je zmiňována jako základní kámen kontroly AMR [9].
Problém narůstající rezistence je alarmující o to více, že v preklinickém výzkumu je jen velmi málo nových účinných molekul, a nelze proto v blízké budoucnosti očekávat zásadní rozšíření současného spektra dostupných antibiotik [10].
Rezistence bakterií k antibiotikům
Rezistence bakterií k antibiotikům může být buď primární, přirozená, nebo sekundární, získaná.
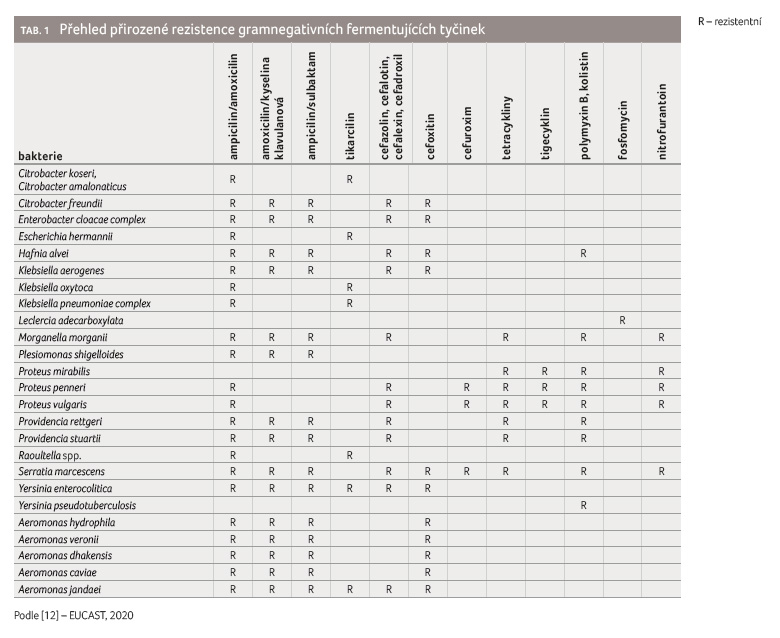
Primární rezistence je charakteristická pro daný bakteriální druh či rod, není závislá na předchozí expozici antibiotiku a není vázána na horizontální genetický přenos. Mezi nejčastější příčiny patří nepřítomnost vazebných struktur pro dané antibiotikum, např. mykoplazmata nemají buněčnou stěnu, tudíž ani betalaktamová ani gly
kopeptidová antibiotika nelze použít, protože se nemají kde navázat a co inhibovat [11]. Příklady přirozené rezistence gramnegativních fermentujících tyčinek jsou souhrnně uvedeny v tabulce 1 [12].
Mechanismy rezistence se dají shrnout do jednotlivých skupin, přičemž rezistence vůči některé skupině antibiotik
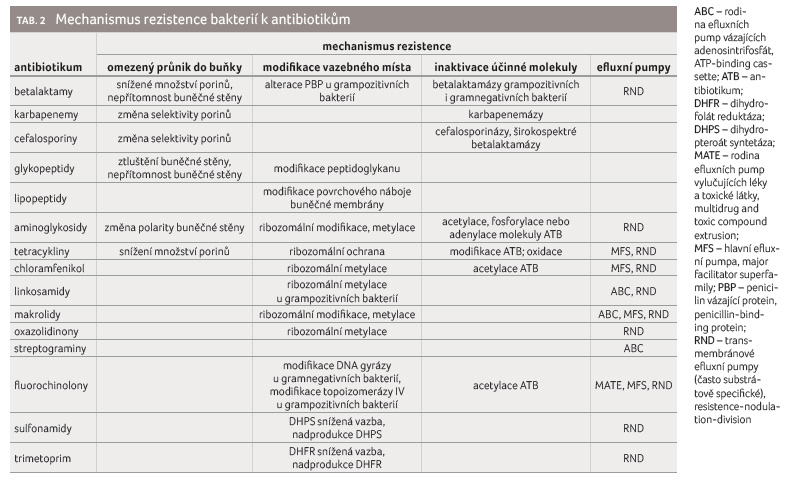
může být dána i více mechanismy. Mezi hlavní mechanismy rezistence patří snížený průnik antibiotika do buňky, modifikace vazebného místa, inaktivace molekuly antibiotika, změna metabolické dráhy či aktivní eflux [13] (tab. 2).
Zatímco gramnegativní bakterie dokážou využít každý z těchto mechanismů, jsou možnosti grampozitivních bakterií limitované, především proto, že nemají lipopolysacharidovou membránu a ani potřebné spektrum efluxních pump [14]. Přesto i zde existují výjimky potvrzující pravidlo a např. grampozitivní Staphylococcus aureus dokáže využít všechny zmíněné mechanismy vůči různým skupinám antibiotik (tab. 3).
Na příkladu S. aureus lze snadno demonstrovat schopnost bakterií rychle se přizpůsobit podmínkám zevního prostředí a vybudovat si různé obranné mechanismy. V roce 1942, tedy dva roky po uvedení penicilinu na trh, byl prokázán první nemocniční kmen S. aureus rezistentní k penicilinu, později byly tyto kmeny zaznamenány i v komunitě a v šedesátých letech bylo již téměř 80 % všech kmenů rezistentních k penicilinu. Proto bylo na trh uvedeno penicilináza rezistentní antibiotikum meticilin, avšak v roce 1961, dva roky po jeho uvedení, byl izolován první kmen, který vykazoval rezistenci k meticilinu v důsledku získání genu mecA, jenž modifikuje vazebné místo pro betalaktamová antibiotika. Během následujících desetiletí se po
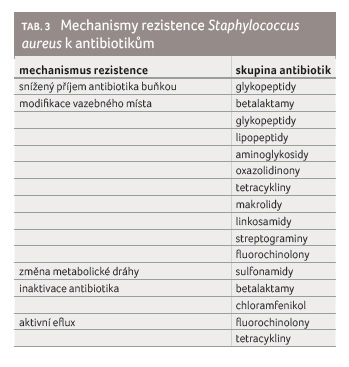
celém světě rozšířily různé klony tzv. nemocničních multirezistentních kmenů meticilin rezistentních S. aureus (hospital associated methicillin resistant Staphylococcus aureus, HA MRSA), které jsou rezistentní nejenk meticilinu, ale také zároveň k makrolidům, linkosamidům, gentamicinu a fluorovaným chinolonům. V roce 1993 se objevil první tzv. komunitní virulentní kmen S. aureus (community associated methicillin resistant Staphylococcus aureus, CA MRSA) charakterizovaný produkcí Pantonova‒Valentinova leukocidinu. Kmen byl izolován od domorodého pacienta v Západní Austrálii, který nikdy předtím nebyl hospitalizovaný a neměl žádné predisponující faktory rozvoje infekce MRSA [15]. Tento kmen byl rezistentní pouze k meticilinu.
Kmeny CA MRSA a HA MRSA se liší jak fenotypově, tak genotypově, na rozdíl od nemocničních izolátů jsou CA MRSA většinou dobře citlivé k non betalaktamovým antibiotikům. Klony CA MRSA se již začaly šířit po světě, jejich prevalence je naštěstí stále nízká, přesto má vzrůstající tendenci. V posledních letech však začínají CA MRSA nahrazovat HA MRSA v některých zdravotnických zařízeních ve Spojených státech amerických a na Tchaj wanu [16].
Stále se zvyšující rezistence je problémem celosvětovým, ne pouze České republiky, avšak jednotlivé země se liší jak v četnosti, tak ve spektru výskytu jednotlivých patogenů. V Evropě je dlouhodobě pozorován signifikantní vzestup rezistence u bakterií z řádu Enterobacterales (především Escherichia coli, Klebsiella pneumoniae) k cefalosporinům třetí generace, nejčastěji v důsledku produkce širokospektrých betalaktamáz, dále k fluorovaným chinolonům a aminoglykosidům. V případě K. pneumoniae je patrný signifikantní nárůst výskytu tzv. multirezistentních kmenů, tj. kmenů rezistentních ke třem a více různým skupinám antibiotik, kdy např. v České republice v roce 2015 bylo 41,5 % kmenů K. pneumoniae izolovaných z hemokultur multirezistentních, na Slovensku dokonce 59,6 % [17].
V praxi to znamená, že se používají stále „silnější“ antibiotika, která byla dříve řazena mezi tzv. rezervní. Pacienti s infekcí vyvolanou rezistentní bakterií musejí být často hospitalizováni a léčeni intravenózně podávanými antibiotiky pouze proto, že perorální formy jsou již neúčinné. Lékem volby na infekce způsobené multirezistentními kmeny se tak staly karbapenemy, avšak bakterie záhy zareagovaly vyselektováním karbapenem rezistentních kmenů a tyto jsou terapeuticky velmi těžko ovlivnitelné. U některých bývá zachována citlivost již pouze ke kolistinu či tigecyklinu, ale některé jsou už panrezistentní, tj. nejsou laboratorně citlivé k žádnému stávajícímu antibiotiku. Velmi vysoký podíl karbapenem rezistentních kmenů K. pneumoniae je dlouhodobě pozorován v Řecku a Itálii, kde v roce 2015 byla míra rezistence ke karbapenemům 62,7 %, resp. 35,7 % [17].
Betalaktamová antibiotika
Podíváme li se na rezistenci ze strany antibiotik, jistě jednou z nejdůležitějších a nejpoužívanějších skupin antibiotik jsou právě betalaktamová antibiotika, kam patří peniciliny, cefalosporiny a karbapenemy. Přispívají k tomu jejich relativně vysoká účinnost, výborný průnik, minimální nežádoucí účinky a v neposlední řadě nízká cena. Toto samozřejmě vede k tomu, že bakterie si záhy začaly vůči nim vytvářet rezistenci. Jsou též jedinou skupinou antibiotik, u nichž jsme schopni alespoň jeden z mechanismů rezistence částečně překonat.
Nejčastějším mechanismem rezistence bakterií k betalaktamům je produkce enzymů ‒ betalaktamáz, které dovedou tato antibiotika hydrolyzovat [18]. Po několik desetiletí se tak pátrá po molekulách schopných betalaktamázy inhibovat. V dnešní době je na trhu několik kombinací betalaktamů s tzv. inhibitory betalaktamáz a nové inhibitory jsou vyvíjeny, ale zdá se, že cesta k panbetalaktamázovému inhibitoru bude ještě dlouhá.
Rezistence k betalaktamům
Bakterie mají několik mechanismů ochrany proti betalaktamovým antibiotikům. Jak již bylo zmíněno, nejčastějším z nich je produkce betalaktamáz (viz dále). Kromě toho však mohou nastat změny v aktivním místě proteinů vázajících penicilin (penicillin binding protein, PBP), což snižuje afinitu k betalaktamovým antibiotikům a vede také k rezistenci k nim. Dalším způsobem obrany může být snížená exprese proteinů vnější membrány (outer membrane proteins, OMP). Některé z těchto proteinů (například poriny) umožňují betalaktamům přístup k vnitřní membráně a tím k PBP, které jsou cílovým místem jejich mechanismu účinku. Pokud geny pro OMP obsahují bodové mutace, výsledné proteiny mají sníženou, nebo žádnou funkci, a to vede k poklesu permeability pro betalaktamy. V neposlední řadě pak k rezistenci mohou přispívat efluxní pumpy, díky nimž jsou bakterie schopné exportovat antibiotika z buňky do okolního prostoru [19].
Betalaktamázy
Betalaktamázy jsou enzymy produkované
bakteriemi, které pomocí hydrolýzy betalaktamového kruhu
inaktivují antibakteriální účinky betalaktamových antibiotik,
tedy penicilinů, cefalosporinů a karbapenemů. K datu
2. května 2019 bylo identifikováno více než 4 300 různých
betalaktamáz [20]. Vzhledem k obrovskému počtu různých typů
enzymů byla snaha zavést jejich klasifikaci. V současnosti se
používají dvě: a) strukturální Amblerova klasifikace, b)
funkční klasifikace dle Bushové‒Jacobyho‒Medeirose (tab. 4)
[21,22].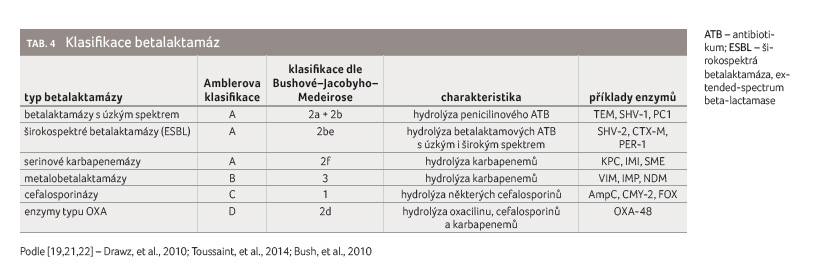
Betalaktamázy Amblerovy třídy A jsou nejčastěji produkovány bakteriemi řádu Enterobacterales a obecně platí, že jsou in vitro inhibovatelné základními betalaktamázovými inhibitory (beta lactamase inhibitor, BLI) klavulanátem, sulbaktamem a tazobaktamem. Výjimkou jsou serinové karbapenemázy, které mají kromě hydrolytických vlastností širokospektrých betalaktamáz (extended spectrum beta lactamase, ESBL) navíc ještě schopnost hydrolyzovat karbapenemy.
Betalaktamázy Amblerovy třídy B neboli metalobetalaktamázy (MBL) charakterizuje přítomnost atomu zinku v aktivním místě. Tyto enzymy nejsou inhibovatelné běžnými BLI a stávají se tak zásadním problémem. Ve vývoji jsou kombinace betalaktamů s inhibitory betalaktamáz (beta lactam/beta lactamase inhibitor combination, BLIC), které slibují inhibici těchto enzymů.
Betalaktamázy Amblerovy třídy C jsou produkovány gramnegativními bakteriemi a jsou většinou zprostředkovány chromozomálně; tato skupina obsahuje enzymy AmpC. Jejich produkce je inducibilní, exprese genu většinou nastane až po kontaktu s některými antibiotiky či inhibitory betalaktamáz. Takové kmeny mohou při testování citlivosti k antibiotikům in vitro vykazovat citlivost k cefalosporinům. Hyperprodukce AmpC typicky vede k rezistenci k širokospektrým cefalosporinům, v kombinaci s jinými mechanismy rezistence (např. změny v porinových kanálech) dokonce k rezistenci ke karbapenemům.
Betalaktamázy Amblerovy třídy D zahrnují enzymy typu OXA, převážně ESBL a karbapenemázy. Na rozdíl od ESBL skupiny A a karbapenemáz jiných skupin produkuje enzymy třídy D primárně Pseudomonas aeruginosa a Acinetobacter baumannii [21].
Inhibitory betalaktamáz a jejich
kombinace s antibiotiky
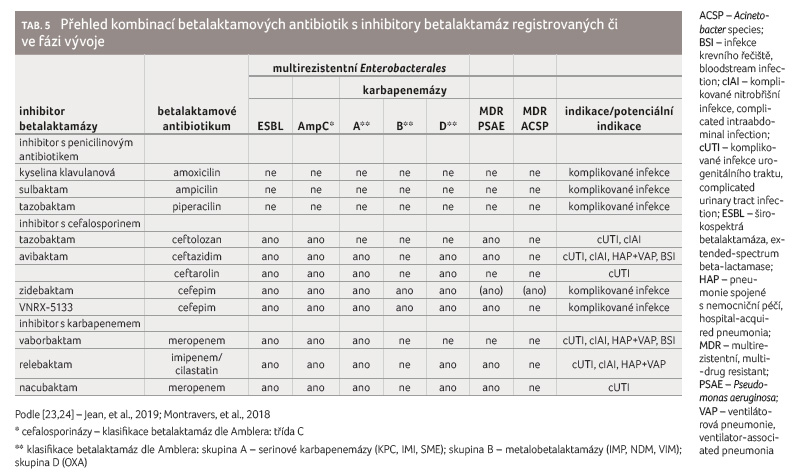
S nárůstem počtu kmenů produkujících betalaktamázy se zvyšovala potřeba látky schopné aktivitu těchto enzymů inhibovat. Kombinace inhibitorů betalaktamáz s betalaktamy jsou shrnuty v tabulce 5 [23,24].
„Klasické“ betalaktamové inhibitory betalaktamáz
První BLI – kyselina klavulanová (klavulanát) – se objevila v roce 1972 jako vedlejší produkt Streptomyces clavuligerus, následována sulbaktamem (1978) a tazobaktamem (1984). Tyto molekuly jsou betalaktamové struktury, ale jejich antibiotický efekt je téměř nulový [21]. Užitečné jsou v kombinaci s betalaktamovými antibiotiky, kdy se ireverzibilně vážou na betalaktamázy a ochraňují tak samotné antibiotikum před inaktivací. Tyto BLI inhibují převážně enzymy třídy A, mají nízký efekt na enzymy třídy C a D, a vůbec neinhibují MBL (třída B) [25]. Klavulanát je součástí nejpoužívanějšího přípravku, který spojuje betalaktam s inhibitorem betalaktamázy (amoxicilin/kyselina klavulanová). Sulbaktam má nezanedbatelný účinek proti Acinetobacter species a k dostání je v kombinaci s ampicilinem [26]. Tazobaktam má podobnou strukturu jako sulbaktam a byl původně vyvinut pro kombinaci s piperacilinem, ale ukázalo se, že výhodná je i jeho novější kombinace s ceftolozanem.
Ceftolozan/tazobaktam
Ceftolozan je v současné době
nejsilnějším betalaktamovým antibiotikem s účinkem
na Pseudomonas aeruginosa. Díky své aktivitě proti
AmpC, poruchám porinových kanálů i efluxním pumpám
účinkuje většinou i proti kmenům P. aeruginosa
běžně rezistentním na antipseudomonádová antibiotika, jako
jsou ceftazidim a karbapenemy [27,28]. Kombinace s tazobaktamem
rozšiřuje spektrum ceftolozanu na kmeny Enterobacterales
produkující ESBL. Jeho základní indikace jsou
intraabdominální infekce a komplikované infekce
urogenitálního traktu. Tato kombinace klasického inhibitoru
s cefalosporinem 3. generace byla schválena v roce
2014 a v současné době je dostupná i na českém
trhu. Přehled základního dávkování viz tabulku 6 [29].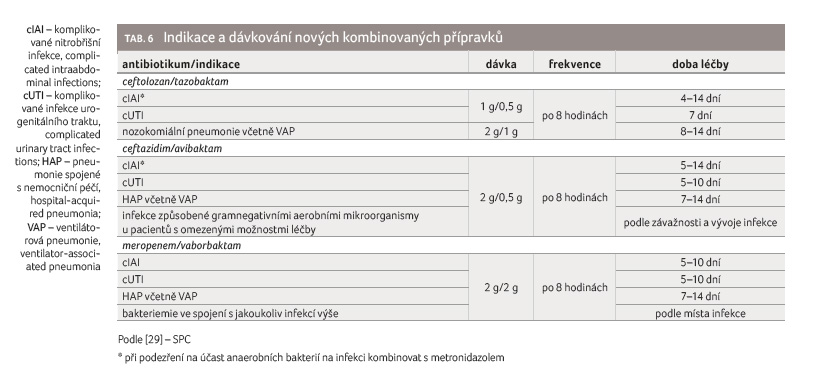
Inhibitory betalaktamáz nové generace
Infekce, které způsobují kmeny necitlivé ke kombinacím s klasickým BLI z důvodu produkce enzymů, se v posledních dvou desetiletích stávají závažným problémem. Výzkum se tedy opět obrátil směrem k BLI, ale bylo nutné vyvinout molekuly nové, schopné překonat slabiny klasických BLI. Objevily se tak BLI nové generace, diazabicyklooktany (DABCO), které mimikují betalaktamové BLI, ale jsou strukturálně odlišné. Mohou tak uniknout běžným mechanismům rezistence účinným proti klasickým BLI. Navíc mají mnohem širší spektrum inhibičního potenciálu a vyšší vazebnou kapacitu v porovnání s klavulanátem.
Avibaktam vznikl jako první DABCO. Nejenže dokáže inhibovat většinu betalaktamáz Amblerovy třídy A, včetně karbapenemáz typu KPC (Klebsiella pneumoniae carbapenemases), ale je účinný i proti betalaktamázám třídy C a některým třídy D, včetně OXA 48 [30‒32]. Oproti klasickým BLI se avibaktam na betalaktamázu váže reverzibilně a po acetylaci enzymu je uvolněn nezměněný, což ho činí velmi stabilním vůči hydrolýze betalaktamázami [33]. Navíc se ukázalo, že stačí pouze 1‒5 molekul avibaktamu k inhibici betalaktamázy, oproti počtu více než 50 molekul u tazobaktamu či klavulanátu [32]. Na trhu je v současnosti v přípravku kombinován s ceftazidimem a ve vývoji jsou jeho kombinace s ceftarolinem a aztreonamem; spolu s aztreonamem slibuje aktivitu proti všem třídám betalaktamáz včetně MBL.
Ceftazidim/avibaktam
Ceftazidim je antibiotikum s širokým gramnegativním spektrem zahrnujícím Enterobacterales a P. aeruginosa. Bohužel je snadno inhibován ESBL a karbapenemázami. S přidáním avibaktamu se ceftazidimu obnoví aktivita proti multirezistentním kmenům produkujícím betalaktamázy třídy A, C a D (včetně většiny kmenů produkujících OXA 48) [34]. Tento přípravek byl schválen v roce 2014 pro tyto indikace: intraabdominální infekce, komplikované infekce urogenitálního traktu a pneumonie spojené s nemocniční péčí, včetně ventilátorové pneumonie. Navíc je ještě schválen pro infekce způsobené gramnegativními aerobními mikroorganismy u pacientů s omezenými možnostmi léčby [35]. Tento přípravek je také dostupný na českém trhu, základní dávkování viz tabulku 6.
Relebaktam je BLI skupiny DABCO ve vývoji. Strukturou je podobný avibaktamu a zkoumá se jeho synergie s imipenemem a jejich efekt proti různým ESBL i KPC.
Zidebaktam je další DABCO nacházející se ve vývoji. Má vysokou afinitu k PBP a výrazně zvyšuje efektivitu cefepimu proti serinovým betalaktamázám (ESBL, KPC) [36].
Nacubaktam je nejnovějším BLI typu DABCO a bylo zjištěno, že velmi dobře doplňuje betalaktamová antibiotika (meropenem) vzhledem ke své vysoké afinitě k PBP [37].
Při hledání vhodného inhibitoru betalaktamáz se ukázalo, že deriváty kyseliny boronové by mohly mít ideální vlastnosti. Struktura boronátů se velmi podobá intermediární formě molekuly betalaktamu, která vzniká při napadení betalaktamázou těsně před hydrolýzou (otevřením betalaktamového kruhu). Tato intermediární forma se vyskytuje při hydrolýze serinových betalaktamáz i MBL, což by potenciálně mohlo znamenat inhibici všech tříd betalaktamáz, a tedy vznik panbetalaktamázového inhibitoru.
Vaborbaktam je prvním cyklickým boronátem. Nevykazuje žádnou antibiotickou aktivitu, ale silně potencuje aktivitu meropenemu proti KPC, ESBL a AmpC [38].
Meropenem/vaborbaktam
Tato kombinace byla v roce 2018 schválena pro následující indikace: komplikované infekce urogenitálního traktu, intraabdominální infekce, pneumonie spojené s nemocniční péčí včetně ventilátorové pneumonie a infekce krevního řečiště (pokud je ve spojení s výše uvedenými infekcemi) [23]. Základní dávkování viz tabulku 6.
VNRX 5133 je novým boronátovým BLI, který slibuje aktivitu proti všem třídám betalaktamáz, včetně MBL. Testuje se v kombinaci s cefepimem [38].
Závěr
Antibiotika jsou určena k léčbě infekcí vyvolaných bakteriálními původci. V případě jiné než bakteriální etiologie antibiotika účinná nejsou a jejich podávání nevede k úzdravě pacienta, ale může ho naopak dokonce významně poškodit. Tento fakt lze snadno vysvětlit. Antibiotika si nedokážou „vybrat“ špatné bakterie, které onemocnění vyvolávají, ale působí na všechny přítomné bakteriální buňky, které jsou vůči nim vnímavé. Vzhledem k tomu, že velká část infekcí je endogenního původu, v konečném důsledku antibiotika aktivně působí i vůči bakteriím, jež jsou součástí přirozené mikrobioty našeho těla. Nejenže se antibiotický tlak spolupodílí na selekci rezistentních kmenů bakterií, ale především na ovlivnění křehkého ekosystému mikrobioty lidského těla. Následkem toho vznikají další infekční komplikace. Na druhou stranu je třeba si uvědomit, že antibiotika jsou zcela nenahraditelným přírodním dědictvím a povinností každého z nás by měla být snaha o zachování jejich účinnosti. Řešením není vývoj nových molekul s antimikrobní účinností, protože to problém pouze oddálí. Je třeba úplně změnit chápání a přístup k antibiotické léčbě.
Jestliže nedojde k zásadní změně uvažování o používání antibiotik, resp. nepřestanou se nadužívat, bude rezistence dále zcela nekontrolovaně narůstat a infekce vyvolané těmito rezistentními bakteriemi budou čím dál častěji příčinou úmrtí. Již nyní každý rok zemře jenom v Evropě 33 000 lidí na infekce vyvolané rezistentními bakteriemi, celosvětově je to kolem 700 000 úmrtí, z toho 230 000 úmrtí na tuberkulózu vyvolanou multirezistentními kmeny Mycobacterium tuberculosis. Nedojde li k žádné změně, odhaduje se, že na tyto infekce zemře v roce 2050 až 10 milionů lidí, což bude vyšší počet úmrtí než na onkologická či kardiovaskulární onemocnění. Ekonomické dopady nekontrolovaného nárůstu bakteriální rezistence jsou srovnatelné s dopady globální finanční krize v letech 2008‒2009 [39].
Seznam použité literatury
- [1] Fleming A. Penicillin. Nobel Lecture. December 11, 1945. Dostupné na: https://www.nobelprize.org/prizes/medicine/1945/fleming/lecture/
- [2] Ventola CL. The antibiotic resistance crisis: part 1: causes and threats. P T. 2015; 40: 277‒283.
- [3] DʼCosta VM, King CE, Kalan L, et al. Antibiotic resistance is ancient. Nature 2011; 477: 457–461.
- [4] Malhotra‑Kumar S, Lammens C, Coenen S, et al. Effec of azithromycin and clarithromycin therapy on pharyngeal carriage of macrolide‑resistant streptococci in healthy volunteers: a randomised, double‑blind, placebo‑controlled study. Lancet 2007; 369: 482–490.
- [5] World Health Organisation (WHO). Antimicrobial resistance: global report on surveillance 2014. Geneva: WHO; 2014. Dostupné na: http://www.who.int/drugresistance/ ocuments/surveillancereport/en/
- [6] World Health Organization (WHO). World health day 2011. Geneva: WHO; 2011. Dostupné na: http://www.who.int/mediacentre/news/statements/2011/whd_20110407/en/
- [7] World Health Organization (WHO). Antimicrobial resistence in the European Union and the world. Geneva: WHO; 2012. Dostupné na: http://www.who.int/dg/speeches/2012/amr_20120314/en/
- [8] Critchley IA, Karlowsky JA. Optimal use of antibiotic resistance surveillance systems. Clin Microbiol Infect 2004; 10: 502–511.
- [9] World Health Organization (WHO). Global action plan on antimicrobial resistance. Geneva: WHO; 2015. Dostupné na: http://www.who.int/antimicrobial‑resistance/publications/ global‑action‑plan/en/
- [10] Theuretzbacher U, Outterson K, Engel A, et al. The global preclinical antibacterial pipeline. Nat Rev Microbiol 2020; 18: 275‒285.
- [11] Davies J, Davies D. Origins and evolution of antibiotic resistance. Microbiol Mol Biol Rev 2010; 74: 417–433.
- [12] The European Committee on Antimicrobial Susceptibility Testing. Intrinsic resistance and Unusual phenotypes. Version 3.2, 2020. Dostupné na: http://www.eucast.org/expert_rules_and_intrinsic_resistance/
- [13] Martinez JL. General principles of antibiotic resistance in bacteria. Drug Discov Today 2014; 11: 33–39.
- [14] Chancey ST, Zähner D, Stephens DS. Acquired inducible antimicrobial resistance in Gram‑positive bacteria. Future Microbiol 2012; 7: 959–978.
- [15] Lowy FD. Antimicrobial resistance: the example of Staphylococcus aureus. J Clin Invest 2003; 111: 1265–1273.
- [16] Salgado CD, Farr BM, Calfee DP. Community‑acquired methicillin‑resistant Staphylococcus aureus: a meta‑analysis of prevalence and risk factors. Clin Infect Dis 2003; 36: 131–139.
- [17] http://atlas.ecdc.europa.eu/public/index.aspx
- [18] Wilke MS, Lovering AL, Strynadka NC, et al. Beta‑lactam antibiotic resistence: a current structural perspective. Curr Opin Microbiol 2005; 8: 525‒533.
- [19] Drawz SM, Bonomo RA. Three decades of beta‑lactamase inhibitors. Clin Microbiol Rev 2010; 23: 160‒201.
- [20] Beta‑lactamase DataBase. Structure and Function. [online]. [cit. 2019‑05‑06]. Dostupné na: www.bldb.eu.
- [21] Toussaint KA, Gallagher JC. Beta‑lactam/Beta‑lactamase inhibitor combinations: from then to now. Ann Pharmacother 2015; 49: 86‒88.
- [22] Bush K, Jacoby GA. Updated functional classification of beta‑lactamases. Antimicrob Agents Chemother 2010; 54: 969‒976.
- [23] Jean SS, Gould IM, Lee WS, et al. New drugs for multidrug‑resistant gram‑negative organisms: time for stewardship. Drugs 2019; 79: 705‒714.
- [24] Montravers P, Bassetti M. The ideal patient profile for new beta‑lactam/beta‑lactamase inhibitors. Curr Opin Infect Dis 2018; 31: 587‒593.
- [25] Docquier J‑D, Mangani S. An update on beta‑lactamase inhibitor discovery and development. Drug Resist Updat 2018; 36: 13‒29.
- [26] Poulikakos P, Tansarli G, Falagas M. Combination antibiotic treatment versus monotherapy for multidrug‑resistant, extensively drug‑resistant, and pandrug‑resistant Acinetobacter infections: a systematic review. Eur J Clin Microbiol Infect Dis 2014; 33: 1675‒1685.
- [27] Hawkey PM, Warren RE, Livermore DM, et al. Treatment of infections caused by multidrug‑resistant Gram‑negative bacteria: report of the British Society for Antimicrobial Chemotherapy/Healthcare Infection Society/British Infection Association Joint Working Party. J Antimicrob Chemother 2018; 73(Suppl 3): iii2‒iii78.
- [28] Mensa J, Barberan J, Soriano A, et al. Antibiotic selection in the treatment of acute invasive infections by Pseudomonas aeruginosa: Guidelines by the Spanish Society of Chemotherapy. Rev Esp Quimioter 2018; 31: 78–100.
- [29] Souhrn údajů o přípravku. [online]. [cit. 2019‑05‑06]. Dostupné na: www.sukl.cz
- [30] Bonnefoy A, Dupuis‑Hamelin C, Steier V, et al. In vitro activity of AVE1330A, an innovative broad‑spectrum non‑beta‑lactam beta‑lactamase inhibitor. J Antimicrob Chemother 2004; 54: 410–417.
- [31] Ehmann DE, Jahic H, Ross PL, et al. Kinetics of avibactam inhibition against class A, C, and D beta‑lactamases. J Biol Chem 2013; 288: 27960–27971.
- [32] Stachyra T, Levasseur P, Péchereau MC, et al. In vitro activity of beta‑lactamase inhibitor NXL104 against KPC‑2 carbapenemase and Enterobacteriaceae expressing KPC carbapenemases. J Antimicrob Chemother 2009; 64: 326–329.
- [33] Ehmann DE, Jahic H, Ross PL, et al. Avibactam is a covalent, reversible, non‑beta‑lactam beta‑lactamase inhibitor. Proc Natl Acad Sci 2012; 109: 11663–11668.
- [34] Rodriguez‑Bano J, Gutierrez‑Gutierrez B, Machuca I, et al. Treatment of infections caused by extended‑spectrum‑beta‑lactamase‑, AmpC‑, and carbapenemase‑producing Enterobacteriaceae. Clin Microbiol Rev 2018; 31: pii e00079‑1.
- [35] Carmeli Y, Armstrong J, Laud PJ, et al. Ceftazidime‑avibactam or best available therapy in patients with ceftazidime‑resistant Enterobacteriaceae and Pseudomonas aeruginosa complicated urinary tract infections or complicated intra‑abdominal infections (REPRISE): a randomised, pathogen‑directed, phase 3 study. Lancet Infect Dis 2016; 16: 661–673.
- [36] Livermore DM, Mushtaq S, Warner M, et al. In vitro activity of cefepime/zidebactam (WCK 5222) against Gram‑negative bacteria. J Antimicrob Chemother 2017; 72: 1373‒1385.
- [37] Bentley D, Fettner S, Patel K, et al. Safety, tolerability, and pharmacokinetics of nacubactam, a novel beta‑lactamase inhibitor, administered alone and with meropenem in healthy volunteers. In: 28th European congress of clinical microbiology and infectious diseases, Madrid, Spain, 21–24 April, 2018. P2214.
- [38] Zhanel GG, Lawrence CK, Adam H, et al. Imipenem‑relebactam and meropenem‑vaborbactam: two novel carbapenem‑beta‑lactamase inhibitor combinations. Drugs 2018; 78: 65–98.
- [39] https://www.who.int/antimicrobial‑resistance/interagency‑coordination‑group/IACG_final_report_EN.pdf?ua=1