Rituximab a jeho indikace
Souhrn:
Syrová D. Rituximab a jeho indikace. Remedia 2019; 29: 394–400.
Rituximab je historicky první monoklonální protilátka, která byla schválena americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA), v roce 1997, pro léčbu relabovaného nebo refrakterního folikulárního lymfomu. Tato chimérická monoklonální protilátka je namířena proti antigenu CD20, který se vyskytuje na B lymfocytech. Mechanismus účinku vede k dalšímu zkoumání a výsledky přispívají k rozšiřování indikací a k použití rituximabu při léčbě řady nemocí i mimo hematoonkologii. Zavedení rituximabu do praxe v monoterapii nebo v kombinaci znamenalo obrat v léčbě a změnu osudu nemocného. Výhodou je minimální toxicita a vyšší specifita účinku a tím i lepší kvalita života. Rituximab a obecně cílená léčba monoklonálními protilátkami představuje vysoce specifickou terapii, která se stala standardní součástí léčebných režimů u řady onemocnění.
Summary:
Syrova D. Rituximab and its indications. Remedia 2019; 29: 394–400.
Rituximab is the first historically registered monoclonal antibody approved by FDA in 1997 for the treatment of relapsed or refractory follicular lymphoma. This chimeric monoclonal antibody is directed against the CD20 antigen that is found on B‑lymphocytes. The mechanism of its effect leads to additional research, and the results contribute to the extension of indication and its use in the treatment of number of diseases, even beyond hematooncology. Rituximab introduction as a monotherapy or combination into clinical practice lead to a turning point in the treatment and changed the fate of patients. Its minimal toxicity and higher specificity of effects, and thus better quality of life, is the advantage. Rituximab, and generally targeted treatment with monoclonal antibodies, represents highly specific treatment that became a standard part of treatment regimens in number of diseases.
Key words: rituximab, monoclonal antibodies, CD20, B‑lymphocyte
Úvod
Pokroky ve výzkumu v oblasti molekulární biologie, poznávání regulačních mechanismů a chování buněk přispěly k nové cestě léčby, kterou představují monoklonální protilátky. Vznikla nová generace léčiv zasahujících na úrovni regulačních a signálních proteinů, která neovlivňuje genetickou informaci, tzv. targeted therapy – cílená léčba. Vzhledem k větší selektivitě k nádorovým buňkám a mechanismu působení se jedná o léčbu s mnohem nižší toxicitou a s vyšší protinádorovou účinností. Chemoterapie je totiž nespecifická, zaměřená proti genetické výbavě nádorových buněk, zasahuje však i zdravé buňky. Působí tedy většinou na nádorové buňky vysoce proliferující, homogenní a se zachovanými apoptotickými mechanismy. Většina karcinomů má ovšem vysokou heterogenitu, nízkou proliferaci i blokádu apoptotických mechanismů. Z těchto důvodů je chemoterapie méně účinná, má úzký terapeutický index, tedy malý rozdíl mezi účinnou dávkou a dávkou toxickou pro organismus. Biologická léčiva se postupně stala terapeutickým standardem jak v monoterapii, tak v kombinaci s chemoterapií či s další léčbou a posilují její účinek. Mezi významné a hojně užívané skupiny této nové generace léčiv patří kromě monoklonálních protilátek inhibitory tyrozinkinázy, inhibitory proteazomu a imunomodulační léky.
Monoklonální
protilátky
Monoklonální protilátky (MP) nejsou
žádnou novinkou, neboť jejich koncepci představil Paul Ehrlich
již v 19. století, ale teprve objevením a popsáním
tvorby pomocí hybridomu v roce 1975 začala éra jejich
praktického využití. Objeviteli této hybridomové technologie
byli George Köhler, Cesar Milstein a Niels Jerne, jimž byla
za tento objev a za práci v oblasti imunitního
systému udělena v roce 1984 Nobelova cena. Principem hybridomů
je vytvoření nesmrtelných linií buněk vzniklých fúzí buněk
myelomu a imunizovaných B lymfocytů ze sleziny myší
[1–3]. Tvorba je schematicky znázorněna na obrázku 1.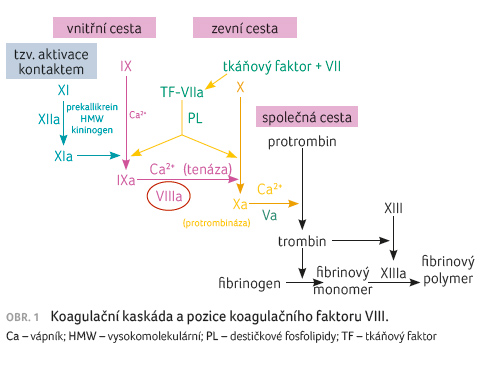
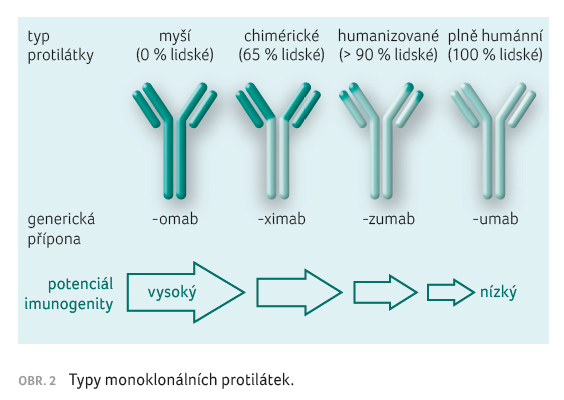
Původně používané myší protilátky vyvolávaly v organismu tvorbu anti myších protilátek (tzv. HAMA), které bránily navození terapeutického efektu a ohrožovaly pacienty vznikem anafylaktických reakcí či vznikem sérové nemoci. Z tohoto důvodu byly vyvinuty tzv. humanizované (chimérické humánní/myší) MP. Jejich konstantní úsek je tvořen lidským imunoglobulinem a variabilní úsek kódující antigenní specifitu myším imunoglobulinem.
Monoklonální protilátky lze rozdělit podle původu na tři typy s charakteristickou příponou jejich názvu (obr. 2):- nemodifikované myší, které vyvolávají tvorbu anti myších protilátek (tzv. HAMA) – s příponou omab;
- chimérické, kde konstantní část tvoří 60–70 % lidské bílkoviny a 30–40 % myší protilátky variabilní části – s příponou ximab;
- humanizované, kde konstantní část tvoří 90–95 % lidské bílkoviny a 5–10 % myší protilátky – s příponou zumab nebo humánní – s příponou mumab.
Monoklonální protilátky jsou namířeny na cílovou strukturu, tj. na specifický antigen na povrchu buňky. Mezi nejvýznamnější antigeny v hematoonkologii patří CD20, antigen, který se vyskytuje u pacientů s danou malignitou a jehož exprese ve zdravé tkáni je zanedbatelná. Účinnost MP je závislá na homogenitě antigenu a na expresi na povrchu buňky. Přítomnost volných antigenů v extracelulární tekutině, špatné krevní zásobení a velikost nádorové masy má negativní vliv na účinnost.
Mezi další známé antigeny, proti nimž mohou být MP namířeny, patří i epidermální růstový faktor (cetuximab, trastuzumab), tumor nekrotizující faktor alfa – TNFα (infliximab, adalimumab), vaskulární endoteliální růstový faktor (bevacizumab), interleukin 2 (daklizumab), α4 β1 integrin (natalizumab), komplement C5 (ekulizumab) či imunoglobulin E (omalizumab). Některé z nich našly své stálé uplatnění v praxi.
Pro posílení a co možná nejpřesnější zacílení účinku lze protilátky navázat s další látkou a vytvořit konjugované MP. Protilátka má v tomto případě pouze funkci nosiče se zajištěním antigenní specifity. Kombinovat MP lze s efektorovými složkami (imunotoxiny, cytostatiky, cytokiny, radioizotopy). V případě navázaného radioligandu, kdy uplatnění našel Y90, je tak maximálně ozářena cílová nádorová buňka, která na svém povrchu exprimuje antigen komplementární k podané protilátce. Mezi přípravky, které jsou v současnosti povoleny pro klinické použití, patří ibritumomab tiuxetan, myší IgG1 MP cílená na protein CD20, jenž se nachází na B lymfocytech a je silně exprimován u některých lymfomů. Tato konjugovaná molekula je určena ke konsolidační léčbě u dříve neléčených pacientů s folikulárním lymfomem v remisi po indukční terapii a k léčbě CD20 pozitivního folikulárního B nehodgkinského lymfomu v relapsu po terapii rituximabem nebo v refrakterní fázi u dospělých pacientů.
Charakteristika rituximabu
Jedná se o chimérickou (myší – lidskou) MP namířenou proti antigenu CD20, což je neglykosylovaný membránově vázaný fosfoprotein, který čtyřikrát prochází membránou. Těžké řetězce tvoří 451 aminokyselin a lehké mají 213 aminokyselin. Konstantní část protilátky IgG1 je lidská a zabezpečuje efektorové funkce (Fc fragment), čímž se minimalizuje tvorba protilátek proti této protilátce (bílkovině). Vazbu na antigen CD20 zajišťuje variabilní část (Fab fragment), která je myšího původu. CD20 je povrchový antigen nacházející se na normálních i maligních B lymfocytech. Nevyskytuje se na kmenových hematopoetických buňkách, pro B buňkách, normálních plazmatických buňkách ani na jiných normálních buňkách. Je exprimován ve vysoké koncentraci na více než 95 % B buněk nehodgkinských B lymfomů [2,4]. Po navázání protilátky se tento antigen neinternalizuje a neuvolňuje se z povrchu buňky, necirkuluje v plazmě jako volný antigen a nevzniká tak kompetice o navázání protilátek. Rituximab se vyrábí genetickým inženýrstvím kultivací ovariálních buněk čínských křečků.
Mechanismus účinku
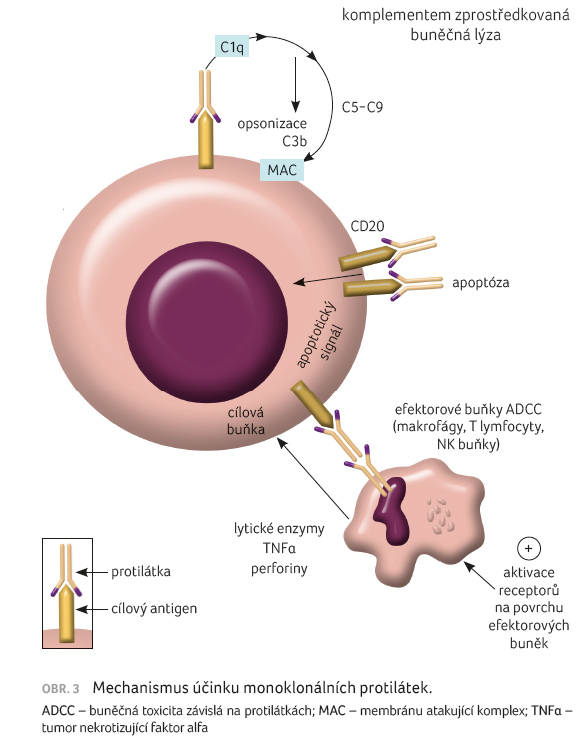
Rituximab navázáním na povrch B lymfocytu zahajuje řadu imunitních reakcí, jejichž konečným výsledkem je lýza buňky. Mezi známé mechanismy účinku patří (obr. 3):
- cytotoxická reakce vyvolaná aktivací komplementu (complement dependent cytotoxicity – CDC),
- aktivace na protilátce dependentních cytotoxických buněk (aktivace receptoru Fc na povrchu granulocytů, makrofágů a NK buněk), kdy dochází k protilátkami zprostředkované buněčné cytotoxicitě (antibody dependent cellular cytotoxicity – ADCC),
- přímá vazba rituximabu na antigen CD20, který kontroluje vápníkový kanál v průběhu buněčného cyklu, vyvolává apoptózu, blokuje vazbu ligandů na receptor, a nakonec vede ke smrti B lymfocytů.
Bylo prokázáno, že rituximab zvyšuje i citlivost nádorových buněk k chemoterapii [3,5].
Schválené indikace
Rituximab byl poprvé zaveden do praxe v roce 1997 pro léčbu nehodgkinských B lymfomů. Mechanismus účinku přispívá k dalšímu zkoumání jeho působení. Klinické studie a praktické zkušenosti vedou k postupnému rozšiřování jeho indikací i mimo oblast hematoonkologie. Mezi oficiálně schválené terapeutické indikace v současné době patří:
Nehodgkinské lymfomy (NHL)
- u dosud neléčených pacientů s folikulárním lymfomem (FL) III. a IV. klinického stadia v kombinaci s chemoterapií,
- udržovací terapie u pacientů s FL, kteří odpovídají na indukční léčbu,
- u pacientů s FL III. a IV. klinického stadia po druhém nebo dalším relapsu po chemoterapii nebo při chemorezistenci,
- u pacientů s CD20 pozitivním difuzním velkobuněčným lymfomem z B buněk (DLBCL) v kombinaci s chemoterapií.
- u pacientů s dříve neléčenou nebo relabující či refrakterní CLL v kombinaci s chemoterapií.
Revmatoidní artritida (RA)
v kombinaci s metotrexátem (MTX) u pacientů, kteří odpovídali nedostatečně na léčbu chorobu modifikujícími protirevmatickými přípravky (DMARD, disease modifying antirheumatic drugs), včetně jedné či více terapií inhibitory TNFα, či kteří tuto léčbu netolerovali.
Granulomatóza s polyangiitidou a mikroskopická polyangiitida
- u pacientů k indukci remise v kombinaci s glukokortikoidy.
Klinické použití
Hematologie
Rituximab se stal první monoklonální protilátkou uvedenou do praxe. Zařadil se do standardní součásti léčebných režimů oficiálně schválených indikací. Více než dvacetiletá klinická zkušenost s imunochemoterapií vede k jejímu použití také v léčbě dalších hematologických malignit, i když off label. Rituximabem byly celosvětově léčeny již více než čtyři miliony pacientů a v klinických studiích kolem 18 tisíc (např. PRIMA, RESORT, EORTC, ECOG, MInT, SAKK) [6]. Existují zkušenosti u lymfomů z buněk z plášťové a marginální zóny, u některých typů agresivní formy Burkittova lymfomu, Hodgkinova lymfomu, agresivní B buněčné akutní lymfoblastové leukemie. Pacientům při použití v monoterapii i v kombinaci prodlužuje rituximab přežití bez progrese a v mnoha případech i celkové přežití. Toto bylo dokázáno řadou klinických studií. Na jejich podkladě se stanovila optimální dávka, kombinace s chemoterapií, optimální intervaly mezi podáváním, rychlost infuze, nežádoucí účinky, doba podávání. Jednotlivé diagnózy mají sice různou patologii, agresivitu, prognózu, standardní léčbu, ale společným znakem je antigen CD20 na B lymfocytech. Výhodou rituximabu je jeho široké terapeutické okno a zvládnutelný bezpečnostní profil.
Prospektivní randomizované studie prokazují významné zlepšení charakterizované zvýšením počtu i delším trváním léčebných odpovědí a prodloužením přežití jak u nepředléčených, tak u relabovaných pacientů. Rituximab prokazuje přínos i v udržovací terapii po dobu dvou let, což doložila studie PRIMA u nepředléčených pacientů. Tato multicentrická studie prokázala význam udržovací terapie rituximabem v první linii léčby FL. Pacienti dostávali kombinaci rituximabu a chemoterapie a po dosažení kompletní remise (CR) či parciální remise (PR) byli randomizováni mezi observaci a udržovací léčbu, tj. podávání rituximabu 1× za dva měsíce po dobu dvou let. Přežití bez progrese v průběhu tří let činilo 74,9 % versus 57,6 % v observačním rameni [7]. Při dlouhodobém sledování po dobu šesti let byl přínos dvouletého podávání přidaného rituximabu 59,2 % versus 42,7 % [8].
Studie EORTC hodnotila význam udržovací terapie rituximabem u pacientů s relapsem FL. Pacienti v době relapsu dostávali buď režim 6× R CHOP (rituximab, cyklofosfamid, doxorubicin, vinkristin, prednison), anebo 6× CHOP (bez rituximabu). Skupina s rituximabem dosáhla častěji CR (30 % vs. 16 %). Pokud dosáhli alespoň PR, byli pacienti podruhé randomizováni mezi udržovací léčbu rituximabem 1× za tři měsíce po dobu dvou let a observaci. Doba do progrese při udržovací léčbě oproti observaci byla 51,5 měsíce versus 14,9 měsíce. Tříletého přežití dosáhli pacienti v 85 % versus 77 % ve prospěch rituximabu, pětiletého v 74 % versus 65 % [9].
U pacientů s DLBCL prokázaly studie GELA a MInT také příznivý účinek přidaného rituximabu. Studie GELA u starších osob zjistila míru pětiletého celkového přežití 58 % versus 45 % a míru desetiletého přežití 44 % versus 28 %. U mladších jedinců prokázala studie MInT míru šestiletého celkového přežití 90 % versus 80 % [10].
Ve studii CLL8 bez předchozí terapie se porovnával režim šesti cyklů léčby R FC (rituximab, fludarabin, cyklofosfamid) a FC. V uvedených ramenech bylo zjištěno tříleté přežití bez progrese 65 % versus 45 % a pětileté přežití bez progrese 47 % versus 26 %. Medián přežití bez progrese se tak u pacientů s CLL významně prodloužil na dobu 56,8 měsíce oproti 32,9 měsíce [11].
Dříve léčení pacienti byli sledováni ve studii REACH, kdy se podávalo také šest cyklů R FC a šest cyklů FC. Doba přežití bez progrese se prodloužila na 30,6 měsíce oproti 20,6 měsíce v rameni s FC [12].
Význam a zlepšení výsledků léčby CLL přidáním rituximabu potvrzují a ověřují i další studie, jejichž součástí jsou různé chemoterapeutické režimy (bendamustin, chlorambucil).
Revmatologie
B lymfocyty hrají důležitou roli v patogenezi revmatoidní artritidy. Působí jako antigen prezentující buňky a jako důležitý signál pro klonální expanzi CD4+ T lymfocytů [13]. Revmatoidní sinoviální membrána obsahuje B buňky, které sekretují prozánětlivé cytokiny (TNFα, chemokiny) a produkují i revmatoidní faktor (RF), který může přispívat k aktivaci Th buněk. To vše může vést k aktivaci komplementu a k rozvoji zánětlivé reakce [14].
Molekula CD20 je skoro ideálním terapeutickým antigenem. První zkušenosti s užitím rituximabu u revmatoidní artritidy pocházejí od pacientů, kteří měli kromě hematologické malignity i revmatoidní artritidu a jejichž obtíže se zmírnily. Následovaly klinické studie, které prokázaly účinnost a bezpečnost rituximabu a vedly k jeho schválení a zavedení do praxe. Klíčovou byla studie fáze IIb DANCER, která hodnotila účinnost různých dávek rituximabu a také efekt přidávaných kortikosteroidů [15]. Pacienti byli rozděleni do tří skupin. První dostávala rituximab 2× 500 mg intravenózně (i.v.) v den (D) 1 a D15 a MTX, druhá 2× 1 000 mg rituximabu i.v. v D1 a D15 a MTX, třetí placebo i.v. a MTX. Pacienti byli rozděleni i dle toho, zda dostávali kortikoid, či nikoliv. Ve větvi s premedikací i.v. kortikoidy byl snížen především výskyt nežádoucích reakcí na infuzi, aniž byly ovlivněny výsledky samotné léčby. Obě dávky rituximabu významně zlepšovaly kvalitu života.
Další významnou studií bylo klinické hodnocení fáze III REFLEX. Tato dvojitě zaslepená randomizovaná studie porovnávala dvě skupiny. První dostávala dvě infuze 1 000 mg rituximabu v D1 a D15 a MTX, druhé byl podáván pouze MTX. Všichni pacienti byli premedikováni 100 mg metylprednisolonu i.v. a pak dostávali per os prednison 60 mg v D2–D7 a 30 mg v D8–D14. Do studie byli zařazeni pacienti, u nichž selhala léčba alespoň jedním biologickým léčivem blokujícím cytokin TNFα. Byla prokázána účinnost a zpomalení progrese nemoci. I u těchto pacientů se významně zlepšila kvalita života a fyzická zdatnost [16].
Nefrologie
Biologická léčba se stala součástí i léčby nefrologických onemocnění. Rituximab je indikován u relabujících či refrakterních asociovaných vaskulitid (AAV) nebo u lupusové nefritidy. Efekt se objevuje i v případě relapsu membranózní glomerulonefritidy a též u idiopatického nefrotického syndromu. Rituximab byl podáván pacientům s AAV, kteří byli refrakterní na běžnou terapii, tj. na standardní imunosupresivní léčbu kortikosteroidy, s pulzním cyklofosfamidem v indukci a s azathioprinem v udržovací léčbě. Aplikovaly se čtyři dávky 375 mg/m2 v odstupu jednoho týdne nebo dvě dávky po 1 000 mg s odstupem dvou týdnů. Léčba se kombinovala obvykle s metylprednisolonem či cyklofosfamidem. Úspěšně navozená CR byla ale dočasná [17,18].
U nově diagnostikovaných AAV je možné dle provedené evropské studie RITUXVAS použití rituximabu v indukční léčbě, pokud nelze podat cyklofosfamid. Americká studie RAVE potvrdila také účinnost u nově diagnostikovaných, ale i u relabujících, kdy má rituximab vyšší účinek i v dosažení remise než při podávání cyklofosfamidu. Lze jej podat i pacientům s těžkým renálním onemocněním i s krvácením do plic [19].
Velmi dobré zkušenosti byly získány i v udržovací terapii, jak dokládají výsledky studie MAINRITSAN [20]. Tím získal rituximab standardní postavení v terapii AAV a byl schválen americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) v této indikaci.
I systémový lupus erythematodes (SLE) a lupusová nefritida (LN) se vyznačují ztrátou tolerance B lymfocytů a tvorbou protilátek. Studie s rituximabem u SLE byly problematické pro větší výskyt protilátek HACA (human anti chimeric antibodies) a progresivní multifokální leukoencefalopatie (PML) než u jiných diagnóz. Zřejmě to souvisí s vyšším výskytem komorbidit u těchto pacientů [21]. Studie LUNAR a EXPLORER potvrdily, že rituximab by měl být rezervován spíše pro pacienty s refrakterním onemocněním a měl by být porovnáván se standardní léčbou, a ne k ní být přidáván [22,23].
Rituximab se testuje se slibnými výsledky i u dalších nefrologických diagnóz. Objevují se zprávy o účinnosti a možném využití při léčbě např. poměrně vzácné trombotické mikroangiopatie; u idiopatického nefrotického syndromu, kdy pediatři zkoušeli léčit dětské pacienty s opakovanými relapsy; u rekurence membranózní glomerulonefritidy.
Roztroušená skleróza
Roztroušená skleróza (RS) je chronické neurologické onemocnění, kde se v patogenezi uplatňuje autoimunitní zánět a mechanismy neuroaxonální degenerace. Rituximab je jednou z možných perspektiv v léčbě tohoto závažného onemocnění. Bylo zjištěno, že B lymfocyty a protilátky hrají také významnou roli v patogenezi RS. Snížením počtu B lymfocytů se omezuje i produkce aberantního spektra cytokinů B buňkami a tím i nadměrná stimulace T lymfocytů. Rituximab byl zkoušen v klinické studii fáze II u pacientů s relabující remitující formou RS (RR RS) s velmi dobrým efektem na MR parametry (potlačení gadoliniem sytících se lézí). Pacienti dostávali 1 000 mg rituximabu i.v. v D1 a D15 nebo placebo [24]. Další studie testovala dávku 375 mg/m2 týdně, celkem čtyři dávky jako přídavek ke stávající terapii, a potvrdila snížený počet gadoliniem sytících se lézí [25]. Významnou a nespornou efektivitu prokázaly výsledky studií na snížení počtu relapsů u neuromyelitis optica a spolu s azathioprinem se rituximab řadí mezi nadějné léky v léčbě tohoto onemocnění [26]. Rituximab není oficiálně schválen u RS, ale na podkladě uskutečněných studií se používá off label.
Pemphigus vulgaris
Pemphigus vulgaris je vzácná kožní porucha provázená vznikem bolestivých puchýřů na kůži a sliznicích. Onemocnění zprostředkovává imunitní systém. Má často relabující a remitující průběh, který může vyústit až v ohrožení života. Postihuje většinou dospělé středního a staršího věku. Vedle systémové léčby kortikoidy se jeví léčba rituximabem jako velmi slibná. Retrospektivní studie naznačuje menší počet infekcí, hospitalizací, laboratorně potvrzených remisí a návštěv na klinice za rok. Remise onemocnění bylo dosaženo dříve než u konvenční terapie a snížilo se i množství užívaných kortikoidů [27].
Idiopatická trombocytopenická purpura
Idiopatická trombocytopenická purpura (ITP) je autoimunitní onemocnění charakterizované izolovanou trombocytopenií, ale může být i součástí základního onemocnění, např. SLE či infekce HIV. Základem léčby je imunosuprese, imunomodulace, splenektomie a terapie agonisty trombopoetinového receptoru.
Rituximab prokázal účinnost také u ITP, ale není oficiálně schválen, nicméně je poměrně často používán. Jeho užití je off label ve specializovaných centrech. Mechanismus účinku způsobuje eliminaci B lymfocytů produkujících patologické protilátky, dochází k přerušení kostimulačního signálu pro CD4+ T lymfocyty a k inhibici a zahlcení fagocytujících buněk opsonizovanými B lymfocyty. Efekt je doložen u dospělých s primární ITP při podávání rituximabu v dávkování 375 mg/m2 týdně po dobu čtyř týdnů. Zkoušely se i nižší dávky – podávání 100 mg i.v. týdně bez ohledu na hmotnost celkem po čtyři týdny [28,29]. V porovnání se standardní dávkou je rozdílem kratší trvání odpovědi, ale k získání jasných výsledků o vlivu dávky jsou nutné další studie.
Efekt rituximabu se hodnotil i u dětských pacientů s ITP, oproti podávanému vinkristinu byl doložen vyšší počet pozitivních léčebných odpovědí a nižší rekurence. Může se tak navodit řada měsíců bez trombocytopenie. Bezpečnostní profil je stejný jako u dospělých. U části dětí se vyvinula hypogamaglobulinemie, která v některých případech vyžadovala substituční léčbu [30]. Léčba je však také off label.
Farmakodynamické vlastnosti
Rituximab snižuje počet B lymfocytů v periferní krvi již od první dávky. U pacientů s hematologickou malignitou je pokles velmi rychlý (do tří dnů). V průběhu šesti měsíců po léčbě se počet B lymfocytů obnovuje a k normálu se vrací během 12 měsíců po ukončení terapie. Hluboká deplece B lymfocytů byla pozorována u pacientů s revmatoidní artritidou po podání dvou infuzí rituximabu. Obnova začala obvykle od 24. do 40. týdne. U pacientů s granulomatózou s polyangiitidou a mikroskopickou polyangiitidou počet B lymfocytů po dvoutýdenním podávání infuzí klesal na méně než 10 buněk/µl [31]. Obnova začala až po šesti měsících s návratem po 12 měsících, respektive 18 měsících. U malého počtu pacientů dochází k obnově počtu B lymfocytů po delší době (trvající až dva roky i déle).
Dávkování
Velikost dávky a doba podávání závisí na druhu onemocnění. U lymfomů je doporučená dávka intravenózně 375 mg/m2 tělesného povrchu dle předepsaného chemoterapeutického režimu. Při léčbě CLL se podává v prvním cyklu 375 mg/m2 a v každém dalším cyklu se pokračuje dávkou 500 mg/m2. Standardní dávka není u CLL účinná pro nižší denzitu CD20 na leukemických lymfocytech a rychlé odstranění rituximabu z oběhu solubilním CD20.
V indikaci revmatoidní artritidy se podávají celkem dvě infuze 1 000 mg rituximabu s odstupem 14 dnů. Léčbu je možné zopakovat nejdříve za 24 týdnů, pokud přetrvává reziduální aktivita nemoci. Účinnost opakovaných cyklů je stejně dobrá jako při prvních cyklech. Rituximab zpomaluje i progresi revmatoidní artritidy. U pacientů, kde selhala léčba alespoň jedním anti TNF přípravkem, se terapie kombinuje s MTX.
U granulomatózy s polyangiitidou a mikroskopickou polyangiitidou se aplikují celkem čtyři dávky rituximabu 375 mg/m2 v odstupu jednoho týdne.
Způsob podávání
Intravenózní aplikace
Léčivo se může aplikovat pouze na specializovaném pracovišti pod dohledem zkušeného lékaře s návazností na další léčbu včetně resuscitace. Podání je možné ambulantně s monitorováním vitálních funkcí. Pro možný výskyt nežádoucích reakcí je nutno před každou dávkou podat premedikaci, obvykle antipyretikum a antihistaminikum. U hematologických malignit se přidává i glukokortikoid, pokud není součástí léčby. Délka první infuze by měla být 4–5 hodin. Pokud se nevyskytnou během aplikace nežádoucí reakce, lze od druhé dávky u pacientů s lymfomy dobu aplikace zkrátit na 90 minut. Úvodní rychlost by měla tedy být 50 mg/h. Pokud nedojde k reakci, lze po 30 minutách zvýšit rychlost o 50 mg/h a takto pokračovat vždy po 30 minutách až do maximální rychlosti 400 mg/h. Následné infuze lze podávat úvodní rychlostí 100 mg/h a po 30 minutách zvyšovat postupně až do nejvyšší rychlosti 400 mg/h.
Pacientům s revmatoidní artritidou se doporučuje premedikace 100 mg metylprednisolonu i.v. [32,33]. Pokud se při podání první dávky nevyskytnou potíže, mohou být druhá a další následné infuze podány ve zrychleném režimu při použití stejné koncentrace jako u předchozích infuzí (4 mg/ml v objemu 250 ml). Počáteční rychlost infuze je 250 mg/h prvních 30 minut a pak 600 mg/h následujících 90 minut.
Při diagnóze granulomatózy s polyangiitidou nebo při mikroskopické polyangiitidě je vhodné podat i.v. 1 000 mg metylprednisolonu 1–3 dny před první infuzí rituximabu. Poslední dávka může být aplikována v den infuze. Na ni by mělo navazovat perorální podávání, maximálně však 80 mg denně, a postupné snižování dávek metylprednisolonu dle klinického stavu.
Subkutánní aplikace
V hematoonkologické indikaci je možné aplikovat lék i subkutánně (s.c.) ve fixní dávce 1 400 mg pro NHL od roku 2014 a 1 600 mg pro CLL od roku 2016. Tento způsob podání byl ověřován řadou multicentrických studií (SparkThera, SABRINA, MabEase, PrefMab, Sawyer). Rituximab s.c. se používá u dospělých pacientů k léčbě B nehodgkinských lymfomů a CLL:
- u dosud neléčených nemocných s FL III. a IV. klinického stadia v kombinaci s chemoterapií,
- v udržovací léčbě u pacientů s FL, kteří odpovídají na indukční léčbu,
- v kombinaci s chemoterapií CHOP u pacientů s CD20 pozitivním DLBCL,
- u dosud neléčených nebo relabujících/refrakterních pacientů s CLL.
První dávka rituximabu musí být ale vždy podána i.v.; pokud pacient snáší léčivo dobře, lze další dávky podat s.c. K tomuto podání je dostupný přípravek v síle 1 400 mg pro NHL nebo 1 600 mg pro CLL s.c., který nelze zaměňovat za léčivo 100 mg a 500 mg určené k i.v. podání [31]. Bezpečnostní profil je srovnatelný s přípravkem pro infuzní podání s výjimkou reakcí v místě vpichu (bolest, otok, ztuhnutí, krvácení, erytém, pruritus, vyrážka). Výhodou je kratší doba aplikace bez nutnosti nitrožilního přístupu [34]. Doba aplikace se pohybuje v rozmezí 6−10 minut. Není třeba přepočítávat a upravovat dávky, aplikuje se vždy stejná dávka 1 400 mg nebo 1 600 mg. Hlavní nevýhodou je vyšší bolestivost v místě podání. Extracelulární matrix podkoží pojme 1–2 ml, ale při podání 11 ml dojde k poškození podkožní tkáně a to způsobí bolest. Obsažený enzym hyaluronidáza (rHuPH20) pomáhá rozvolnění podkoží, zajišťuje dobrou vstřebatelnost a tím i optimální biologickou dostupnost [35]. Významnou potenciální časovou úsporu oceňuje nejen zdravotnický personál, ale i samotní pacienti, a proto tuto formu podání preferují. Uskutečněné studie ukazují vyšší počet kompletních remisí. Podkožní aplikace je nadějnou formou podání léku s řadou časových úspor, která je zároveň i bezpečná, účinná a srovnatelná s i.v. podáním. Potencionálně snižuje toto podání i riziko vzniku chyb v dávkování a je alternativou pro pacienty se špatným venózním přístupem.
Bezpečnost léčby a nežádoucí
reakce
Rituximab je poměrně dobře snášen a patří mezi relativně málo toxická léčiva i při podávání po delší dobu. Aplikace může být provázena řadou nežádoucích účinků, jako je akutní cytokinová reakce při nebo po infuzi. Uvolněný interleukin 6 a TNFα způsobuje třesavku, teplotu, nevolnost. Reakci lze zmírnit podáním premedikace a rovněž zpomalením či přerušením infuze. Frekvence výskytu vedlejších reakcí se obvykle snižuje s podáváním dalších infuzí léku. Mezi další nežádoucí reakce patří zvracení, hypotenze, urtika, vyrážka, slabost, svědění kůže, bolest hlavy, dušnost, bronchospasmus, otok jazyka a hrdla, iritace hrdla, rýma, pocit návalů horka a syndrom nádorového rozpadu. V revmatologické indikaci se objevuje vedle infuzní reakce nejčastěji bolest hlavy, hypertenzní reakce, nauzea, pruritus, kopřivka a zčervenání.
Z mechanismu účinku vyplývá i určité riziko infekčních komplikací. Nebyl pozorován vzestup výskytu oportunních infekcí, TBC či reaktivace TBC infekce. U pacientů s anamnézou opakovaných a chronických infekcí rituximab zvyšuje náchylnost k závažné infekci. Nejčastěji jsou popisovány infekce respiračního traktu. Rituximab by neměl být podáván při probíhající akutní infekci, jakou je např. sepse, oportunní infekce, tuberkulóza.
V doporučeních je monitorace hodnot imunoglobulinů (Ig) v rozmezí tří měsíců, přestože většinou zůstávají v mezích normy i přes pokles koncentrace B lymfocytů, neboť plazmatické buňky přežívají [4]. U pacientů s hematologickou malignitou je však často přítomna hypoglobulinemie i před léčbou. Aplikace rituximabu může tento stav prohloubit. Byl popsán ojedinělý případ sedm let trvajícího poklesu hodnot IgG, IgM a IgA po kombinaci rituximabu s chemoterapií [36]. Rizikem je hlavně dlouhodobá terapie rituximabem.
Vyskytly se i případy reaktivace hepatitidy B a PML [37,38]. Ve druhém případě se sice jedná o vzácné demyelinizační onemocnění centrálního nervového systému, ale při propuknutí může vést k těžké invaliditě, nebo dokonce k úmrtí. Byly popsány případy PML, z toho většina u onkologické léčby a méně u léčby autoimunitních chorob. Většina pacientů s tímto nežádoucím účinkem byla léčena dalšími imunosupresivními léky. PML se vyskytuje u pacientů s těmito diagnózami i bez léčby rituximabem.
Pro možný výskyt pozdní neutropenie (dle literatury až 8 %) je vhodné monitorovat i krevní obraz. Kritériem neutropenie je pokles počtu neutrofilů na méně než 1,0 × 109/l v trvání alespoň čtyř týdnů od aplikace rituximabu. Tento nežádoucí jev se může rozvinout v průběhu 1–12 měsíců od zahájení léčby. Granulocytární růstové faktory nejsou při nekomplikovaném průběhu podávány. Vyhrazeny jsou pro systémové infekční komplikace.
Rezistence
Část pacientů vyvíjí klinickou rezistenci a dochází k progresi, respektive k relapsu při léčbě nebo do šesti měsíců od aplikace poslední dávky. Přesný mechanismus vzniku rezistence kromě obecných principů není znám. Mezi možné příčiny může patřit vymizení antigenu CD20, přítomnost antagonistických molekul CD55 a CD59, polymorfismus Fcγ části receptoru IgG.
Závěr
Zavedení rituximabu do klinické praxe představuje milník v léčbě lymfomů. Dramaticky mění výsledky léčby a osud nemocných. Stává se standardem léčby CD20 pozitivních NHL a prodlužuje medián celkového přežití. Přináší zásadní obrat a znamená velký pokrok v léčbě řady dalších onemocnění. Účinný je tam, kde B lymfocyty hrají důležitou roli v patogenezi. Po navázání rituximabu na buněčný povrch dochází ke smrti B buněk. Rituximab vede k přechodné depleci B lymfocytů související se snížením/vymizením patologických (auto)protilátek. Tohoto efektu se využívá v léčbě autoimunitních onemocnění, ale často v režimu off label. V revmatologii bylo prokázáno, že rituximab v kombinaci s MTX snižuje rychlost progrese kloubního poškození a zlepšuje fyzické funkce. Mezi další choroby, kde se zdá být rituximab účinný a nachází uplatnění, i když mimo schválené indikace, se řadí například ITP, autoimunní hemolytická anémie, dermatomyozitida, SLE, roztroušená skleróza. Další možné indikace jsou předmětem budoucího výzkumu a klinických studií.
Nové formy podání vedou k velkým časovým úsporám pro zdravotnický personál i samotné pacienty, kdy nemusejí mít zavedený port či katétr. Snižuje se riziko vzniku infekcí a sepse. Subkutánní podání představuje pohodlnější aplikační formu, která vede k větší spokojenosti pacientů.
Rituximab je lékem určeným pro cílenou, méně toxickou terapii s vyšší specifitou účinku, která zlepšuje kvalitu života a přináší mnoha nemocným naději na zlepšení výsledků jejich léčby. Cíleným ovlivněním cytokinů a buněčných populací rychle a účinně navodí dlouhotrvající remisi onemocnění. Světová zdravotnická organizace (WHO) zařadila v roce 2015 rituximab do Seznamu základních léčiv.
Seznam použité literatury
- [1] Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256: 495–497.
- [2] Papajík T, Faber E, Indrák K. Nové směry a perspektivy v léčbě hematologických malignit. Interní Med 2003; 2: 71–77.
- [3] Belada D. Monoklonální protilátky v léčbě lymfomů. Remedia 2008; 18: 416–423.
- [4] Vášová I, Mayer J, Navrátil M. Rituximab v léčbě lymfoproliferativních onemocnění. Trendy ve farmakoterapii. Příloha Zdravotnických novin 2002; 3: 7–9.
- [5] McLaughlin P. Rituximab perspective on single agent experience and future directions in combination trials. Crit Rev Oncol Hematol 2001; 40: 3–16.
- [6] Salles G, Barrett M, Foà R, et al. Rituximab in B‑cell hematologic malignancies: a review of 20 years of clinical experience. Adv Ther 2017; 34: 2232–2273.
- [7] Salles G, Seymour JF, Offner F, et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): a phase 3, randomised controlled trial. Lancet 2011; 377: 42–51.
- [8] Salles GA, Seymour JF, Feugier P, et al. Updated 6‑year follow‑up of the PRIMA study confirms the benefit of 2‑year rituximab maintenance in follicular lymphoma patients responding to frontline immunochemotherapy. Blood 2013; 122: 509.
- [9] van Oers MH, Klasa R, Marcus RE, et al. Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non‑Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood 2006; 108: 3295–3301.
- [10] Pfreundschuh M, Kuhnt E, Trumper L, et al. CHOP‑like chemotherapy with or without rituximab in young patients with good‑prognosis diffuse large‑B‑cell lymphoma: 6‑year results of an open‑label randomised study of the MabThera International Trial (MInT) Group. Lancet Oncol 2011; 12: 1013–1022.
- [11] Fischer K, Bahlo J, Fink AM, et al. Long‑term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood 2016; 127: 208–215.
- [12] Robak T, Dmoszynska A, Solal‑Céligny P, et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression‑free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28: 1756–1765.
- [13] Gause A, Bereck C. The role of B cells in the pathogenesis of rheumatoid arthritis. Potential implications for treatment. Bio Drugs 2001; 15: 73–79.
- [14] Taylor R, Lindorfer MA. Drug insight: the mechanism of action of rituximab in autoimmune disease – the immune complex decoy hypothesis. Nature Clin Pract Rheumatol 2007; 3: 86–95.
- [15] Emery P, Fleischmann R, Filipowicz‑Sosnowska A, et al. The efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexat treatment: results of a phase IIB randomized, double‑blind, placebo‑controlled, dose‑ranging trial. Arthritis Rheum 2006; 54: 1390–1400.
- [16] Cohen SB, Emery P, Greenwald MW, et al. Rituximab for rheumatoid arthritis refractory to nati‑tumor necrosis factor therapy. Results of a multicenter, randomized, double‑blind, placebo‑controlled, phase III trial evaluating primary efficacy and safety at twenty‑four weeks. Arthritis Rheum 2006; 54: 2793–2806.
- [17] Keogh KA, Ytterberg SR, Fervenza FC, et al. Rituximab for refractory Wegener's granulomatosis: report of a prospective, open‑label pilot trial. Am J Respir Crit Care Med 2006; 173: 180–187.
- [18] Stasi R, Stipa E, Del Poeta G, et al. Long‑term observation of patients with anti‑neutrophil cytoplasmic antibody‑associated vasculitis treated with rituximab. Rheumatology 2006; 45: 1432–1436.
- [19] Falk RJ, Jennette C. Rituximab in ANCA‑associated disease. N Engl J Med 2009; 361: 11–21.
- [20] Terrier B, Pagnoux C, Perrodeau E, et al. Rituximab Versus Azathioprine to Maintain Remission of ANCA Associated Vasculitides (MAINRITSAN): Follow up at 60 Months [abstract]. Arthritis Rheumatol 2016; 68(Suppl 10).
- [21] Driver CB, Ishimori M, Weismam MH. The B cell in systemic lupus erythematosus: a rational target for more effective therapy. Ann Rheum Dis 2008; 67: 1374–1381.
- [22] Rovin BH, Furie R, Latinis K, et al. Efficacy and safety of rituximab in patients with active proliferative lupus nephritis: The Lupus Nephritis Assessment with Rituximab (LUNAR) Study. Arthritis Rheum 2012; 64: 1215–1226.
- [23] Merrill JT, Neuwelt CM, Wallace DJ, et al. Efficacy and safety of rituximab in moderately‑to‑severely active systemic lupus erythematosus: the randomized, double‑blind, phase II/III systemic lupus erythematosus evaluation of rituximab trial. Arthritis Rheum 2010; 62: 222–233.
- [24] Hauser SL, Waubant E, Arnold DL, et al.; HERMES Trial Group. B‑cell depletion with rituximab in relapsing–remitting multiple sclerosis. N Engl J Med 2008; 358: 676–688.
- [25] Naismith RT, Piccio L, Lyons JA, et al. Rituximab add‑on therapy for breakthrough relapsing multiple sclerosis: a 52‑week phase II trial. Neurology 2010; 74: 1860–1867.
- [26] Stellmann JP, Krumbholz M, Friede T, et al. (Neuromyelitis Optica Study Group). Immunotherapies in neuromyelitis optica spectrum disorder: efficacy and predictors of response. J Neurol Neurosurg Psychiatry 2017; 88: 639–647.
- [27] Agarwal A, Hall RP, Bañez LL, Cardones AR. Comparison of rituximab and conventional adjuvant therapy for pemphigus vulgaris: a retrospective analysis. PLOS One 2018; 13: e0198074.
- [28] Zaja F, Vianelli N, Volpetti S, et al. Low‑dose rituximab in adult patients with primary immune thrombocytopenia. Eur J Haematol 2010; 85: 329–334.
- [29] Zaja F, Battista ML, Pirrotta MT, et al. Lower dose rituximab is active in adults patients with idiopathic thrombocytopenic purpura. Haematologica 2008; 93: 930–933.
- [30] Dai WJ, Zhang RR, Yang XC, Yuan YF. Efficacy of standard dose rituximab for refractory idiopathic thrombocytopenic purpura in children. Eur Rev Med Pharmacol Sci 2015; 19: 2379–2383.
- [31] Souhrn údajů o přípravku MabThera, http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑Product_Information/human/000165/WC500025821.pdf, navštíveno 22. 2. 2019.
- [32] Pavelka K. Rituximab v léčbě revmatoidní artritidy. Remedia 2007; 17: 440–447.
- [33] Bečvář R, Vencovský J, Němec P, et al. Doporučení České revmatologické společnosti pro léčbu revmatické artritidy. Účinnost a strategie léčby. Čes Revmatol 2007; 15: 73–90.
- [34] Rule S, Collins G, Samanta K. Subcutaneous vs intravenous rituximab in patients with non‑Hodgkin lymphoma: a time and motion study in the United Kingdom. Journal of Medical Economics 2014; 17: 459–468.
- [35] Shpilberg O, Jackisch C. Subcutaneous administration of rituximab (MabThera) and trastuzumab (Herceptin) using hyaluronidase. Br J Cancer 2013; 109: 1556–1561.
- [36] Worch J, Makarova O, Burkhardt B. Immunreconstitution and infectious complications after rituximab treatment in children and adolescents: what do we know and what can we learn from adults? Cancers (Basel) 2015; 7: 305–328.
- [37] Ryšavá R. Možnosti použití biologické léčby u nemocných s glomerulárními chorobami. Urol praxi 2012; 13: 246–252.
- [38] Pelosini M, Focosi D, Rita F, et al. Progressive multifocal le ukoencephalopathy: report of three cases in HIV‑ negative hematological pati ents and revi ew of literature. Ann Hematol 2008; 87: 405– 412.