Riziko osteoporotických zlomenin u pacientů s roztroušenou sklerózou
Souhrn:
Zikán V. Riziko osteoporotických zlomenin u pacientů s roztroušenou sklerózou. Remedia 2021; 31: 524–528.
Je nepochybné, že roztroušená skleróza (RS) je spojena s významně zvýšeným rizikem výskytu osteoporózy a zlomenin. Rozvoj osteoporózy u pacientů s RS může souviset s kumulativními účinky řady faktorů. Fyzická neaktivita a snížené mechanické zatížení skeletu jsou pravděpodobně hlavním faktorem přispívajícím k rozvoji osteoporózy. Snížená svalová síla, poruchy svalové koordinace a rovnováhy navíc významně zvyšují riziko pádů. K úbytku kostní hmoty může přispívat i deficit vitaminu D a léčba glukokortikoidy. Některé faktory, které mohou přispívat ke zvýšenému riziku výskytu osteoporózy a zlomenin, zatím nebyly dostatečně studovány, včetně zánětu a střevní mikrobioty, autonomní dysfunkce, únavy a deprese. Hodnocení denzity kostního minerálu a rizika zlomenin by proto mělo být nedílnou součástí komplexního vyšetření u nemocných s RS.
Summary:
Zikan V. Risk of osteoporotic fractures in multiple sclerosis. Remedia 2021; 31: 524–528.
There is mounting evidence that multiple sclerosis (MS) is associated with a significantly increased risk of osteoporosis and fractures. The development of osteoporosis in MS patients can be related to the cumulative effects of various factors. Physical inactivity and reduced mechanical load on the bones is likely the major contributing factor for osteoporosis in MS. Additional possible factors leading to reduced bone mass are low vitamin D levels and medications such as glucocorticoids. In addition, decreased muscle strength and coordination and balance disorders significantly increase the risk of falls. Some factors that may contribute to increased risk of osteoporosis and fractures have been understudied, including inflammation and gut microbiome, autonomic dysfunction, fatigue, and depression. Therefore, bone mineral density and fracture risk assessment should be a part of the integral management of persons with MS.
Key words: osteoporosis, risk of fractures, multiple sclerosis
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé onemocnění centrálního nervového systému (CNS), v jehož patogenezi se uplatňují jak autoimunitní děje, tak následná neurodegenerace. Incidence RS se udává 3-7 osob na 100 000 obyvatel a prevalence 100–120 osob na 100 000 obyvatel [1]. Klinická symptomatologie je u pacientů s RS velmi rozmanitá: poruchy zraku, poruchy rovnováhy a sfinkterů, kognitivní deficit, poruchy čití a hybnosti [2]. Osteoporóza a zlomeniny se vyskytují u pacientů s RS častěji než ve zdravé populaci [3]. Zlomeniny jsou přitom zvláště závažné, jelikož mají za následek další zhoršení hybnosti i kvality života a dále prohlubují závislost postižených osob na dopomoci. Dosud nebyla diagnóza RS formálně integrována do nástrojů pro hodnocení rizika zlomenin a nejsou jednotné doporučené postupy, které by pomáhaly v rozhodování, jak a kdy sledovat a léčit osteoporózu u RS.
Patogeneze a rizikové faktory osteoporózy a zlomenin u RS
Kvalita a množství kostní hmoty u dospělých osob závisí na věku, genetické dispozici a dalších převážně modifikovatelných faktorech, jako jsou fyzická aktivita, tělesná hmotnost, výživa, hormonální stav nebo toxické vlivy prostředí. Centrální zánětlivé a neurodegenerativní procesy u RS vedou k motorickému deficitu, poruchám autonomního nervového systému a k poškození neurální a neurohumorální regulace kostní remodelace [4]. U pacientů s RS se na rozvoji osteoporózy podílí zejména progredující hybný deficit s omezením chůze [2,5,6]. Pacienti s hybným deficitem a s omezením chůze mají sníženou denzitu kostního minerálu (bone mineral density, BMD) především v oblasti kyčle a téměř třikrát vyšší riziko zlomenin kyčle ve srovnání s nemocnými bez poruchy chůze [7-9]. K vyšší prevalenci zlomenin u pacientů s RS přispívá zvýšené riziko pádů v důsledku hybného deficitu a ztráty svalové síly a koordinace a poruchy rovnováhy [6]. Vyšší riziko pádů může být spojeno také s nedostatkem vitaminu D a s léčbou glukokortikoidy (GK), která má katabolické účinky na svalovou tkáň. Nedostatek vitaminu D byl dokumentován častěji, zejména u pacientů s vyšším stupněm motorického deficitu [10]. Nedostatečné sérové koncentrace 25 hydroxyvitaminu D (25[OH]D < 75 nmol/l v populaci bez RS) přispívají k rozvoji sekundární hyperparatyreózy a k úbytku kostní hmoty [11]. Nedostatek vitaminu D vede i ke snížení svalové síly. Svalová síla je nezbytná pro udržení rovnováhy mezi tvorbou kosti a její resorpcí. Receptor pro vitamin D je vysoce exprimován také v tenkém a v tlustém střevě. Experimentální práce ukazují, že vitamin D má důležitou roli při udržování integrity střevní bariéry a jeho nedostatek vede ke střevní dysbióze a narušení střevní bariéry [12]. Dlouhodobá léčba GK není u RS tak častá vzhledem k dostupnosti moderních imunomodulačních léků. Za rizikové z hlediska zlomenin se však považují již dávky 2,5 mg prednisonu za den, pokud jsou podávány déle než šest měsíců. U pacientů s RS je časté užití pulzní léčby vysokou dávkou GK po dobu 3–5 dní v době akutní exacerbace (ataky) onemocnění. Byť pulzní léčba GK hluboce potlačuje kostní novotvorbu a zvyšuje přechodně kostní resorpci, po jejím ukončení dochází k rychlému vzestupu ukazatelů kostní novotvorby. Opakované podání i.v. pulzu metylprednisolonu během 12 měsíců neprokázalo významný úbytek BMD [13], ale nelze vyloučit, že častější podání zhorší kostní kvalitu a zvýší riziko zlomenin.
Imunologické změny u RS jsou charakterizovány zvýšením počtu prozánětlivých buněk, jako jsou CD4+ T lymfocyty, monocyty, makrofágy, zánětlivé dendritické buňky a B lymfocyty, a poklesem počtu CD8+ T lymfocytů a CD4+ CD25+ FoxP3+ regulačních T lymfocytů [14]. Aktivované T lymfocyty exprimují prozánětlivé cytokiny, především tumor nekrotizující faktor alfa (TNFα), interleukin 1 (IL 1), IL 6 a IL 11, které dále stimulují expresi RANKL (ligand pro receptor aktivující nukleární faktor kappa B) v kostním mikroprostředí. RANKL produkují i samotné aktivované T lymfocyty. Nadbytek RANKL vede k vyšší aktivaci osteoklastů a zvýšené kostní resorpci.
Experimentální práce ukázaly, že existují vzájemné interakce mezi střevní mikrobiotou, střevní bariérou a imunitním systémem, jež se mohou uplatňovat v patofyziologii jak RS [12], tak osteoporózy [15]. Fyziologická mikrobiota má lokální i systémové protizánětlivé účinky a vytváří chemické substance, které ovlivňují enterické neurony i funkce CNS. U pacientů s RS byly dokumentovány významné změny střevní mikrobioty (střevní dysbióza), zvýšená permeabilita střev a změny metabolismu žlučových kyselin [16,17]. Objasnění významu střevního mikrobiomu ve vztahu k imunitnímu systému a kostní remodelaci u RS nepochybně vyžaduje další experimentální a klinický výzkum.
Současná imunomodulační léčba může mít příznivé účinky na kostní metabolismus. Interferon beta (IFNβ) potlačuje osteoklastogenezi a diferenciaci osteoklastů a dlouhodobá léčba IFNβ nemá negativní vliv na BMD. Fingolimod (FTY720) je analog sfingosinu, který moduluje receptory pro sfingosin 1 fosfát nejen na lymfoidní a nervové tkáni, ale uplatňuje se i v patogenezi mnoha dalších onemocnění, včetně osteoporózy, kde potlačuje osteoresorpci [18].
Objevy, které ukázaly, že na regulaci kostní hmoty se přímo podílejí i CNS a neurohumorální systém, přinesly nový pohled i na patogenezi osteoporózy, která je chápána jako neuroskeletální onemocnění. CNS komunikuje s osteoblasty (a pravděpodobně i s osteocyty) pomocí sympatického nervového systému. Autonomní dysfunkce u RS vede k výskytu řady klinických příznaků, např. k poruchám spánku, kognitivní dysfunkci nebo depresi. Epidemiologické studie svědčí o zvýšené prevalenci depresivních poruch a úzkosti u pacientů s RS. Deprese je spojena s dysfunkcí imunitního systému, s narušením cirkadiánního rytmu řady hormonů a s aktivací sympatického nervového systému. Deprese a/nebo léčba antidepresivy rovněž zvyšuje riziko pádů. Bylo zjištěno, že s vyšším rizikem rozvoje osteoporotických fraktur je spojeno užívání antidepresiv s vysokou afinitou k 5 HTT (5 hydroxytryptamin reuptake transporter) [19]. Mezi častěji užívaná léčiva u RS, která podmiňují zvýšené riziko zlomenin, patří také benzodiazepiny a některá antiepileptika nebo dlouhodobá léčba inhibitory protonové pumpy.
Hodnocení rizika zlomenin
Jelikož BMD nehodnotí kvalitu kosti, je vhodné posuzovat BMD společně s klinickými rizikovými faktory, které vypovídají nepřímo o kvalitě kosti (tab. 1). U postmenopauzálních žen a u mužů bez RS ve věku 40–90 let se osvědčuje využití kalkulátoru FRAX (Fracture Risk Assessment Tool; http://www.shef.ac.uk/FRAX), který hodnotí individuální pravděpodobnost prodělat jednu z hlavních osteoporotických zlomenin (kyčle, klinické zlomeniny obratle, humeru a zápěstí) nebo zlomeninu kyčle v následujících 10 letech. U pacientů s RS nejsou zatím při výpočtu FRAX zohledněny klinicky významné rizikové faktory, jako jsou hybný deficit, poruchy rovnováhy a riziko pádů, tedy FRAX ve skutečnosti u nemocných s RS podhodnocuje riziko zlomenin [20,21].
Jako praktické se ukazuje hodnocení stavu disability pomocí Kurtzkeho škály (Expanded Disability Status Scale, EDSS), jelikož je hodnocena zejména schopnost chůze, jejíž omezení je samo o sobě významným rizikovým faktorem výskytu zlomenin. EDSS navíc koreluje se ztrátou svalové hmoty a s rizikem pádů. Hodnota EDSS ≥ 6 je považována za práh, od nějž je vždy indikováno vyšetření BMD. Už hodnota EDSS 6 je totiž ve většině případů spojena s nevratnou progresí motorického postižení, při EDSS ≥ 6 významně klesá BMD v proximálním femuru a významně se zvyšuje riziko výskytu pádů a zlomenin. Další výzkum je nezbytný k zodpovězení otázky, zda i lehčí omezení schopnosti chůze (EDSS ≥ 4) neznamená, zvláště v kombinaci s dalšími rizikovými faktory, vyšší riziko úbytku kostní a svalové hmoty a nárůstu výskytu zlomenin. Hybný deficit a snížená fyzická aktivita dále přispívají k úbytku svalové hmoty a síly. Anamnéza opakovaných pádů v běžné populaci zvyšuje riziko zlomenin přibližně dvojnásobně, u pacientů s RS může být toto riziko ještě vyšší. Hodnocení svalové síly a poruchy rovnováhy by mělo být nedílnou součástí vyšetření u pacientů s RS. K vyššímu riziku pádů mohou přispívat i některé léky, např. anxiolytika a hypnotika.
Diagnostika a diferenciální diagnostika
Vyhodnocení stavu skeletu a rizika
zlomenin by mělo být nedílnou součástí plánu péče o pacienty
s RS, a to nejen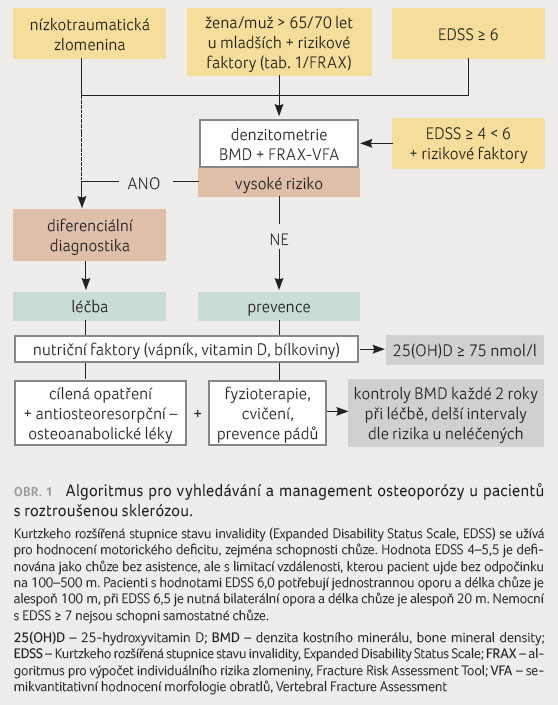 u žen po menopauze a u mužů
starších 70 let, ale i u mladších osob při vyšším
stupni motorického postižení (EDSS ≥ 6) nebo pokud
jsou přítomny další rizikové faktory (obr. 1). Anamnéza
je důležitá k vyloučení možných sekundárních příčin
osteoporózy a zahrnuje rodinnou anamnézu nízkotraumatických
zlomenin v první linii příbuzných a osobní anamnézu
klinických rizikových faktorů osteoporózy a zlomenin
(tab. 1). Fyzikální vyšetření je zaměřeno
na klinické příznaky osteoporózy a na onemocnění, jež
vedou k sekundární osteoporóze. Standardní metodou pro
diagnostiku osteoporózy je měření BMD pomocí dvouenergiové
rentgenové absorpciometrie (Dual-Energy X Ray Absorptiometry,
DXA) v oblasti bederní páteře a celkového proximálního
femuru a krčku femuru. DXA umožňuje včas diagnostikovat
osteoporózu, resp. zvýšené riziko výskytu zlomenin. Nízká BMD
v pásmu osteoporózy je u postmenopauzálních žen a mužů
ve věku nad 50 let definována jako T skóre ≤ -2,5
směrodatné odchylky (SD). U premenopauzálních žen a u mužů
mladších 50 let je doporučeno hodnotit Z skóre. Hodnoty
Z skóre ≤ −2,0 SD se považují
za „významně snížené vzhledem ke kalendářnímu věku“.
Pro spolehlivou diagnózu osteoporózy u mladých dospělých
osob je však vyžadována jak nízká BMD (Z skóre ≤ 2
SD), tak současná přítomnost nízkotraumatických zlomenin nebo
sekundárních faktorů a klinických stavů, jež vedou
k úbytku kostní hmoty a zvyšují riziko výskytu
zlomenin.
u žen po menopauze a u mužů
starších 70 let, ale i u mladších osob při vyšším
stupni motorického postižení (EDSS ≥ 6) nebo pokud
jsou přítomny další rizikové faktory (obr. 1). Anamnéza
je důležitá k vyloučení možných sekundárních příčin
osteoporózy a zahrnuje rodinnou anamnézu nízkotraumatických
zlomenin v první linii příbuzných a osobní anamnézu
klinických rizikových faktorů osteoporózy a zlomenin
(tab. 1). Fyzikální vyšetření je zaměřeno
na klinické příznaky osteoporózy a na onemocnění, jež
vedou k sekundární osteoporóze. Standardní metodou pro
diagnostiku osteoporózy je měření BMD pomocí dvouenergiové
rentgenové absorpciometrie (Dual-Energy X Ray Absorptiometry,
DXA) v oblasti bederní páteře a celkového proximálního
femuru a krčku femuru. DXA umožňuje včas diagnostikovat
osteoporózu, resp. zvýšené riziko výskytu zlomenin. Nízká BMD
v pásmu osteoporózy je u postmenopauzálních žen a mužů
ve věku nad 50 let definována jako T skóre ≤ -2,5
směrodatné odchylky (SD). U premenopauzálních žen a u mužů
mladších 50 let je doporučeno hodnotit Z skóre. Hodnoty
Z skóre ≤ −2,0 SD se považují
za „významně snížené vzhledem ke kalendářnímu věku“.
Pro spolehlivou diagnózu osteoporózy u mladých dospělých
osob je však vyžadována jak nízká BMD (Z skóre ≤ 2
SD), tak současná přítomnost nízkotraumatických zlomenin nebo
sekundárních faktorů a klinických stavů, jež vedou
k úbytku kostní hmoty a zvyšují riziko výskytu
zlomenin.
U pacientů s RS je vhodné přihlédnout k hybnému deficitu, a tedy k rozdílům v úbytku BMD mezi bederní páteří a proximálním femurem a zvažovat i stranovou diferenci BMD u hemiparetických pacientů. Pro posouzení přítomnosti zlomenin obratlů lze s výhodou užít boční projekci páteře v rozsahu T4-L4 pomocí DXA (tzv. Vertebral Fracture Assessment, VFA). Standardem je radiologické vyšetření páteře. U pacientů s RS, zvláště při paraplegii, musíme pomýšlet i na netypicky se manifestující zlomeniny proximálního femuru. Diferenciálně diagnostické vyšetření, jehož součástí je i laboratorní vyšetření, je nezbytné provést u všech pacientů s nálezem ní
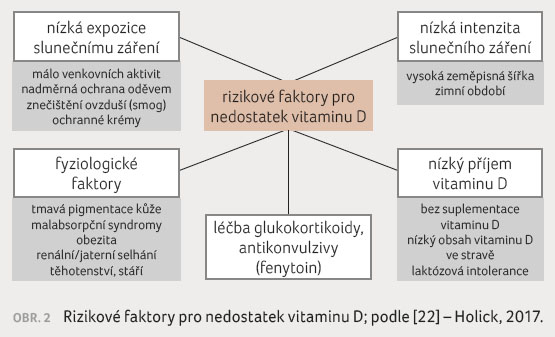
zké BMD a/nebo zlomeniny po nepřiměřeně malé zátěži a vyloučit tak možné sekundární příčiny úbytku BMD a/nebo jiné metabolické nebo nádorové onemocnění. U nemocných s RS je důležité neopomenout i vyšetření hodnoty 25(OH)D, případně pohlavních hormonů při podezření na hypogonadismus. Rizikové faktory pro nedostatek vitaminu D jsou uvedeny na obrázku 2 [22].
Prevence osteoporózy a zlomenin
Důležitá je snaha o zajištění přiměřené pravidelné fyzické aktivity, a to jednak cvičením, které zatěžuje skelet a stimuluje osteocyty a osteoblasty k novotvorbě kostní hmoty, jednak cvičením, které pomáhá upravit svalovou koordinaci, a snižuje tak riziko pádů. Pravidelné cvičení zlepšuje u pacientů s RS kvalitu života, přispívá k odstranění únavy a depresivní symptomatiky a také snižuje strach z pádu. Krátkodobé programy cvičení ukázaly objektivní zlepšení svalové síly dolních končetin a prodloužila se vzdálenost, kterou pacienti ujdou. Důležité je nezapomínat i na možný vliv léků, jako jsou například anxiolytika nebo hypnotika, jež mohou přispívat k vyššímu riziku pádů [21].
V prevenci osteoporózy doporučujeme dostatečný příjem vápníku a kvalitních bílkovin. Zejména mléčné výrobky zajišťují kromě vápníku rovněž proteiny, draslík a hořčík a fermentované mléčné výrobky obsahují také prebiotika a probiotika. Doporučený denní příjem vápníku (1 000 mg u premenopauzálních žen a u mužů ve věku do 70 let a 1 200 mg u postmenopauzálních žen a mužů starších 70 let) je vhodné zajistit u všech osob s RS. Mléčné výrobky mohou zajišťovat až 65 % doporučeného denního příjmu vápníku a 20–28 % požadavků na příjem bílkovin. Pro využití co největšího množství podaného vápníku je vhodné podávat vápník alespoň 2-3krát denně tak, aby jednotlivá dávka elementárního vápníku nepřekročila 500 mg. Na druhé straně, omezení příjmu vápníku může být nezbytné v některých případech hyperkalciurie a také při těžké imobilizaci, zvláště pokud se vyskytují další vlivy stimulující osteoresorpci (např. vyšší kostní obrat při deficitu sexagenů). Doporučovaný denní příjem bílkovin u osob starších 50 let činí 1,0-1,2 g/kg tělesné hmotnosti/den. Nedostatečný příjem bílkovin a nízký energetický příjem vedou k úbytku jak svalové, tak kostní hmoty a zvyšují riziko pádů a zlomenin.
Doporučený denní příjem vitaminu D 800 IU denně není v běžné potravě v ČR zajištěn (ani desetina doporučené denní dávky) a většina vitaminu D se tvoří v kůži pod vlivem UVB záření. Účinnost suplementace lze ověřit stanovením sérové koncentrace 25(OH)D. Cílové koncentrace 25(OH)D v populaci pacientů s RS nebyly stanoveny, ale v běžné populaci je doporučovanou cílovou hodnotou koncentrace 25(OH)D alespoň 75 nmol/l (75-150 nmol/l) [11,23]. Denní příjem až 4 000 IU vitaminu D se považuje za bezpečný u většiny populace s výjimkou nemocných s urolitiázou a při vyšší střevní absorpci vápníku (např. při sarkoidóze). Vyšší substituční dávka 6 000 IU denně může být potřebná po omezenou dobu k normalizaci sérových koncentrací 25(OH)D u pacientů s nedostatkem vitaminu D, zejména pokud jsou přítomny rizikové faktory (obr. 2). Algoritmus s doporučením pro suplementaci vitaminu D3 podle sérových koncentrací 25(OH)D je uveden na obrázku 3 [24]. Pro suplementaci vitaminu D je preferován
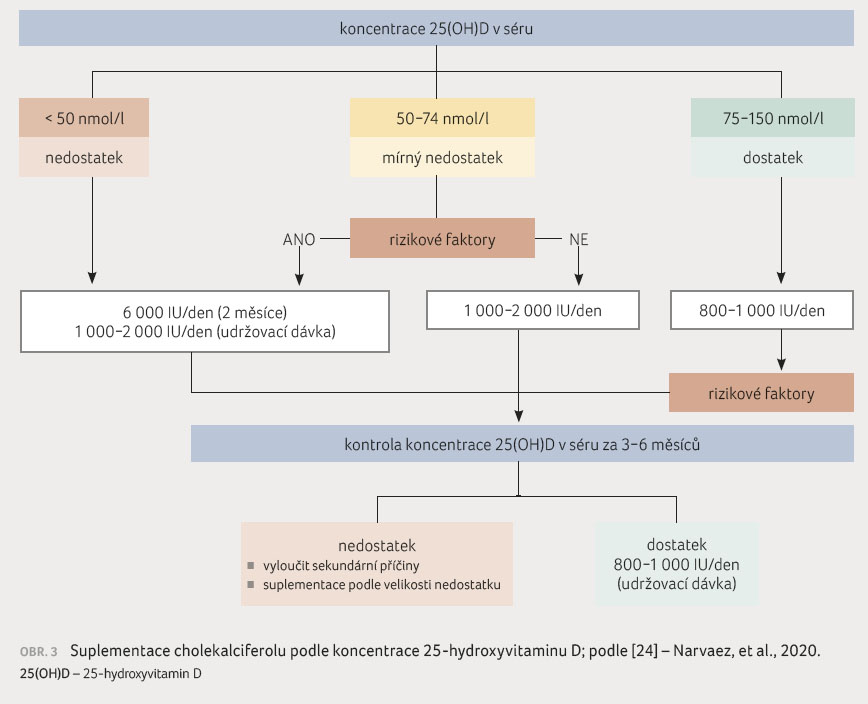
cholekalciferol (vitamin D3) před ergokalciferolem (vitamin D2). Nežádoucí účinky se mohou vyskytnout až při vyšším dávkování (hyperkalciurie až hyperkalcemie). Intermitentně podávané vysoké dávky vitaminu D (např. cholekalciferol 150 000 IU p.o. jednou za tři měsíce) nebyly účinné ve snížení rizika pádů, zlepšení mobility nebo zlepšení svalové síly u starších žen bez RS, ale bylo naopak dokumentováno vyšší riziko pádů a zlomenin [25,26].
Z dalších složek stravy je vhodné zajistit odpovídající příjem nenasycených tuků a esenciálních mastných kyselin, dostatečný příjem vlákniny, antioxidantů a omezit příjem zpracovaných potravin s vyšším obsahem chloridu sodného, fosfátů a jednoduchých cukrů a upravit případný nedostatek stopových prvků, minerálů a vitaminů (D, C a B). Recentní studie dokumentovaly významné spojení mezi stravovacími zvyklostmi a kvalitou života u pacientů s RS. U pacientů s RS jsou stravovací zvyklosti ovlivněny řadou faktorů, např. únavou, depresí, kognitivním deficitem, dysfagií a hybným deficitem. To může vést například k vyššímu příjmu energeticky bohatých tzv. rychlých jídel nebo tzv. pohodlných potravin, čímž se zvyšuje riziko rozvoje řady chronických metabolických chorob se zhoršením průběhu onemocnění a kvality života. Nevhodná strava má prozánětlivé účinky a vede ke střevní dysbióze, která se může významně uplatňovat v patogenezi jak RS, tak osteoporózy. Nové studie naznačují, že úprava střevní mikrobioty, např. pomocí probiotik a prebiotik, může být slibnou cestou v léčbě a prevenci nejen RS, ale i osteoporózy [15,27].
Farmakologická léčba
Cílem farmakologické intervence je prevence zlomenin. Většina léčiv je však primárně určena pro prevenci a léčbu postmenopauzální, resp. involuční osteoporózy a průkaz jejich účinnosti v randomizovaných klinických studiích u pacientů s RS zatím chybí. Přesto můžeme z hlediska patogeneze osteoporózy u RS očekávat, že tyto léky budou alespoň zčásti účinné. Byť chybějí prospektivní studie s užitím bisfosfonátů (BP) u pacientů s RS, řada klinických hodnocení svědčí pro účinnost BP při osteoporóze spojené s imobilizací. Bisfosfonáty zpomalují remodelaci kosti a redukují imobilizací navozenou hyperkalcemii. K možným častějším nežádoucím účinkům léčby BP patří iritace horní části zažívacího traktu. S ohledem na častější dysfagie horního typu u pacientů s RS lze s výhodou užít intravenózní formy BP (např. kyselina zoledronová). Bisfosfonáty se dlouhodobě akumulují ve skeletu a také pronikají skrze placentární bariéru, je tedy u žen ve fertilním věku nutná opatrnost. Denosumab je možností léčby i u pacientů s RS a osteoporózou, zejména při nesnášenlivosti nebo kontraindikaci léčby BP, i když podobně jako u léčby BP se jedná o užití tzv. off label. Výhodou této léčby může být dobrý průnik léku do kortikální kosti. Reverzibilita účinku denosumabu může být nevýhodou v případě vynechání další dávky, kdy dochází k rychlému úbytku BMD s nárůstem rizika výskytu vícečetných zlomenin obratlů, zejména u pacientů s těžkou osteoporózou.
Aminobisfosfonáty a denosumab potlačují remodelaci kosti a jejich nevýhodou zejména u pacientů, kteří mají poruchu hybnosti nebo dlouhodobě užívají GK, je další snížení kostního obratu na úroveň, jež může být nedostatečná pro normální obnovu kosti. U těchto pacientů je proto vhodné užití osteoanabolické léčby teriparatidem (PTH 1-34). Tato léčba může přímo kompenzovat hlavní patogenetický mechanismus GK indukované osteoporózy, útlum kostní novotvorby, z tohoto důvodu je tato léčba řádově účinnější než léčba BP [28]. Současná úhradová omezení však umožňují léčbu teriparatidem aplikovat jen u pacientů, kteří užívají GK v denní dávce odpovídající alespoň 5 mg prednisonu po dobu delší než šest měsíců, pokud je v oblasti bederní páteře nebo proximálního femuru T skóre ≤ -2,5 SD. Velmi slibné jsou výsledky experimentálních i klinických studií s protilátkou proti sklerostinu. Sklerostin ve zvýšené míře uvolňují osteocyty, není li skelet dostatečně zatěžován, a jeho nadbytek vede k útlumu kostní novotvorby. U žen po menopauze trpících osteoporózou byla léčba monoklonální protilátkou proti sklerostinu (romosozumabem) spojena s významným snížením rizika výskytu zlomenin obratlů v porovnání s placebem již po roce léčby [29]. Tato léčba by mohla být velmi účinnou variantou i u pacientů s RS a významným hybným deficitem.
Závěr
Zlomeniny jsou u pacientů s RS zvláště závažné, jelikož mají za následek další zhoršení hybnosti i kvality života a dále prohlubují závislost postižených osob na dopomoci. Vyhodnocení stavu skeletu a rizika zlomenin by mělo být nedílnou součástí plánu péče o pacienty s RS, a to i u mladších pacientů, zejména při vyšším stupni hybného deficitu (EDSS ≥ 6). Možnosti prevence ale začínají nepochybně již u mladších žen a mužů s lehčím stupněm motorického deficitu, zvláště pokud jsou přítomny další rizikové faktory. Včasná identifikace rizikových faktorů, které predisponují pacienta s RS k rozvoji osteoporózy a výskytu zlomenin, je odůvodněná, protože včasný zásah může významně snížit riziko výskytu zlomenin. Doporučené postupy pro diagnostiku a léčbu osteoporózy u pacientů s RS zatím nejsou jednotné. Hlubší poznání patogeneze osteoporózy u RS jistě přispěje i k lepší identifikaci rizikových osob a umožní včasné zahájení vhodných preventivních nebo léčebných opatření.
Publikace byla podpořena MZ ČR – RVO VFN64165.