Roflumilast v léčbě chronické obstrukční plicní nemoci
Roflumilast je léčivo, které účinkuje jako dlouhodobě působící selektivní inhibitor enzymu fosfodiesterázy 4 (PDE4). Potlačuje zánětlivou reakci v bronších u chronické obstrukční plicní nemoci (CHOPN), jak bylo prokázáno poklesem hladiny zánětlivých mediátorů ve sputu. Zlepšuje plicní funkce a snižuje počet exacerbací CHOPN. Roflumilast zlepšuje plicní funkce i při kombinovaném podávání s dlouhodobě působícími bronchodilatancii, jako jsou b2-agonisté a dlouhodobě působící anticholinergikum. Nežádoucí účinky jsou nezávažné. Nejčastěji se vyskytuje nauzea, průjem a hubnutí. Podává se v perorální formě. Doporučená dávka je 500 mg jednou denně. V červnu 2010 byl roflumilast schválen v Evropské unii pro léčbu těžké CHOPN spojené s chronickou bronchitidou.
Úvod
Chronická obstrukční plicní nemoc (CHOPN) je léčitelné onemocnění, jehož vzniku je možno předcházet. CHOPN má významné mimoplicní účinky, které mohou přispívat k celkové závažnosti onemocnění u jednotlivých pacientů. Plicní složka CHOPN je charakterizována omezeným průtokem vzduchu v průduškách neboli bronchiální obstrukcí, která není úplně reverzibilní. Bronchiální obstrukce obvykle progreduje a je spojena s abnormální zánětlivou odpovědí plic na škodlivé částice a plyny [1].
Bronchiální obstrukce typická pro CHOPN vzniká společným postižením drobných dýchacích cest (obstrukční bronchiolitidou) a destrukcí plicního parenchymu (emfyzémem). Poměr stupně postižení těmito dvěma složkami je individuální. Chronická bronchitida je definována jako kašel s vykašláváním trvající nejméně 3 měsíce ve dvou po sobě následujících letech. Emfyzém je definován anatomicky jako trvalé zvětšení dechových cest distálně od terminálního bronchiolu spojené s destrukcí jejich stěn bez zřetelné fibrózy [2].
CHOPN je celosvětově nejčastějším plicním onemocněním [3]. Prevalence se udává mezi 4 % až 10 % [4]. V České republice se prevalence odhaduje na 7,7 % [5]. Hlavním rizikovým faktorem pro vznik CHOPN je kouření cigaret [6]. I pasivní kouření je rizikovým faktorem. CHOPN vzniká u 50 % kuřáků. Expozice pasivnímu kouření doma i v práci po dobu více než 40 hodin týdně v trvání 5 let zvyšuje riziko vzniku CHOPN o 48 % [7]. Vznik CHOPN se snaží vysvětlit teorie oxidačního stresu a teorie nerovnováhy mezi proteázami a antiproteázami. Tyto dva mechanismy vedou k rozvoji chronického zánětu, který je charakterizován zvýšeným počtem neutrofilů, makrofágů a CD8+ lymfocytů [3]. Významnou úlohu v obraně proti rozvoji zánětu hraje cyklický adenosinmonofosfát (cAMP); je syntetizován adenylátcyklázou, která je lokalizována na vnitřní straně plazmatické membrány buněk, a vzniká z adenosintrifosfátu (ATP). Adenylátcykláza je aktivována řadou signálních molekul, které aktivují adenylátcyklázu stimulující receptor. cAMP působí jako druhý posel uvnitř buněk a je odbouráván pomocí enzymu fosfodiesterázy na andenosinmonofosfát (AMP). Existuje více než 5 podtypů fosfodiesterázy. Nejúčinnějším je fosfodiesteráza 4 (PDE4).
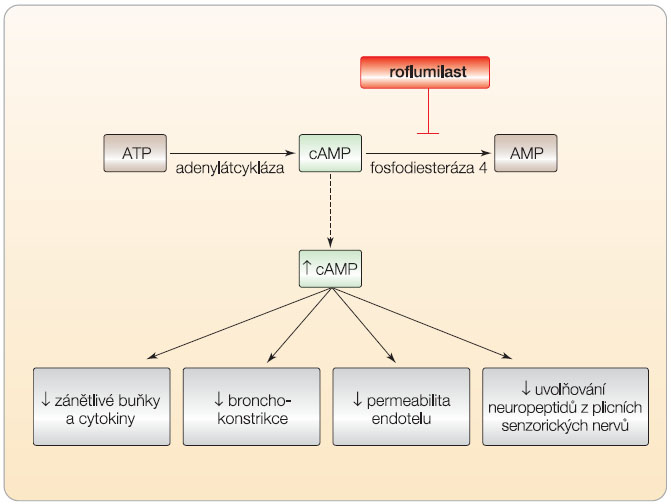 Zvýšená koncentrace cAMP zvyšuje samočisticí schopnost epitelu dýchacích cest, snižuje proliferaci a infiltraci zánětlivých buněk, inhibuje expresi a uvolňování prozánětlivých mediátorů, potlačuje funkci leukocytů, zesiluje uvolňování protizánětlivých mediátorů, potlačuje proliferaci hladké svaloviny a fibroblastů, snižuje permeabilitu endotelu (obr. 1).
Zvýšená koncentrace cAMP zvyšuje samočisticí schopnost epitelu dýchacích cest, snižuje proliferaci a infiltraci zánětlivých buněk, inhibuje expresi a uvolňování prozánětlivých mediátorů, potlačuje funkci leukocytů, zesiluje uvolňování protizánětlivých mediátorů, potlačuje proliferaci hladké svaloviny a fibroblastů, snižuje permeabilitu endotelu (obr. 1).
Podle současných doporučení pro léčbu CHOPN se používá terapie krátkodobě nebo dlouhodobě působícími bronchodilatancii a inhalačními kortikosteroidy [3, 8, 9]. Metaanalýzy řady studií ukázaly, že podání krátkodobě nebo dlouhodobě působících b2-agonistů nebo kortikosteroidů snižuje počet exacerbací o 13 % až 25 % ve srovnání s placebem [9]. Rovněž tak tiotropium prodlužuje čas do první exacerbace a první hospitalizace [10]. Mnoho kliniků věří, že adherence nemocných k perorálně podaným lékům je lepší, nicméně údajů podporujících toto tvrzení je málo [11].
V léčbě CHOPN se rovněž používají teofyliny. Jsou to neselektivní inhibitory PDE dostupné v perorální formě. Podávají se u nemocných s CHOPN s perzistujícími symptomy a exacerbacemi, kteří pravidelně užívají inhalační bronchodilatační léky [3]. Širokému užití brání jejich četné nežádoucí účinky včetně síňových a komorových tachyarytmií a možnosti vyvolání epileptických záchvatů. Tyto účinky jsou zřejmě způsobeny tím, že teofylin je nespecifickým inhibitorem PDE [12].
Mechanismus účinku
Roflumilast je léčivo, které účinkuje jako dlouhodobě působící selektivní inhibitor enzymu PDE4. Podává se v perorální formě. Chemicky se jedná o 3-(cyklopropylme-thoxy)-N-(3,5-dichloropyridin-4-yl)-4-(difluoromethoxy)benzamid.
Roflumilast moduluje in vitro i in vivo aktivitu různých buněk zánětu. Je schopen utlumit tvorbu klíčového prozánětlivého cytokinu, tj. tumor necrosis faktoru a (TNF-a). Tímto mechanismem dojde k potlačení řady aktivit neutrofilů, jako je tvorba kyslíkových radikálů a adheze k buňkám endotelu [13, 14]. Roflumilast též snižuje proliferaci a tvorbu cytokinů tvořených CD4+, což vede k inhibici nitrobuněčných signálních pochodů, viz obr. 1 [15, 16]. Tohoto protizánětlivého účinku lze využít v léčbě chronických zánětlivých onemocnění, jako je astma, CHOPN a emfyzém [17–20].
Farmakokinetické vlastnosti
 Hlavní farmakokinetické vlastnosti jsou shrnuty v tab. 1. Při perorálním podání je roflumilast rychle absorbován s absolutní biologickou dostupností 79 % [21]. Dostupnost roflumilastu není ovlivněna ani jídlem s vysokým obsahem tuků, i když resorpce je tučným jídlem lehce snížena. Distribuční objem je 2,9 l/kg, což znamená významnou tkáňovou depozici s vysokou vazbou na proteiny (< 96 %) [22]. Při jednorázovém a opakovaném podání roflumilastu nebyly zjištěny rozdíly v průběhu lineárního zvyšování koncentrací k dosažení maximální koncentrace (cmax) roflumilastu, ani v ploše pod křivkou (AUC) roflumilastu i jeho metabolitu [23]. Roflumilast je metabolizován cytochromem P-450 (CYP) 3A4 a CYP 1A2 na aktivní metabolit roflumilast N-oxid, který je stejně účinný jako roflumilast [21, 23]. Dávkování jednou denně umožňuje dlouhý poločas – 14 až 16 hodin u roflumilastu a 19 až 21 hodin u roflumilastu N-oxidu [21, 23, 24].
Hlavní farmakokinetické vlastnosti jsou shrnuty v tab. 1. Při perorálním podání je roflumilast rychle absorbován s absolutní biologickou dostupností 79 % [21]. Dostupnost roflumilastu není ovlivněna ani jídlem s vysokým obsahem tuků, i když resorpce je tučným jídlem lehce snížena. Distribuční objem je 2,9 l/kg, což znamená významnou tkáňovou depozici s vysokou vazbou na proteiny (< 96 %) [22]. Při jednorázovém a opakovaném podání roflumilastu nebyly zjištěny rozdíly v průběhu lineárního zvyšování koncentrací k dosažení maximální koncentrace (cmax) roflumilastu, ani v ploše pod křivkou (AUC) roflumilastu i jeho metabolitu [23]. Roflumilast je metabolizován cytochromem P-450 (CYP) 3A4 a CYP 1A2 na aktivní metabolit roflumilast N-oxid, který je stejně účinný jako roflumilast [21, 23]. Dávkování jednou denně umožňuje dlouhý poločas – 14 až 16 hodin u roflumilastu a 19 až 21 hodin u roflumilastu N-oxidu [21, 23, 24].
Pouze malá část roflumilastu a roflumilastu N-oxidu je vylučována v nezměněné formě močí (< 1 %). Proto se farmakokinetické parametry u nemocných s renální nedostatečností nemění [25]. U nemocných s lehkým nebo středně těžkým poškozením jater došlo po podání roflumilastu i roflumilastu N-oxidu k mírnému zvýšení AUC i cmax, nicméně k ovlivnění bezpečnosti a tolerability nedošlo, takže není potřeba upravovat dávkování u nemocných s postižením jater [26].
Klinické zkušenosti
Účinnost roflumilastu byla zkoušena v řadě randomizovaných dvojitě zaslepených a placebem kontrolovaných studií u nemocných v různých stadiích CHOPN [27–31]. Byla provedena multicentrická dvojitě zaslepená studie fáze 3 kontrolovaná placebem, jíž se zúčastnilo 1411 nemocných se středním a těžkým stadiem CHOPN. Nemocní byli randomizováni do tří skupin k léčbě trvající 24 týdnů: první skupina dostávala roflumilast v dávce 250 mg jednou denně, druhá 500 mg jednou denně a třetí placebo jednou denně. Byly sledovány tyto parametry: hodnota pobronchodilatačního usilovně vydechnutého vzduchu za 1. sekundu (FEV1), změny v kvalitě života hodnocené pomocí specifického dotazníku Svatého Jiří (SGRQ), objem usilovně vydechnutého vzduchu (FVC), objem usilovně vydechnutého vzduchu za 6 sekund (FEV6) a výdechová rychlost pohybující se v rozmezí 25–75 % vitální kapacity (FEF25-75). U pacientů léčených oběma dávkami roflumilastu došlo k signifikantnímu vzestupu FEV1 proti placebu (p < 0,0006). Podobně došlo k signifikantnímu zvýšení pobronchodilatační hodnoty FVC, FEV6 a FEF25-75 při léčbě roflumilastem ve srovnání s placebem (p < 0,05). K signifikantnímu zlepšení kvality života ve srovnání s placebem nedošlo. Pacienti léčení dávkou 500 mg měli méně exacerbací než ti, kteří dostávali dávku 250 mg nebo placebo (p = 0,014). Přestože v této studii nebylo přímo porovnáno dávkování 250 mg a 500 mg, ukázalo se, že u nemocných s vyšší dávkou se sledované parametry zlepšily dříve [27].
Malá 4týdenní dvojitě zaslepená zkřížená studie kontrolovaná placebem prokázala, že dávka 500 mg roflumilastu ve srovnání s placebem signifikantně zvyšuje jak prebronchodilatační, tak pobronchodilatační hodnotu FEV1 (p < 0,001 prebronchodilatačně; p = 0,018 pobronchodilatačně) [28]. Proto byla tato dávka byla zvolena pro další studie.Do multicentrické randomizované dvojitě zaslepené studie kontrolované placebem bylo zařazeno 1513 nemocných s těžkou CHOPN [29]. Po vstupním období trvajícím 4 týdny, kdy nemocní dostávali placebo a salbutamol jako úlevovou medikaci, byli randomizováni do dvou skupin a po dobu 52 týdnů dostávali placebo, nebo roflumilast v dávce 500 mg jednou denně. Primárním cílem studie bylo zjistit změnu prebronchodilatačního FEV1 z bazální hodnoty a počet středně těžkých a těžkých exacerbací za rok. Dalším cílem bylo zjistit změny dalších funkčních parametrů a též kvality života měřené pomocí SGRQ. Průměrná hodnota FEV1 po bronchodilataci se zlepšila ve srovnání s placebem (o 12 ml, p < 0,0001). Nebyly prokázány rozdíly v počtu exacerbací (0,857/pacient/rok při léčbě roflumilastem, 0,918/pacient/rok při podávání placeba, p = 0,451). Nicméně nemocní léčení roflumilastem měli o 36 % méně těžkých exacerbací ve srovnání s placebem (1,014/pacient/rok vs.1,588/pacient/rok; p = 0,024). Signifikantně méně nemocných vyžadovalo při léčbě exacerbací léčbu systémovými kortikosteroidy (p = 0,029). Neprokázal se ale rozdíl v ovlivnění kvality života (p = 0,651).
![Graf 1 Prebronchodilatační a pobronchodilatační FEV1 u pacientů, kteří dostávali roflumilast 500 mg denně, nebo placebo; podle [30] – Calverley, et al. 2009.](https://www.remedia.cz/photo-a-28166---.jpg) Účinnost roflumilastu v léčbě nemocných s CHOPN byla studována ve dvou velkých klinických studiích, jejichž výsledky byly hodnoceny a publikovány souborně [30]. Obě studie trvaly 52 týdnů. Nemocní dostávali buď roflumilast v dávce 500 mg/den (1537 pacientů), nebo placebo (1554 pacientů). Hlavními sledovanými parametry byly změny v prebronchodilatační hodnotě FEV1 a počet exacerbací. Sekundárními cíli byly změny pobronchodilatační hodnoty FEV1, čas do úmrtí a koncentrace C-reaktivního proteinu (CRP). Prebronchodilatační FEV1 se ve skupině léčené roflumilastem signifikantně zvýšily a snížily se ve skupině léčené placebem (40 + 6 ml vs. -9 + 5 ml, p < 0,0001), viz graf 1. Rovněž se zvýšily hodnoty pobronchodilatačního FEV1 u skupiny léčené roflumilastem ve srovnání s placebovou skupinou (p < 0,0001). K tomuto zvýšení došlo bez ohledu na léčbu dlouhodobě působícími b2-agonisty. Počet středně těžkých a těžkých exacerbací byl signifikantně nižší u skupiny léčené roflumilastem než ve skupině léčené placebem (1,14/pacient/rok vs. 1,37/pacient/ rok, p = 0,0003). K signifikantnímu ovlivnění mortality ani koncentrace CRP nedošlo. Tyto studie prokázaly, že roflumilast je účinný u nemocných se středním nebo těžkým stupněm CHOPN.
Účinnost roflumilastu v léčbě nemocných s CHOPN byla studována ve dvou velkých klinických studiích, jejichž výsledky byly hodnoceny a publikovány souborně [30]. Obě studie trvaly 52 týdnů. Nemocní dostávali buď roflumilast v dávce 500 mg/den (1537 pacientů), nebo placebo (1554 pacientů). Hlavními sledovanými parametry byly změny v prebronchodilatační hodnotě FEV1 a počet exacerbací. Sekundárními cíli byly změny pobronchodilatační hodnoty FEV1, čas do úmrtí a koncentrace C-reaktivního proteinu (CRP). Prebronchodilatační FEV1 se ve skupině léčené roflumilastem signifikantně zvýšily a snížily se ve skupině léčené placebem (40 + 6 ml vs. -9 + 5 ml, p < 0,0001), viz graf 1. Rovněž se zvýšily hodnoty pobronchodilatačního FEV1 u skupiny léčené roflumilastem ve srovnání s placebovou skupinou (p < 0,0001). K tomuto zvýšení došlo bez ohledu na léčbu dlouhodobě působícími b2-agonisty. Počet středně těžkých a těžkých exacerbací byl signifikantně nižší u skupiny léčené roflumilastem než ve skupině léčené placebem (1,14/pacient/rok vs. 1,37/pacient/ rok, p = 0,0003). K signifikantnímu ovlivnění mortality ani koncentrace CRP nedošlo. Tyto studie prokázaly, že roflumilast je účinný u nemocných se středním nebo těžkým stupněm CHOPN.
![Graf 2 Změna prebronchodilatační hodnoty FEV1 u pacientů, kterým byl k léčbě tiotropiem přidán roflumilast, nebo placebo; podle [31] – Fabbri, et al. 2009.](https://www.remedia.cz/photo-a-28167---.jpg) K ověření, zda je roflumilast účinný i v kombinaci s jinými dlouhodobě působícími bronchodilatačními léky, byly provedeny další dvě studie, jejichž výsledky byly souhrnně publikovány [31]. Studie M2-127 a M2-128 sledovaly účinek roflumilastu přidaného buď k salmeterolu (LABA), nebo k tiotropiu (LAMA). Ke srovnání byly použity skupiny osob léčených LABA nebo LAMA s placebem, po 4týdenním vstupním období trvaly tyto multicentrické dvojitě zaslepené studie dalších 24 týdnů. Primární i sekundární cíle u obou studií byly stejné. Primárním cílem bylo zjistit změnu prebronchodilatační hodnoty FEV1. Sekundární cíle zahrnovaly zjištění změny pobronchodilatační FEV1, FVC, dotazníku dušnosti (SOBQ), počtu exacerbací a počtu použití úlevové medikace. Po vyhodnocení získaných dat bylo zjištěno, že přidáním roflumilastu k salmeterolu došlo k významnému zlepšení prebronchodilatačního FEV1 o 49 ml (p < 0,001), přidáním k tiotropiu dokonce o 80 ml (p < 0,001), viz graf 2. Nicméně nebyl zjištěn pokles četnosti lehkých, středně těžkých nebo těžkých exacerbací při kombinované léčbě roflumilastem se salmeterolem nebo v kombinaci roflumilast a tiotropium. V obou větvích došlo k prodloužení průměrného času do první exacerbace (p < 0,05).
K ověření, zda je roflumilast účinný i v kombinaci s jinými dlouhodobě působícími bronchodilatačními léky, byly provedeny další dvě studie, jejichž výsledky byly souhrnně publikovány [31]. Studie M2-127 a M2-128 sledovaly účinek roflumilastu přidaného buď k salmeterolu (LABA), nebo k tiotropiu (LAMA). Ke srovnání byly použity skupiny osob léčených LABA nebo LAMA s placebem, po 4týdenním vstupním období trvaly tyto multicentrické dvojitě zaslepené studie dalších 24 týdnů. Primární i sekundární cíle u obou studií byly stejné. Primárním cílem bylo zjistit změnu prebronchodilatační hodnoty FEV1. Sekundární cíle zahrnovaly zjištění změny pobronchodilatační FEV1, FVC, dotazníku dušnosti (SOBQ), počtu exacerbací a počtu použití úlevové medikace. Po vyhodnocení získaných dat bylo zjištěno, že přidáním roflumilastu k salmeterolu došlo k významnému zlepšení prebronchodilatačního FEV1 o 49 ml (p < 0,001), přidáním k tiotropiu dokonce o 80 ml (p < 0,001), viz graf 2. Nicméně nebyl zjištěn pokles četnosti lehkých, středně těžkých nebo těžkých exacerbací při kombinované léčbě roflumilastem se salmeterolem nebo v kombinaci roflumilast a tiotropium. V obou větvích došlo k prodloužení průměrného času do první exacerbace (p < 0,05).
Lékové interakce
Roflumilast se metabolizuje N-oxidací prostřednictvím izoenzymů cytochromu P-450 (CYP) 3A4 a CYP 1A2 a v menší míře prostřednictvím enzymů CYP1A1 a CP2C19 na aktivní metabolit, který je následně dealkylován CYP3A4, glukuronizován a vylučuje se ledvinami. Proto může potenciálně dojít k řadě interakcí s jinými léky. Byl studován vliv silného inhibitoru CYP3A4 ketokonazolu na farmakokinetiku roflumilastu a jeho metabolitů [33]. Autoři sledovali interakci mezi jednorázovou dávkou ketokonazolu a rovnovážným stavem roflumilastu a mezi rovnovážným stavem ketokonazolu a podáním roflumilastu. Při rovnovážném stavu roflumilastu (500 mg jednou denně po dobu 11 dní) a jednorázovém podání ketokonazolu se zvýšila AUC o 34 %, k ovlivnění cmax roflumilastu však nedošlo. Opakované podání ketokonazolu vedlo k dvojnásobnému zvýšení AUC a zvýšení cmax o 23 %. Nedošlo ani k poklesu aktivity PDE4. Ukazuje se, že není nutná změna dávky ani při podávání silných inhibitorů CYP3A4, které představuje ketokonazol.
Rovněž bylo zkoumáno ovlivnění farmakokinetiky u kuřáků [34]. Nebyly prokázány rozdíly ve farmakokinetických nebo bezpečnostních parametrech u kuřáků a nekuřáků. Podání roflumilastu v kombinaci s antacidem obsahujícím magnesium hydroxid/aluminium hydroxid nevedlo ke změně farmakokinetiky roflumilastu nebo jeho metabolitu [35]. To znamená, že změny acidity nevedou ke změnám metabolismu roflumilastu a že by neměly vést ke vzniku nežádoucích účinků.
Kombinace s jinými léčivy
Podání roflumilastu v kombinaci s budesonidem nemění účinnost a bezpečnost ani jednoho z obou léčiv [36]. Stejně tak podání roflumilastu v kombinaci s warfarinem nemění jeho farmakokinetiku a farmakodynamiku. Oba přípravky lze podat současně beze změn jejich dávkování [37].
Nežádoucí účinky
Bezpečnost roflumilastu byla ověřována v rámci klinických studií [27, 29–31]. Nejčastějšími nežádoucími účinky byly gastrointestinální poruchy, jako je nauzea (3–5 %), průjem (5–9,3 %) a hubnutí (6–12 %). Průjem, nauzea, bolest hlavy, hubnutí se vyskytovaly signifikantně častěji než ve skupině léčené placebem (p < 0,05). Výskyt nežádoucích účinků nezávisel na tom, zda byl roflumilast podáván nalačno, nebo se stravou [22].
Průjem, nauzea a hubnutí byly častější při podávání roflumilastu se salmeterolem než při monoterapii roflumilastem (p < 0,05). Též při kombinovaném podávání roflumilastu s tiotropiem bylo ve srovnání s podáváním samotného roflumilastu zaznamenáno signifikantně větší množství nežádoucích účinků, jako je průjem, hubnutí a bolesti hlavy (p < 0,05). Dále se často vyskytovala bolest hlavy (2–6,2 %), chřipka (< 1–5,3 %) a nazofaryngitida (6–8 %). Předčasné ukončení studií bylo častější ve skupině léčené roflumilastem než ve skupině užívající placebo. Nejčastějším důvodem ukončení byly exacerbace CHOPN. V žádné z provedených studií nedošlo k závažným změnám vitálních funkcí a ke změnám na elektrokardiogramu (EKG). Neprokázalo se, že by roflumilast ve srovnání s placebem zvýšil riziko kardiovaskulárního postižení, jako je fibrilace síní (1 % vs. 1 %), a poruch srdečního rytmu (2,1 % vs. 1,4 %) [30]. Ve srovnání s incidencí síňových tachyarytmií, které se vyskytují zejména při vyšších koncentracích teofylinu, jde o patrný rozdíl [38, 39].
Dávkování
Podle dostupných klinických údajů je doporučováno dávkování 500 mg roflumilastu jednou denně [27, 29–31]. Lék může být podáván s jídlem i nalačno [22]. Farmakokinetické údaje dokládají, že není třeba měnit dávkování u nemocných s ledvinným selháním nebo u pacientů s lehkým či středním stupněm jaterní cirhózy [25, 26]. Farmakokinetika roflumilastu se při srovnání dávky 100 mg a 250 mg u dětí (6–10 let) nebo dospívajících (11–16 let) neodlišuje od farmakokinetiky u dospělých [40].
Závěr
Seznam použité literatury
- [1] Musil J, Kos S, Vondra V, Salajka F. (Překlad.) Světová iniciativa o chronické obstrukční plicní nemoci: Světová strategie diagnostiky, léčby a prevence chronické obstrukční plicní nemoci. Praha, Vltavín 2007; 164 s.
- [2] Snider GL, Kleinerman J, Thurlbeck WM, et al. The definition of emphysema: report of a National Heart and Blood Institute, Division of Lung Diseases, workshop. Am Rev Resp Dis 1985; 132: 182–185.
- [3] Global Initiative for Chronic obstructive Lung Disease. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease (updated December 2009). Available at: http://goldcopd.com Accessed December 8, 2009.
- [4] Halbert RJ, Isonaka S, George D, et al. Interpreting COPD prevalence estimates: what is the true burden of disease? Chest 2003; 123: 1684–1692.
- [5] Vondra V, et al. Péče o nemocné chronickou obstrukční plicní nemocí v České republice. Praha, Jalna 1996; 160 s.
- [6] Lopez AD, Mathers CD, Ezzati M, et al. Global burden of disease and risk factors. Washington: The World Bank, 2006.
- [7] Yin P, Juan CQ, Cheng KK, et al. Passive smoking exposure and risk of COPD among adults in China: the Guangzou Biobank Cohort Study. Lancet 2007; 370: 751–757.
- [8] Wilt TJ, Niewohner D, MacDonald R, et al. Management of stable chronic obstructive pulmonary disease: a systemnatic review for a clinical practise guideline. Ann Intern Med 2007; 147: 639–973.
- [9] Qaseem A, Snow V, Shekelle P, et al. Clinical Efficacy Assessement Subcommitte of the American College of Physicians. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practise guideline from the American College of Physicians. Ann Intern Med 2007; 147: 633–638.
- [10] Vincken W, van Noord A, Greefhorst APM, et al. Improved health outcomes in patients with COPD during 1 year treatment with tiotropium. Eur Respir J 2002; 19: 209–216.
- [11] Lipworth BJ. Phosphodiesterase-4 inhibitors for asthma and chronic obstructive pulmonary disease. Lancet 2005; 365: 167–175.
- [12] Currie GP, Butler CA, Anderson WJ, et al. Phosphodiesterase 4 inhibitors in chronic obstructive pulmonary disease: a new approach to oral treatment. Br J Clin Pharmacol 2008; 65: 803–810.
- [13] Hatzelmann A, Schudt C. Anti-inflammatory and immunomodulatory potential of the novel PDE4 inhibitor roflumilast in vitro. J Pharmacol Exp Ther 2001; 297: 267–279.
- [14] Bundschuh DS, Eltze M, Barsig J, et al. In vivo efficacy in airway disease model of roflumilast, a novel orally active PDE4 inhibitor. J Pharmacol Exp Ther 2001; 297: 280–290.
- [15] Jones NA, Boswell-Smith V, et al. The effect of selective phosphodiesterase isoenzyme inhibition on neutrofil function in vitro. Pulm Pharmacol Ther 2005; 18: 93–101.
- [16] Kwak HJ, Song JS, Heo JY, et al. Roflumilast inhibits lipopolysaccharide-induced inflammatory mediators via suppression of nuclear factor-kappaB, p38 mitogen-activated protein kinase, and c-Jun NH2-terminal kinase activation. J Pharmacol Exp Ther 2005; 315: 1188–1195.
- [17] Boswell-Smith V, Spina D. PDE-4 inhibitors as potential therapeutics agents in the treatment of COPD focus on roflumilast. Intern J of COPD 2007; 2: 121–129.
- [18] Herbert C, Hettiaratchi A, Webb DC, et al. Suppresssion of cytokine expression by roflumilast and dexamethasone in model of chronic asthma. Clinical and Experimental Allergy 2008; 38: 847–856.
- [19] Hohlfeld JM, Schoenfeld K, Lavae-Mokhtari M, et al. Roflumilast attenuates pulmonary inflammation upon segmental endotoxin challenge in healthy subjects: a randomized placebo controlled trial. Pulm Pharmacology and Therapeutics 2008; 21: 616–623.
- [20] Field SK. Roflumilast: an oral, once daily selective PDE-4 inhibitor for the management of COPD and asthma. Expert Opinion of Investigational Drugs 2008; 17: 811–818.
- [21] David M, Zech K, Seiberling M, et al. Roflumilast, a novel, oral, selective PDE4 inhibitor, shows high absolute bioavailability. J Allergy Clin Immunol 2004; 113: S220–S221.
- [22] Hauns B, Hermann R, Hunnemeyer A, et al. Investigation of a potential food effect on the pharmacokinetics of roflumilast, an oral, once daily phosphodiesterase 4 inhibitor, in healthy subjects. J Clin Pharmacol 2006; 46: 1146–1153.
- [23] Bethke TD, Bohmer GM, Hermann R, et al. Dose-proportional intraindividual single- and repeated-dose pharmacokinetics of roflumilast, an oral, once daily phoshodiesterase 4 inhibitor. J Clin Pharmacol 2007; 47: 26–36.
- [24] Hunnemeyer A, Hauns B, David M, et al. Pharmacokinetics and safety of roflumilast, a once daily oral, selective PDE4 inhibitor, and its active metabolite roflumilast N-oxide in healthy subjects. J Allergy Clin Immunol 2004; 113 (Suppl): S222.
- [25] Nassr N, Bethke T, Hartmann M, et al. No dose adjustment of roflumilast in patiens with severe renal impairment. Eur J Clin Pharmacol 2002; 58: S82. Abstract.
- [26] Hermann R, Nassr N, Lahu G, et al. Steady-state pharmacokinetics of roflumilast and roflumilast N-oxide in patiens with mild and moderate liver cirrhosis. Clin Pharmacokinet 2007; 46: 403–416.
- [27] Rabe KF, Bateman ED, O’Donnel D, et al. Roflumilast – an oral anti-inflammatory treatment for chronic obstructive pulmonary disese: a randomized controlled trial. Lancet 2005; 366: 563–571.
- [28] Gootendorst DC, Gauw SA, Verhoosel RM, et al. Reduction in sputum neutrophil and eosinophil numbers by the PDE4 inhibitor roflumilast in patiens with COPD. Thorax 2007; 62: 1081–1087.
- [29] Calverley PM, Sanchez-Toril F, McIvor A, et al. Effect of 1-year treatment with roflumilast in severe chronic obstructive pulmonary disease Am J Respir Crit Care Med 2007; 176: 154–161.
- [30] Calverley PM, Rabe KF, Goehring UM, et al. M2-124 and M2-125 study groups. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomized clinical trials. Lancet 2009; 374: 685–694.
- [31] Fabri LM, Calverley PM, Izquierdo-Alonso JL, et al. M2-127 and M2-128 study groups. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with long-acting bronchodilators: two randomized clinical trials. Lancet 2009; 374: 695–703.
- [32] Baker EL, Baker W. Roflumilast: A new phosphodiesterase 4 inhibitor for chronic obstructive pulmonary disease. Formulary 2010; 44: 6–13.
- [33] Lahu G, Hunnemeyer A, von Richter O, et al. Effect of single and repeated doses of ketoconazole on the pharmacokinetics of roflumilast and roflumilast N-oxide. J Clin Pharmacol 2008; 48: 1339–1349.
- [34] Nassr N, Hunnemeyer A, Hauns B, et al. Smoking has no influence on the pharmacokinetics of roflumilast and its metabolite N-oxide. Eur J Clin Pharmacol 2002; 58: 41. Abstract.
- [35] Nassr N, Lahu G, Hunnemeyer A, et al. Magnesium hydroxide/aluminium hydroxide-containing antacid does not affect the pharmacokinetics of the targeted phoshodiesterase 4 inhibitor roflumilast. J Clin Pharmacol 2007; 47: 660–666.
- [36] Hermann R, Siegmund W, Giessmann T. The Oral, Once-Daily Phoshopodiesterase 4 Inhibitor Roflumilast Lacks Relevant Pharmacokinetic Interaction With Inhaled Budesonide. J Clin Pharmacol 2007; 47: 1005–1013.
- [37] Hunnemeyer A, Zech K, Tarblanche J, et al. Roflumilast shows no pharmacokonetic interaction with warfarin in healthy subjects. Chest 2004; 126: 804S (Abstract).
- [38] Levine JH, Michael JR, Guarnieri T. Multifocal atrial tachycardia: a toxic effect of theophylline. Lancet 1985; 1: 12–24.
- [39] Varriale P, Ramaprasad S. Aminophylline induced atrial fibrillation. Pacing Clin Electrophysiol 1993; 16: 1953–1955.
- [40] Neville KA, Szefler SJ, Abdel-Rahman SM, et al. Single-dose pharmacokinetics of roflumilast in children and adolescents. J Clin Pharmacol 2008; 48: 978–985.
- [41] Wagner LT, Kenreigh CA. Roflumilast: The Evidence for its Clinical Potential in the Treatment of Chronic Obstructive Pulmonary Disease. http:// www.medscape.com/viewarticle/523218