Rotavirové infekce - patogeneze a očkování
Celosvětově je ročně přičítáno rotavirům okolo 125 milionů diagnóz gastroenteritid. Přes půl milionu těchto případů pak končí smrtí pacienta a většina zemřelých pochází z rozvojových zemí. Zdrojem rotavirové nákazy je člověk. Nejčastější cestou přenosu je fekálně-orální způsob. V zemích mírného pásu, kde nebylo dosud zavedeno plošné očkování, vykazuje infekce sezonní závislost s vrcholem v zimním období. V tropických zemích tento jev nebyl pozorován. Standardní hygienická a sanitární opatření nefungují stoprocentně. Vzhledem k tomu, že minimální infekční dávka viru je 10 virových částic, je očkování jedinou spolehlivou cestou, jak zamezit šíření rotavirových infekcí v populaci.
Celosvětově vedou akutní gastroenteritidy přehledové tabulky WHO (Světová zdravotnická organizace) a CDC (Centers for Disease Control and Prevention) shrnující příčiny mortalit u dětí ve věku do pěti let (obr. 1). Vrchol incidence byl opakovaně zachycen ve skupinách kojenců mezi 7. až 15. měsícem života [1, 2]. V mnohých rozvojových 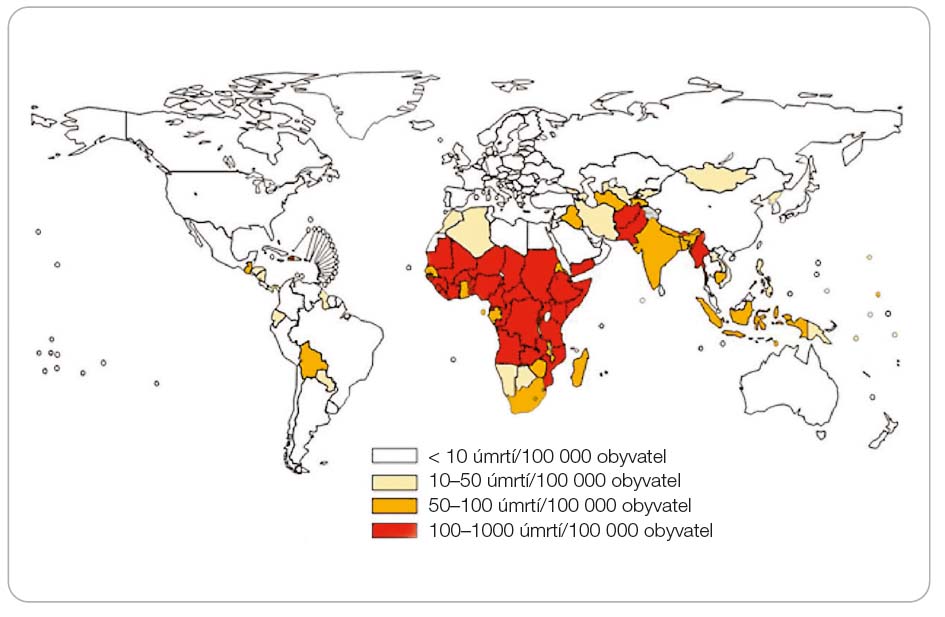 zemích pak tato onemocnění zaujímají první místo. Každoročně je hlášeno přes sedm set milionů průjmových onemocnění z Afriky, Asie a Latinské Ameriky. Odhaduje se, že okolo dvou až tří mi-lionů dětí onemocnění ročně podlehne a zemře. Tato informace koresponduje se statistickým údajem 6600 až 9000 úmrtí dětí denně [3]. V nejchudších skupinách obyvatel Peru a Brazílie onemocní dítě mladší dvou let v průměru 10krát a vícekrát ročně průjmovým onemocněním. Oproti tomu v Kostarice, v zemi s dobrou životní úrovní, je průměrná roční četnost průjmového onemocnění dítěte ve věku 0–1 rok 0,7 [4–6].
zemích pak tato onemocnění zaujímají první místo. Každoročně je hlášeno přes sedm set milionů průjmových onemocnění z Afriky, Asie a Latinské Ameriky. Odhaduje se, že okolo dvou až tří mi-lionů dětí onemocnění ročně podlehne a zemře. Tato informace koresponduje se statistickým údajem 6600 až 9000 úmrtí dětí denně [3]. V nejchudších skupinách obyvatel Peru a Brazílie onemocní dítě mladší dvou let v průměru 10krát a vícekrát ročně průjmovým onemocněním. Oproti tomu v Kostarice, v zemi s dobrou životní úrovní, je průměrná roční četnost průjmového onemocnění dítěte ve věku 0–1 rok 0,7 [4–6].
Průjmová onemocnění mohou být způsobena celou řadou agens, která zahrnují bakterie (Vibrio cholerae, Shigella dysenteriae, Salmonella typhi, Campylobacter, Clostridium difficile, Escherichia coli, Listeria monocytogenes, Salmonella enteritidis), parazity (Cryptosporidium parvum, Giardia lamblia) a viry (rotaviry, noroviry, adenoviry, astroviry).
Zejména v rozvojových zemích je v důsledku nedostatečného diagnostic-kého laboratorního zázemí často velmi obtížné stanovit správně etiologii těchto onemocnění [3, 7, 8].
Epidemiologie rotavirů
Již práce staršího data [9, 10] ukazují, že rod rotavirů (čeleď Reoviridae) je nejčastější příčinou gastroenteritid u kojenců a malých dětí; tyto gastroenteritidy jsou často doprovázeny dehydratací, a to jak v rozvojových zemích, tak v zemích s vysokou životní úrovní. Odhaduje se, že rotaviry jsou původci více než 125 milionů případů dětských gastroenteritid, z toho ve 418 000 až 520 000 případů jsou příčinou úmrtí. Z celkového počtu pak 85 % nemocných pochází z rozvojových zemí [3].
Ve Spojených státech prodělá infekci rotavirem takřka každé dítě, pokud nebylo do konce prvního roku života proti rotavirům očkováno. Většina těchto dětí trpí příznaky symptomatické gastroenteritidy. V rámci probíhající očkovací kampaně proti rotavirům bylo na konci roku 2008 v USA očkováno minimálně jednou dávkou 73 % dětí mladších jeden rok, 64 % dětí starších než jeden rok a 8 % dětí ve věku mezi dvěma až čtyřmi roky. Data ukázala, že v letech 2007 až 2008 došlo v důsledku očkování proti rotavirům k 75% poklesu dětských hospitalizací v porovnání s předvakcinačním obdobím. V letech 2008 až 2009 byl pak sledován 60% pokles incidence [3, 11, 12].
V České republice se předpokládá „podhlášenost“ rotavirových gastroente-ritid na úkor salmonelóz a kampylobakterióz. Mezi lety 2006 až 2009 bylo v systému Epidat zachyceno 2800 virových průjmových onemocnění, kdy většina těchto hlášení přišla v důsledku hospitalizace pa-cientů. Odhaduje se, že z tohoto počtu zhruba 1600 případů patří rotavirovým infekcím, a to zejména u dětí do tří let věku. Realistický odhad pak říká, že v důsledku rotavirové infekce onemocní ročně v České republice kolem 20 000 pacientů [13–15].
Řada prací [16, 17] vycházejících z publikovaných analýz poukazuje na sezonní charakter rotavirových infekcí v zemích mírného pásu, zatímco v tropických zemích tato sezonnost chybí. Zimní měsíce – od prosince do března na severní polokouli a od června do září na jižní polokouli – jsou považovány za období nejčastějšího výskytu rotavirových infekcí pro země ležící v mírném podnebním pásu. Naopak nesezonnost onemocnění v tropických zemích se přičítá odlišným podnebním podmínkám, jako je lokální cirkulace vzduchu, tlaková pásma, eventuálně i různá míra kolísání intenzity slunečního svitu během roku v jednotlivých pásmech. Lze tedy shrnout, že lokální klimatické faktory mají zřejmě vliv na sezonnost výskytu rotavirových infekcí v různých částech světa [18].
Rotaviry nejsou jedinými známými viry, u kterých pozorujeme tuto závislost. Obdobně se chová herpetický virus varicella-zoster (VZV), který také vykazuje sezonní závislost v zemích mírného pásu, zatímco v tropických oblastech se vyskytuje celoročně [19].
Molekulární biologie rotavirů
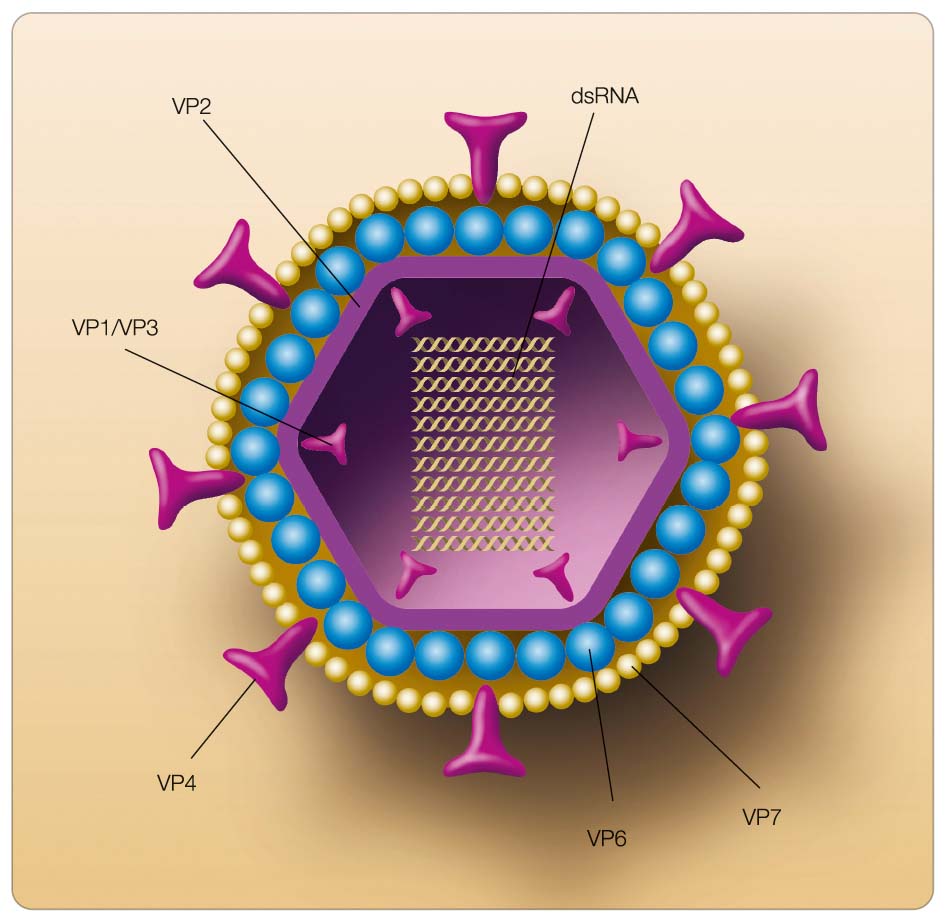 Rotaviry patří mezi neobalené RNA viry, které byly objeveny a popsány v roce 1973. Virion rotavirů dosahuje v průměru velikosti mezi 65 a 75 nm (obr. 2). Je tvořen ikosahedrálním jádrem a dvouvrstevnou kapsidou [20]. Jádro o velikosti 36 nm je tvořeno dvouvláknovou RNA, která obsahuje 11 segmentů. RNA kóduje 6 strukturálních (VP) a 6 nestrukturálních proteinů (NSP) [21]. Rotaviry jsou jediné savčí viry, u nichž byla popsána dvouvláknová RNA orga-nizovaná takto do segmentů. Jednotlivé segmenty jsou různě dlouhé, kdy například segment 11 má délku 667 párů bází, zatímco segment 1 je dlouhý 3302 párů bází. Celková délka jaderné RNA je okolo 18 500 párů bází, dle typu virového kmene. Není bez zajímavosti, že rotavirové sekvence jsou bohaté na přítomnost A–T bází (58–67 %). Jádro viru je složeno z proteinů VP1, VP2 a VP3 kódovaných geny 1, 2 a 3. Všech jedenáct segmentů kóduje jak virové strukturální, tak nestrukturální proteiny a zhruba u 50 % známe jejich funkce [22–26].
Rotaviry patří mezi neobalené RNA viry, které byly objeveny a popsány v roce 1973. Virion rotavirů dosahuje v průměru velikosti mezi 65 a 75 nm (obr. 2). Je tvořen ikosahedrálním jádrem a dvouvrstevnou kapsidou [20]. Jádro o velikosti 36 nm je tvořeno dvouvláknovou RNA, která obsahuje 11 segmentů. RNA kóduje 6 strukturálních (VP) a 6 nestrukturálních proteinů (NSP) [21]. Rotaviry jsou jediné savčí viry, u nichž byla popsána dvouvláknová RNA orga-nizovaná takto do segmentů. Jednotlivé segmenty jsou různě dlouhé, kdy například segment 11 má délku 667 párů bází, zatímco segment 1 je dlouhý 3302 párů bází. Celková délka jaderné RNA je okolo 18 500 párů bází, dle typu virového kmene. Není bez zajímavosti, že rotavirové sekvence jsou bohaté na přítomnost A–T bází (58–67 %). Jádro viru je složeno z proteinů VP1, VP2 a VP3 kódovaných geny 1, 2 a 3. Všech jedenáct segmentů kóduje jak virové strukturální, tak nestrukturální proteiny a zhruba u 50 % známe jejich funkce [22–26].
Vnější kapsida je složena ze dvou povrchových proteinů VP4 (P protein) a VP7 (G protein). VP7 je glykoprotein kódovaný geny 7, 8 nebo 9. VP4 je protein kódo-vaný genem 4. Povrch kapsidy je zhruba z 90 % vytvořen VP7 a je perforován 132 kanálky, které procházejí virionem a končí v jádře [27]. VP4 ovlivňuje jednak virulenci rotaviru, jednak adherenci viru ke speci-fickým receptorům [28]. Oba tyto povrchové proteiny nezávisle na sobě indukují produkci neutralizačních protilátek v hostiteli, a právě proto hrají zásadní roli při designu rotavirových vakcín [28]. Podle jejich antigenního složení rozeznáváme okolo dvaceti sérotypů P a G. Dalším důležitým proteinem je VP6 protein nalézající se v oblasti vniřní kapsidy. VP6 je kódován genem 6 a podílí se z 51 % na stavbě virionu [29].
Podle antigenní struktury proteinu vnitřní vrstvy kapsidy se rotaviry dělí do sérologických skupin označovaných A až G [30]. Skupina A zahrnuje sérotypy G1, G2, G3, G4 a G9. Tyto sérotypy jsou svázány s geografickým a sezonním výskytem, není ale známa vazba na závažnost klinického průběhu [30, 31].
Na základě molekulárně genetických analýz bylo dosud detekováno u lidí a zvířat nejméně 19 G genotypů, které reprezentují 14 sérotypů, a 27 P genotypů reprezentujících 18 sérotypů [32, 33]. Kombinace G a P typů je podkladem tzv. binomické typizace, která je používána k identifikaci jednotlivých rotavirových kmenů. Teoreticky je možná existence více než 110 různých kombinací mezi G a P segmenty.
Nicméně G sérotypy G1–G4 a G9 a P genotypy P4 a P8 jsou ve světě predominantní a zodpovídají za 90 % infekcí v průmyslově vyspělých zemích a za zhruba 68 % infekcí v Jižní Americe a Asii. Globálně predominantní genotyp je P[8]-G1, za ním následuje P[8]-G3, P[4]-G2 a P[8]-G4 [34, 35]. Genotyp G9 byl detekován poprvé kolem roku 2000 a převažuje v některých oblastech Evropy, Thajska a v části východní Asie. Méně obvyklé jsou kombinace P[6]-G8 v Africe, P[8]-G5 v Brazílii a P[11]-G10 a P[6]-G12 v Indii [36, 37].
Podstatná většina lidských rotavirů patří do skupiny A a vakcíny jsou primárně připravovány právě proti rotavirům z této skupiny. De facto pouze tato skupina zahrnuje viry vyvolávající těžké gastroenteritidy s možnými dehydratacemi a má epide-miologický význam [38]. Rotaviry skupiny B byly zachyceny na asijském kontinentu (např. v Číně, západní Indii nebo v Japonsku), kde jsou zodpovědné za průjmová onemocnění převážně dospělých pacientů [39]. Rotaviry skupiny C nacházíme velmi vzácně mezi dětmi v nejrůznějších zemích světa, ve větší míře jsou nacházeny zejména u prasat [40]. Zbylé skupiny rotavirů D až G nebyly dosud v lidské populaci detekovány a nacházejí se nejčastěji u primátů, skotu, koní, prasat a ovcí [40].
Molekulárně genetické studie porovnávající individuální segmenty sekvencí prokázaly existenci mechanismů genetického shiftu (reasortmentu) a driftu, obdobně jako je tomu u viru chřipky typu A. Sérotypy zvířecích rotavirů jsou sice odlišné od kmene s nejvyšší prevalencí u lidí, nicméně mezi jednotlivými zvířecími a lidskými kmeny rotavirů je vysoká homologie. Předpokládá se, že podobnost vznikla v důsledku reasortmentu jednoho či více zvířecích rotavirových genů do genomu lidského rotaviru během infekcí in vivo [40].
Cesty přenosu, zdroje nákazy, rizikové skupiny
Nejčastější cestou přenosu je fekálně-orální způsob (obzvláště kontaminací rukou). O přenosech respirační kapénkovou cestou se spekuluje, nicméně WHO považuje tento názor za neprokázanou hypotézu. Přesto se zdá pravděpodobné, že respirační příznaky patří do klinického obrazu rotavirové infekce [41].
Mezi rizikové skupiny patří děti, pracovníci ve zdravotnictví, klienti a zaměstnanci geriatrických jednotek, domovů důchod-ců a pečovatelské služby, zaměstnanci v mateřských školkách a jeslích. V rámci zmínky o rizikových skupinách nesmíme opomenout imunosuprimované pacienty a mezi nimi pacienty s infekcí HIV [42].
Rotaviry jsou řazeny mezi časté nozokomiální patogeny dětských oddělení nemocnic. Během hospitalizace onemocní průjmovým onemocněním 5–30 % hospitalizovaných dětí [41].
Velmi častým vehikulem rotavirových nákaz jsou kontaminované potraviny – především jídla neprocházející tepelnou úpravou, jako jsou různé zeleninové saláty, nedostatečně omyté ovoce, a dále pak kontaminovaná voda a led [43, 45].
V závislosti na typu povrchového materiálu rotaviry přežívají na různém povrchu různě dlouho. Studie, které testovaly dobu přežití živého viru na hračkách vyrobených z různých materiálů a s různým typem povrchu, ukázaly schopnost viru přežít až několik dnů na materiálech z plastu, gumy či kovu nebo ze dřeva, zatímco na rukou virus přežíval jen několik hodin [43–45].
Experimentálně bylo ověřeno, že nejlepší dezinfekcí na odstranění rotavirů je alkohol (99% účinnost), zatímco běžné mýdlo a voda jsou účinné pouze mezi 72 % až 84 %, což je jedním z důvodů, které podtrhují význam očkování jako nejvhodnějšího způsobu boje proti rotavirům.
Jak již bylo zmíněno, dostačující infek-ční dávka pro dítě je pouhých 10 virionů a inkubační doba se pohybuje mezi 24 až 72 hodinami. Rotavirus přežívá až několik let ve zmražené formě při minus 60 °C, naopak teplota 56 °C ho spolehlivě inaktivuje do 30 minut. Ultrafialové záření naruší pak virové partikule již po několikaminutovém působení [46, 47].
Virus je stabilní při pH 3,5–10 a prochází tím snadněji žaludkem, čím vyšší je pH sliznice. V normálním prostředí pH 2 v žaludku přežije maximálně minutu, ale pH žaludku kojence se pohybuje okolo 3,2, a právě proto je toto prostředí méně schopné zabránit postupu živého viru dále do gastrointestinálního traktu.
Klinický průběh onemocnění
Infekce rotavirem je obvykle omezena na střevní sliznici. Rotavirus adheruje na zralé epiteliální buňky vrcholků klků v horních dvou třetinách tenkého střeva (nejčastěji v oblasti duodena a proximální části jejuna) [15, 33, 41] pomocí virového proteinu VP4 a během jednoho až dvou dnů se v nich masivně pomnoží. Zralé virové částice se uvolňují rozpadem epitelií a do střeva se tak dostává velké množství viru, který infikuje další buňky (obr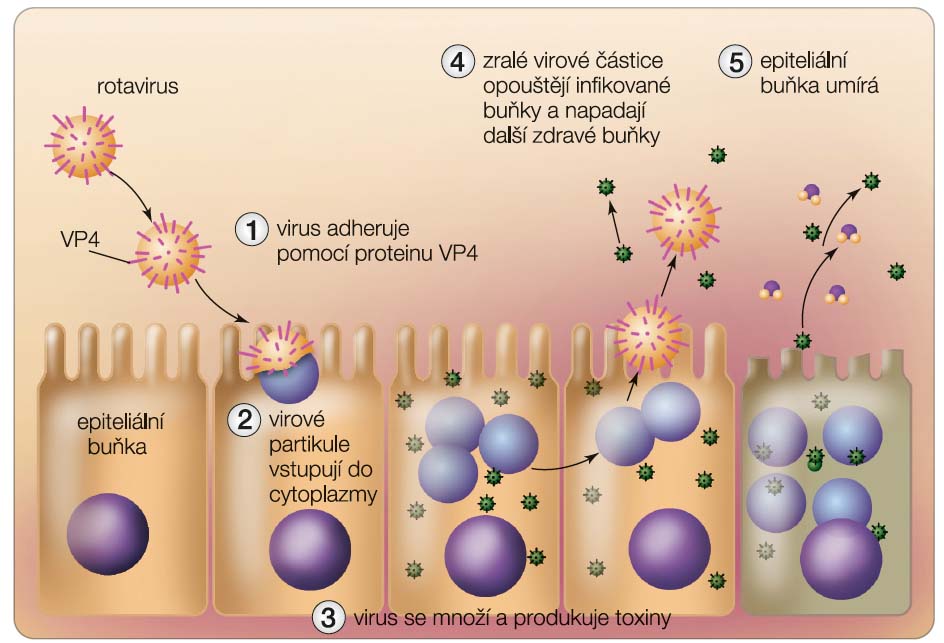 . 3). Nové viriony pak dozrávají a uvolňují se v deseti- až dvanáctihodinových cyklech [47]. Střevní stěna napadená viry je poškozena, čímž dojde k zásadnímu snížení schopnosti absorbovat soli a vodu [47]. Objeví se poruchy trávení a malabsorpce živin, což má za následek osmotický průjem, zvracení a dehydrataci.
. 3). Nové viriony pak dozrávají a uvolňují se v deseti- až dvanáctihodinových cyklech [47]. Střevní stěna napadená viry je poškozena, čímž dojde k zásadnímu snížení schopnosti absorbovat soli a vodu [47]. Objeví se poruchy trávení a malabsorpce živin, což má za následek osmotický průjem, zvracení a dehydrataci.
Onemocnění probíhá zhruba 5 až 7 dnů. Typické symptomy zahrnují zvracení, ho-rečku, bolesti břicha a vodnaté nekrvavé průjmy. Zásadním problémem je dehydratace, a to zhruba u 2 % nemocných, kdy v případě nemožnosti adekvátní rehydratační terapie může dojít k šoku, nerovnováze elektrolytů a ke smrti. Zvracení a horečka (zhruba třetina pacientů vykazuje teploty vyšší než 39 °C) jsou obvykle typické pro první dva až tři dny nemoci, zatímco průjem obvykle přetrvává po dobu 5 až 8 dnů [48]. Imunita po prodělání onemocnění není kompletní, onemocnění se může opakovaně vracet, nicméně obvykle v mírnější formě než při první rotavirové infekci. Kojení neposkytuje ochranu proti rotavirovým infekcím, ale předpokládá se, že průběh je u kojených dětí mírnější [49–51]. Infekce dospělých je možná, avšak obvykle probíhá asymptomaticky a longitudinální studie z několika zemí ukázaly, že asymptomatické rotavirové infekce dospělých jsou poměrně velmi časté [52, 53].
Vývoj rotavirových vakcín
Základní strategií pro vytvoření účinné vakcíny je v případě rotavirů snaha získat očkovací látku, která navodí celoživotní imunitu proti život ohrožujícím průjmovým onemocněním doprovázeným dehydratacemi.
První kandidátní vakcíny byly derivovány z monovalentních bovinních nebo opičích (Makak rhesus) rotavirových kmenů. Studie s těmito vakcínami aplikovanými v jednodávkových schématech ukázaly, že živá vakcína podaná per os je bezpečná a navozuje imunitu proti rotavirovým dětským průjmům. Nicméně účinnost těchto vakcín nebyla konzistentní. Přestože vakcíny navodily heterotypickou protilátkovou odpověď, převládl názor, že by bylo vhodnější vyvinout multivalentní očkovací látku, u které bude ještě větší jistota, že navodí širokou specifickou imunitu vůči všem kmenům rotavirů [53]. Je nicméně pravda, že v současnosti jsou na trhu dvě licencované živé perorální vakcíny (jedna monovalentní, druhá pentavalentní) a studie ukázaly, že účinnost a bezpečnost je u obou vakcín na stejné úrovni [54, 55].
První vakcíny proti rotavirům byly založeny na postulátu Edwarda Jennera starém více než 200 let: příbuzný živý ate-nuovaný patogen nehumánního původu může fungovat jako imunogen ve chvíli, kdy je vpraven do lidského organismu [56]. Proto první kandidátní vakcíny obsahovaly atenuovaný bovinní rotavirový kmen, například NCDV (Nebraska calf diarrhoea virus) [56].
V devadesátých letech minulého století byla postupně vyvinuta a testována celá řada dalších kandidátních vakcín, které využívaly bovinní nebo opičí kmeny (kmen MMV 18006, virus z mladé opice Makak rhesus).
Ve druhé polovině roku 1998 udělil FDA (Food and Drug Administration, USA) licenci tetravalentní vakcíně RRV-TV (the rhesus-human rotavirus reassortant-tetravalent vaccine). Tato vakcína byla určena pro děti v USA. Očkovací dávka byla podávána perorálně a byla založena na reasortmentu, tj. přetřídění či výměně genetického materiálu lidských a opičích kmenů rotavirů při společné infekci. Aplikační schéma bylo třídávkové – ve 2., 4. a 6. měsíci věku dítěte. Během následujících jedenácti mě-síců bylo aplikováno okolo jednoho a půl milionu dávek přibližně 900 000 dětem [57]. V červenci 1999 byla vakcína stažena, protože CDC vyhodnotilo v rámci systému VAERS (Vaccine Adverse Event Repor-ting System) 15 případů intususcepce (tj. vchlípení jedné části střeva do části následující) ve skupině dětí, které byly touto vakcínou očkovány [57, 58]. V říjnu 1999 obsahoval systém VAERS už 114 případů intususcepce, z nichž bylo 99 jako intususcepce potvrzeno. Z těchto 99 případů se 49 objevilo po podání první očkovací dávky, 10 případů po druhé dávce vakcíny a 1 případ po podání třetí dávky očkování. U 32 pacientů byl nutný chirurgický zásah, včetně 7 resekcí střeva. V jednom případě, u pětiměsíčního dítěte, došlo k úmrtí.
Následoval další vývoj očkovacích látek, kdy byly testovány vakcíny založené na lidských kmenech rotavirů. Prvním takto po-užitým kmenem byl kmen izolovaný od dítěte z jeslí. Tato idea byla založena na studiích z Austrálie, Švédska, UK a Venezuely, které ukazovaly, že lidské rotavirové kmeny u dětí se zdají být přirozeně ate-nuované [59]. První testovaná vakcína lidského původu, pojmenovaná M37, byla vypěstována na tkáňových kulturách a v této vakcíně byl použit kmen 29krát pasážovaný. Původní izolát pro vznik této rotavirové vakcíny pocházel ze stolice asymptomatického novorozence z Venezuely. Zároveň byly testovány i další izoláty, ale studie účinnosti neprokázaly uspokojivé výsledky [60].
Rotavirové vakcíny v současnosti
V současnosti jsou na trhu k dispozici dva druhy vakcín. Obě vakcíny vykazují vysokou imunogenicitu a protektivitu [61].
První typ představuje živá oslabená pentavalentní vakcína podávaná perorálně. Obsahuje celkem pět živých kmenů vzniklých reasortmentem lidských a bovinních rotavirů. Rodičovské kmeny reasortmentů byly izolovány z lidských a bovinních hostitelů. Čtyři reasortmenty rotavirů exprimují kapsidové proteiny G1, G2, G3 nebo G4 z lidského rodičovského kmene. Protein P7 pak pochází z rodičovského bovinního rotavirového kmene. Pátý reasortment rotaviru exprimuje protein P1A z lidského rodičovského kmene a kapsidový protein G6 z bovinního rotavirového rodičovského kmene. Jednotlivé kmeny jsou připravovány odděleně a pomnožovány na Vero buňkách v tkáňových kulturách. Bovinní kmeny jsou atenuovány „přirozeně", protože se špatně samy o sobě replikují v lidském těle. Vakcína se podává od šestého týdne věku dítěte ve třech dávkách s minimálním rozestupem čtyř týdnů. Očkování by mělo být ukončeno nejlépe před dosažením 20.–22. týdne věku dítěte, nejpozději však do 26. týdne věku [62].
Druhý typ vakcíny je monovalentní, také perorálně podávaná živá oslabená vakcína. Očkovací látka obsahuje rotavirový kmen RIX4414 vyvinutý z atenuovaného lidského kmene G1P, který je nejčastěji se vyskytujícím rotavirovým kmenem. Kultura je pomnožována opět na Vero buňkách tkáňových kultur. Lze ji aplikovat od 6. tý-dne věku, a to ve dvou dávkách, s minimálním odstupem čtyři týdny. Očkování je třeba ukončit do 24. týdne života dítěte [63].
Pro aplikaci obou dvou vakcín nejsou doporučována žádná omezení z hlediska jídla, pití a kojení před očkováním a po něm. Vakcíny mezi sebou nelze zaměňovat, očkovací schéma je nutné provést jednou danou vakcínou. Obě dvě očkovací látky jsou dobře tolerované, ale vzhledem k předchozím problémům s první komerčně po-užívanou vakcínou proti rotavirovým nákazám je podávání nových vakcín kontraindikováno u dětí, u nichž je zjištěna intususcepce v anamnéze anebo které mají vrozenou malformaci gastrointestinálního traktu [64].
WHO doporučuje začlenit očkování proti rotavirům do národních očkovacích kalendářů s důrazem na význam očkování proti rotavirům v rozvojových zemích, kde onemocnění obvykle probíhají s vysokou mortalitou. Za nejdůležitější považuje WHO zavedení očkování v oblastech, kde je mortalita dětí mladších pěti let vyšší nebo rovna deseti procentům. WHO neupřednostňuje jednu vakcínu před druhou. Do-poručuje podat první dávku ve věku 6 až 15 týdnů a ukončit očkování do 32. týdne věku dítěte.
V současnosti se rutinně očkuje ve 14 ze-mích na americkém a evropském kontinentu. Vakcína byla akceptována v Guayaně, Hondurasu, Nikaragui a Bolívii. Severní Súdán je první zemí afrického kontinentu, která přistoupila k očkovací kampani, a to v létě 2011. Nadace GAVI (Global Alliance for Vaccines and Immunizations) plánuje ve spolupráci s WHO očkovací kampaň, která zahrne 50 milionů dětí ze 40 nejchudších zemí světa, s tím, že očkovací akce by měla proběhnout do roku 2015 [65].
Závěr
Závěrem je možné shrnout, že pozitivní dopad očkování proti rotavirovým infekcím je potvrzen a nelze než očkování doporučit pro populaci České republiky, kde se bohužel množství očkovaných dětí zatím pohybuje v relativně nízkých číslech [66].
Seznam použité literatury
- [1] Meloni A, Locci D, Frau G, et al. Epidemiology and prevention of rotavirus infection; an underestimated issue? J Matern Fetal Neonatal Med 2011; Suppl 2: 48–51.
- [2] Moore SR, Lima AA, Guerrant RL. Infection: Preventing 5 million child deaths from diarrhea in the next 5 years. Nat Rev Gastroenterol Hepatol 2011; 8: 363–364.
- [3] Rotavirus surveillance worldwide – 2009. Wkly Epidemiol Rec 2011; 86: 174–176.
- [4] Black RE, Lopez de Romana G, Brown KH, et al. Incidence and etiology of infantile diarrhea and major routes of transmission in Huascar, Peru. Am J Epidemiol 1989; 129: 785–799.
- [5] Schorling JB, Wanke CA, Schorling SK, et al. A prospective study of persistent diarrhea among children in urban Brazilian slum. Patterns of occurrence and etiologic agents. Am J Epidemiol 1990; 132: 144–156.
- [6] Simhon A, Mata L, Vives M, et al. Low endemicity and low pathogenicity of rotaviruses among rural children in Costa Rica. J Infect Dis 1985; 152: 1134–1142.
- [7] Latipov R, Utegenova E, Kuatbayeva K, et al. Epidemiology and burden of rotavirus disease in Central Asia. Int J Infect Dis 2011; 15: e464–469.
- [8] Fischer Walker CL, Black RE. Rotavirus vaccine and diarrhea mortality: quantifying regional varia-tion in effect size. BMC Public Health 2011; Suppl 3: S16.
- [9] Cook SM, Glass RI, LeBaron CW, Ho MS. Global seasonality of rotavirus infections. Bull World Health Organ 1990; 68: 171–177.
- [10] Kapikian AZ. Overview of viral gastroenteritis. Arch Virol Suppl 1996; 12: 7–19.
- [11] Glass RI, Patel M, Parashar U. Lessons from the US rotavirus vaccination program. JAMA 2011; 306: 1701–1702.
- [12] Cortes JE, Curns AT, Tate JE, et al. Rotavirus vaccine and health care utilization for diarrhea in U.S. children. N Engl J Med 2011; 365: 1108–1117.
- [13] Pazdiora P, Taborska J, Svecova M. Long-term follow-up of nosocomial rotavirus infections at the Infectious Diseases Clinic of the Medical School Hospital in Plzen (1987-1994). Epidemiol Mikro-biol Imunol 1996; 45: 95–100.
- [14] Pazdiora P, Svecova M. Serologic overview of rotavirus antibodies in children under 2 years of age. Epidemiol Mikrobiol Imunol 1997; 46: 34–35.
- [15] Pazdiora P, Benes C. Diagnosis and notification of rotavirus infection in the Czech Republic. Epide-miol Mikrobiol Imunol 2000; 49: 16–18.
- [16] Bhowmick K, Kang G, Bose A, et al. Retrospective surveillance for intussusceptions in children aged less than five years in a South Indian tertiary-care hospital. J Health Popul Nutr 2009; 27: 660–665.
- [17] Atchison C, Lopman B, Edmunds WJ. Modelling the seasonality of rotavirus disease and the impact of vaccination in England and Wales. Vaccine 2010; 19: 3118–3126.
- [18] Levy K, Hubbard AE, Eisenberg JN. Seasonality of rotavirus disease in the tropics: a systematic review and meta-analysis. Int J Epidemiol 2009; 38: 1487–1496.
- [19] Enskhsaikhan D, Loparev VN, Bostik V, et al. Genotyping of varicella zoster virus strains isolated in Mongolia. Vopr Virusol 2010; 55: 40–43.
- [20] Ruiz MC, Leon T, Diaz Y, Michelangeli F. Molecular biology of rotavirus entry and replication. Scientific World Journal 2009; 9: 1476–1997.
- [21] da Silva MF, Tort LF, Gómez MM, et al. Phylogenetic analysis of VP1, VP2, and VP3 gene segments of genotype G5 group A rotavirus strains circulating in Brazil between 1986 and 2005. Virus Res 2011; 160: 381–388.
- [22] Donker NC, Foley M, Tamvakis DC, et al. Identification of an antibody-binding epitope on the rotavirus A non-structural protein NSP2 using phage display analysis. J Gen Virol 2011; 92: 2374–2382.
- [23] Akita F, Miyazaki N, Hibino H, et al. Viroplasm matrix protein Pns9 from rice gall dwarf virus forms an octameric cylindrical structure. J Gen Virol 2011; 92: 2214–2221.
- [24] Top KA, Esquilin JM, Yen C, et al. Detection of mutations in antigenic regions of rotavirus viral proteins 4 and 7 in a child with chronic shedding of rotavirus vaccine-type strain. Pediatr Infect Dis J 2011; 30: 630.
- [25] McDonald SM, Patton JT. Rotavirus VP2 core shell regions critical for viral polymerase activation. J Virol 2011; 85: 3095–3105.
- [26] Ghosh S, Paul SK, Hossain MA, et al. Full genomic analyses of two human G2P[4] rotavirus strains detected in 2005: identification of a caprine-like VP3 gene. J Gen Virol 2011; 92: 1222–1227.
- [27] McDonald SM, Patton JT. Assortment and packing of the segmented rotavirus genome. Trends Microbiol 2011; 19: 136–144.
- [28] Ghosh S, Adachi N, Gatheru Z, et al. Whole-genome analysis reveals the complex evolutionary dynamics of Kenyan G2P[4] human rotavirus strains. J Gen Virol 2011; 92: 2201–2208.
- [29] Zhou H, Guo L, Wang M, et al. Prime immuniza-tion with rotavirus VLP 2/6 followed by boosting with an adenovirus expressing VP6 induces protective immunization against rotavirus in mice. Virol J 2011; 8: 3.
- [30] Kirkwood CD. Genetic and antigenic diversity of human rotaviruses: potential impact on vaccination programs. J Infect Dis 2010; 1: S43–48.
- [31] Steele AD, Page N, de Beer M, Sawadogo S. Antigenic and molecular characterization of unusual rotavirus strains in Burkina Faso in 1999. J Infect Dis 2010; 202: S225–230.
- [32] O'Ryan M. The ever-changing landscape of rotavirus serotypes. Pediatr Infect Dis J 2009; 28: S60–62.
- [33] Velázquez FR. Protective effects of natural rotavirus infection. Pediatr Infect Dis J 2009; 28: S54–56.
- [34] Antunes H, Afonso A, Iturriza M, et al. G2P[4] the most prevalent rotavirus genotype in 2007 winter season in an European non-vaccinated population. J Clin Virol 2009; 45: 76–78.
- [35] Karsten C, Baumgarte S, Friedrich AW, et al. Incidence and risk factors for community-acquired acute gastroenteritis in north-west Germany in 2004. Eur J Clin Microbiol Infect Dis 2009; 28: 935–943.
- [36] Kiulia NM, Nyaundi JK, Peenze I, et al. Rotavirus infections among HIV-infected children in Nairobi, Kenya. J Trop Pediatr 2009; 55: 318–323.
- [37] Kamel AH, Ali MA, El-Nady HG, et al. Predominance and circulation of enteric viruses in the region of Greater Cairo, Egypt. J Clin Microbiol 2009; 47: 1037–1045.
- [38] Ushijima H, Ishida S. Rotavirus vaccine. Nihon Rinsho 2008; 66: 1977–1983.
- [39] Jin Y, Chneg WX, Yang XM, et al. Viral agents associated with acute gastroenteritis in children hospitalized with diarrhea in Lanzhou, China. J Clin Virol 2009; 44: 238–241.
- [40] Midgley SE, Bányai K, Buesa J, et al. Diversity and zoonotic potential of rotaviruses in swine and cattle across Europe. Vet Microbiol 2011; Oct. 25 Epub ahead of print.
- [41] Taborska J, Pazdiora P. Rotavirus jako nejčastější původce průjmů u dětí. Pediatrie pro praxi 2005; 3: 135–140.
- [42] Cunningham AL, Grohman GS, Harkness J, et al. Gastrointestinal viral infections in homosexual men who were symptomatic and seropositive for human immunodeficiency virus. J Infect Dis 1988; 158: 386–391.
- [43] Goodgame RW. Viral causes of diarrhea. Gastroenterol Clin North Am 2001; 30: 779–795.
- [44] Glass RI, Bresee J, Jiang B, et al. Gastroenteritis viruses: an overview. Novartis Found Symp 2001; 238: 5–19.
- [45] Oliveira CS, Linhares AC. Rotavirus: clinical features and prevention. J Pediatr 1999; 75: S91–102.
- [46] Ojeh CK, Cusack TM, Yolken RH. Evaluation of the effects of disinfectants on rotavirus RNA and infectivity by the polymerase chain reaction and cell-culture methods. Mol Cell Probes 1995; 9: 341–346.
- [47] Li D, Gu AZ, He M, et al. UC inactivation and resistance of rotavirus evaluated by integrated cell culture and real-time RT-PCR assay. Water Res 2009; 43: 3261–3269.
- [48] Greenberg HB, Estes MK. Rotaviruses: from pa-thogenesis to vaccination. Gastroenterology 2009; 136: 1939–1951.
- [49] Desselberger U, Manktelow E, Li W, et al. Rotaviruses and rotavirus vaccines. Br Med Bull 2009; 90: 37–51.
- [50] Parashar UD, Gibson CJ, Bresse JS, Glass RI. Rotavirus and severe childhood diarrhea. Emerg Infect Dis 2006; 12: 304–306.
- [51] Forster J, Guarino A, Parez N, et al. Hospital-based surveillance to estimate the burden of rotavirus gastroenteritis among European children younger than 5 years of age. Pediatrics 2009; 123: 393–400.
- [52] Phillips G, Lopman B, Rodrigues LC, Tam CC. Asymptomatic rotavirus infections in England: prevalence, characteristics, and risk factors. Am J Epidemiol 2010; 171: 1023–1030.
- [53] Eckardt AJ, Baumgart DC. Viral gastroenteritis in adults. Recent Pat Antiinfect Drug Discov 2011; 6: 54–63.
- [54] Gray J. Rotavirus vaccines: safety, efficacy and public health impact. J Intern Med 2011; 270: 206–214.
- [55] Tate JE, Parashar UD. Monitoring impact and effectiveness of rotavirus vaccination. Expert Rev Vaccines 2011; 10: 1123–1125.
- [56] Kawamura N. Rotavirus vaccine. Nihon Rinsho 2011; 69: 1609–1615.
- [57] Dennehy PH. Rotavirus vaccine: an overview. Clin Microbiol Rev 2008; 21: 198–208.
- [58] Matson DO. RotaShield: the ill-fated rhesus-human reassortant rotavirus vaccine. Pediatr Ann 2006; 35: 44–50.
- [59] Ward RL, McNeal MM, Steele AD. Why does the world need another rotavirus vaccine? Ther Clin Risk Manag 2008; 4: 49–63.
- [60] Glass RI, Bressee JS, Turcios R, et al. Rotavirus vaccine: targeting the developing world. J Infect Dis 2005; 192: S160–166.
- [61] Vesikari T, Giaguinto C, Huppertz HI. Clinical trials of rotavirus vaccine in Europe. Pediatr Infect Dis J 2006; 25: S42–47.
- [62] http://www.ema.europe.eu.
- [63] Plosker GL. Rotavrius vaccine RIX4414 (Rotarix™): a pharmacoeconomic review of its use in the prevention of rotavirus gastroenteritis in developed countries. Pharmacoeconomics 2011; 29: 439–454.
- [64] Lob-Levyt J. Contribution of the GAVI Alliance to improving health and reducing poverty. Philos Trans R Soc Lond B Biol Sci 2011; 366: 2473–2477.
- [65] Nossai GJ. Vaccines and future global health needs. Philos Trans R Soc Lond B Biol Sci 2011; 366: 2833–2840.
- [66] Pazdiora P. Rotavirové infekce v současnosti, možnosti prevence a očkování. Postgraduální medicína 2011; 9: 964–970.