Rozšiřující se možnosti léčby intersticiálního plicního postižení u systémových onemocnění pojiva
Souhrn:
Horák P, Žurková M, Skoumalová A, Žurek M, Skácelová M. Rozšiřující se možnosti léčby intersticiálního plicního postižení u systémových onemocnění pojiva. Remedia 2022; 32: 12–20.
Intersticiální plicní postižení je častou orgánovou manifestací systémových chorob pojiva, jako jsou systémová sklerodermie, idiopatické zánětlivé myopatie či revmatoidní artritida. Byť tyto formy plicního postižení mají lepší prognózu než idiopatická plicní fibróza, představují i tak hlavní determinantu zvýšené morbidity a mortality revmatických chorob. V současnosti je třeba přehodnotit roli, která se připisuje metotrexátu v souvislosti s rozvojem intersticiálního plicního onemocnění. Z nově publikovaných studií vyplývá, že rozvoj intersticiálního plicního postižení není spojen s užíváním metotrexátu, ba naopak, jeho užívání může u nemocných rozvoj této manifestace pravděpodobně zpomalit. Historicky i v současnosti jsou manifestace intersticiálního plicního postižení u revmatických chorob léčeny především širokou paletou protizánětlivých léčiv, jejichž preference se u jednotlivých chorob liší. Je možné použít glukokortikoidy, cyklofosfamid, mykofenolát mofetil, azathioprin, kalcineurinové inhibitory či rituximab. Nová data poukazují také na efekt tocilizumabu v léčbě intersticiálního plicního postižení u sklerodermie. Efekt těchto léků je však nízký u fibrotizujících forem, kde se začínají uplatňovat antifibrotické léky používané již dříve v terapii idiopatické plicní fibrózy. Nintedanib je intracelulární inhibitor tyrozinkináz, který je již zavedenou léčebnou modalitou u idiopatické plicní fibrózy. Klinické studie prokázaly jeho efekt na zpomalení progrese intersticiálního plicního postižení u systémové sklerodermie, jakož i u dalších systémových chorob pojiva.
Summary:
Horak P, Zurkova M, Skoumalova A, Zurek M, Skacelova M. Broadening the treatment possibilities of interstitial lung damage in systemic connective tissue diseases. Remedia 2022; 32: 12–20.
Interstitial lung disease is a common organ manifestation of systemic connective tissue diseases such as systemic scleroderma, idiopathic inflammatory myopathies or rheumatoid arthritis. Although these forms of pulmonary involvement have a better prognosis than idiopathic pulmonary fibrosis, they are still a significant determinant of increased morbidity and mortality in rheumatic diseases. The role of methotrexate in the development of interstitial lung disease needs to be reconsidered. Newly published studies show that the development of interstitial lung disease is not associated with its use; on the contrary, its use in patients is likely to slow down the development of this manifestation. Historically and today, the manifestations of interstitial lung disease in rheumatic diseases are treated primarily by a wide range of anti‑inflammatory drugs, whose preferences vary from disease to disease. Glucocorticoids, cyclophosphamide, mycophenolate mofetil, azathioprine, calcineurin inhibitors or rituximab may be used. The new data also point to the effect of tocilizumab in the treatment of interstitial lung disease in scleroderma. However, the effect of these drugs is low in fibrotic forms, where antifibrotic drugs used previously in the treatment of idiopathic pulmonary fibrosis are beginning to be used. Nintedanib is an intracellular tyrosine kinase inhibitor, an established treatment modality in idiopathic pulmonary fibrosis. Clinical studies have shown its effect in slowing disease progression in interstitial lung disease in systemic scleroderma as well as in other systemic connective tissue diseases.
Key words: systemic connective tissue diseases, systemic scleroderma, idiopathic inflammatory myopathies, rheumatoid arthritis, interstitial lung disease, treatment, tocilizumab, nintedanib.
Úvod
Systémové choroby pojiva (connective
tissue diseases, CTD) jsou orgánově nespecifické autoimunitní
nemoci, které mohou postihovat řadu tkání lidského organismu,
přičemž struktury plic jsou častým cílem autoimunitního
procesu. Lze se setkat s postižením plicního intersticia,
dýchacích cest, pleury či plicní vaskulatury [1].
Četnost těchto manifestací se mezi jednotlivými chorobami liší
(tab. 1). Plicní manifestace je častou determinantou zvýšené
morbidity a mortality těchto nemocných.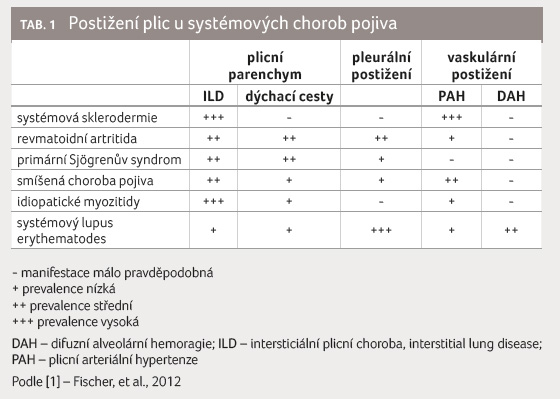
Předložený článek se věnuje současným a nově se otvírajícím perspektivám léčby intersticiálního plicního postižení (interstitial lung disease, ILD) u této specifické skupiny nemocných.
Intersticiální plicní postižení u revmatických chorob
Mezi nejčastější typy intersticiálního plicního postižení u systémových chorob pojiva (CTD ILD) se řadí nespecifická intersticiální pneumonie (NSIP), obvyklá intersticiální pneumonie (UIP), organizující se pneumonie (OP), lymfocytární intersticiální pneumonie (LIP), akutní intersticiální pneumonie (AIP)/difuzní alveolární poškození (DAD) a vzácně pak deskvamující intersticiální pneumonie (DIP) [2]. Nejčastěji se ILD vyskytuje u systémové sklerodermie (SSc), pak u idiopatických myozitid a u revmatoidní artritidy (RA). Plicní fibróza se stává ruku v ruce s plicní arteriální hypertenzí (PAH) hlavní příčinou úmrtí nemocných se SSc [3]. ILD je závažnou manifestací idiopatické myozitidy či RA, která výrazně zhoršuje prognózu nemocných [4].
U systémového lupusu erythematodes (SLE), Sjögrenova syndromu a u nediferencované choroby pojiva se ILD vyskytuje také, ale relativně méně často, proto uvedeným chorobám tento článek speciální pozornost nevěnuje.
Rozlišení mezi idiopatickou plicní fibrózou (IPF) a CTD ILD je důležité z pohledu prognózy. Všeobecně lze říci, že sekundární formy ILD mají příznivější průběh, byť i jejich dopad je velmi závažný [5].
Systémová sklerodermie
U více než 50 % nemocných se
SSc se vyskytuje ILD (dále SSc ILD). Nejčastějším typem
postižení je NSIP (obr. 1). Klinicky závažnější formy
se vyvíjejí zpravidla u difuzní formy SSc charakterizované
rozsáhlejším kožním postižením a přítomností
protilátky proti topoizomeráze anti SCl 70. Souběžný
výskyt ILD a PAH předznamenává výrazně ho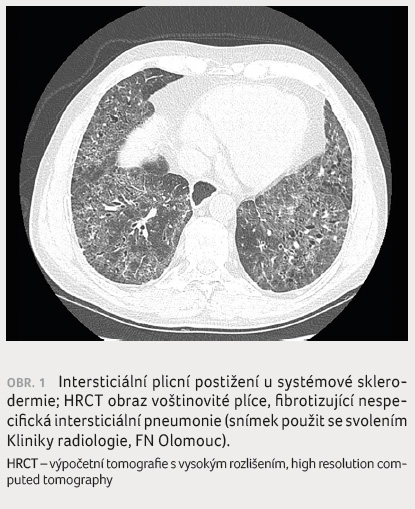 rší prognózu
a vyžaduje agresivní léčbu s včasnou úvahou
o transplantaci plic. Mezi další rizikové faktory rozvoje
nepříznivé formy ILD patří časný pokles usilovné vitální
kapacity (forced vital capacity, FVC) a difuzní kapacity pro
oxid uhelnatý (DLCO), rozsah postižení plicního parenchymu
pozorovaný pomocí výpočetní tomografie s vysokým
rozlišením (high resolution computer tomography, HRCT), vyšší
věk, mužské pohlaví a afroamerické etnikum nemocných
[6,7].
rší prognózu
a vyžaduje agresivní léčbu s včasnou úvahou
o transplantaci plic. Mezi další rizikové faktory rozvoje
nepříznivé formy ILD patří časný pokles usilovné vitální
kapacity (forced vital capacity, FVC) a difuzní kapacity pro
oxid uhelnatý (DLCO), rozsah postižení plicního parenchymu
pozorovaný pomocí výpočetní tomografie s vysokým
rozlišením (high resolution computer tomography, HRCT), vyšší
věk, mužské pohlaví a afroamerické etnikum nemocných
[6,7].
Idiopatické myozitidy
Značná část morbidity a mortality těchto nemocných je rovněž spojena s ILD. Nejčastějším typem intersticiálního procesu je NSIP a OP. Prognóza je horší u starších nemocných, amyopatických forem choroby a při akutních průbězích plicního postižení s iniciálně nízkou FVC.
Zvláštní pozornost si zasluhuje
antisyntetázový syndrom s vysokou frekvencí ILD (obr. 2),
která může progredovat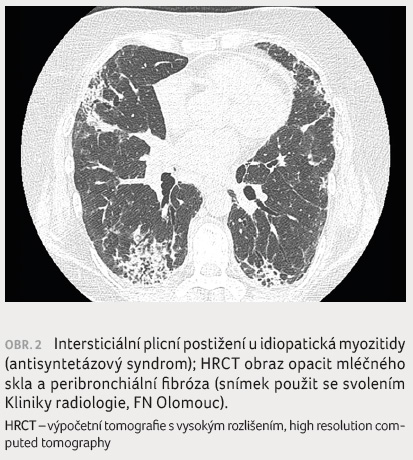 směrem k rozvoji UIP. Tato jednotka
je charakteristická přítomností artritidy rukou, změnami typu
„ruka jemného mechanika“ (fine mechanic hand), Raynaudovým
fenoménem, horečkou a často variabilní přítomností
myozitidy. Nejčastějšími protilátkami jsou anti Jo 1
[2,8].
směrem k rozvoji UIP. Tato jednotka
je charakteristická přítomností artritidy rukou, změnami typu
„ruka jemného mechanika“ (fine mechanic hand), Raynaudovým
fenoménem, horečkou a často variabilní přítomností
myozitidy. Nejčastějšími protilátkami jsou anti Jo 1
[2,8].
Protilátka MDA5 se pojí s idiopatickou myozitidou a také s amyopatickými formami nemoci a u značné části nemocných vede k rychle progredující formě ILD s rozvojem závažné plicní dysfunkce s rizikem časné smrti [9,10].
Revmatoidní artritida
Revmatoidní artritida může postihnout všechny části dýchacího systému. Nejvýznamnější je ILD a postižení dýchacích cest (bronchiektazie, bronchiolitida). Klinicky významná ILD se vyskytuje u zhruba 10 %, subklinické formy postihují až 30 % nemocných s RA (dále RA ILD) [11]. V některých případech může manifestace RA ILD předcházet kloubní chorobě. Na rozdíl od SSc převažuje v 60 % typ UIP, který se jeví prognosticky závažnějším [12]. Observační studie u pacientů s RA ILD prokázala vysokou mortalitu této manifestace (tříletá mortalita 10 %, šestiletá 30 %, o
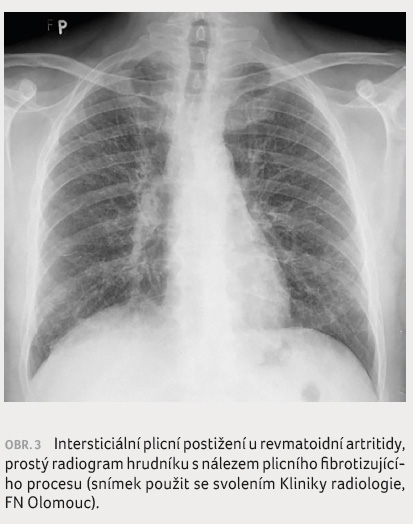
smiletá 50 %) [4]. Mezi rizikové faktory rozvoje patří mužské pohlaví, vyšší věk, séropozitivita a kouření [12]. V patogenezi RA ILD hraje významnou roli citrulinace proteinů a přítomnost protilátek proti cyklickým citrulinovaným peptidům (ACPA), což je předmětem intenzivního vědeckého zájmu. Může se vyskytnout i velmi akutní exacerbace RA ILD, která je spojena s rychlým rozvojem přítomnosti opacit mléčného skla a kondenzací plicního parenchymu patrných při radiologickém vyšetření (obr. 3) a má časnou a vysokou mortalitu [11].
Metotrexát a riziko rozvoje ILD
Užívání metotrexátu (MTX) jako základního chorobu modifikujícího léku řady zánětlivých revmatických chorob je spojeno s rizikem rozvoje vzácné, ale potenciálně fatální komplikace – metotrexátové plíce. Jedná se v klasickém případě o akutní zánětlivou pneumonitidu. Obavy z vlivu MTX omezovaly jeho použití či vedly k jeho vysazování u nemocných s ILD spojenou zejména s RA. Tento předpoklad byl zpochybněn retrospektivními údaji naznačujícími, že progrese RA ILD je pomalejší při nasazení MTX než při srovnávané jiné terapii modifikující chorobu [13]. V roce 2020 pak několik na sobě nezávislých studií [14–17] významně přehodnotilo spojitost mezi rozvojem RA ILD a užíváním MTX. Z nich vyplývá, že rozvoj RA ILD nejen že není spojen s užíváním MTX, ale že naopak jeho užívání u nemocných může rozvoj RA ILD pravděpodobně zpomalit. Zda tato data ovlivní běžnou klinickou praxi, závisí na průkazu kauzality a vyhodnocení prospektivních dat [18].
Diagnostika ILD u revmatických chorob
Včasná diagnostika ILD je základním předpokladem úspěšné terapie. Hlavní roli zde hraje mezioborová spolupráce revmatologa, pneumologa a radiologa a povědomí o významném riziku rozvoje ILD u revmatických chorob. Včasné odeslání k pneumologovi je indikováno samozřejmě tváří v tvář klinickým symptomům (dušnost, kašel, oboustranný poslechový krepitus, hypoxemie, clubbing prstů – tzv. paličkovité prsty). Screeningové strategie pro včasnou diagnostiku ILD u pacientů s revmatickým onemocněním jsou založeny na konsenzu a u jednotlivých chorob se mohou lišit dle frekvence rizika ILD [2].
U všech nemocných se systémovou sklerodermií se doporučuje provést vstupně funkční plicní vyšetření, skiagram hrudníku a echokardiografii, případě zvážit provedení HRCT hrudníku. V případě normálního nálezu je doporučeno každoročně opakovat funkční vyšetření plic.
Podobná strategie se používá také u idiopatických myozitid, frekvence opakovaných funkčních vyšetření plic má být častější u nemocných s rizikovým protilátkovým profilem.
U asymptomatických pacientů s RA se plicní funkční testy doporučují zejména v rizikových skupinách (kuřáci, muži, vyšší věk), HRCT se doplňuje dle jejich výsledků.
K posouzení typu zánětu, který hraje v rozvoji ILD roli, je třeba v některých případech přikročit k provedení bronchoalveolární laváže s následným cytologickým vyšetřením aspirátu, což může pomoci při volbě vhodné farmakoterapie. Současně probíhá intenzivní výzkum potenciálních sérových ukazatelů rizika rozvoje ILD u revmatických chorob.
Léčba ILD u revmatických chorob
Historicky i v současnosti jsou manifestace ILD u revmatických chorob léčeny především širokou paletou protizánětlivých léčiv, jejichž preference se u jednotlivých chorob liší. V léčbě zánětlivých chorob s obrazem buněčně bohaté NSIP či OP je možné použít glukokortikoidy (GK), cyklofosfamid (CFA), mykofenolát mofetil (MMF), azathioprin (AZA), kalcineurinové inhibitory (CNI) či B depleční terapii (rituximab). Nová data poukazují také na efekt tocilizumabu (inhibitor interleukinu 6 [IL 6]) v terapii SSc ILD.
Efekt těchto léků je však nízký u fibrotizujících forem (fibrotizujících NSIP, UIP), kde se začínají uplatňovat antifibrotické léky používané již dříve v terapii primárních forem ILD (nintedanib).
Glukokortikoidy
U CTD ILD je možné GK použít, zatímco u IPF jsou kortikoidy užívány pouze k léčbě akutních exacerbací či k ovlivnění kašle. V případě NSIP a OP může jejich použití vést k regresi konsolidací [2]. U SSc ILD nebyl prokázán jejich pozitivní efekt, naopak vyšší dávky GK zvyšují nebezpečí rozvoje renální krize. U závažných forem ILD doprovázejících myozitidy (antisyntetázový syndrom, pozitivita protilátky MDA5) je třeba podávat GK ve vysokých pulzních dávkách [8].
U RA ILD jsou k dispozici převážně retrospektivní, observační a empirická data poukazující na zlepšení plicních funkcí, výsledků testů chůze a na stabilizaci radiologického nálezu při terapii GK [19,20].
Cyklofosfamid
U SSc ILD se použití CFA opírá o randomizované, placebem kontrolované studie FAST (Fibrosing Alveolitis in Scleroderma) a SLC I (Scleroderma Lung Study I) [21,22], které prokázaly určitý pozitivní trend léčby na zlepšení FVC (byť v případě studie FAST nesignifikantní). Další analýzy poukázaly na fakt, že lepších výsledků dosahovali nemocní s výraznějším postižením plic a kůže [23].
Analýza publikovaných nerandomizovaných klinických studií sledujících efekt CFA na ILD u idiopatických myozitid ukazuje, že jeho použití může pozitivně ovlivnit jak svalovou sílu a funkci, tak i plicní funkce u pacientů s refrakterními formami nemocí a je efektivní rovněž v léčbě ILD asociovaného s antisyntetázovým syndromem [24].
Údaje o úspěšném použití CFA u RA ILD jsou rozporuplné a pouze observační. Nedávno publikovaná rozsáhlá japonská retrospektivní analýza 129 nemocných léčených CFA oproti 516 kontrolám neprokázala žádný pozitivní efekt léčby [25].
Mykofenolát mofetil a azathioprin
Mykofenolát mofetil a azathioprin patří do skupiny antimetabolicky působících léků a oba jsou široce užívány v léčbě CTD. MMF představuje alternativu CFA v indukční léčbě, je používán také jako udržovací léčba dosažené remise či nízké aktivity choroby. AZA je dlouhodobě používaným lékem v udržení remise CTD a uplatňuje se jako lék snižující potřebu použití GK. Oba přípravky jsou také nasazovány u CTD ILD.
U SSc ILD byl MMF porovnáván s CFA v randomizované studii SLS II (Scleroderma Lung Study II), kdy prokázal srovnatelný efekt na FVC a podobně jako CFA minimální efekt na kožní sklerózu. V porovnání s CFA byl lépe tolerován s menším množstvím nežádoucích účinků zejména infekční povahy [26]. Další observační studie poukazují na lepší přežívání a na určitý pozitivní efekt MMF na remodelaci plicního řečiště při PAH [27,28]. AZA je v léčbě SSc ILD používán empiricky a dlouhodobě zejména jako udržovací léčba po předchozí terapii CFA.
MMF a AZA prokazují podobný pozitivní efekt na zachování FVC v léčbě ILD rovněž u idiopatických myozitid v jedné retrospektivní studii [29]. MMF má v této studii lepší bezpečnostní profil.
Důkazy podporující použití MMF u RA ILD stále chybějí, MMF je navíc neúčinný na kloubní manifestace choroby, což limituje případný prospěch z léčby. Existují pouze malé série případů a retrospektivní data poukazující na lepší přežití pacientů s RA ILD léčených MMF než AZA [30], souhrnně o nich referuje loňská review [31].
Kalcineurinové inhibitory
Cyklosporin A a takrolimus reprezentují CNI, které inhibují aktivaci T lymfocytů. U SSc ILD jsou používány minimálně pro obavy z indukce renální krize. Jejich potenciál pro léčbu CTD ILD je značný u myozitid, kde je jejich použití podpořeno i nově publikovanou randomizovanou otevřenou studií [32] a kde příznivě ovlivňují častokrát i myozitickou složku nemoci. U RA ILD je jejich efekt dokumentován jen sporadicky [33].
Rituximab
Efekt B depleční terapie lze teoreticky očekávat zejména tam, kde v patogenezi ILD dominuje přítomnost lymfoidní infiltrace či folikulů nebo typ LIP (například u onemocnění dýchacích cest u RA nebo Sjögrenova syndromu), ale také u některých forem s typem postižení UIP. Systematická review z roku 2021 u SSc zahrnující tři randomizované a sedm nerandomizovaných studií ukazuje v pěti případech statisticky významné zlepšení FVC, z pohledu kůže pak osm studií prokazuje statisticky významné zlepšení modifikovaného Rodnanova kožního skóre [34]. Retrospektivní data hodnotí pozitivně efekt rituximabu u ILD asociovaného s idiopatickými myozitidami včetně rychle progredujícího postižení plic u MDA5 pozitivních pacientů [35,36]. Terapie rituximabem v observačních studiích [37] či v údajích z registrů [38] zpomaluje rovněž rozvoj RA ILD.
V posledních letech byly publikovány výsledky rozsáhlých multicentrických prospektivních, randomizovaných a dvojitě zaslepených, placebem kontrolovaných studií zkoumajících u nemocných s CTD ILD efekt farmakoterapie tocilizumabem a nintedanibem.
Tocilizumab u SSc ILD
Již studie fáze II přinesla předběžný důkaz o účinnosti subkutánně podávaného inhibitoru IL 6 tocilizumabu u SSc ILD, kdy podstatně méně účastníků léčených tocilizumabem vykázalo proti placebové skupině pokles hodnoty FVC. Při hodnocení FVC plic se jednalo o sekundární cíl této 48týdenní dvojitě zaslepené studie fáze II (faSScinate) [39] a její extenze [40]. Do studie bylo zařazeno 87 nemocných se SSc – šlo o populaci časných forem sklerodermie do pěti let od první manifestace choroby (nepočítaje v to Raynaudův fenomén) s laboratorně vyšší zánětlivou aktivitou. Nutno podotknout, že primárního cíle, signifikantního ovlivnění progrese modifikovaného Rodnanova kožního skóre, dosaženo nebylo.
Studie fáze III (focuSSed trial) pak zahrnula 210 nemocných s časnou formou sklerodermie s vyšší zánětlivou aktivitou (do 5 let trvání příznaků). Výsledky byly ve 48. týdnu konzistentní se studií fáze II. Ani zde nebyl prokázán pozitivní vliv na primární cílový ukazatel studie – kožní skóre. Byl však doložen statisticky signifikantní pozitivní efekt tocilizumabu oproti placebu na zachování FVC plic s rozdílem 4,2 bodu (95% interval spolehlivosti [CI] 2,0–6,4; p = 0,0002; hodnoceno statistickou metodou nejmenších čtverců průměru hodnot) [41].
Výsledky těchto studií prokazující efekt podávání subkutánního tocilizumabu na zachování plicních funkcí u časných forem SSc se vstupně vyšší zánětlivou aktivitou vedly americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) v roce 2021 k registraci tocilizumabu pro léčbu SSc ILD. Evropská léková agentura (European Medicines Agency, EMA) k registraci tocilizumabu pro tuto indikaci zatím nepřikročila.
Jak potvrzuje dosavadní zkušenost, výsledky tocilizumabu nelze automaticky extrapolovat pro další formy CTD ILD, u kterých existují prozatím pouze observační či retrospektivní data [42].
Nintedanib u SSc ILD a CTD ILD
Nintedanib je intracelulární inhibitor tyrozinkináz, který je již zavedenou léčebnou modalitou u IPF. Ačkoliv IPF a plicní postižení v rámci systémových chorob pojiva mají jiné spouštěče, u obou nemocí dochází k transformaci fibroblastů do myofibroblastového fenotypu a k nadměrné depozici proteinů extracelulární matrix do intersticiálního prostoru. Předpokládá se, že v patogenezi fibrózy hraje důležitou roli řada profibrotických mediátorů včetně růstového faktoru odvozeného od destiček (platelet derived growth factor, PDGF), fibroblastového růstového faktoru (fibroblast growth factor, FGF) a transformačního růstového faktoru beta. Nintedanib je malá molekula a silný inhibitor receptoru tyrozinkináz, PDGF, FGF a receptoru vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor, VEGF). Studie in vitro ukázaly, že nintedanib interferuje s procesy aktivovanými při fibróze, jako jsou proliferace, migrace a diferenciace fibroblastů a sekrece extracelulární matrix. Kromě toho nintedanib prokázal konzistentní antifibrotickou a protizánětlivou aktivitu na zvířecích modelech plicní fibrózy [43]. Tyto údaje poskytly dobrý důvod pro klinický výzkum jeho efektu také u CTD ILD.
Studie SENSCIS
SENSCIS (Safety and Efficacy of Nintedanib in Systemic Sclerosis) byla 52týdenní multicentrická prospektivní, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III, v níž byl 576 zařazeným nemocným se SSc ILD podáván nintedanib v dávce 2× 150 mg denně či placebo [44]. Hlavní zařazovací kritéria představovala SSc s prvním ne Raynaudovým symptomem < 7 let do screeningu, rozsah fibrotických změn ≥ 10 % na HRCT, FVC ≥ 40 % normálních hodnot a DLCO 30–89 %. Jako konkomitantní terapie byly povoleny prednison ≤ 10 mg/den nebo ekvivalent, podávání stabilní dávky MMF nebo MTX ≥ 6 měsíců před randomizací. Primárním hodnoceným parametrem byla roční míra poklesu FVC (ml/rok). Sekundárními parametry byly absolutní změna modifikovaného Rodnanova kožního skóre (mRSS) a změna celkového skóre (St. George Respiratory Questionnaire, SGRQ).
Při analýze byla pozorována roční
míra změny FVC –52,4 ml ve skupině s nintedanibem
a –93,3 ml ve skupině s placebem (rozdíl,
41,0 ml/rok; 95% CI 2,9–79,0; p = 0,04), graf 1A, B. Rodnanovo modifikované kožní skóre se mezi skupinami
po 52 měsících s rozdíly –0,21 (95% CI –0,94
až 0,53; p = 0,58) významně nelišilo [44].
Průjem, jako nejběžnější nežádoucí účinek, byl hlášen
u 75,7 % pacientů ve skupině s nintedanibem
a u 31,6 % pacientů ve skupině s placebem
[45].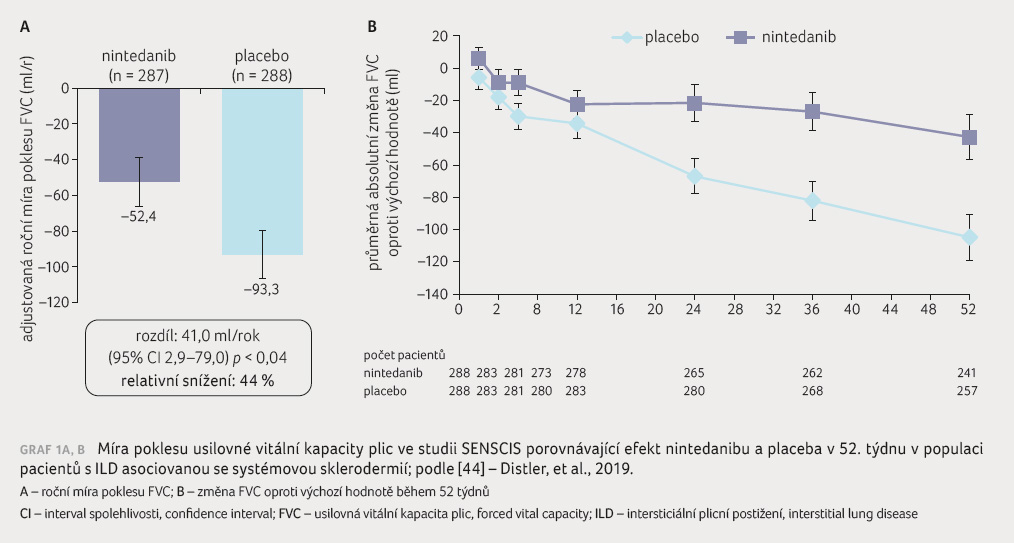
Studie INBUILD
Studie INBUILD (Efficacy and Safety of
Nintedanib in Patients with Progressive Fibrosing Interstitial Lung
Disease) se zaměřila na účinnost a bezpečnost
nintedanibu u pacientů s progredujícími formami ILD mimo
IPF bez ohledu na etiologii onemocnění. Pacienti zahrnutí
do sledování měli ILD postihující více než 10 % plicní
tkáně dle HRCT. U nemocných bylo požadováno splnění
kritérií pro progresi ILD v průběhu 24 měsíců před
screeningem. Léčba AZA, cyklosporinem, MMF, takrolimem,
rituximabem, CFA a vyššími dávkami perorálních
GK v době zařazení do studie byly vylučujícím
kritériem. Do 52týdenní studie bylo zařazeno 663 nemocných.
nintedanib prokázal překvapivou účinnost oproti placebu při
posuzování poklesu FVC: –80,3 ml/rok vs. –187,8 ml/rok
(rozdíl 107,5 ml/rok; 95% CI 65,4–148,5, p < 0,001);
efekt byl doložen v obou hlavních hodnocených podskupinách
(typu UIP vs. non UIP dle HRCT) [46], graf 2A, B.
Nejčastějším onemocněním byla chronická hypersenzitivní
pneumonitida (26,1 %), následovala skupina pacientů s CTD ILD
(25,6 %) zahrnující RA ILD, SSc-ILD a ILD asociované
s ostatními CTD. Multivariační analýza nenalezla rozdíly
v efektu mezi jednotlivými diagnostickými kategoriemi
(p = 0,41) [47,48]. Nejčastějšími nežádoucími
účinky výrazně frekventnějšími než při podávání placeba
byly průjem (66,8 % vs. 23,99 %) a nauzea (28,9 % vs.
9,4 %) [46].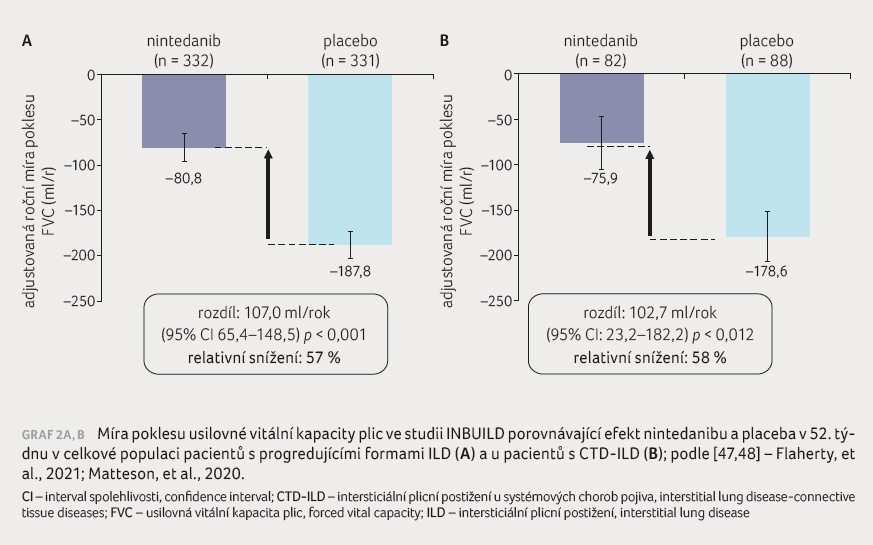
Na základě těchto studií rozšířily FDA i EMA původní indikaci nintedanibu z léčby IPF také na ostatní chronické ILD s progresivním fenotypem. V České republice se jedná o centrový lék, který má v současnosti následující úhradová kritéria:
Léčba nintedanibem je hrazena u dospělých pacientů:
- s IPF, u kterých se FVC pohybuje v rozmezí 50–90 %, TLCO ≥ 30 % a kteří dodržují zákaz kouření;
- s jinými chronickými fibrotizujícími ILD s progresivním fenotypem navzdory stávajícímu individualizovanému léčebnému postupu, přičemž progresivní fenotyp je definován jako relativní pokles FVC o alespoň 10 % ve srovnání s předchozí hodnotou nebo relativní pokles FVC o alespoň 5 % ve srovnání s předchozí hodnotou se současným zhoršováním respiračních symptomů či zvětšováním fibrotického postižení plic nebo jako zhoršování respiračních symptomů a současně zvětšování fibrotického postižení plic; vše hodnoceno kdykoliv během posledních 24 měsíců před zahájením léčby nintedanibem. Diagnóza ILD musí být potvrzena multidisciplinárním týmem příslušného specializovaného centra. Pacienti musejí dále mít FVC alespoň 45 % predikovaných hodnot, TLCO alespoň 30 % a dominující fibrotické změny na HRCT. Úspěšnost terapie v obou indikacích musí být pravidelně přehodnocena po 6, 12 a 18 měsících léčby (a dále také každých 6 měsíců) a zaznamenána ve zdravotnické dokumentaci (dušnost, FVC, TLCO, akutní exacerbace, hospitalizace pro respirační potíže), viz www.sukl.cz.
Transplantace hematopoetických
kmenových buněk
Autologní transplantace hematopoetických kmenových buněk (haematopoietic stem cell transplantation, HSCT) se užívá zřídka k léčbě závažných forem systémových autoimunitních onemocnění, nejvíce údajů je však k dispozici u sklerodermie. Efekt HSCT zde byl hodnocen pozitivně ve třech randomizovaných kontrolovaných studiích [49–51]. Poslední a největší z nich [51] randomizovala 75 nemocných se závažnou SSc k autologní HSCT nebo k infuzím CFA. Během 72 měsíců sledování zemřelo sedm pacientů po autologní transplantaci a 18 pacientů léčených CFA. Přežívání pacientů podle Kaplanovy–Meierovy analýzy dosahovalo po autologní transplantaci 80 %, po léčbě CFA 52 % (p = 0,03), k orgánovému selhání došlo u dvou nemocných po transplantaci a u šesti pacientů léčených CFA. U transplantované skupiny byla nižší potřeba syntetických imunosupresiv (2 pacienti vs. 7 pacientů), větší část nemocných však tuto léčbu nepotřebovala vůbec (92 % vs. 61 %, p = 0,01).
S ohledem na výsledky studií i na rizika spojená s HSCT odborníci doporučují, aby se o této léčbě uvažovalo u vybraných rizikových pacientů s rychle progredujícím typem SSc s rizikem orgánového selhání (zejména plic). HSCT by měla být prováděna ve vybraných centrech se zkušenostmi s tímto druhem léčby [52].
Transplantace plic
U pacientů se selhávající plící trpících CTD může být zvážena orgánová transplantace. Limitujícími faktory jsou aktivita choroby, celkový stav nemocného, možnost restrikčního postižení hrudníku při sklerodermii či riziko aspirace v případě postižení jícnu. Pro hodnocení přínosu transplantace plic při CTD ILD existuje relativně málo dat, retrospektivní studie udávají roční přežívání mezi 81–93 %, pětileté přežití v rozsahu 60–66 % [53,54], v těchto studiích se však jednalo o pečlivě vybrané a selektované pacienty.
Směry dalšího vývoje
V oblasti nových léčiv a postupů terapie CTD ILD se rozvíjí intenzivní preklinický i klinický výzkum. Probíhají studie s přípravky abatacept, pirfenidon, ifetroban, tofacitinib a s dalšími. Na vytvoření indikačních kritérií čeká také HSCT, na zhodnocení přínosu u zánětlivých myozitid pak výměnná plazmaferéza.
Závěr
Intersticiální plicní postižení významně zhoršující prognózu pacientů trpících CTD se dostává do středu pozornosti vývoje nových léčiv. Je nutno opětovně zdůraznit potřebu mezioborové spolupráce revmatologa, pneumologa a radiologa, která umožní včasnou detekci plicního postižení. Současně je třeba vyvinout účinné screeningové strategie ILD u těchto nemocných, zkoumat potenciální markery plicního postižení a vyvíjet a zkoušet další léčebné modality.
Podpořeno MZ ČR RVO FNOL 0098892 a grantem IGA_LF_2021_004.
Seznam použité literatury
- [1] Fischer A, du Bois R. Interstitial lung disease in connective tissue disorders. Lancet 2012; 380: 689–698.
- [2] Doyle TJ, Dellaripa PF. Lung Manifestations in the Rheumatic Diseases. Chest 2017; 152: 1283–1295.
- [3] Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972‑2002. Ann Rheum Dis 2007; 66: 940–944.
- [4] Nieto MA, Rodriguez‑Nieto MJ, Sanchez‑Pernaute O, et al. Mortality rate in rheumatoid arthritis‑related interstitial lung disease: the role of radiographic patterns. BMC Pulm Med 2021; 30: 205.
- [5] Ha YJ, Lee YJ, Kang EH. Lung Involvements in Rheumatic Diseases: Update on the Epidemiology, Pathogenesis, Clinical Features, and Treatment. Biomed Res Int 2018; 2018: 6930297.
- [6] Nihtyanova SI, Schreiber BE, Ong VH, et al. Prediction of pulmonary complications and long‑term survival in systemic sclerosis. Arthritis Rheumatol 2014; 66: 1625–1635.
- [7] Jaeger VK, Wirz EG, Allanore Y, et al. Incidences and Risk Factors of Organ Manifestations in the Early Course of Systemic Sclerosis: A Longitudinal EUSTAR Study. PLoS One 2016; 11: e0163894.
- [8] Fujisawa, T. Management of Myositis‑Associated Interstitial Lung Disease. Medicina 2021, 57: 347.
- [9] Nakashima R, Hosono Y, Mimori T. Clinical significance and new detection system of autoantibodies in myositis with interstitial lung disease. Lupus 2016; 25: 925–933.
- [10] Ye S, Chen XX, Lu XY. Adult clinically amyopathic dermatomyositis with rapid progressive interstitial lung disease: a retrospective cohort study. Clin Rheumatol 2007; 26: 1647–1654.
- [11] Kadura S, Raghu G. Rheumatoid arthritis‑interstitial lung disease: manifestations and current concepts in pathogenesis and management. Eur Respir Rev 2021; 30: 210011.
- [12] Solomon JJ, Chung JH, Cosgrove GP, et al. Predictors of mortality in rheumatoid arthritis‑associated interstitial lung disease. Eur Respir J 2016; 47: 588–596.
- [13] Rojas‑Serrano J, Herrera‑Bringas D, Pérez‑Román DI, et al. Rheumatoid arthritis‑related interstitial lung disease (RA‑ILD): methotrexate and the severity of lung disease are associated to prognosis. Clin Rheumatol 2017; 36: 1493–1500.
- [14] Juge PA, Lee JS, Lau J, et al. Methotrexate and rheumatoid arthritis associated interstitial lung disease. Eur Respir J 2021; 57: 2000337.
- [15] Robles‑Pérez A, Luburich P, Bolivar S, et al. A prospective study of lung disease in a cohort of early rheumatoid arthritis patients. Sci Rep 2020; 10: 15640.
- [16] Ibfelt EH, Jacobsen RK, Kopp TI, et al. Methotrexate and risk of interstitial lung disease and respiratory failure in rheumatoid arthritis: a nationwide population‑based study. Rheumatology (Oxford) 2021; 60: 346–352.
- [17] Li L, Liu R, Zhang Y, et al. A retrospective study on the predictive implications of clinical characteristics and therapeutic management in patients with rheumatoid arthritis‑associated interstitial lung disease. Clin Rheumatol 2020; 39: 1457–1470.
- [18] Wells AU. New insights into the treatment of CTD‑ILD. Nat Rev Rheumatol 2021; 17: 79–80.
- [19] Yamano Y, Taniguchi H, Kondoh Y, et al. Multidimensional improvement in connective tissue disease‑associated interstitial lung disease: Two courses of pulse dose methylprednisolone followed by low‑dose prednisone and tacrolimus. Respirology 2018; 23: 1041–1048.
- [20] Song JW, Lee HK, Lee CK, et al. Clinical course and outcome of rheumatoid arthritis‑related usual interstitial pneumonia. Sarcoidosis Vasc Diffuse Lung Dis 2013; 30: 103–112.
- [21] Hoyles RK, Ellis RW, Wellsbury J, et al. A multicenter, prospective, randomized, double‑blind, placebo‑controlled trial of corticosteroids and intravenous cyclophosphamide followed by oral azathioprine for the treatment of pulmonary fibrosis in scleroderma. Arthritis Rheum 2006; 54: 3962–3970.
- [22] Tashkin DP, Elashoff R, Clements PJ, et al. Scleroderma Lung Study Research Group. Cyclophosphamide versus placebo in scleroderma lung disease. N Engl J Med 2006; 354: 2655–2666.
- [23] Roth MD, Tseng CH, Clements PJ, et al. Scleroderma Lung Study Research Group. Predicting treatment outcomes and responder subsets in scleroderma‑related interstitial lung disease. Arthritis Rheum 2011; 63: 2797–2808.
- [24] Ge Y, Peng Q, Zhang S, et al. Cyclophosphamide treatment for idiopathic inflammatory myopathies and related interstitial lung disease: a systematic review. Clin Rheumatol 2015; 34: 99–105.
- [25] Nakamura K, Ohbe H, Ikeda K, et al. Intravenous cyclophosphamide in acute exacerbation of rheumatoid arthritis‑related interstitial lung disease: A propensity‑matched analysis using a nationwide inpatient database. Semin Arthritis Rheum 2021; 51: 977–982.
- [26] Tashkin DP, Roth MD, Clements PJ, et al. Sclerodema Lung Study II Investigators. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma‑related interstitial lung disease (SLS II): a randomised controlled, double‑blind, parallel group trial. Lancet Respir Med 2016; 4: 708–719.
- [27] Simeón‑Aznar CP, Fonollosa‑Plá V, Tolosa‑Vilella C, et al. Effect of mycophenolate sodium in scleroderma‑related interstitial lung disease. Clin Rheumatol 2011; 30: 1393–1398.
- [28] Fischer A, Brown KK, Du Bois RM, et al. Mycophenolate mofetil improves lung function in connective tissue disease‑associated interstitial lung disease. J Rheumatol 2013; 40: 640–646.
- [29] Huapaya JA, Silhan L, Pinal‑Fernandez I, et al. Long‑Term Treatment With Azathioprine and Mycophenolate Mofetil for Myositis‑Related Interstitial Lung Disease. Chest 2019; 156: 896–906.
- [30] Kelly C, Young A, Ahmad Y, et al. The effect of steroids, azathioprine and mycophenolate on the risk of death in rheumatoid arthritis. Rheumatology 2016; 55: i99–i100.
- [31] Cassone G, Sebastiani M, Vacchi C, et al. Efficacy and safety of mycophenolate mofetil in the treatment of rheumatic disease‑related interstitial lung disease: a narrative review. Drugs Context 2021; 10: 2020‑8‑8.
- [32] Fujisawa T, Hozumi, H, Kamiya, Ye, et al. Prednisolone and tacrolimus versus prednisolone and cyclosporin A to treat polymyositis/dermatomyositis‑associated ILD: A randomized, open‑label trial. Respirology 2021; 26: 370–377.
- [33] Cassone G, Manfredi A, Vacchi C, et al. Treatment of Rheumatoid Arthritis‑Associated Interstitial Lung Disease: Lights and Shadows. J Clin Med 2020; 9: 1082.
- [34] Caldas MMVDF, Azevedo KPMD, Nunes ACDF, et al. Is rituximab effective for systemic sclerosis? A systematic review and meta‑analysis. Adv Rheumatol 2021; 61: 15.
- [35] Ge Y, Li S, Tian X, et al. Anti‑melanoma differentiation‑associated gene 5 (MDA5) antibody‑positive dermatomyositis responds to rituximab therapy. Clin Rheumatol 2021; 40: 2311–2317.
- [36] Mao MM, Xia S, Guo BP, et al. Ultra‑low dose rituximab as add‑on therapy in anti‑MDA5‑positive patients with polymyositis /dermatomyositis associated ILD. Respir Med 2020; 172: 105983.
- [37] Fui A, Bergantini L, Selvi E, et al. Rituximab therapy in interstitial lung disease associated with rheumatoid arthritis. Intern Med J 2020; 50: 330–336.
- [38] Vadillo C, Nieto MA, Romero‑Bueno F, et al. Efficacy of rituximab in slowing down progression of rheumatoid arthritis‑related interstitial lung disease: data from the NEREA Registry. Rheumatology (Oxford) 2020; 59: 2099–2108.
- [39] Khanna D, Denton CP, Jahreis A, et al. Safety and efficacy of subcutaneous tocilizumab in adults with systemic sclerosis (faSScinate): a phase 2, randomised, controlled trial. Lancet 2016; 387: 2630–2640.
- [40] Khanna D, Denton CP, Lin CJF, et al. Safety and efficacy of subcutaneous tocilizumab in systemic sclerosis: results from the open‑label period of a phase II randomised controlled trial (faSScinate). Ann Rheum Dis 2018; 77: 212–220.
- [41] Khanna D, Lin CJF, Furst DE, et al. Tocilizumab in systemic sclerosis: a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet Respir Med 2020; 8: 963–974.
- [42] Manfredi A, Cassone G, Furini F, et al. Tocilizumab therapy in rheumatoid arthritis with interstitial lung disease: a multicentre retrospective study. Intern Med J 2020; 50: 1085–1090.
- [43] Wollin L, Wex E, Pautsch A, et al. Mode of action of nintedanib in the treatment of idiopathic pulmonary fibrosis. Eur Respir J 2015; 45: 1434–1445.
- [44] Distler O, Highland KB, Gahlemann M, et al. Nintedanib for Systemic Sclerosis‑Associated Interstitial Lung Disease. N Engl J Med 2019; 380: 2518–2528.
- [45] Seibold JR, Maher TM, Highland KB, et al. Safety and tolerability of nintedanib in patients with systemic sclerosis‑associated interstitial lung disease: data from the SENSCIS trial. Ann Rheum Dis 2020; 79: 1478–1484.
- [46] Wells AU, Flaherty KR, Brown KK, et al. Nintedanib in patients with progressive fibrosing interstitial lung diseases‑subgroup analyses by interstitial lung disease diagnosis in the INBUILD trial: a randomised, double‑blind, placebo‑controlled, parallel‑group trial. Lancet Respir Med 2020; 8: 453–460.
- [47] Flaherty KR, Wells AU, Cottin V, et al. Nintedanib in progressive interstitial lung diseases: data from the whole INBUILD trial. Eur Respir J 2021; 2004538. doi: 10.1183/13993003.04538‑2020. Epub ahead of print.
- [48] Matteson E, Kelly C, Distler J, et al. Effect of nintedanib on progression of interstitial lung disease (ILD) in patients with autoimmune disease‑related ILDs: further data from the INBUILD trial. Ann Rheum Dis 2020; 79(Suppl 10): 76 (Abstract).
- [49] Burt RK, Shah SJ, Dill K, et al. Autologous non‑myeloablative haemopoietic tem‑cell transplantation compared with pulse cyclophosphamide once per month for systemic sclerosis (ASSIST): an open‑label, randomised phase 2 trial. Lancet 2011; 378: 498–506.
- [50] van Laar JM, Farge D, Sont JK, et al. Autologous hematopoietic stem cell transplantation vs intravenous pulse cyclophosphamide in diffuse cutaneous systemic sclerosis: a randomized clinical trial. JAMA 2014; 311: 2490–2798.
- [51] Sullivan KM, Goldmuntz EA, Keyes‑Elstein Lynette, et al. Myeloablative Autologous Stem‑Cell Transplantation for Severe Scleroderma. N Engl J Med 2018; 378: 35–47.
- [52] Kowal‑Bielecka O, Fransen J, Avouac J, et al. Update of EULAR recommendations for the treatment of systemic sclerosis. Ann Rheum Dis 2017; 76: 1327–1339.
- [53] Pradère P, Tudorache I, Magnusson J, et al. Lung transplantation for scleroderma lung disease: An international, multicenter, observational cohort study. J Heart Lung Transplant 2018; 37: 903–911.
- [54] Miele CH, Schwab K, Saggar R, et al. Lung Transplant Outcomes in Systemic Sclerosis with Significant Esophageal Dysfunction. A Comprehensive Single‑Center Experience. Ann Am Thorac Soc 2016; 13: 793–802.