Sacubitril/valsartan – nový duální inhibitor neprilysinu a receptorů pro angiotensin II
Souhrn:
Při srdečním selhání dochází k aktivaci celé řady neurohumorálních systémů, jejich výsledkem je vazokonstrikce, retence sodíkových iontů a proliferace vaziva, které srdeční selhání zhoršují, a uzavírají tak bludný kruh. Inhibice těchto neurohumorálních systémů, zejména renin angiotensin aldosteronového a sympatoadrenálního, se stala základem farmakoterapie chronického srdečního selhání se sníženou ejekční frakcí levé komory. Při srdečním selhání se ale současně aktivují i kontraregulační neurohumorální systémy, které vedou k vazodilataci, k natriuréze a působí antiproliferačně. Jde zejména o systém natriuretických peptidů. Byly vyvinuty duální neurohumorální inhibitory, které na jedné straně blokují renin angiotensin aldosteronový systém a na straně druhé inhibicí neutrální endopeptidázy neprilysinu brání odbourávání natriuretických peptidů, a potencují tak jejich účinky. Historicky první duální inhibitor angiotensin konvertujícího systému (ACE) a neutrální endopeptidázy omapatrilat byl neúspěšný, protože zvyšoval výskyt nežádoucích účinků, zejména angioedému. Po letech byl vyvinut duální inhibitor neutrální endopeptidázy a receptorů AT1 pro angiotensin II sacubitril/valsartan, označený kódově LCZ696. Tento nový duální inhibitor byl hodnocen ve velké mortalitně morbiditní klinické studii PARADIGM HF u nemocných s chronickým srdečním selháním se sníženou ejekční frakcí proti aktivní léčbě inhibitorem ACE enalaprilem na pozadí ostatní „evidence based“ farmakoterapie a ukázal se být významně účinnější než enalapril v prevenci kardiovaskulární mortality (–20 %) i celkové mortality (–16 %) a hospitalizací pro srdeční selhání (–21 %). V současnosti probíhá další mortalitně morbiditní studie PARAGON, ve které bude porovnán účinek LCZ696 proti valsartanu u nemocných se srdečním selháním se zachovanou ejekční frakcí. Je velmi pravděpodobné, že v budoucnosti nahradí LCZ696 v léčbě nemocných s chronickým srdečním selháním se sníženou ejekční frakcí inhibitory ACE a sartany.
Key words: chronic heart failure – RAAS – natriuretic peptides – dual inhibition – LCZ696.
Summary:
Activation of many neurohumoral systems occurs in heart failure, resulting in vasoconstriction, retention of natrium ions, and tissue proliferation, all of which worsen the heart failure and thus close the vicious circle. Inhibition of such neurohumoral systems, especially of renin angiotensin aldosterone system and sympatoadrenal system, became the cornerstone of pharmacotherapy of chronic heart failure with reduced ejection fraction. However, contraregulatory neurohumoral systems are also activated, leading to vasodilatation, natriuresis, and antiproliferative effects. System of natriuretic peptides is the crucial one of these. Neurohumoral inhibitors were developed, blocking renin angiotensin aldosteron system on one side and inhibiting neutral endopeptidase neprilysin, which cleaves natriuretic peptides and thus potentiates their effects, on the other side. Historically, the first dual inhibitor of both, the angiotensin-converting enzyme (ACE) and neutral endopeptidase omapatrilat was not successful as it was increasing side effects rate, especially of that angioedema. After several years a novel dual inhibitor of neutral endopeptidase and AT1 receptors for angiotensin II sacubitril/valsartan, referred to as LCZ696, was developed. This novel dual inhibitor was tested in patients with chronic heart failure with reduced ejection fraction in major mortality/morbidity clinical trial PARADIGM HF versus active treatment with ACE inhibitor enalapril on the background of other evidence based pharmacotherapy. The trial results showed that LCZ696 was superior to enalapril with respect to prevention of cardiovascular deaths (–20%), all cause deaths (–16%), and heart failure hospitalizations (–21%). There is another ongoing major mortality morbidity clinical trial PARAGON, in which LCZ696 will be compared with valsartan in the treatment of patients with heart failure with preserved ejection fraction. It is very probable that, in future, LCZ696 will substitute ACE inhibitors and sartans in the treatment of patients with chronic heart failure with reduced ejection fraction.
Něco z historie
Koncept neurohumorální aktivace při srdečním selhání jako hlavního mechanismu vedoucího k progresi srdečního selhání, který byl formulován v průběhu osmdesátých let minulého století, změnil převratným způsobem léčbu chronického srdečního selhání. Představa, že dlouhodobá aktivace neurohumorálních systémů, jako je renin‑angiotensin‑aldosteronový systém (RAAS) a sympatoadrenální systém (SAS), je při srdečním selhání škodlivá, uzavírá bludný kruh, a tak zhoršuje již existující srdeční selhání, vedla k vývoji a ke klinickému hodnocení léků, které jsou schopny příslušné neurohumorální systémy inhibovat. Do léčby chronického srdečního selhání se sníženou ejekční frakcí levé komory (heart failure with reduced ejection fraction, HFrEF) tak v devadesátých letech minulého století postupně vstoupily inhibitory angiotensin konvertujícího enzymu (ACE), beta‑blokátory, blokátory receptorů AT1 pro angiotensin II (ABR, tzv. sartany) a blokátory mineralokortikoidních receptorů (MRA). Všechny tyto léky zásadním způsobem zlepšily osud nemocných, snížily nejenom morbiditu, ale i mortalitu a staly se základem současné farmakoterapie nemocných s HFrEF [1,2].
Při chronickém srdečním selhání se však neaktivují pouze neurohumorální systémy, jejichž aktivace má škodlivé důsledky, jako je vazokonstrikce, retence sodíkových iontů, proliferace vaziva, remodelace cév i levé srdeční komory, hypertrofie kardiomyocytů a jejich apoptóza, ale současně se také aktivují kontraregulační neurohumorální systémy, které vedou k důsledkům opačným – k vazodilataci, natriuréze a diuréze, inhibují abnormální růst, tlumí aktivitu RAAS a SAS, působí antiapoptoticky a antifibroticky. Nejlépe prozkoumaným kontraregulačním neurohumorálním systémem s takovýmito vlastnostmi prospěšnými při srdečním selhání je systém natriuretických peptidů (NP). Prvním mediátorem systému NP, který byl identifikován, je natriuretický peptid typu A (ANP), který je syntetizován a produkován především myokardem srdečních předsíní při jejich distenzi. Natriuretický peptid typu A se váže na receptor NPR‑A, který aktivuje a zvyšuje tak intracelulární koncentraci cyklického guanosinmonofosfátu (cGMP). Natriuretický peptid typu A je odstraňován buď vazbou na NPR‑C (tzv. clearancový receptor), nebo je rozštěpen na neaktivní štěpy enzymem neutrální endopeptidázou, který je označován také mnoha dalšími synonymy, mezi nimiž dnes dominuje termín neprilysin [3]. Natriuretický peptid typu B (BNP), který byl identifikován později, je tvořen a produkován převážně myokardem srdečních komor v reakci na zvýšené napětí komorových stěn. Má podobné účinky a je biodegradován stejnými cestami jako ANP [3].
Cílem našich dosavadních farmakoterapeutických snah byla inhibice patologicky aktivovaných neurohumorálních systémů RAAS a SAS. Druhou teoretickou možností, jak farmakologicky zmírnit symptomy srdečního selhání a zabránit jeho progresi, je stimulovat neurohumorální systémy s vazodilatačními, natriuretickými a antiproliferačními vlastnostmi, především systém natriuretických peptidů (NP). K tomu jsou možné dvě cesty – první je exogenní podávání natriuretických peptidů připravených metodami genového inženýrství a druhou je zabránění jejich biodegradaci a tak zvýšení jejich plazmatických koncentrací. První cesta byla vyzkoušena a přinesla zklamání. Rekombinantně připravený lidský mozkový natriuretický peptid (brain natriuretic peptide, BNP) nesiritid, který se musí podávat parenterálně, sice měl při akutním srdečním selhání příznivé hemodynamické, neurohumorální a renální účinky a v klinické studii u pacientů s akutním srdečním selháním také vedl k mírnému snížení dušnosti, ale při dlouhodobém podávání nesnížil ani mortalitu, ani morbiditu [4,5].
Jak již bylo zmíněno výše, jsou natriuretické peptidy biodegradovány dvojím způsobem. Prvním je vazba na NPR‑C a druhým jejich hydrolýza na inaktivní peptidy enzymem neutrální endopeptidázou, označovaným také jako neprilysin. Zatímco ovlivnit expresi nebo aktivitu receptorů NPR typu C zatím neumíme, inhibovat enzym neutrální endopeptidázu – neprilysin – dovedeme. S perspektivou nového léčebného principu chronického srdečního selhání byly hodnoceny různé inhibitory neutrální endopeptidázy (např. racecadotril, ecadotril a candoxatril). Při akutním podání byla pozorována celá řada příznivých účinků, např. zvýšení plazmatické koncentrace ANP, zvýšená natriuréza, snížení tlaku v pravé síni a tlaku v zaklínění plicnice. Farmaceutický průmysl se soustředil na léčebné využití inhibitorů neutrální endopeptidázy především u hypertenze, a proto bylo velkým zklamáním, že chronicky podávaný candoxatril nevedl k významnému poklesu krevního tlaku [6]. Další klinický výzkum této skupiny látek byl proto zastaven. Pravděpodobným vysvětlením toho, proč inhibice neutrální endopeptidázy nebyla spojena s trvalým poklesem krevního tlaku (TK), je fakt, že substrátem enzymu neutrální endopeptidázy jsou nejenom peptidy s vazodilatačními účinky (NP, bradykinin aj.), ale také peptidy s účinky vazokonstrikčními (např. angiotensin II, endotelin aj.). Při inhibici neutrální endopetidázy jsou tedy vazodilatační a jiné prospěšné účinky natriuretických peptidů znehodnoceny opačnými účinky např. angiotensinu II [7,8].
Duální inhibice RAAS a systému natriuretických peptidů
Při chronickém srdečním selhání se mezi neurohumorálními působky vazokonstrikčními, antinatriuretickými a promitotickými a působky vazodilatačními, natriuretickými a antimitotickými vytváří určitá rovnováha. Blokátory RAAS (inhibitory ACE a blokátory receptorů AT1 pro angiotensin II – sartany) a beta‑blokátory jsou v současnosti u pacientů s HFrEF léky první volby. Dalšími neurohumorálními blokátory, které by se měly podávat každému symptomatickému nemocnému s HFrEF, jsou blokátory mineralokortikoidních receptorů spironolacton nebo eplerenon [1,2]. Teoreticky lze podobný prospěšný účinek očekávat také od stimulace aktivity kontraregulačních neurohumorálních systémů, především systému natriuretických peptidů. Izolovaná stimulace systému natriuretických peptidů inhibicí neutrální endopeptidázy se, jak již bylo zmíněno výše, neosvědčila. Logickým řešením tohoto problému by proto byla kombinovaná inhibice neutrální endopeptidázy a RAAS. Byla vyvinuta řada duálních inhibitorů, jejichž hlavním představitelem byl omapatrilat, látka, která současně inhibovala neutrální endopeptidázu a angiotensin konvertující enzym (kininázu II), a jak se později ukázalo, ještě další enzym – aminopeptidázu P. Omapatrilat byl hodnocen ve velkých klinických studiích jednak u nemocných se srdečním selháním (studie OVERTURA), jednak u nemocných s arteriální hypertenzí (studie OCTAVE). Komparátorem byl v obou případech inhibitor ACE enalapril. Ve studii OVERTURA nebyl u 5 770 nemocných s HFrEF zjištěn žádný rozdíl ani v mortalitě, ani v hospitalizacích pro srdeční selhání mezi pacienty léčenými omapatrilatem podávaným v denní dávce 1× 40 mg ve srovnání s pacienty léčenými enalaprilem podávaným v dávce 2× 10 mg [9]. Do studie OCTAVE bylo zařazeno celkem 25 302 hypertoniků, kterým byl podáván buď omapatrilat v denní dávce titrované od 10 mg do 80 mg podávané 1× denně nebo enalapril titrovaný od dávky 5 mg do 40 mg 1× denně. Omapatrilat se sice ukázal být ve snížení krevního tlaku superiorní k enalaprilu (systolický krevní tlak za 8 týdnů snížil v průměru o 3,6 mm Hg více), ale významně častěji se při této léčbě vyskytoval angioedém (2,17 % vs. 0,68 %) [10]. Ze vzniku angioedému je obviňován bradykinin a substance P. Omapatrilat inhibuje hned tři enzymy, které bradykinin odbourávají – ACE (kininázu II), neutrální endopeptidázu a aminopeptidázu P. Tím byl vysvětlován trojnásobný výskyt angioedému při léčbě omapatrilatem u hypertoniků ve studii OCTAVE. Zvýšený výskyt nežádoucích účinků, zejména angioedému a také non‑superiorita omapatrilatu ve srovnání s enalaprilem u nemocných s HFrEF vedly k ukončení klinického výzkumu této látky i všech příbuzných molekul v této třídě léků. V té době se zdálo, že duální inhibici RAAS a natriuretických peptidů je navždy odzvoněno.
LCZ696 (sacubitril/valsartan) – nový duální inhibitor neprilysinu a receptorů AT1 pro angiotensin II
Inhibitory receptorů AT1 pro angiotensin II a enzymu neprilysinu (angiotensin receptor neprilysin inhibitor, ARNI) jsou novou třídou léčiv, která byla vyvinuta k současné inhibici RAAS a k potenciaci účinků natriuretických peptidů. Tyto inhibitory mají potenciál příznivě modulovat neurohumorální dysbalanci, která charakterizuje chronické srdeční selhání. Protože blokády RAAS je dosaženo zablokováním receptorů AT1 pro angiotensin II, a niko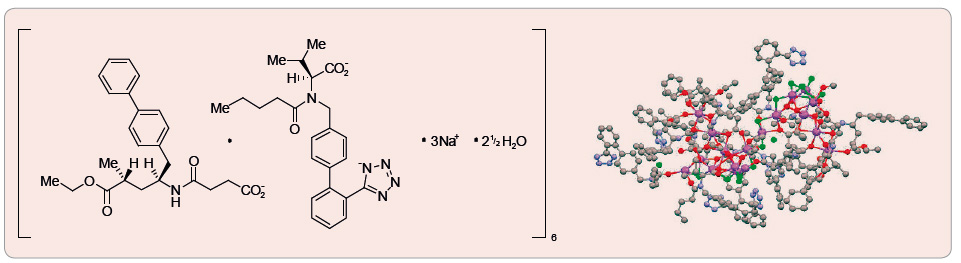 liv inhibicí ACE (a/nebo aminopeptidázy P), jako tomu bylo u omapatrilatu, předpokládá se, že riziko vzniku angioedému nebude při podávání ARNI zvýšeno. První ARNI, který byl vyvinut a klinicky testován společností Novartis, dostal kódové označení LCZ696. Chemicky je LCZ696 krystalický valsartan a sacubitril v molárním poměru 1 : 1. Jeden komplex LCZ696 se skládá ze šesti valsartanových a ze šesti sacubitrilových aniontů, z 18 sodíkových kationů a z 15 molekul vody (obr. 1). Nejde tedy o fixní kombinaci dvou samostatných léčiv v jedné tabletě, ale o skutečnou chemickou vazbu mezi oběma složkami. Sacubitril (AHU377) je prolék, který je aktivován na sacubitrilat(LBQ657) deethylací esterázami. Sacubitril inhibuje enzym neprilysin, neutrální endopeptidázu, která štěpí vazoaktivní peptidy včetně natriuretických peptidů, bradykininu a adrenomedulinu. Tak dochází ke zvýšení koncentrace těchto peptidů v plazmě a ve tkáních.
liv inhibicí ACE (a/nebo aminopeptidázy P), jako tomu bylo u omapatrilatu, předpokládá se, že riziko vzniku angioedému nebude při podávání ARNI zvýšeno. První ARNI, který byl vyvinut a klinicky testován společností Novartis, dostal kódové označení LCZ696. Chemicky je LCZ696 krystalický valsartan a sacubitril v molárním poměru 1 : 1. Jeden komplex LCZ696 se skládá ze šesti valsartanových a ze šesti sacubitrilových aniontů, z 18 sodíkových kationů a z 15 molekul vody (obr. 1). Nejde tedy o fixní kombinaci dvou samostatných léčiv v jedné tabletě, ale o skutečnou chemickou vazbu mezi oběma složkami. Sacubitril (AHU377) je prolék, který je aktivován na sacubitrilat(LBQ657) deethylací esterázami. Sacubitril inhibuje enzym neprilysin, neutrální endopeptidázu, která štěpí vazoaktivní peptidy včetně natriuretických peptidů, bradykininu a adrenomedulinu. Tak dochází ke zvýšení koncentrace těchto peptidů v plazmě a ve tkáních.
Orální podání LCZ696 vedlo u hypertenzních dvojitě transgenních krys kmene Sprague‑Dawley ke vzestupu imunoreaktivity ANP (díky inhibici neutrální endopetidázy) závislému na dávce a k protrahovanému poklesu krevního tlaku, který byl opět závislý na dávce. U zdravých dobrovolníků v randomizované, dvojitě zaslepené a kontrolované studii (n = 80) ukázalo jednorázové podání LCZ696 (200–1 200 mg) i jeho opakované perorální podávání (50–900 mg 1× denně po dobu 14 dnů), že maximálních plazmatických koncentrací všech složek molekuly je dosaženo rychle – v případě valsartanu za 1,6–4,9 hodiny, u pr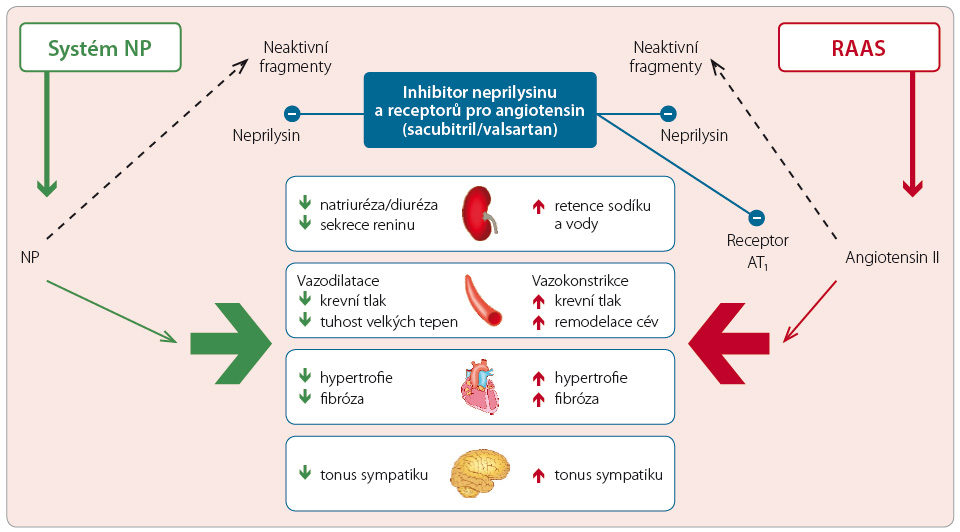 oléku sacubitrilu (AHU377) za 0,5–1,1 hodiny a v případě aktivního léku sacubitrilatu (LBQ657) za 1,8–3,5 hodiny. Léčba přípravkem LCZ696 vedla ke vzestupu plazmatické koncentrace cGMP, koncentrace i aktivity reninu a angiotensinu II, což dokládá současnou inhibici neutrální endopeptidázy a blokádu receptorů pro angiotensin II. Schematické zobrazení mechanismu účinku LCZ696 – viz obr. 2. V randomizované otevřené studii typu „cross‑over“ u zdravých jedinců (n = 56) se prokázalo, že podání dávky LCZ696 400 mg denně (resp. 2× 200 mg) a dávky valsartanu 320 mg denně (resp. 2× 160 mg) vede ke stejné expozici valsartanu [11]. Vzhledem k tomu, že dávka valsartanu 2× 160 mg byla v minulosti úspěšně vyhodnocena v klinických studiích u nemocných se srdečním selháním, byla pro klinické hodnocení LCZ696 zvolena denní dávka 400 mg rozdělená do dvou denních dávek po 200 mg. V těchto studiích fáze I se LCZ696 ukázal být bezpečný a dobře tolerovaný.
oléku sacubitrilu (AHU377) za 0,5–1,1 hodiny a v případě aktivního léku sacubitrilatu (LBQ657) za 1,8–3,5 hodiny. Léčba přípravkem LCZ696 vedla ke vzestupu plazmatické koncentrace cGMP, koncentrace i aktivity reninu a angiotensinu II, což dokládá současnou inhibici neutrální endopeptidázy a blokádu receptorů pro angiotensin II. Schematické zobrazení mechanismu účinku LCZ696 – viz obr. 2. V randomizované otevřené studii typu „cross‑over“ u zdravých jedinců (n = 56) se prokázalo, že podání dávky LCZ696 400 mg denně (resp. 2× 200 mg) a dávky valsartanu 320 mg denně (resp. 2× 160 mg) vede ke stejné expozici valsartanu [11]. Vzhledem k tomu, že dávka valsartanu 2× 160 mg byla v minulosti úspěšně vyhodnocena v klinických studiích u nemocných se srdečním selháním, byla pro klinické hodnocení LCZ696 zvolena denní dávka 400 mg rozdělená do dvou denních dávek po 200 mg. V těchto studiích fáze I se LCZ696 ukázal být bezpečný a dobře tolerovaný.
LCZ696 v léčbě srdečního selhání – PARADIGM‑HF a jiné studie
V klinickém hodnocení látky LCZ696 byla prakticky přeskočena fáze II klinického hodnocení a nový lék byl rovnou testován u nemocných s HFrEF proti aktivní léčbě enalaprilem ve velké mortalitně‑morbiditní studii PARADIGM‑HF (Prospective comparison of ARNI with ACE‑I to Determine Impact on Global Mortality and morbidity in Heart Failure) [12]. Studie byla navržena tak, aby bylo minimalizováno riziko nežádoucích účinků. Denní dávka léku LCZ696 byla podávána dvakrát denně místo podávání vysoké dávky omapatrilatu jednou denně, jak tomu bylo ve studiích OVERTURA a OCTAVE; cílem rozdělení dávky do dvou denních podání bylo zabránit vzniku hypotenze a zajistit skutečně 24hodinovou inhibici účinků angiotensinu II i neprilysinu. U všech nemocných byla také před randomizací testována tolerance jak enalaprilu v denní dávce 2× 10 mg, tak LCZ696 v denní dávce 2× 200 mg v průběhu „run‑in periody“. V průběhu této periody byli identifikováni nemocní, kteří byli náchylní k hypotenzi a/nebo ke vzniku angioedému a ti pak nebyli do studie zařazeni. Do studie PARADIGM‑HF bylo zařazeno 8 442 nemocných se srdečním selháním ve funkční třídě NYHA II–IV podle New York Heart Association (NYHA), jejichž ejekční frakce levé komory na počátku studie dosahovala hodnoty ≤ 0,40, v průběhu zařazování nemocných do studie byla ejekční frakce snížena dodatkem k protokolu na hodnotu ≤ 0,35. Pro zařazení nemocných do studie byly současně vyžadovány také zvýšené plazmatické koncentrace natriuretických peptidů (BNP ≥ 150 pg/ml nebo NT‑proBNP ≥ 600 pg/ml). Nemocní byli v poměru 1 : 1 randomizováni k užívání buď LCZ696 v dávce 2× 200 mg denně nebo enalaprilu v dávce 2× 10 mg denně, přidávaných k ostatní farmakoterapii podle stávajících doporučení, tedy především k léčbě beta‑blokátory a blokátory mineralokortikoidních receptorů. Primárním sledovaným ukazatelem byl součet úmrtí z kardiovaskulárních příčin a hospitalizací pro srdeční selhání [12].
Klinická studie PARADIGM‑HF znamenala jednoznačný úspěch. Její výsledky byly prezentovány v prestižní sekci Hotlines na výročním sjezdu Evropské kardiologické společnosti 2014 v Barceloně a současně publikovány v New England Journal of Medicine [13]. Podle pravidel předem stanovených protokolem byla studie ukončena předčasně po průměrné době sledování 27 mě![Graf 1 Studie PARADIGM-HF: výskyt primárního sledovaného kombinovaného klinického ukazatele (kardiovaskulární mortality a hospitalizací pro srdeční selhání) při léčbě přípravkem LCZ696 a enalaprilem; podle [13] – McMurray, et al., 2014. LCZ696 – sacubitril/valsartan; HR – hazard ratio, poměr rizik; NNT – number needed to treat, počet nemocných, které je třeba léčit, aby se zabránilo vzniku jedné příhody](https://www.remedia.cz/photo-a-30557---.jpg) síců, protože byly překročeny hranice pro jednoznačný prospěch z léčby LCZ696. V době ukončení studie se primární složený cílový ukazatel objevil u 914 (21,8 %) nemocných, kteří užívali LCZ696, a u 1 117 (26,5 %) nemocných, kteří užívali enalapril (poměr rizik, hazard ratio – HR: 0,80 pro LCZ696; interval spolehlivosti, confidence interval – CI: 0,73–0,87; p < 0,001), graf 1. Podávání LCZ696 také vedlo k významnému poklesu celkové mortality (HR: 0,84; CI: 0,76–0,93; p < 0,001) stejně jako kardiovaskulární mortality (HR: 0,80; CI: 0,71–0,89; p < 0,001). Ve srovnání s enalaprilem snížil LCZ696 také riziko hospitalizací pro srdeční selhání o 21 % (p < 0,001) a zmírnil symptomy a zlepšil toleranci zátěže (p < 0,001). Také kvalita života měřená pomocí dotazníku KCCQ (Kansas City Cardiomyopathy Questionnaire) byla při léčbě LCZ696 významně zlepšena, viz tab. 1. Co se týká bezpečnosti, u nemocných, kteří užívali LCZ696, byl sice zaznamenán vyšší výskyt hypotenze, ale nižší výskyt případů zhoršení renálních funkcí, hyperkalemie a kašle než u nemocných, kteří užívali enalapril. Výskyt angioedému byl
síců, protože byly překročeny hranice pro jednoznačný prospěch z léčby LCZ696. V době ukončení studie se primární složený cílový ukazatel objevil u 914 (21,8 %) nemocných, kteří užívali LCZ696, a u 1 117 (26,5 %) nemocných, kteří užívali enalapril (poměr rizik, hazard ratio – HR: 0,80 pro LCZ696; interval spolehlivosti, confidence interval – CI: 0,73–0,87; p < 0,001), graf 1. Podávání LCZ696 také vedlo k významnému poklesu celkové mortality (HR: 0,84; CI: 0,76–0,93; p < 0,001) stejně jako kardiovaskulární mortality (HR: 0,80; CI: 0,71–0,89; p < 0,001). Ve srovnání s enalaprilem snížil LCZ696 také riziko hospitalizací pro srdeční selhání o 21 % (p < 0,001) a zmírnil symptomy a zlepšil toleranci zátěže (p < 0,001). Také kvalita života měřená pomocí dotazníku KCCQ (Kansas City Cardiomyopathy Questionnaire) byla při léčbě LCZ696 významně zlepšena, viz tab. 1. Co se týká bezpečnosti, u nemocných, kteří užívali LCZ696, byl sice zaznamenán vyšší výskyt hypotenze, ale nižší výskyt případů zhoršení renálních funkcí, hyperkalemie a kašle než u nemocných, kteří užívali enalapril. Výskyt angioedému byl 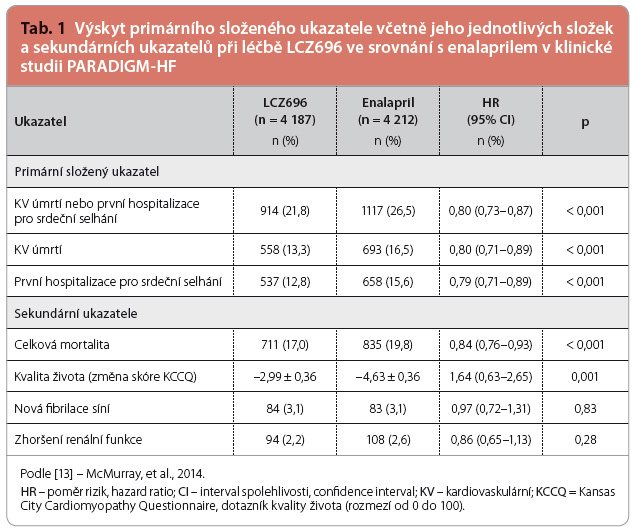 zanedbatelný a žádný z případů nebyl klinicky závažný, viz tab. 2. Studie tak naprosto přesvědčivě prokázala, že duální inhibice LCZ696 je významně účinnější jak v prevenci úmrtí, tak i v prevenci hospitalizací než v současnosti používané inhibitory RAAS (inhibitory ACE nebo sartany) a přinejmenším stejně bezpečná. Při podskupinové analýz
zanedbatelný a žádný z případů nebyl klinicky závažný, viz tab. 2. Studie tak naprosto přesvědčivě prokázala, že duální inhibice LCZ696 je významně účinnější jak v prevenci úmrtí, tak i v prevenci hospitalizací než v současnosti používané inhibitory RAAS (inhibitory ACE nebo sartany) a přinejmenším stejně bezpečná. Při podskupinové analýz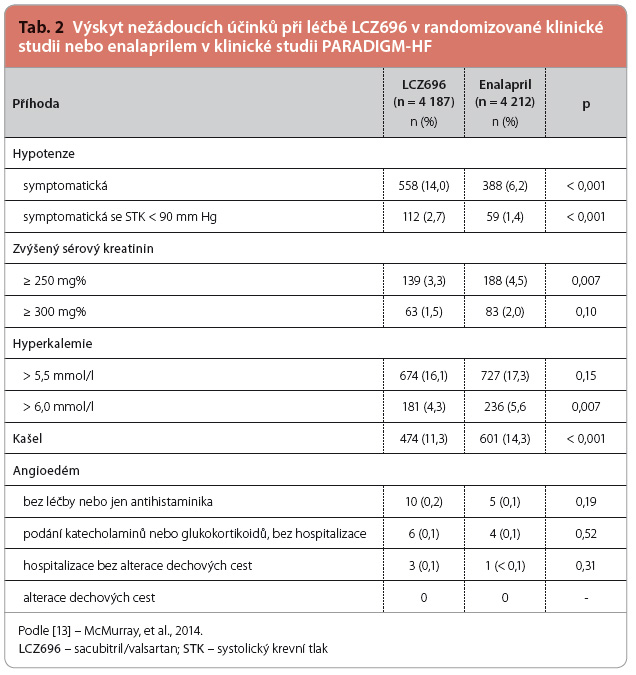 e nebyly nalezeny žádné skupiny nemocných, kteří by z duální inhibice LCZ696 měli větší, nebo naopak menší prospěch než ostatní nemocní [13].
e nebyly nalezeny žádné skupiny nemocných, kteří by z duální inhibice LCZ696 měli větší, nebo naopak menší prospěch než ostatní nemocní [13].
V současné době se zařazují nemocní do obdobné klinické studie, která probíhá pod akronymem PARAGON‑HF (Prospective comparison of ARni with Arb Global Outcomes in heart failure with preserved ejectioN fraction) a má testovat účinnost a bezpečnost LCZ696 z hlediska mortality a morbidity nemocných se srdečním selháním a se zachovanou ejekční frakcí (heart failure with preserved ejection fraction, HFpEF). Komparátorem v této studii však není enalapril, ale valsartan. Tato studie navazuje na slibné výsledky pilotní studie PARAMOUNT (Prospective comparison of ARNI with ARB on Management Of heart failUre with preserved ejectioN fracTion) [14].
Klinické implikace výsledků studie PARADIGM‑HF
Lék LCZ696 dostal obchodní název Entresto® a byl na základě výše uvedených přesvědčivých výsledků studie PARADIGM‑HF registrován jak americkým regulačním Úřadem pro potraviny a léky (Food and Drug Administration, FDA), tak i Evropskou lékovou agenturou (European Medicines Agency, EMA) pro léčbu pacientů trpících srdečním selháním se sníženou ejekční frakcí levé komory. V České republice v současnosti probíhá správní řízení pro stanovení úhrady a jejích podmínek u tohoto nového léku.
Již takřka tři desetiletí jsou inhibitory ACE (a při jejich intoleranci sartany) jedním ze základních pilířů farmakoterapie HFrEF. Výsledky studie PARADIGM‑HF však ukázaly, že prospěch z duální neurohumorální inhibice ARNI je ve srovnání s enalaprilem statisticky i klinicky velmi přesvědčivý. K zabránění vzniku jedné příhody tvořící v této studii primární kombinovaný ukazatel (kardiovaskulární úmrtí nebo hospitalizace pro srdeční selhání) bylo potřeba léčit přípravkem LCZ696 po dobu trvání studie (v průměru 27 měsíců) 21 nemocných a k zabránění jednomu úmrtí z kardiovaskulárních příčin bylo třeba léčit daným přípravkem 32 nemocných. To vše ve srovnání s jinou účinnou léčbou inhibitorem ACE enalaprilem. Porovnat účinnost nové a nepochybně účinnější léčby proti placebu není z etických důvodů možné. Autoři studie PARADIGM‑HF se o to pokusili alespoň nepřímým srovnáním LCZ696 s tzv. předpokládaným placebem. Použili k tomu jednak výsledky studie SOLVD‑T jako historické reference pro srovnání účinnosti inhibitoru ACE enalaprilu oproti placebu, jednak výsledky studie CHARM‑Alternative jako historické reference pro srovnání blokátoru receptorů pro angiotensin II candesartanu proti placebu. Relativní riziko výskytu primárního složeného ukazatele bylo při léčbě LCZ696 sníženo oproti předpokládanému placebu ze studie SOLVD‑T o 43 % (p < 0,0001) s podobným účinkem na jednotlivé složky primárního ukazatele – kardiovaskulární úmrtí –34 % (p < 0,0001) a hospitalizace pro srdeční selhání –49 % (p < 0,0001). Celková mortalita byla oproti předpokládanému placebu snížena o 28 % (p < 0,0001). Při analýze účinků proti předpokládanému placebu ze studie CHARM‑Alternative byly výsledky podobné. Těchto pozoruhodných výsledků bylo dosaženo i přesto, že ve studii PARADIGM‑HF byl přípravek LCZ696 přidáván k léčbě beta‑blokátory a blokátory mineralokortikoidních receptorů [15].
Po publikaci výsledků studie PARADIGM‑HF se začalo diskutovat o některých jejích aspektech. Nejčastěji bylo poukazováno na to, že jako komparátor byl ve studii použit jeden z nejstarších inhibitorů ACE enalapril, druhá část námitek směřovala proti jeho denní dávce, která byla považována za příliš nízkou. Enalapril je inhibitor ACE, který byl v klinických studiích u nemocných s HFrEF hodnocen vůbec nejčastěji. Je to také jediný inhibitor ACE, u kterého bylo prokázáno, že u těchto nemocných snižuje mortalitu. Průměrná denní dávka enalaprilu, které bylo dosaženo u nemocných v enalaprilové větvi studie PARADIGM‑HF, byla 18,9 mg. To je vůbec nejvyšší dávka enalaprilu, jaké bylo v klinických studiích s nemocnými s HFrEF dosaženo. V existujících registrech nemocných s HFrEF jsou průměrné denní dávky enalaprilu nebo ekvipotentní dávky jiných inhibitorů ACE také výrazně nižší. Další kritika byla zaměřena na bezpečnost přípravku LCZ696; ta měla být uměle zvýšena uspořádáním studie PARADIGM‑HF, a sice tím, že randomizaci nemocných do studie předcházela „run‑in“ perioda, ve které byla testována tolerance obou léčiv – enalaprilu i LCZ696. Během této periody bylo kvůli nežádoucím účinkům vyřazeno 12 % nemocných, vyřazení bylo častější pro intoleranci enalaprilu než LCZ696. Po randomizaci v průběhu studie přerušilo léčbu pro jakékoliv nežádoucí účinky méně nemocných, kteří užívali LCZ696, než těch, kteří užívali enalapril (10,7 % vs. 12,3 %; p = 0,03); LCZ696 tak byl tolerován přinejmenším stejně dobře jako enalapril [16].
Ve studii PARADIGM‑HF byl po osmi měsících léčby pozorován větší pokles systolického krevního tlaku při léčbě LCZ696 než při podávání enalaprilu (v průměru o 3,2 ± 0,4 mm Hg). Autoři studie jsou přesvědčeni, že rozdíl v hodnotách krevního tlaku nebyl odpovědný za výrazný prospěch z léčby LCZ696. Zajímavé je, že dříve testovaná samotná inhibice neprilysinu nevedla ke klinicky významnému poklesu krevního tlaku, pravděpodobně proto, že neprilysin inhibuje také biodegradaci vazokonstrikčních peptidů, jako je angiotensin II [17].
Lék Entresto® by měl být podán především nemocným, kteří jsou již léčeni inhibitorem ACE/sartanem a jsou při stávající léčbě v klinicky stabilizovaném stavu. U těchto nemocných by měl lék Entresto® nahradit léčbu inhibitorem ACE/sartanem. V letošním roce budou publikována nová doporu![Obr. 3 Současnost a pravděpodobná budoucnost léčby nemocných s chronickým srdečním selháním se sníženou ejekční frakcí založená na důkazech: nahradí ARNI inhibitory ACE/sartany?; podle [7] – McMurray, 2015. ACEI – angiotensin converting enzyme inhibitor, inhibitor angiotensin konvertujícího enzymu; ARB – angio tensin II type 1 receptor blocker, blokátor receptorů AT1 pro angiotensin; ARNI – angiotensin receptor neprilysin inhibitor, duální inhibitor receptorů pro angiotensin II a neprilysinu; CABG – coronary artery bypass grafting, chirurgická koronární revaskularizace; CRT – cardiac resynchronization therapy, srdeční resynchronizační léčba; H-ISDN – hydralazin/isosorbid dinitrát; ICD – implantable cardioverter-defi brillator, implantabilní kardioverter-defi briátor; MRA – mineralocorticoid antagonist, antagonista mineralokortikoidních receptorů; Tx – transplantace srdce; VAD – ventricular assist device, mechanická podpora komory](https://www.remedia.cz/photo-a-30560---.jpg) čení Evropské kardiologické společnosti pro diagnostiku a léčbu srdečního selhání. Nejsou nejmenší pochybnosti o tom, že tato doporučení již budou duální inhibici ARNI obsahovat a jasně stanoví místo tohoto přípravku v algoritmu léčby nemocných s HFrEF. Je ale velmi pravděpodobné, že dříve nebo později ARNI nahradí inhibitory ACE/sartany jako jeden ze základních kamenů léčby nemocných s HfrEF (obr. 3).
čení Evropské kardiologické společnosti pro diagnostiku a léčbu srdečního selhání. Nejsou nejmenší pochybnosti o tom, že tato doporučení již budou duální inhibici ARNI obsahovat a jasně stanoví místo tohoto přípravku v algoritmu léčby nemocných s HFrEF. Je ale velmi pravděpodobné, že dříve nebo později ARNI nahradí inhibitory ACE/sartany jako jeden ze základních kamenů léčby nemocných s HfrEF (obr. 3).
LCZ696 v léčbě arteriální hypertenze
Dosavadní klinický výzkum a vývoj duálního inhibitoru angiotensinu II a neprilysinu – přípravku LCZ696 – byl zaměřen naprosto dominantně na léčbu srdečního selhání. Nicméně vlastnosti tohoto nového léku ho předurčují také k léčbě hypertenze. Na loňském výročním sjezdu Evropské kardiologické společnosti v Londýně byly prezentovány výsledky studie PARAMETER (Prospective comparison of Angiotensin Receptor neprilysin inhibitor with Angiotensin receptor blocker MEasuring arterial sTiffness in the eldERly study) [18]. Cílem této studie bylo zhodnotit krátkodobé (12 týdnů) i dlouhodobé (52 týdnů) účinky LCZ696 ve srovnání s blokátorem receptorů pro angiotensin II olmesartanem na ukazatele centrální aortální hemodynamiky a arteriální tuhost u starších nemocných se systolickou hypertenzí a se zvýšeným pulsním tlakem (PP). Do studie bylo zařazeno 454 starších nemocných se systolickým TK ≥ 150 mm Hg a s PP > 60 mm Hg. Po 12 týdnech snížil LCZ696 centrální aortální systolický tlak v průměru o 3,7 mm Hg více než olmesartan (–12,6 mm Hg vs. –8,9 mm Hg; p = 0,01) a pulsový tlak v průměru o 2,4 mm Hg více než olmesartan (–6,4 mm Hg vs. –4,0 mm Hg; p = 0,012). Podobně byl LCZ696 účinnější ve snížení brachiálního systolického krevního tlaku (Δ –3,8 mm Hg; p = 0,016) a brachiálního pulsního tlaku (Δ –2,8 mm Hg; p = 0,013). Při 24hodinovém ambulantním monitorování byl po LCZ696 pokles všech tlaků nejvýraznější v během noci. Větší pokles krevního tlaku přetrvával i po 52 týdnech léčby, vymizela ale statistická významnost rozdílů proti olmesartanu, protože v průběhu studie bylo povoleno přidávání dalších antihypertenziv (v pořadí amlodipin – hydrochlorothiazid). Počet nemocných, kterým bylo pro nedostatečnou kontrolu hypertenze potřeba přidat do léčby další antihypertenziva, byl při podávání LCZ696 významně nižší než při podávání olmesartanu. Přípravek LCZ696 také vedl k většímu poklesu rychlosti šíření karotido‑femorální pulsové vlny, tento pokles byl tím výraznější, čím vyšší byla výchozí hodnota rychlosti pulsové vlny, tedy čím byla tuhost tepen větší.
Závěr
Po mnoha letech se do léčby srdečního selhání dostává nový léčebný koncept – duální inhibice neprilysinu a receptorů AT1 pro angiotensin II. Prvním zástupce této nové třídy léků je přípravek sacubitril/valsartan, označovaný kódovým označením LCZ696, který dostal obchodní název Entresto®. Ve velké mortalitně‑morbiditní studii PARADIGM‑HF se prokázalo, že LCZ696 je na pozadí ostatní léčby navržené současnými doporučenými postupy jednoznačně superiorní ve srovnání s inhibitorem ACE enalaprilem. Proti aktivní léčbě inhibitorem ACE významně snižuje kardiovaskulární mortalitu, celkovou mortalitu i počet hospitalizací pro srdeční selhání. Do léčby nemocných trpících chronickým srdečním selháním se sníženou ejekční frakcí se tak poprvé dostává lék, který se nebude přidávat ke stávajícím lékům, jejichž prospěšnost byla prokázána klinickými studiemi, ale má reálné ambice postupně nahradit inhibitory ACE/sartany, protože je výrazně účinnější.
Seznam použité literatury
- [1] McMurray JJ, Adamopoulos S, Anker SD, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33: 1787–1847.
- [2] Hradec J, Vítovec J, Špinar J. Summary of the ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Prepared by the Czech Society of Cardiology. Cor Vasa 2013; 55: e25–e40; česky: Cor et Vasa 2013; 55: 33–48.
- [3] Mangiafico S Jr, Costello Boerrigter LC, Andersen IA, et al. Neutral endopeptidase inhibition and the natriuretic peoptide system: an evolving strategy in cardiovascular therapeutics. Eur Heart J 2013; 34: 886–893c.
- [4] Publication Committee for the VMAC Investigators (Vasodilatation in the Management of Acute CHF). Intravenous neseritide vs nitroglycerin for treatment of decompensated congestive heart failure: a randomized controlled trial. JAMA 2002; 287: 1531–1540.
- [5] Yancy CW, Krum H, Massie BM, et al. Safety and efficacy of outpatient nesiritide in patients with advanced heart failure: results of the Second Follow Up Serial Infusions of Nesiritide (FUSION II) trial. Circ Heart Fail 2008; 1: 9–16.
- [6] Bevan EG, Connell JM, Doyle J, et al. Candoxatril, a neutral endopeptidase inhibitor: efficacy and tolerability in essential hypertension. J Hypertens 1992; 10: 607–613.
- [7] McMurray JJV. Neprilysin inhibition to treat heart failure: a tale of science, serendipity, and second chances. Eur J Heart Fail 2015; 17: 242–247.
- [8] Hradec J. Renezance duální inhibice endopeptidáz a systému RAS v léčbě kardiovaskulárních onemocnění. Ve sborníku: Hypertenze 2016, Triton, Praha, 2016: v tisku.
- [9] Packer M, Califf R, Konstam MA, et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: the Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE). Circulation 2002; 106: 920–926.
- [10] Kostis JB, Packer M, Black HR, et al. Omapatrilat and enalapril in patients with hypertension: the Omapatrilat Cardiovascular Treatment vs. Enalapril (OCTAVE) trial. Am J Hypertens 2004; 7: 103–111.
- [11] Gu J, Noe A, Chandra P, et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dual acting angiotensin receptor – neprilysin inhibitor (ARNI). J Clin Pharmacol 2010; 50: 401–414.
- [12] McMurray JJV, Packer M, Desai AS, et al. Dual angiotensin receptor and neprilysin inhibition as an alternative to angiotensin converting enzyme inhibition in patients with chronic systolic heart failure: rationale for and design of the Prospective comparison of ARNI with ACEI to Determine Impact on Global Mortality and morbidity in Heart Failure trial (PARADIGM HF). Eur J Heart Fail 2013; 15: 1062–1073.
- [13] McMurray JJV, Packer M, Desai AS, et al. PARADIGM HF Investigators and Committees. Angiotensin neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993–1004.
- [14] Solomon SD, Zile M, Pieske B, et al. Prospective comparison of ARNI with ARB on Management Of heart failUre with preserved ejectioN fracTion (PARAMOUNT) Investigators. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double blind randomised controlled trial. Lancet 2012; 380: 1387–1395.
- [15] McMurray JJV, Packer M, Desai A, et al. A putative placebo analysis of the effects of LCZ696 on clinical outcomes in heart failure. Eur Heart J 2015; 36: 434–439.
- [16] Jessup M. Neprilysin inhibition – a novel therapy for heart failure. N Engl J Med 2014; 371: 1062–1064.
- [17] Ruilope LM, Dukat A, Böhm M, et al. Blood pressure reduction with LCZ696, a novel dual acting inhibitor of angiotensin receptor and neprilysin: a randomised, double blind, placebo controlled, active comparator study. Lancet 2010; 375: 1255–1266.
- [18] Williams B, Cockroft JR, Kario K, et al. Principle results of the Prospective comparison of Angiotensin Receptor neprilysin inhibitor with Angiotensin Receptor blocker MEasuring arterial sTiffness in the eldERly (PARAMETER) study. Prezentováno v sekci Hotlines na výročním kongresu ESC 2015, Londýn, UK.