Současná farmakoterapie benigní hyperplazie prostaty
Benigní hyperplazie prostaty (BHP) je nejčastějším benigním nádorem u mužů ve vyšším věku. BHP můžeme histologicky prokázat u více než 50 % šedesátiletých mužů, ve věku 85 let a více trpí histopatologickou BHP asi 90 % mužů. Klinická manifestace tohoto onemocnění ve formě symptomů dolních močových cest (lower urinary tract symptoms, LUTS) zhoršuje kvalitu života pacientů. Medikamentózní léčba LUTS/BHP prodělala v posledních 15 letech obrovský pokrok. Byly vyvinuty nové účinné a bezpečné přípravky, které výrazně změnily algoritmy v léčbě LUTS/BHP. Výrazně ubylo operací pro tuto diagnózu a přibývá nemocných léčených medikamentózně. Autoři shrnují současné možnosti a trendy v konzervativní léčbě BHP, pozorné sledování a medikamentózní terapii.
Úvod
Benigní hyperplazie prostaty (BHP) je histologicky prokázaná diagnóza označující proliferaci buněk hladké svaloviny a epiteliálních buněk v přechodné zóně prostaty (obr. 1) [1]. Můžeme ji histologicky prokázat asi u 50 % šedesátiletých mužů a témě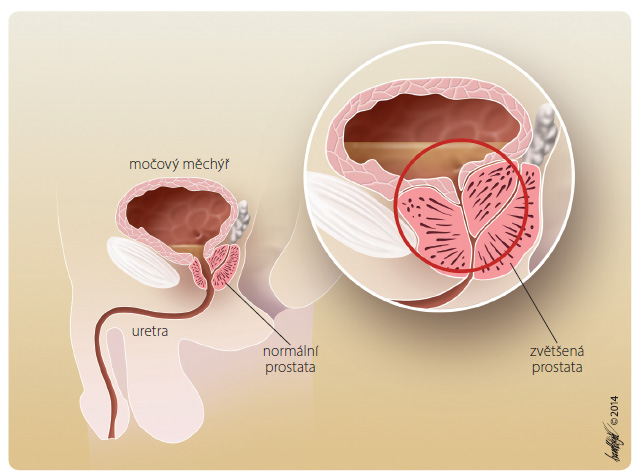 ř u 90 % mužů ve věku 85 let a více [2]. Přesná příčina vzniku tohoto onemocnění není známa. Předpokládá se, že zvětšená prostata přispívá k rozvoji komplexu symptomů dolních močových cest (lower urinary tract symptoms, LUTS) minimálně dvěma způsoby: 1. prostřednictvím obstrukce výtoku z močového měchýře (bladder outlet obstruction, BOO), která je způsobena zvětšenou prostatickou žlázou (statická komponenta), a 2. v důsledku zvýšeného tonu hladké svaloviny a rezistence ve zvětšené žláze (dynamická komponenta). Mikční symptomy jsou přisuzovány přítomnosti BOO, hyperaktivita detruzoru přispívá ke vzniku jímacích symptomů v rámci LUTS (obr. 2) [3].
ř u 90 % mužů ve věku 85 let a více [2]. Přesná příčina vzniku tohoto onemocnění není známa. Předpokládá se, že zvětšená prostata přispívá k rozvoji komplexu symptomů dolních močových cest (lower urinary tract symptoms, LUTS) minimálně dvěma způsoby: 1. prostřednictvím obstrukce výtoku z močového měchýře (bladder outlet obstruction, BOO), která je způsobena zvětšenou prostatickou žlázou (statická komponenta), a 2. v důsledku zvýšeného tonu hladké svaloviny a rezistence ve zvětšené žláze (dynamická komponenta). Mikční symptomy jsou přisuzovány přítomnosti BOO, hyperaktivita detruzoru přispívá ke vzniku jímacích symptomů v rámci LUTS (obr. 2) [3].
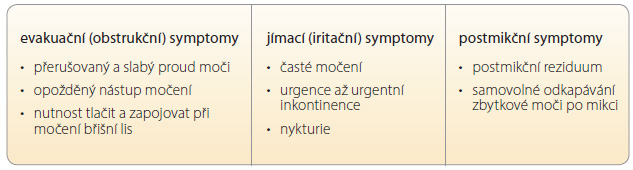 Ačkoli LUTS v důsledku BHP (LUTS/BHP) obvykle nepředstavují život ohrožující stav, dopad na kvalitu života pacienta může být zásadní a neměl by být podceňován. Klinicky se BHP manifestuje LUTS, a to jak evakuačními, tak jímacími mikčními a postmikčními příznaky, močovou retencí, nestabilitou detruzoru, infekcí močových cest, hematurií, či dokonce hydronefrózou a renální insuficiencí. LUTS se vyskytuje přibližně u 30 % mužů starších 65 let [4, 5]. Obecně lze říci, že BHP je jedním z nejčastějších onemocnění postihujících stárnoucí muže a že se jedná o onemocnění progresivní, které může skončit selháním funkcí dolních močových cest a renální insuficiencí.
Ačkoli LUTS v důsledku BHP (LUTS/BHP) obvykle nepředstavují život ohrožující stav, dopad na kvalitu života pacienta může být zásadní a neměl by být podceňován. Klinicky se BHP manifestuje LUTS, a to jak evakuačními, tak jímacími mikčními a postmikčními příznaky, močovou retencí, nestabilitou detruzoru, infekcí močových cest, hematurií, či dokonce hydronefrózou a renální insuficiencí. LUTS se vyskytuje přibližně u 30 % mužů starších 65 let [4, 5]. Obecně lze říci, že BHP je jedním z nejčastějších onemocnění postihujících stárnoucí muže a že se jedná o onemocnění progresivní, které může skončit selháním funkcí dolních močových cest a renální insuficiencí.
V posledních 15 letech vedl výzkum v oblasti farmakologie k vývoji a aplikaci řady nových přípravků, díky nimž došlo k výraznému posunu v léčbě BHP. Klasická operační léčba je stále častěji nahrazována farmakoterapií a vývoj zaznamenávají i minimálně invazivní techniky. Primární cíl léčby tradičně spočíval v úlevě od obtěžujících LUTS pramenících ze zvětšené prostaty. V poslední době se však léčba zaměřuje navíc na změny v progresi onemocnění a na prevenci možných komplikací, jež mohou souviset s BHP/LUTS [6].
Pozorné sledování – WW
Pozorné sledování, označované zkratkou WW (watchful waiting), jako způsob léčby uplatňujeme v současné době u řady mužů s LUTS, kteří si nestěžují na vysokou míru obtíží. Jedná se o muže s mírnými nebo s mírnými/středními LUTS (nezpůsobujícími vážné zdravotní ohrožení), které kvalitu jejich života ovlivňují jen minimálně, nebo ji neovlivňují vůbec, a nepotřebují tedy ani konzervativní, ani chirurgickou léčbu. Součástí léčby je uklidnění pacienta a jeho edukace (poskytnout informace o BHP, o tom, že LUTS neprogreduje u každého, o karcinomu prostaty), pravidelné sledování a úprava životního stylu pacienta (snížení příjmu tekutin v určitou dobu, omezení příjmu kofeinu, alkoholu, kontrola, eventuálně úprava chronické medikace). Během sledování bude pouze u části pacientů (pokud zůstanou neléčeni) onemocnění progredovat k akutní močové retenci a komplikacím BHP. Naopak u řady pacientů zůstávají symptomy stabilní řadu let a některé symptomy se mohou v průběhu WW spontánně zmírnit [7]. U mnohých mužů je tento typ léčby považován za první stupeň v léčebné kaskádě, a proto je řadě mužů v počáteční fázi choroby nabídnuto WW.
Farmakoterapie BHP
Fytoterapie
Fytoterapie se v léčbě LUTS a BHP používá již více než dvacet let. Mnoho lidí preferuje „přírodní léčbu“, kdy fytoterapie má minimální nežádoucí účinky a mnohé fytopreparáty jsou volně dostupné ke koupi bez receptu. Nejznámějším a nejpoužívanějším z nich je výtažek z plodů trpasličí palmy Serenoa repens (synonymum Sabal serrulata, serenoa pilovitá), která roste na jihovýchodě Severní Ameriky. Důkazy různé kvality naznačují, že Serenoa repens může vykazovat účinek podobný inhibitorům 5-alfa-reduktázy, protizánětlivé a antiproliferativní působení [8]. V nedávné době provedená aktualizace metaanalýzy, která zahrnuje i novější studie, dospěla k závěru, že extrakt ze Serenoa repens není při léčbě močových symptomů doprovázejících BHP účinnější než placebo [9].
Dalšími rostlinnými látkami užívanými k léčebným účelům jsou výtažky z kopřivy dvoudomé (Urtica dioica), z kůry africké švestky (Pygeum africanum), ze semen dýně obecné (Cucurbita pepo), z jihoafrické hvězdicovité trávy (Hypoxis rooperi), z pylu žita setého (Secale cereale) [10] či z vrbovky malokvěté (Epilobium parviflorum), která je u nás jistě nejznámější. Fytoterapeutika jsou obvykle nabízena v podobě přípravků kombinujících různé výtažky, u nichž se předpokládá účinek při léčbě LUTS. Většina těchto přípravků obsahuje extrakt ze Serenoa repens v kombinaci s dalšími doplňky stravy. Nežádoucí účinky fytopreparátů jsou minimální, nejčastěji se popisují mírné gastrointestinální obtíže.
U fytoterapie není definována účinná látka ani mechanismus jejího působení, není definována standardní extrakce z rostlin, a navzdory dlouholetému výzkumu a velkému počtu publikací je kvalita, velikost a délka trvání většiny studií nedostačující, což znemožňuje stanovit konkrétní doporučení a jasné klinické postupy. Z výše uvedených důvodů není fytoterapie doporučena pro léčbu pacientů s BHP [11].
Inhibitory 5-alfa-reduktázy
Normální vývoj prostaty i její abnormální proliferace vedoucí k BHP jsou pod vlivem androgenní stimulace. Proliferační a růstové aktivity v prostatě jsou zprostředkovány derivátem testosteronu dihydrotestosteronem (DHT). Hladina DHT je relativně stabilní bez ohledu na věk nebo přítomnost BHP. DHT vede k aktivaci transkripce androgen-dependentních genů, čímž dochází k růstu a diferenciaci buněk. Množství DHT navázané na specifické receptory v buněčném jádře je rozhodující pro stimulační účinek androgenů na růst tkáně prostaty [12]. 5-alfa-reduktáza je enzym, který konvertuje testosteron na účinnější DHT, vyskytuje se ve dvou formách, jako typ 1 a typ 2. V prostatě se uplatňuje hlavně typ 2, a to takřka výlučně v jejím stromatu [13].
Finasterid je kompetitivní inhibitor lidské 5-alfa-reduktázy (5-ARI) s vyšší afinitou k 5-alfa-reduktáze 2. typu. Finasterid snižuje plazmatickou hladinu DHT až o 75 %, aniž by ovlivňoval hladinu testosteronu, nemá vliv na kvalitu spermatu a neovlivňuje kostní denzitu ani hladiny sérových lipidů [14]. Léčba finasteridem v dávce 5 mg denně po dobu 12 měsíců snižuje hladiny prostatického specifického antigenu (PSA) o 50 %, nezpůsobuje však zastření možné přítomnosti karcinomu prostaty [15]. Opakované vyšetření hladin PSA umožňuje dosáhnout přesného zhodnocení stavu.
V současné době, po ukončení četných randomizovaných, placebem kontrolovaných klinických studií, je zřejmé, že finasterid je účinnější u pacientů s objemem prostaty větším než 30 ml a hladinou PSA vyšší než 1,5 ng/ml, že snižuje objem prostaty, zlepšuje skóre symptomů a rychlost průtoku moči [16–18]. Maximální účinnosti finasteridu je dosaženo po 6měsíční době léčby. S ohledem na úlevu od LUTS vykazuje finasterid nižší účinnost než alfablokátory, a není tedy vhodnou modalitou pro muže s LUTS, kteří nemají zvětšenou prostatu.
Finasterid zastavuje přirozenou progresi BHP u mužů se zvětšenou prostatou, významně snižuje riziko akutní močové retence a potřebu chirurgické léčby [17, 18]. Díky vlivu na růstové faktory (vaskulární endotelový růstový faktor) v tkáni prostaty se finasterid podílí i na redukci hematurie z prostaty při BHP [19, 20].
Nežádoucí účinky léčby finasteridem jsou minimální. Ve studii PLESS bylo prokázáno, že nežádoucí sexuální účinky související s léčbou finasteridem (pokles libida u 6,4 % pacientů, impotence u 8,1 %, snížení objemu ejakulátu u 3,7 % pacientů léčených finasteridem) se vyskytovaly hlavně v prvním roce léčby, v dalších letech již byly srovnatelné s podáváním placeba [21], což nasvědčuje tomu, že porucha sexuální a ejakulační funkce souvisí spíše s věkem pacienta než s přímým účinkem léčby. Dvouletá otevřená studie, která představuje rozšíření studie PLESS, neuvádí mezi pacienty užívajícími finasterid nebo placebo žádný rozdíl ve výskytu závažných nežádoucích účinků [22].
Dutasterid je druhým přípravkem ze skupiny 5-ARI schváleným k léčbě LUTS a BHP; oproti finasteridu je dutasterid inhibitorem izoenzymů 1. i 2. typu 5-alfa-reduktázy a v důsledku toho způsobuje pokles hladiny DHT v séru asi o 90 %. Při zamezení konverze testosteronu na DHT dochází k poklesu hladin jak sérových, tak intraprostatických. Tento stav vede k atrofii glandulárně-epiteliální komponenty tkáně prostaty i v přechodné zóně a následně ke zmenšení objemu prostaty o 20–25 %. Publikované studie prokazují dobrou klinickou účinnost dutasteridu, obdobnou finasteridu [23–25], nicméně nebyly zveřejněny žádné studie, které by přímo srovnávaly dutasterid s finasteridem. Uváděné nežádoucí účinky zahrnují erektilní dysfunkci, pokles libida, poruchy ejakulace a gynekomastii.
Inhibitory 5-alfa-reduktázy představují léčebnou volbu pro pacienty se středními/většími obtížemi, zvětšenou prostatou (> 30 ml) a/nebo s vyšší hladinou PSA (> 1,5 ng/ml).
Alfablokátory
Obstrukci prostatické uretry u pacientů s BHP tvoří dvě komponenty: statická, vyvolaná objemem tkáně, a dynamická, daná tonusem hladkých svalových vláken žlázy. Prostata má dvojí inervaci, adrenergní a cholinergní. Sympatická (adrenergní) inervace má určující vliv na tonus svalových vláken. Adrenergní receptory jsou ve stěně a hrdle močového měchýře, v prostatě a v uretře zastoupeny nerovnoměrně. Maximum je prokázáno ve stromatu žlázy. Adrenoreceptory α lze prokázat i v hladkém svalstvu jiných orgánových systémů, především v systému kardiovaskulárním. Receptory α1 se vyskytují zejména v hladké svalovině uropoetického traktu, receptory α2 převažují v hladké svalovině cév. Receptory α1 dělíme dále na subtypy α1A (převážně hrdlo močového měchýře, prostata, uretra), α1B (cévy) a α1D (močový měchýř – detruzor). Všechny tkáně obsahují všechny podtypy, avšak v různém procentuálním zastoupení.
Alfablokátory způsobují uvolnění subvezikální obstrukce snížením tonu hladké svaloviny hrdla močového měchýře, prostaty a prostatického pouzdra blokováním receptorů α1. Alfablokátory mají rychlý nástup účinku (plný účinek se rozvine přibližně za 2 týdny), neovlivňují hladinu PSA a minimálně ovlivňují sexuální funkce. Mohou vést k rychlému zlepšení skóre symptomů a ke zvýšení rychlosti průtoku moči [26].
Klinické studie uvádějí, že míra výskytu specifických nežádoucích účinků je nízká a srovnatelná s placebem. Nejčastějšími nežádoucími účinky léčby alfablokátory jsou bolesti hlavy, závratě, únava, posturální hypotenze, periferní otoky a retrográdní ejakulace [26]. Tyto účinky jsou dány periferním a také centrálním působením, i když se mnohé z léčiv honosí přívlastkem uroselektivní.
Alfablokátory jsou volbou pro pacienty se středními a velkými obtížemi, s výhodou u pacientů vyžadujících rychlou úlevu od obtíží a s převahou iritačních příznaků. Drobné rozdíly zaznamenané v účinnosti jednotlivých alfablokátorů (alfuzosin, doxazosin, tamsulosin, terazosin, silodosin) nejsou statisticky ani klinicky významné. Alfuzosin má prokázán nejnižší výskyt retrográdní ejakulace, a je proto vhodný pro mladší muže odmítající tento typ nežádoucího účinku. Terazosin a doxazosin vyžadují titraci dávky a monitorování krevního tlaku, častěji se při jejich podávání vyskytují závratě a astenie. Tamsulosin nejvýrazněji snižuje frekvenci nočního močení, tamsulosin a silodosin jsou spojeny s nejnižším výskytem ortostatických hypotenzí, a jsou proto vhodné i pro pacienty starší 70 let.
V současné době jsou u většiny alfablokátorů používaných k léčbě BHP k dispozici lékové formy s řízeným uvolňováním léčivé látky. K nežádoucím účinkům léčby těmito přípravky naopak patří častější retrográdní ejakulace a syndrom vlající duhovky, který v roce 2005 popsali Chang a Cambell během operace šedého zákalu u pacientů užívajících tamsulosin. Tento stav nazvali IFIS (intraoperative floppy iris syndrome, syndrom vlající duhovky). Syndrom je charakterizován nedokonalou mydriázou před operací, zúžením zornice během operace a vzdouvající se a vlající duhovkou s tendencí k prolapsům. Příčinou pravděpodobně může být ovlivnění α1-receptorů v dilatátoru duhovky. Ojediněle byl IFIS popsán též u pacientů léčených jinými α1-blokátory, a nelze tedy vyloučit tento účinek u celé lékové skupiny. Jelikož IFIS může způsobovat komplikace během chirurgického výkonu, měl by být operatér o užívání α1-blokátorů vždy informován.
Kombinovaná léčba alfablokátory a 5-ARI
Teprve výsledky multicentrické, randomizované, placebem kontrolované a dvojitě zaslepené studie MTOPS (Medical Therapy of Prostatic Symptoms) přinesly odpovědi na otázky, zdali finasterid nebo doxazosin, ať už podávané v monoterapii, nebo v kombinaci, mohou zastavit nebo oddálit progresi BHP. Doba sledování souboru 3047 mužů byla 4,5 roku. Kombinovaná léčba byla účinnější než monoterapie jedním či druhým přípravkem, a to jak ve snížení symptomového skóre a zlepšení průtokových poměrů, tak z hlediska snížení rizika akutní močové retence a následného chirurgického výkonu [6, 27].
Druhou významnou studií zaměřenou na kombinovanou léčbu je čtyři roky trvající CombAT, která srovnává monoterapii tamsulosinem, monoterapii dutasteridem a kombinaci obou léčiv [24]. Kombinovaná terapie umožňuje podstatně významnější redukci symptomů ve srovnání s aplikací samotného dutasteridu či tamsulosinu a rovněž zlepšení celkového zdravotního stavu souvisejícího s BHP včetně zvýšení maximální rychlosti průtoku moči. Kombinovaná léčba byla ale také spojena s nárůstem nežádoucích účinků (oproti monoterapii).
Studie MTOPS a CombAT tak přinesly zásadní změnu v náhledu na terapii BHP. Dlouhodobé podávání kombinované léčby snižuje riziko akutní močové retence a nutnosti chirurgické léčby. Léčba je vhodná pro pacienty s vysokým rizikem progrese onemocnění (objem prostaty > 40 ml, hladina PSA > 1,5 ng/ml, věk > 50 let, tíže symptomů LUTS). Kombinovaná léčba by měla být podávána dlouhodobě, déle než 12 měsíců, aby bylo dosaženo účinku, pro kratší aplikaci není doporučována.
Antimuskarinika
Iritační symptomy LUTS způsobené BHP, jako jsou frekventní mikce, nykturie, urgence a urgentní inkontinence, patří mezi nejvíce zatěžující obtíže zhoršující kvalitu života pacientů. Kontrakce detruzoru močového měchýře je zprostředkována účinkem acetylcholinu na muskarinových receptorech s následnou kontrakcí hladké svaloviny. Muskarinové receptory se vyskytují i v jiných částech těla a rozlišujeme celkem pět podtypů (M1–M5). Na povrchu buněk detruzoru se v převaze vyskytují receptory M2 a M3. Ačkoliv predominují receptory M2, receptory M3 jsou primárně zodpovědné za kontrakce močového měchýře [28].
Antimuskarinika způsobují blokádu účinku acetylcholinu na muskarinových receptorech v centrálním a periferním nervovém systému. Běžně užívaná antimuskarinika první generace – oxybutynin, propiverin, trospium – inhibují všechny subtypy muskarinových receptorů, a proto je při jejich podávání možný vyšší výskyt typických antimuskarinových nežádoucích účinků (sucho v ústech, poruchy akomodace, zácpa, tachykardie, narušení kognitivních funkcí). Antimuskarinika druhé generace – tolterodin, fesoterodin, darifenacin, solifenacin – mají větší tkáňovou selektivitu k muskarinovým receptorům subtypu M3 a M2 ve stěně detruzoru a v buňkách urotelu. Při srovnatelné účinnosti na symptomy hyperaktivního močového měchýře (overactive bladder, OAB) – nykturie, polyurie, urgence – mají méně nežádoucích účinků než přípravky první generace.
Nově je nyní na trhu kombinovaný přípravek složený z tamsulosinu 0,4 mg a solifenacinu 6 mg v jedné tabletě. Jedná se o nový směr léčby LUTS/BHP. Kombinace alfablokátoru a antimuskarinika zmírňuje obtíže pacienta způsobené LUTS/BHP, snižuje IPSS (International Prostatic Symptom Score, Mezinárodní skóre prostatických symptomů), redukuje počet a naléhavost urgencí a frekvenci mikce, zlepšuje kvalitu života a nevede ke zvýšenému výskytu nežádoucích účinků [29].Antimuskarinika představují vhodnou a účinnou modalitu pro léčbu LUTS v důsledku BHP u mužů, kteří nemají vyšší objem postmikčního rezidua, a u mužů s převážně iritačními LUTS.
Mirabegron
Signifikantní část LUTS je způsobena dysfunkcí detruzoru. Mirabegron jako zástupce nové třídy léčiv pro terapii symptomů OAB je aktivní selektivní agonista adrenoreceptorů β3, snižuje frekvenci kontrakcí detruzoru v průběhu plnící fáze bez ovlivnění amplitudy stahu močového měchýře při mikci. Ve studiích fáze III mirabegron zaznamenal signifikantní redukci počtu epizod urgence, urgentní inkontinence a frekvence močení. Bezpečnostní profil byl srovnatelný s placebem. U žádného pacienta léčeného mirabegronem v dávce 50 mg nedošlo k akutní retenci moči. Nejčastějším nežádoucím účinekem je tachykardie a infekce močových cest. Mezi vzácné, nicméně závažné nežádoucí účinky patří fibrilace síní [30, 31].
Tadalafil
LUTS a sexuální dysfunkce mají vysokou prevalenci u mužů vyššího věku a společně výrazně ovlivňují všeobecnou kvalitu života včetně psychiky. Současná léčba BHP, respektive LUTS, postihuje přímo i nepřímo sexuální funkce. Užití inhibitorů fosfodiesterázy 5 (PDE5-I) v léčbě erektilní dysfunkce pozitivně ovlivňuje LUTS a zmírňuje projevy BHP.
Tadalafil je jedním z PDE5-I, který se primárně používá k léčbě erektilní dysfunkce. Závěry nových studií však prokazují pozitivní účinek na LUTS/BHP. Ke zmírnění symptomů LUTS/BHP léčbou tadalafilem může dojít nejen díky uvolnění hladkého svalstva v prostatě, ale také přímým účinkem na močový měchýř [32]. Relaxace hladké svaloviny cévní stěny v oblasti dolních močových cest zlepšuje prokrvení, a tak i oxygenaci tkání v oblasti orgánů dolních močových cest. Výsledky těchto studií prokázaly pozitivní efekt tadalafilu podávaného v dávce 5 mg denně na zlepšení celkového IPSS, zmírnění symptomů LUTS a zvýšení maximálního průtoku moči (Qmax) a také na celkové zlepšení kvality života [33, 34].
Americký úřad FDA (Food and Drug Administration) nově schválil léčivo tadalafil, původně schválené pro léčbu erektilní dysfunkce, k léčbě příznaků BHP a pro léčbu BHP a erektilní dysfunkce za předpokladu, že se symptomy vyskytují současně.
Závěr
Léčba LUTS/BHP prodělala v posledních 15 letech výrazný pokrok. Byly vyvinuty nové účinné a bezpečné přípravky, které změnily její algoritmy (tab. 1). Ubylo operací pro t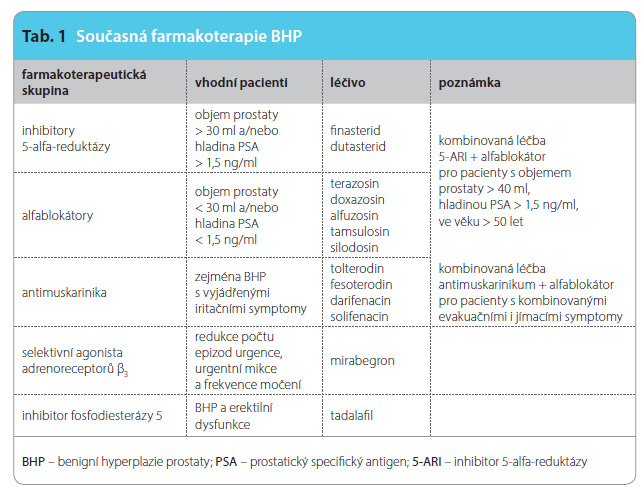 uto diagnózu a přibývá nemocných léčených medikamentózně.
uto diagnózu a přibývá nemocných léčených medikamentózně.
Základem farmakoterapie LUTS/BHP je podávání alfablokátorů, které jsou volbou zejména pro pacienty se středními a velkými obtížemi, s výhodou u pacientů vyžadujících rychlou úlevu od obtíží a s převahou iritačních příznaků. Pacienti s objemem prostaty větším než 30 ml a hladinou PSA vyšší než 1,5 ng/ml a středními až velkými příznaky BHP mají prospěch z podávání inhibitorů 5-alfa-reduktázy. Kombinovaná léčba je vhodná pro pacienty s vysokým rizikem progrese onemocnění. K dosažení požadovaného účinku by měla být podávána dlouhodobě, déle než 12 měsíců, pro kratší aplikaci není doporučována. Tradiční antimuskarinika se používají zejména u pacientů s iritačními symptomy dolních močových cest způsobenými LUTS/BHP. Paletu léčiv používaných k terapii LUTS/BHP nově rozšiřuje tadalafil, léčivo původně registrované pouze k terapii erektilní dysfunkce. Medikamentózní léčba LUTS je velmi nákladná. Z tohoto důvodu je nezbytné, aby tato léčba byla správně indikována a aby z ní pacienti měli co největší prospěch s minimem nežádoucích účinků.
Seznam použité literatury
- [1] Auffenberg GB, Helfand BT, McVary KT. Established medical therapy for benign prostatic hyperplasia. Urol Clin North Am 2009; 36: 443–459.
- [2] Barry JJ, Coffey DS, Walsh PC, Ewing LL. The development of human benign prostatic hyperplasia with age. J Urol 1984; 132: 474–479.
- [3] Reynard J. Does anticholinergic medication have a role for men with lower urinary tract symptoms/benign prostatic hyperplasia either alone or in combination with other agents? Curr Opin Urol 2004; 14: 13–16.
- [4] Berges RR, Pientka L. Management of the BPH syndrome in Germany: who is treated and how? Eur Urol 1999; 36 (Suppl 3): 21–27.
- [5] Bosch JLHR, Hop WCJ, Kirkels WJ, Schröder FH. The International Prostate Symptom Score in a community-based sample of men between fifty-five and seventy-four years of age. Prevalence and correlation of symptoms with age, prostate volume, flow rate and residual urine volume. Br J Urol 1995; 75: 622–630.
- [6] McConnell J, Roehrborn C, Bautista O, et al. The long-term effect of doxazosin, finasteride and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349: 2387–2398.
- [7] Kirby RS. The natural history of benign prostatic hyperplasia: what have we learned in the last decade? Urology 2000; 56: 3–6.
- [8] Avins AL, Bent S. Saw palmetto and lower urinary tract symptoms: what is the latest evidence? Curr Urol Reports 2006; 7: 260–265.
- [9] Tracklind J, MacDonald R, Rutks I, et al. Serenoa repens for benign prostatic hyperplasia (Cochrane Review). The Cochrane Database of Systematic Reviews 2009.
- [10] Wilt T, Ishani A, Stark G, et al. Phytotherapy for benign prostatic hyperplasia. Public Health Nutr 2000; 3: 459–472.
- [11] De la Rosette J, Madersbacher S, Alivizatos G. Guidelines on benign prostatic hyperplasia. In: Urological guidelines EAU March 2004 Edition; 7: 53.
- [12] Kirby RS, et al. Textbook of Benign Prostatic Hyperplasia. Oxford: Isis Medical Media 1996.
- [13] Silver RI, Wiley EL, Thigpen AE, et al. Cell type specific expression of steroid 5alfa-reductase 2. J Urol 1994; 152: 438–442.
- [14] Matsumoto AM, Tenover L, McClung M, et al. PLESS Study Group. The long-term effect of specific type II 5alpha-reductase inhibition with finasteride on bone mineral density in men: results of a 4-year placebo controlled trial. J Urol 2002; 167: 2105–2108.
- [15] Andriole GL, Guess HA, Epstein JL, et al. Treatment with finasteride preserves usefulness of prostate specific antigen in the detection of prostate cancer: results of a randomized, double-blind, placebo-controlled clinical trial. PLESS Study Group. Proscar Long-term Efficacy and Safety Study. Urology 1998; 52: 195–201.
- [16] Bruskewitz R, Girman CJ, Fowler J, et al. Effect of finasteride on bother and other health-related quality of life aspects associated with benign prostatic hyperplasia. PLESS Study Group. Proscar Long-term Efficacy and Safety Study. Urology 1999; 4: 670–678.
- [17] McConnell JD, Bruskewitz R, Walsh P, et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. Finasteride Long-term Efficacy and Safety Study Group. N Engl J Med 1998; 338: 557–563.
- [18] Roehrborn CG, Bruskewitz R, Nickel JC, et al. Urinary retention in patients with BHP treated with finasteride or placebo over 4 years. Characterization of patients and ultimate outcomes. The PLESS Study Group. Eur Urol 2000; 37: 528–536.
- [19] Foley SJ, Soloman LZ, Wedderburn AW, et al. A prospective study of the natural history of hematuria associated with benign prostatic hyperplasia and the effect of finasteride. J Urol 2000; 163: 496–498.
- [20] Canda AE, Mungan MU, Yilmaz O, et al. Effects of finasteride on the vascular surface density, number of microvessels and vascular endothelial growth factor expression of the rat prostate. Int Urol Nephrol 2006; 38: 275–280.
- [21] Wessells H, Roy J, Bannow J, et al. PLESS Study Group. Incidence and severity of sexual adverse experiences in finasteride and placebo-treated men with benign prostatic hyperplasia. Urology 2003; 61: 579–584.
- [22] Roehrborn CG, Bruskewitz R, Nickel JC, et al. Sustained decrease in incidence of acute urinary retention and surgery with finasteride for 6 years in men with benign prostatic hyperplasia. J Urol 2004; 171: 1194–1198.
- [23] Andriole GL, Kirby R. Safety and tolerability of the Dual 5 alpha-Reductase Inhibitor dutasteride in the treatment of benign prostatic hyperplasia. Eur Urol 2003; 44: 82–88.
- [24] Roehrborn C, Siami P, Barkin J, et al. The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the CombAT study. J Urol 2008; 179: 616–621.
- [25] Roehrborn C, Lukkarinen O, Mark S, et al. Longterm sustained improvement in symptoms of benign prostatic hyperplasia with the dual 5alpha-reductase inhibitor dutasteride: results of 4-year studies. BJU Int 2005; 96: 572–577.
- [26] Djavan B, Marberger M. Meta-analysis on the efficacy and tolerability of alpha1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic obstruction. Eur Urol 1999; 36: 1–13.
- [27] McConnell JD. The long term effects of medical therapy on the progression of BPH: Results from the MTOPS trial (Abstract 1042). J Urol 2002; 167 (4, Suppl): 265.
- [28] Caulfield M, Birdsall N. International Union of Pharmacology. XVII. Classification of muscarinic acetylcholine receptors. Pharmacol Rev 1998; 50: 279–290.
- [29] van Kerrebroeck P, Chapple C, Drogendijk T, et al. Combination therapy with solifenacin and tamsulosin oral controlled absorption system in a single tablet for lower urinary tract symptoms in men: efficacy and safety results from the randomised controlled NEPTUNE trial. Eur Urol 2013; 64: 1003–1012.
- [30] Khullar V, Amarenco G, Angulo JC, et al. Efficacy and tolerability of mirabegron, a β3-adrenoceptor agonist, in patients with overactive bladder: results from a randomised European-Australian phase 3 trial. Eur Urol 2013; 63: 283–295.
- [31] Chapple CR, Amarenco G, López Aramburu MA, et al. A proof-of-concept study: Mirabegron, a new therapy for overactive bladder. Neurourol Urodyn 2013; 32: 1116–1122.
- [32] Roehrborn CG, McVary KT, Elion-Mboussa A, et al. Tadalafil administered once daily for lower urinary tract symptoms secondary to benign prostatic hyperplasia: a dose finding study. J Urol 2008; 180: 1228–1234.
- [33] Oelke M, Giuliano F, Mirone V, et al. Monotherapy with tadalafil or tamsulosin similarly improved lower urinary tract symptoms suggestive of benign prostatic hyperplasia in an international, randomised, parallel, placebo-controlled clinical trial. Eur Urol 2012; 61: 917–925.
- [34] Donatucci CF, Brock GB, Goldfischer ER, et al. Tadalafil administered once daily for lower urinary tract symptoms secondary to benign prostatic hyperplasia: a 1-year, open-label extension study. BJU Int 2011; 107: 1110–1116.