Současná role glatiramer acetátu v léčbě roztroušené sklerózy mozkomíšní
Glatiramer acetát je jedním z léků první volby v léčbě relabující-remitující formy roztroušené sklerózy mozkomíšní a klinicky izolovaného syndromu. Je charakterizován dlouhodobou účinností projevující se redukcí počtu atak, stabilizací disability a pozitivním ovlivněním změn v mozkové tkáni při vyšetření magnetickou rezonancí. Jeho bezpečnostní profil je velmi příznivý, bez infekčních a onkologických nežádoucích účinků.
Glatiramer acetát (GA) je jedním z léků první volby pro léčbu relabující-remitující formy roztroušené sklerózy mozkomíšní (RS). Glatiramer acetát a interferony (IFN) beta-1a a beta-1b byly donedávna jedi-nými léky v léčbě RS, v poslední době se však s příchodem nových léků situace mění, což vyžaduje revizi léčebného postavení GA ve spektru dostupných léčiv.
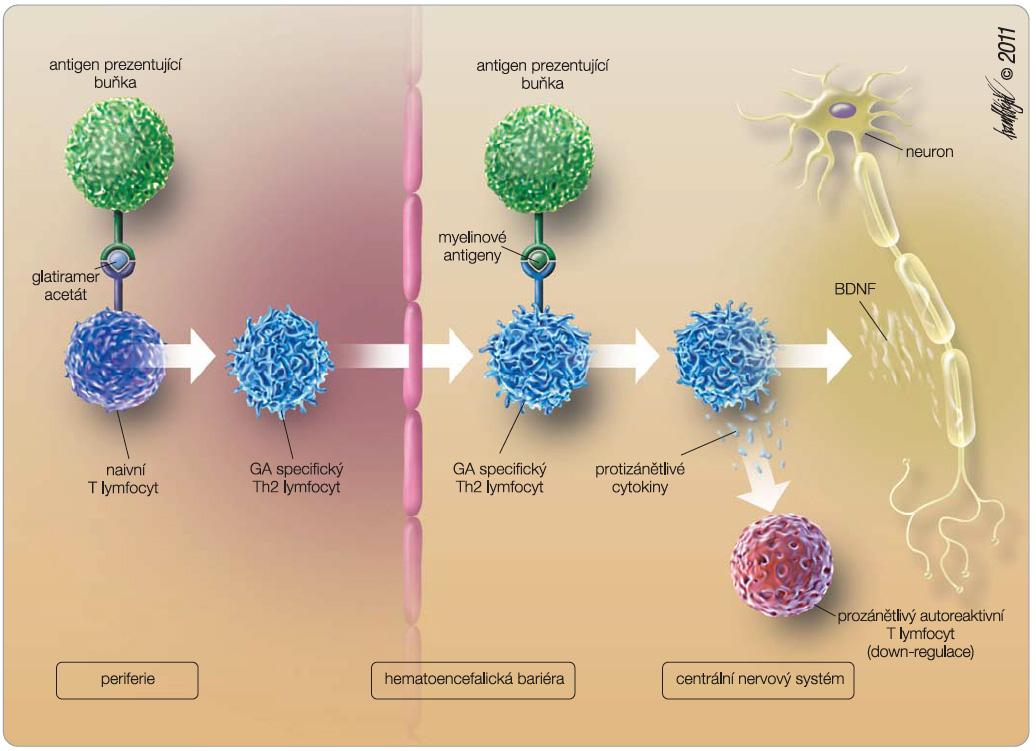 GA je tvořen směsí syntetických polypeptidů odvozených ze 4 aminokyselin původně vytvořených jako peptidový analog myelinového bazického proteinu [1]. Mechanismus působení GA je imunomodulační. GA tlumí zánět a současně má i vlastnosti neuroprotektivní [2]. GA ovlivňuje lymfocytární populace v cirkulaci mechanismem indukce imunoregulačních Th2 lymfocytů [3]. Tyto Th2 imunoregulační lymfocyty přestupují hematoencefalickou bariéru a v centrálním nervovém systému produkují protizánětlivé cytokiny a neuro-trofní faktory [4]. Stimulací sekrece neurotrofních faktorů ochraňuje GA axony a přispívá k reparaci poškozených neuronů, viz obr. 1. Účinnost a bezpečnost GA byla prokázána v klinických studiích, v některých srovnávacích studiích vůči ostatním lékům první volby ze skupiny interferonů beta a bezpečnost byla dále potvrzena v observačních klinických studiích v průběhu dvou dekád [5].
GA je tvořen směsí syntetických polypeptidů odvozených ze 4 aminokyselin původně vytvořených jako peptidový analog myelinového bazického proteinu [1]. Mechanismus působení GA je imunomodulační. GA tlumí zánět a současně má i vlastnosti neuroprotektivní [2]. GA ovlivňuje lymfocytární populace v cirkulaci mechanismem indukce imunoregulačních Th2 lymfocytů [3]. Tyto Th2 imunoregulační lymfocyty přestupují hematoencefalickou bariéru a v centrálním nervovém systému produkují protizánětlivé cytokiny a neuro-trofní faktory [4]. Stimulací sekrece neurotrofních faktorů ochraňuje GA axony a přispívá k reparaci poškozených neuronů, viz obr. 1. Účinnost a bezpečnost GA byla prokázána v klinických studiích, v některých srovnávacích studiích vůči ostatním lékům první volby ze skupiny interferonů beta a bezpečnost byla dále potvrzena v observačních klinických studiích v průběhu dvou dekád [5].
Účinnost GA v léčbě relabující-remitující formy roztroušené sklerózy mozkomíšní
V roce 1995 byla provedena klinická studie třídy I prokazující 29% redukci počtu atak ve srovnání s placebovou skupinou [6]. V následujících letech proběhly tři srovnávací studie týkající se účinnosti GA v porovnání s různými dávkami interferonu beta. Tyto srovnávací studie prokázaly, že není signifikantní rozdíl mezi podáváním vysokých dávek interferonu beta-1b a GA v primárním cíli srovnávání, jímž byla redukce atak. V klinické studii nazvané REGARD (the REbif vs Glatiramer Acetate in Relaps-ing MS Disease) byly srovnávány 2 skupiny pacientů diagnostikovaných na základě McDonaldových kritérií, kteří prodělali nejméně jeden relaps během jednoho roku ![Graf 1 Kaplanovy-Meierovy křivky znázorňující primární výsledek studie – čas do prvního relapsu. Nebyl prokázán statisticky signifikantní rozdíl mezi oběma léčenými skupinami. Během studie nebylo dosaženo očekávaných mediánů; 30. percentil pro dobu do první recidivy činil 495 dnů v rameni s interferonem beta-1a a 432 dnů v rameni s glatiramer acetátem; podle [7] – Mikol, et al., 2008.](https://www.remedia.cz/photo-a-28554---.jpg) před zahájením studie. Pacienti dostávali buď interferon beta-1a (44 mg s.c. 3krát týdně), nebo GA (20 mg s.c. 1krát denně) po dobu 96 týdnů. Po ukončení studie nebyl mezi oběma léčenými skupinami signifikantní rozdíl v roční četnosti atak a v obou skupinách byla tato četnost nižší, než se očekávalo, viz graf 1. V parametrech vyšetření magnetickou rezonancí nebyly významné změny v množství a objemu T2 vážených lézí. Ve skupině pacientů léčených interferonem beta-1a se vyskytlo méně gadolinium enhancujících lézí, zatímco ve skupině pacientů léčených GA byl zaznamenán signifikantně nižší stupeň mozkové atrofie [7]. Studie BEYOND zahrnovala 3 skupiny pacientů, u nichž byly srovnávány 2 dávky interferonu beta-1b (500 mg a 250 mg každý druhý den) a 20 mg GA denně. Pacienti dostávali studijní medikaci po dobu dvou let. Nebyl zjištěn rozdíl v roční četnosti relapsů (0,33, 0,36 a 0,34) a dále nebyl zaznamenán statisticky významný rozdíl v době do objevení se prvního relapsu, v celkovém počtu relapsů a podílu pacientů, kteří zůstali bez relapsu. V parametrech magnetické rezonance nebyl rozdíl v počtu gadolinium enhancujících lézí, T1 lézí a v objemu mozkové tkáně [8]. Statisticky významný rozdíl byl zjištěn v kumulativním počtu nových T2 lézí a jejich objemu ve skupinách pacientů léčených 500 mg IFN beta-1b, 250 mg IFN beta-1b a GA, procentuálně vyjádřený jako 12 %, 10 % a 17 %. Z celkového počtu 2244 sledovaných pacientů studii předčasně ukončilo 161 pacientů léčených dávkou 500 mg interferonu beta-1b, 104 pacientů léčených 250 mg interferonu beta-1b a 71 pacientů léčených GA. V další srovnávací studii (BECOME) byl porovnáván interferon beta-1b versus GA při podání trojité dávky gadolinia a vyšetření pacientů na 3 Tesla magnetické rezonanci. Byl hodnocen parametr nazvaný kombinované aktivní léze zahrnující gadolinium enhancující a nové T2 vážené léze. Výsledky byly pro IFN beta-1b a GA obdobné, bez signifikantního statistického rozdílu. Průměrná roční četnost atak poklesla u IFN beta-1b z výchozí hodnoty 1,8 na 0,37, což představovalo redukci o 79 %, a ve skupině léčené GA došlo k poklesu z hodnoty 1,9 na 0,33, což představovalo redukci o 83 %. Pokud shrneme údaje z těchto studií srovnávajících léčbu vysokými dávkami IFN beta-1b a GA, jedná se o velmi podobné výsledky týkající se účinnosti vyjádřené redukcí roční četnosti atak a začátkem léčebného působení. Navíc redukce ročního počtu atak je výraznější ve srovnání s výsledky primární klinické studie s GA z roku 1995 [6]. Redukce atak prokázaná v těchto srovnávacích studiích se pohybuje v rozmezí 0,29–0,34 ataky/rok, což představuje významný pokles ve srovnání s původní studií, kde snížení v důsledku léčby GA představovalo průměrně 0,59 ataky/rok. Nejpravděpodobnější vysvětlení uvedeného trendu spočívá v odlišné struktuře souboru pacientů vzhledem k časnějšímu zařazení a léčbě umožněné McDonaldovými diagnostickými kritérii zahrnujícími vyšetření magnetickou rezonancí. Výsledky těchto nedávných studií vykazují výraznější účinnost léčby zahájené v časných fázích onemocnění.
před zahájením studie. Pacienti dostávali buď interferon beta-1a (44 mg s.c. 3krát týdně), nebo GA (20 mg s.c. 1krát denně) po dobu 96 týdnů. Po ukončení studie nebyl mezi oběma léčenými skupinami signifikantní rozdíl v roční četnosti atak a v obou skupinách byla tato četnost nižší, než se očekávalo, viz graf 1. V parametrech vyšetření magnetickou rezonancí nebyly významné změny v množství a objemu T2 vážených lézí. Ve skupině pacientů léčených interferonem beta-1a se vyskytlo méně gadolinium enhancujících lézí, zatímco ve skupině pacientů léčených GA byl zaznamenán signifikantně nižší stupeň mozkové atrofie [7]. Studie BEYOND zahrnovala 3 skupiny pacientů, u nichž byly srovnávány 2 dávky interferonu beta-1b (500 mg a 250 mg každý druhý den) a 20 mg GA denně. Pacienti dostávali studijní medikaci po dobu dvou let. Nebyl zjištěn rozdíl v roční četnosti relapsů (0,33, 0,36 a 0,34) a dále nebyl zaznamenán statisticky významný rozdíl v době do objevení se prvního relapsu, v celkovém počtu relapsů a podílu pacientů, kteří zůstali bez relapsu. V parametrech magnetické rezonance nebyl rozdíl v počtu gadolinium enhancujících lézí, T1 lézí a v objemu mozkové tkáně [8]. Statisticky významný rozdíl byl zjištěn v kumulativním počtu nových T2 lézí a jejich objemu ve skupinách pacientů léčených 500 mg IFN beta-1b, 250 mg IFN beta-1b a GA, procentuálně vyjádřený jako 12 %, 10 % a 17 %. Z celkového počtu 2244 sledovaných pacientů studii předčasně ukončilo 161 pacientů léčených dávkou 500 mg interferonu beta-1b, 104 pacientů léčených 250 mg interferonu beta-1b a 71 pacientů léčených GA. V další srovnávací studii (BECOME) byl porovnáván interferon beta-1b versus GA při podání trojité dávky gadolinia a vyšetření pacientů na 3 Tesla magnetické rezonanci. Byl hodnocen parametr nazvaný kombinované aktivní léze zahrnující gadolinium enhancující a nové T2 vážené léze. Výsledky byly pro IFN beta-1b a GA obdobné, bez signifikantního statistického rozdílu. Průměrná roční četnost atak poklesla u IFN beta-1b z výchozí hodnoty 1,8 na 0,37, což představovalo redukci o 79 %, a ve skupině léčené GA došlo k poklesu z hodnoty 1,9 na 0,33, což představovalo redukci o 83 %. Pokud shrneme údaje z těchto studií srovnávajících léčbu vysokými dávkami IFN beta-1b a GA, jedná se o velmi podobné výsledky týkající se účinnosti vyjádřené redukcí roční četnosti atak a začátkem léčebného působení. Navíc redukce ročního počtu atak je výraznější ve srovnání s výsledky primární klinické studie s GA z roku 1995 [6]. Redukce atak prokázaná v těchto srovnávacích studiích se pohybuje v rozmezí 0,29–0,34 ataky/rok, což představuje významný pokles ve srovnání s původní studií, kde snížení v důsledku léčby GA představovalo průměrně 0,59 ataky/rok. Nejpravděpodobnější vysvětlení uvedeného trendu spočívá v odlišné struktuře souboru pacientů vzhledem k časnějšímu zařazení a léčbě umožněné McDonaldovými diagnostickými kritérii zahrnujícími vyšetření magnetickou rezonancí. Výsledky těchto nedávných studií vykazují výraznější účinnost léčby zahájené v časných fázích onemocnění.
Glatiramer acetát v léčbě klinicky izolovaného syndromu (clinically isolated syndrome – CIS)
![Graf 2 Čas do konverze do klinicky definitivní roztroušené sklerózy (CDMS) u pacientů léčených glatiramer acetátem nebo placebem. Ve skupině s glatiramer acetátem bylo prokázáno oddálení doby do manifestace CDMS o 386 dnů; podle [9] – Comi, et al., 2009.](https://www.remedia.cz/photo-a-28555---.jpg) Ve studii PreCISe byl studován vliv léčby GA na oddálení vzniku druhé ataky potvrzující diagnózu klinicky definitivní roztroušené sklerózy [9]. Výsledky této studie ukazují, že GA zpomaluje konverzi do klinicky definitivní roztroušené sklerózy. Do studie bylo zařazeno 481 pacientů, kteří prodělali jednu monofokální klinickou ataku hodnocenou jako CIS. Výsledkem bylo klinicky signifikantní zpomalení přechodu do definitivní roztroušené sklerózy o 386 dnů ve srovnání s neléčenou skupinou, viz graf 2. Rovněž byl prokázán vliv léčby GA na parametry vyšetření magnetickou rezonancí a magnetickou rezonanční spekt-roskopií. U pacientů léčených GA byl prokázán o 58 % nižší vznik nových T2 vážených lézí a též jejich objem byl u pacientů léčených GA menší. Došlo také ke snížení počtu nově vzniklých T1 gadolinium enhancujících lézí a nových T1 vážených lézí [10]. Metodou magnetické rezonanční spektroskopie (MRS) byly zjištěny statisticky významné rozdíly v poměru N-acetyl-aspartátu/cholinu jako markeru neuronální integrity mezi skupinou léčenou GA a placebovou skupinou; tyto rozdíly přetrvávaly dva roky [11].
Ve studii PreCISe byl studován vliv léčby GA na oddálení vzniku druhé ataky potvrzující diagnózu klinicky definitivní roztroušené sklerózy [9]. Výsledky této studie ukazují, že GA zpomaluje konverzi do klinicky definitivní roztroušené sklerózy. Do studie bylo zařazeno 481 pacientů, kteří prodělali jednu monofokální klinickou ataku hodnocenou jako CIS. Výsledkem bylo klinicky signifikantní zpomalení přechodu do definitivní roztroušené sklerózy o 386 dnů ve srovnání s neléčenou skupinou, viz graf 2. Rovněž byl prokázán vliv léčby GA na parametry vyšetření magnetickou rezonancí a magnetickou rezonanční spekt-roskopií. U pacientů léčených GA byl prokázán o 58 % nižší vznik nových T2 vážených lézí a též jejich objem byl u pacientů léčených GA menší. Došlo také ke snížení počtu nově vzniklých T1 gadolinium enhancujících lézí a nových T1 vážených lézí [10]. Metodou magnetické rezonanční spektroskopie (MRS) byly zjištěny statisticky významné rozdíly v poměru N-acetyl-aspartátu/cholinu jako markeru neuronální integrity mezi skupinou léčenou GA a placebovou skupinou; tyto rozdíly přetrvávaly dva roky [11].
Dlouhodobá léčba GA
Přestože roztroušená skleróza je chronické onemocnění a existují doporučení zahájit léčbu co nejdříve, trvá relativní nedostatek údajů týkajících se bezpeč-nosti a účinnosti imunomodulační terapie, které by vypovídaly o období delším než 5 let. Jsou k dispozici výsledky otevřených observačních studií hodnotících neurologický nález na stupnici EDSS (Expanded Disability Status Scale) u pacientů z původní studie s GA provedené v roce 1995 po 16 letech [5]. U pacientů, kteří pokračovali v léčbě GA, poklesla četnost atak z původních 1,18 ataky za rok na ![Graf 3 Čas do doby, kdy pacienti (n = 231) léčení glatiramer acetátem (GA) dosáhli EDSS 4, 6 a 8. Průměrná doba trvání nemoci před zahájením léčby GA činila 8,3 roku. Průměrné skóre EDSS před začátkem podávání GA bylo 2,07 Ī 0,95 (pacienti s EDSS < 4 před začátkem podávání GA), 2,64 Ī 1,34 (pacienti s EDSS < 6 před začátkem podávání GA) a 2,79 Ī 1,50 (pacienti s EDSS < 8 před začátkem podávání GA); podle [5] – Ford, et al., 2006.](https://www.remedia.cz/photo-a-28556---.jpg) přibližně jednu ataku za 5 let, což představuje snížení o více než 80 %. Doba, která je nezbytná ke zvýšení EDSS o jeden stupeň na škále EDSS, byla 8,8 roku. Stav 58 % pacientů léčených GA byl stabilní nebo u nich došlo ke zlepšení na škále EDSS a téměř všichni pacienti měli celkové skóre EDSS nižší než 6, což znamenalo, že byli schopni chůze, viz graf 3. Bezpečnostní profil GA v uvedeném sledování byl příznivý a nežádoucí reakce zahrnovaly lokální injekční reakce (erytém, bolest a otok) a okamžité postinjekční reakce vegetativního charakteru spontánně ustupující. Nebyly zaznamenány žádné jiné nežádoucí účinky, jako jsou autoimunitní onemocnění, infekce a nádorová onemocnění.
přibližně jednu ataku za 5 let, což představuje snížení o více než 80 %. Doba, která je nezbytná ke zvýšení EDSS o jeden stupeň na škále EDSS, byla 8,8 roku. Stav 58 % pacientů léčených GA byl stabilní nebo u nich došlo ke zlepšení na škále EDSS a téměř všichni pacienti měli celkové skóre EDSS nižší než 6, což znamenalo, že byli schopni chůze, viz graf 3. Bezpečnostní profil GA v uvedeném sledování byl příznivý a nežádoucí reakce zahrnovaly lokální injekční reakce (erytém, bolest a otok) a okamžité postinjekční reakce vegetativního charakteru spontánně ustupující. Nebyly zaznamenány žádné jiné nežádoucí účinky, jako jsou autoimunitní onemocnění, infekce a nádorová onemocnění.
Nedostatečná odpovídavost na imunomodulační léčbu a možnost změny terapie
Je známou skutečností, že až 30 % pacientů vykazuje známky nedostatečné léčebné odpovědi v prvních třech letech po zahájení léčby preparáty DMD (disease modifying drugs) první linie – interferony beta a GA [12].
Kritéria pro nedostatečnou terapeutickou odpověď zpravidla zahrnují nezměněný počet atak proti stavu před zahájením léčby, nedokonalou remisi ataky, progresi neurologického deficitu a kognitivní postižení, které vede k závažnému ovlivnění každodenního života [13]. Významným faktorem způsobujícím sníženou odpovídavost na léčbu interferony beta může být tvorba neutralizačních protilátek. Vysoké titry neutralizačních protilátek blokují biologickou aktivitu interferonů beta. Příčinami snížené adherence k léčbě interferony beta mohou být příznaky chřipkového syndromu a lokální kožní reakce po vpichu. Únava, poruchy paměti a pocit pacienta, že léčba není účinná, mohou být dalšími příčinami snížené účinnosti vzhledem k dlouhodobosti injek-ční léčby preparáty DMD [14]. Specifickými nežádoucími účinky léčby GA jsou lokální kožní reakce (zejména lipodystrofie), urtikarie, vazodilatace a dyspnoe. Z těchto důvodů ukončilo předčasně léčbu 5 % pacientů dlouhodobě léčených GA. ![Graf 4 Průměrná roční míra relapsů (ARR) u pacientů, kterým byla z důvodu nedostatečné účinnosti nebo z důvodu nežádoucích účinků změněna léčba interferonem beta-1a na léčbu glatiramer acetátem; podle [15] – Caon, et al., 2006.](https://www.remedia.cz/photo-a-28557---.jpg) Vzhledem k tomu, že existuje značný nedostatek informací o možnostech a účinnosti při přechodu pacientů z léčby interferony beta na léčbu GA, byly uskutečněny tři klinické studie, v nichž byli pacienti nedostatečně odpovídající na léčbu interferonem beta nebo pacienti s neakceptovatelnými vedlejšími účinky převedeni na léčbu GA. Caon a kolektiv hodnotili pacienty, kteří byli kvůli nedostatečné odpovědi na interferon beta-1a podávaný jedenkrát týdně převedeni na léčbu GA. Při podávání GA došlo k redukci četnosti atak z 1,32 na 0,52 a EDSS skóre se zlepšilo o 0,5 stupně, viz graf 4 [15]. V další studii byla prokázána zlepšená účinnost a stabilizace progrese po převedení z léčby interferonem beta na GA, kde byla opět prokázána redukce počtu atak z 0,63 na 0,14 ataky/rok a stabilizace EDSS skóre [16]. V další studii byly srovnávány výsledky mezi 558 pacienty iniciálně léčenými GA a 247 pacienty, kteří byli kvůli nežádoucím účinkům léčby interferonem beta-1b převedeni na léčbu GA. U pacientů v této druhé skupině došlo při podávání GA k průměrnému poklesu četnosti relapsů o 75 % [16]. Uvedené studie prokazují zlepšení v redukci počtu atak a snížení disability u pacientů, kteří byli převedeni na léčbu GA pro nedostatečnou terapeutickou odpověď při léčbě interferony beta [17, 18].
Vzhledem k tomu, že existuje značný nedostatek informací o možnostech a účinnosti při přechodu pacientů z léčby interferony beta na léčbu GA, byly uskutečněny tři klinické studie, v nichž byli pacienti nedostatečně odpovídající na léčbu interferonem beta nebo pacienti s neakceptovatelnými vedlejšími účinky převedeni na léčbu GA. Caon a kolektiv hodnotili pacienty, kteří byli kvůli nedostatečné odpovědi na interferon beta-1a podávaný jedenkrát týdně převedeni na léčbu GA. Při podávání GA došlo k redukci četnosti atak z 1,32 na 0,52 a EDSS skóre se zlepšilo o 0,5 stupně, viz graf 4 [15]. V další studii byla prokázána zlepšená účinnost a stabilizace progrese po převedení z léčby interferonem beta na GA, kde byla opět prokázána redukce počtu atak z 0,63 na 0,14 ataky/rok a stabilizace EDSS skóre [16]. V další studii byly srovnávány výsledky mezi 558 pacienty iniciálně léčenými GA a 247 pacienty, kteří byli kvůli nežádoucím účinkům léčby interferonem beta-1b převedeni na léčbu GA. U pacientů v této druhé skupině došlo při podávání GA k průměrnému poklesu četnosti relapsů o 75 % [16]. Uvedené studie prokazují zlepšení v redukci počtu atak a snížení disability u pacientů, kteří byli převedeni na léčbu GA pro nedostatečnou terapeutickou odpověď při léčbě interferony beta [17, 18].
Závěr
Účinnost a bezpečnost GA je zhodnocena s ohledem na dlouhodobou léčbu a měnící se postavení GA s příchodem nových léků v terapii roztroušené sklerózy. Časná léčba GA nejlépe u CIS a v časných fázích klinicky definitivní RS vykazuje vyšší účinnost než v původní studii z roku 1995 a toto je potvrzeno i srovnávacími studiemi s interferonem beta. Nejsou prokázány neutralizační protilátky vůči GA, které by snižovaly biologickou účinnost. Dlouhodobý bezpečnostní profil je velmi dobrý, bez závažných infekcí a vzniku malignit. Při nedostatečné odpovědi na léčbu DMD první volby je možný přechod na léčbu GA se zlepšením účinnosti.
Seznam použité literatury
- [1] Arnon R. The development of Cop 1 (Copa-xone®), an innovative drug for the treatment of multiple sclerosis: Personal reflections. Immunol Lett 1996; 50: 1–15.
- [2] Schrempf W, Ziemssen T. Glatiramer acetate: Mechanism of action in multiple sclerosis. Autoimmun Rev 2007; 6: 469–475.
- [3] Blanchette F, Neuhas O. Glatiramer acetate evidence for a dual mechanism of action. J Neurol 2008; 255 (1 Suppl.): 26–36.
- [4] Aharoni R, Kayhan B, Eilam R, et al. Glatiramer acetate specific T cells in the brain express T-helper 2/3 cytokines and brain derived neurotrophic factors in situ. Proc Natl Acad Sci USA 2003; 100 (2 Suppl): 14157–14162.
- [5] Ford CC, Johnson KP, Lisak RP, et al. A prospective open-label study of glatiramer acetate: over a decade of continuous use in multiple sclerosis patients. Mult Scler 2006; 12: 309–320.
- [6] Johnson KP, Brooks BR, Cohen JA, et al. Copolymer 1 reduces relaps rate and improves dis-ability in relapsing – remitting multiple sclerosis: results of a phase III multicenter, double blind, placebo-controlled trial. Neurology 1995; 45: 1268–1276.
- [7] Mikol DD, Barkhof F, Chang P, et al. Comparison of subcutaneous interferon beta-1a with glatiramer acetate in patients with multiple sclerosis (the REbif vs Glatiramer acetate in Relapsing MS disease (REGARD) study: a multicentre, randomised, paralel, open-label trial. Lancet Neurol 2008; 7: 903–914.
- [8] O’Connor P, Fillipi M, Arnason B, et al. 250 ug or 500 ug interferon beta-1b versus 20 mg glatiramer acetate in relapsing-remitting multiple sclerosis: a prospective, randomised, multicentre study. Lancet Neurol 2009; 8: 889–897.
- [9] Comi G, Martinelli V, Rodegher M, et al. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome (PreCISe study): a randomised, double-blind, placebo controlled trial. Lancet 2009; 374: 1503–1511.
- [10] Rocca MA, Comi G, Carra A, et al. Treatment with glatiramer acetate reduces T1 and T2 weight-ed magnetic resonance imaging activity in pa-tients with clinically isolated syndrome suggestive of multiple sclerosis. Mult Scler 2008; 14: S29–S293.
- [11] Arnold DL, Narayana S, Antel S. Treatment with glatiramer acetate protects axons in patients with clinically isolated syndromes: evidence from PreCISe trial. Mult Scler 2008; 141: S5–S27.
- [12] Gauthier SA, Glanz BI, Mandel M, et al. Incidence and factors associated with treatment failure in the CLIMB multiple sclerosis cohort study. J Neurol Sci 2009; 284: 116–119.
- [13] Cohen BA, Khan O, Jeffery DR, et al. Identifying and treating patients with suboptimal responses. Neurology 2004; 63 (12 Suppl. 6): S33–S40.
- [14] Rudick RA, Polman CH. Current approaches to the identification and management of break-through disease in patients with multiple sclerosis. Lancet Neurol 2009; 8: 545–559.
- [15] Caon C, Din M, Ching W, et al. Clinical course after change of immunomodulating therapy in relapsing-remitting multiple sclerosis. Eur J Neurol 2006; 13: 471–474.
- [16] Carrá A, Onaha P, Luetic G, et al. Therapeutic outcome 3 years after switching of immunomodulatory therapies in patients with relapsing-remit-ting multiple sclerosis in Argentina. Eur J Neurol 2008; 15: 386–393.
- [17] Zwiebel HL. Glatiramer acetate in treatment – naive and prior interferon beta-1b treated multiple sclerosis patients. Acta Neurol Scand 2006; 113: 378–386.
- [18] Johnson KP. Risks vs benefits of glatiramer acetate. Ther and Clin Risk Management 2010; 6: 153–172.